Distribution patterns of the soil seed bank of Crataegus songarica K. Koch with altitude in the western Tianshan wild fruit forest
-
摘要:
通过野外调查采样和室内实验的方法,对西天山野果林中新疆特有珍稀植物准噶尔山楂(Crataegus songarica K. Koch)土壤种子库组成、空间分布特征及其幼苗更新情况进行分析,并对该物种土壤种子库海拔梯度分布格局进行探讨。结果显示:(1)准噶尔山楂土壤种子库中虫蛀种子、实心种子和饱满种子分别占总种子数的50.83%、46.22%和2.95%;各海拔内饱满种子数量极少,随着海拔上升基本呈现先降后增再降的波动变化趋势,最高密度为(2.36 ± 0.71)粒/m2,出现在海拔1400 ~ 1500 m处。(2)土壤种子库垂直分布中,各土层内以虫蛀种子居多,其次为实心种子,饱满种子密度极显著低于前二者,且各土层间饱满种子密度差异不显著;水平分布上,随着离母树距离的增加,土壤种子库虫蛀、实心和饱满种子密度基本上呈递减的趋势,约94%的饱满种子分布在距母树3 m冠幅范围内。(3)幼苗为近母树分布(2.5 m内),幼苗数量少,实生苗更少,不足1株/50 m2,种苗转化率仅为5‰,趋向于以萌生的无性繁殖为主,实生的有性繁殖为辅。研究结果表明,自然条件下准噶尔山楂种子密度受海拔梯度影响小,种子更新能力差。可以通过调节立地环境因子、改善种子的着地生境,从而提高种苗转化率,促进种群的良好更新。
Abstract:We studied the composition and spatial distribution characteristics of the soil seed bank and seedling renewal rate of the rare Crataegus songarica plant in the Western Tianshan Wild Fruit Forest in Xinjiang along the altitudinal gradient, combining field sampling, laboratory experiments, and data analysis. Results showed that: (1) Wormy seeds, solid seeds, and plump seeds accounted for 50.83%, 46.22%, and 2.95% of the total C. songarica soil seed bank, respectively. The number of plump seeds at each altitude was very low, but showed a fluctuating trend with altitude (first decreasing, then increasing, then decreasing again), reaching a maximum density of (2.36 ± 0.71) grains/m2 at 1400–1500 m. (2) For vertical distribution of the soil seed bank, wormy seeds were dominant in each soil layer, followed by solid seeds, with the density of plump seeds significantly lower than both. The density of plump seeds did not differ significantly between soil layers. For horizontal distribution, the density of wormy seeds, solid seeds, and plump seeds in the soil seed bank showed a decreasing trend with increasing distance from the C. songarica mother plant, with 94% of plump seeds distributed within 3 m of the mother plant. (3) Seedlings were also distributed near the mother plant (within 2.5 m). There were few seedlings, and the number of seed seedlings was even less (< one strain/50 m2). The seedling conversion rate was only 5‰, dominated by emergent asexual reproduction supplemented with native sexual reproduction. In conclusion, C. songarica seed density was not significantly affected by the altitudinal gradient and seed renewal ability was poor under natural conditions. Thus, C. songarica seedling conversion and renewal could be promoted by regulating environmental factors and improving seed habitat.
-
地黄(Rehmannia glutinosa Libosch.)为玄参科地黄属植物,多年生草本,以块根入药,为著名的“四大怀药”之一。地黄最早记载见《神农本草经》,被列为上品,迄今已有2000余年的应用历史。根据炮制方法的不同,地黄药材分为鲜地黄、生地黄和熟地黄[1]。2020版《中国药典》记载,鲜地黄具有清热生津、凉血、止血的功效,生地黄具有清热凉血、养阴生津的功效,熟地黄具有补血滋阴,益精填髓的功效[2]。地黄富含环烯醚萜类、苯乙醇苷类、紫罗兰酮类、三萜类、黄酮类和糖类等,对人体心脑血管、血液、中枢神经和免疫系统等均有显著作用[3]。
毛蕊花糖苷(Acteoside)是地黄中含量较高的苯乙醇苷类化合物[4],具有抗氧化、免疫调节、抗炎、保肝、抗肿瘤、增强记忆力等生物活性[5],是2010版、2015版《中国药典》规定的地黄药材质量控制的指标性成分之一。地黄毛蕊花糖苷的含量易受品种[6]、产地[7]、收获时期[5]、种植密度[8]和光照条件[9]等因素的影响,造成某些年份部分地黄药材的毛蕊花糖苷含量达不到《中国药典》规定的要求。地黄毛状根中也含有丰富的毛蕊花糖苷,本课题组前期研究表明,在毛状根诱导的特定时期添加水杨酸(SA)可显著促进毛蕊花糖苷的含量[10]。然而,地黄生长发育过程中叶面喷施SA对毛蕊花糖苷的含量是否有影响还未见报道。
本研究以大田栽培的地黄为材料,采用叶面喷施方法分析SA对地黄叶片和块根毛蕊花糖苷含量的影响,并利用转录组测序技术分析地黄块根中的基因表达特征,研究结果旨在为生产中应用外源激素提高毛蕊花糖苷的含量提供理论依据。
1. 材料与方法
1.1 实验材料
供试材料为地黄‘温85-5’,种植在河南省武陟县蔡庄村(35°2′51″N,113°18′34″E),经河南农业大学王丰青教授鉴定为Rehmannia glutinosa Libosch.。将浓度为100 μmol/L的SA水溶液均匀喷施在生长180 d处于膨大后期长势一致的地黄叶片上,以叶片完全湿润且无水滴落下为准。分别于处理后1、3和6 h进行取样,取样时选择位置相同的叶片。对照组喷施蒸馏水,与处理组同时取样。样品清洗干净后,将块根切成1 cm3左右的小块,叶片剪碎,55℃烘干后打粉,过3号药典筛。样品粉末存放于干净的8号自封袋中备用。
1.2 毛蕊花糖苷含量测定
对照品毛蕊花糖苷(批号MUST-18032725)购于成都曼斯特科技有限公司,纯度均 ≥ 98%。采用 Agilent1260高效液相色谱仪(美国安捷伦科技有限公司)进行检测。
色谱条件:采用的色谱柱型号为 Dikma Diamonsil C18(4.6 × 250 mm,5 μm),柱温30℃,流速1 min/mL。毛蕊花糖苷的流动相为乙腈−0.1%醋酸水(16 : 84),检测波长334 nm,进样量为20 μL。
供试样品溶液制备:精密称取地黄叶和块根样品粉末0.8 g,放入锥形瓶中,精密吸取50 mL甲醇加入锥形瓶中,称重,并在65℃加热回流提取1.5 h,放凉至室温称重,用甲醇补足失重后,摇匀过滤。于蒸发皿中精密吸取滤液20 mL进行毛蕊花糖苷分析,在电热恒温水浴锅上浓缩至近干,残渣用流动相溶解,转移至5 mL容量瓶中,用流动相稀释至刻度,摇晃均匀,用0.22 μm微孔的滤膜过滤,滤液装入2 mL的进样瓶待测。
含量计算:以本实验室建立的标准曲线Y = 30024X − 110.9来计算毛蕊花糖苷含量,Y为峰面积积分值,X为样品的质量浓度。
1.3 样品RNA提取及高通量测序
用TRIzol试剂提取样品的总RNA,用核酸测定仪检测RNA的浓度和质量。使用带有Oligo dT的磁珠富集具有polyA尾巴的mRNA,然后将RNA片段化,反转录后再合成cDNA第2链,形成双链cDNA。双链cDNA经过末端修复、3′末端加A、添加测序接头、多轮扩增、热变性成单链及单链环化等一系列步骤后,完成测序文库的制备。测序委托华大基因科技有限公司进行,测序平台为BGISEQ-500。
对测序得到的原始序列(Raw reads)进行质控处理,去除低质量、接头及污染序列,获取过滤后的测序序列(Clean reads)。使用Bowtie2将Clean reads比对到课题组前期获得的地黄叶和根的参考基因序列集[11],统计不同样品的片段序列比对率以及分布,之后再使用RSEM 计算基因的表达水平,表达量用FPKM表示。对比分析水杨酸喷施前后地黄块根中基因的表达水平,获取水杨酸喷施处理的特异响应基因,并对其进行GO注释和KEGG注释,根据注释结果进行功能分类和KEGG pathway分类,并使用R软件中的phyper函数进行富集分析,获得水杨酸喷施处理下地黄块根内的关键分子响应进程。
1.4 实时荧光定量(qRT-PCR)分析
用TaKaRa反转录试剂盒对RNA进行反转录,合成cDNA,反应体系包括1 μL oligo dT primer,1 μL dNTP Mixture,2 μg 模板RNA,加水补足体积到10 μL,65℃保温5 min后,冰上迅速冷却。再加0.5 μL的RNase抑制剂,1 μL PrimeScript Ⅱ RTase,4 μL 5 × PrimeScript Ⅱ Buffer,加水补足体积到20 μL。反应程序为42℃ 60 min,95℃ 5 min。以RgTIP41为内参基因,用实时荧光定量PCR检测基因表达水平。所用试剂盒为SYBR® Premix Ex Taq™ Ⅱ(Tli RNaseH Plus) (Takara,大连),使用仪器为Bio-Rad IQ5(上海伯乐公司)。定量反应体系为25 μL,包含2 μL 上述反转录cDNA产物,上、下游引物各1 μL,12.5 μL SYBR® Premix Ex Taq,8.5 μL ddH2O。反应程序为:95℃变性30 s;然后95℃ 5 s, 60℃ 30 s,40个循环。结束反应后获得不同样品的扩增循环数Ct,使用2-ΔΔCt法计算不同基因的相对表达量。
2. 结果与分析
2.1 SA处理对地黄毛蕊花糖苷含量的影响
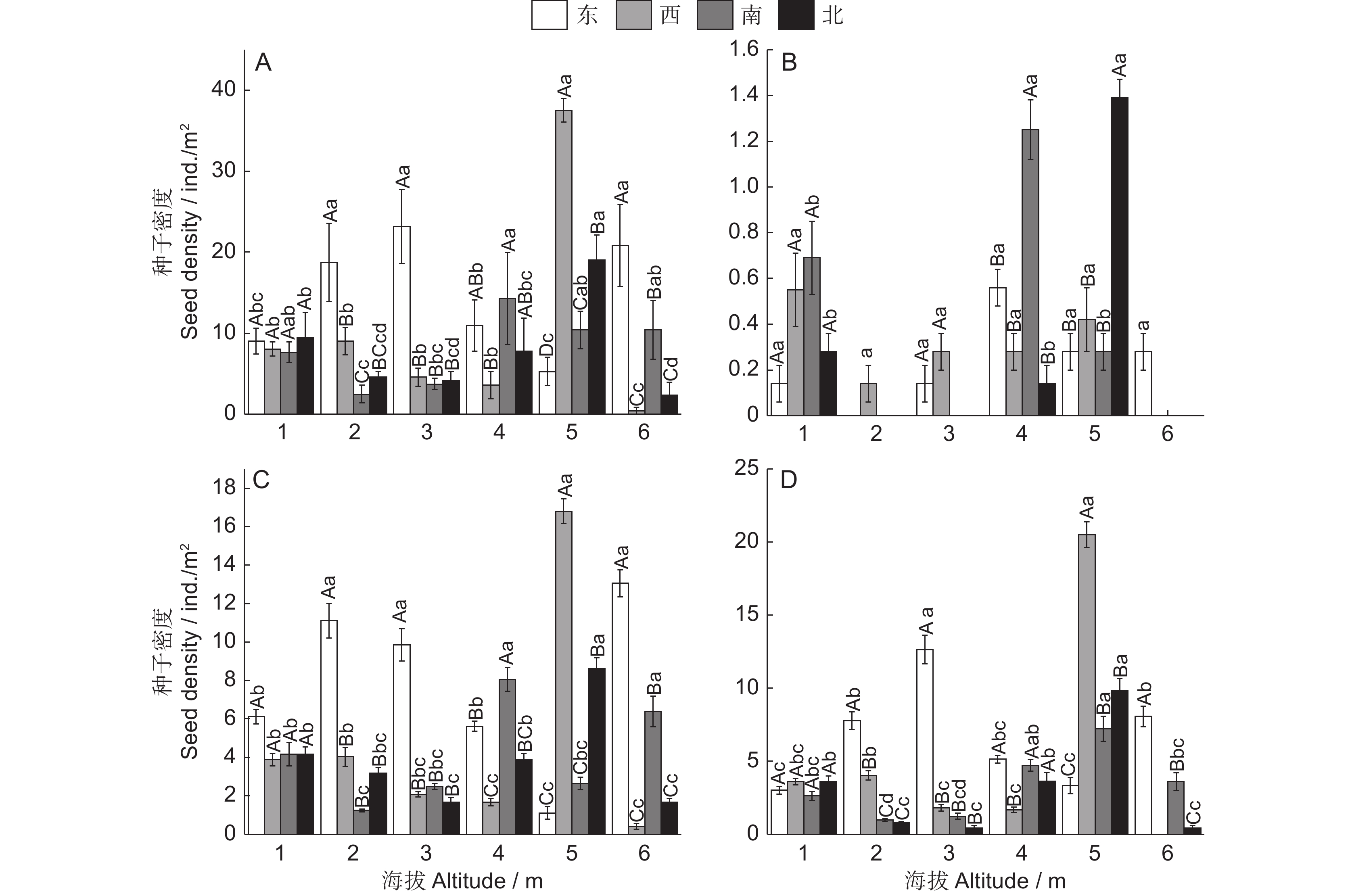
对SA处理的地黄叶和块根中的毛蕊花糖苷含量进行测定,结果表明,SA能够显著提高毛蕊花糖苷的含量(图1)。在叶中, SA处理1 ~ 6 h后,毛蕊花糖苷含量分别提高了11.2% ~ 19.3%。块根中毛蕊花糖苷的提升幅度远高于叶片,分别较对照提高了0.9 ~ 1.4倍,处理 6 h后的毛蕊花糖苷含量最高,达0.5 mg/g,远超2015版《中国药典》规定的0.02%,说明地黄叶面喷施SA可显著提高叶和块根中毛蕊花糖苷的含量。
2.2 地黄块根RNA测序分析
利用Agilent 2100 Bioanalyzer和Fragment Analyzer分别对提取的各样品总RNA质量进行检测,结果显示,12个样品的总RNA浓度在430 ~ 1260 ng/μL,总RNA质量在8.6 ~ 25.2 μg,RNA的浓度和总量满足建库需求。RIN值在8.2 ~ 9.9,28S/18S > 1.6,说明RNA较为完整,符合建库要求。
为了分析SA处理后地黄块根相关基因的表达特性,对SA处理1、3和6 h后的地黄块根进行RNA-seq分析,结果表明(表1),每个测序样本获得的总原始读段量均为21.94 M,去除低质量、接头污染及未知碱基N含量过高的reads,获得的高质量reads在20.98 ~ 21.27 M,碱基数均在1.05 ~ 1.06 Gb,测序数据量基本一致。将每个样品的测序数据匹配地黄参考转录组,发现匹配率在85.04% ~ 87.70%,特异匹配率在47.35% ~ 51.31%,测序数据能够较好地反映细胞中基因表达的真实情况,说明测序质量良好,可以进行后续基因表达分析。
表 1 测序数据统计结果Table 1. Statistics of sequenced data样本
Sample总原始序列
Total raw reads / M总测序序列
Total clean reads / M总测序碱基数
Total clean bases / Gb测序序列比率
Clean read ratio / %总匹配率
Total mapped / %特异匹配率
Uniquely mapped / %Control_1 21.94 21.13 1.06 96.3 87.70 51.31 Control_2 21.94 21.07 1.05 96.04 86.92 51.18 Control_3 21.94 21.08 1.05 96.08 85.72 51.09 SA 1h_1 21.94 21.27 1.06 96.93 85.44 47.35 SA 1h_2 21.94 21.08 1.05 96.05 87.07 48.03 SA 1h_3 21.94 21.15 1.06 96.37 87.28 49.26 SA 3h_1 21.94 20.98 1.05 95.59 86.85 50.36 SA 3h_2 21.94 21.05 1.05 95.93 85.74 49.92 SA 3h_3 21.94 21.05 1.05 95.95 86.81 50.47 SA 6h_1 21.94 21.09 1.05 96.11 86.50 50.25 SA 6h_2 21.94 21.06 1.05 96.00 85.04 49.42 SA6h_3 21.94 21.03 1.05 95.86 86.68 49.97 2.3 SA处理前后差异表达基因分析及筛选
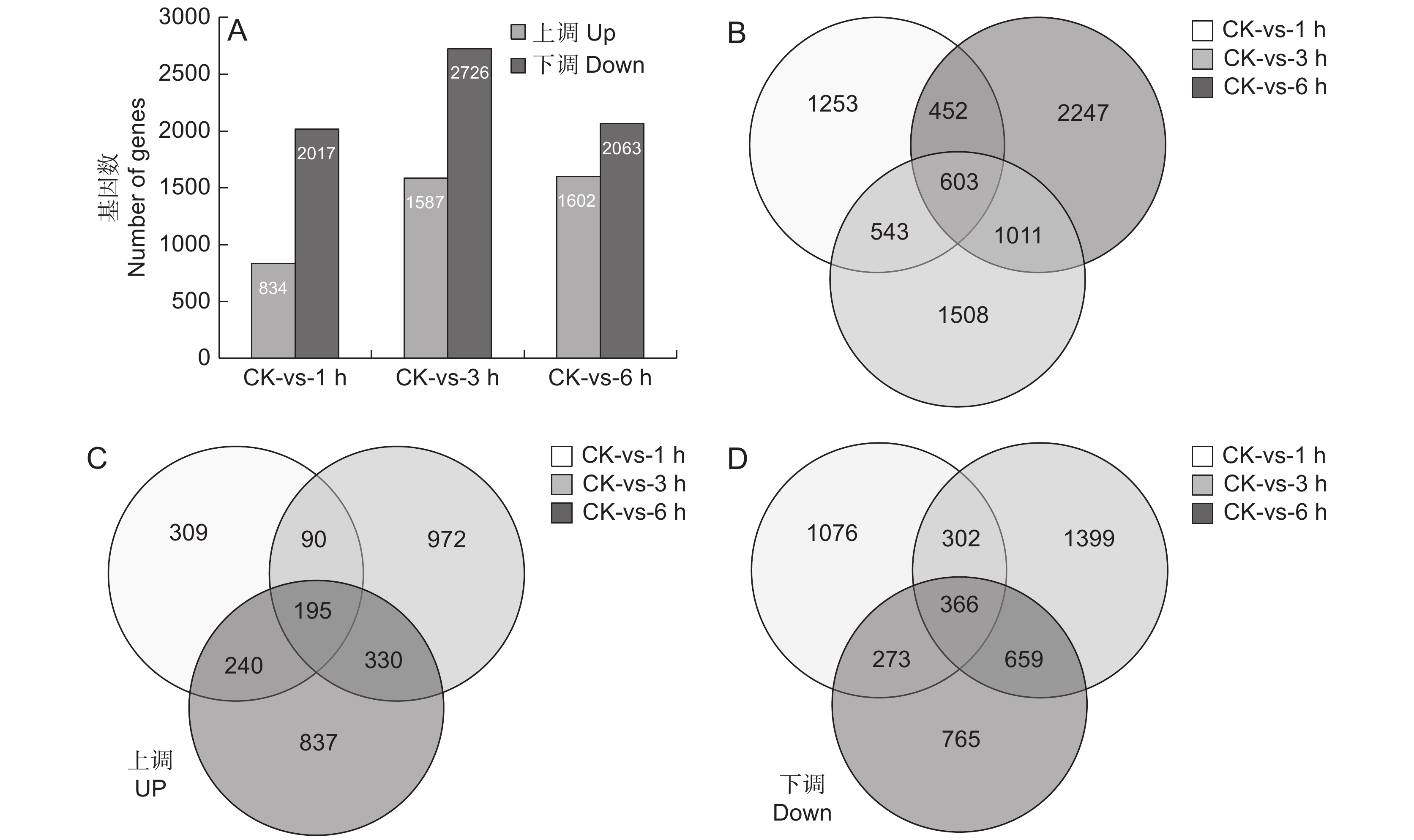
为了分析SA处理后块根中基因的表达特性,采用FPKM值比较基因丰富度的差异(图2)。使用以下标准对差异表达基因(DEGs)进行识别和筛选:校正P值 < 0.001且log2值 ≥ 2。分析SA处理不同时间后与对照样品中的差异表达基因(图2:A),发现SA处理1 h后834个基因上调,2017个基因下调;处理3 h后1587个基因上调,2726个基因下调;处理6 h后1602个基因上调,2063个基因下调。进一步分析SA处理后的3个时间点与CK相比的共同差异表达基因,发现共有603个基因是共同差异表达的(图2:B),其中上调表达和下调表达的基因数分别为195(图2:C)和366个(图2:D)。
![]() 图 2 SA处理后基因显著差异表达A:SA处理过程中上调和下调的基因数目; B ~ D:SA处理后不同时间点鉴别出的总DGEs(B)、上调DGEs(C)和下调DGEs的维恩图。Figure 2. Significant DEGs in response to SA treatmentA: Up-regulated and down-regulated gene numbers during SA treatment; B − D: Venn diagram of total DEGs (B), up-regulated DEGs (C), and down-regulated DEGs (D) identified at different time points after SA treatment.
图 2 SA处理后基因显著差异表达A:SA处理过程中上调和下调的基因数目; B ~ D:SA处理后不同时间点鉴别出的总DGEs(B)、上调DGEs(C)和下调DGEs的维恩图。Figure 2. Significant DEGs in response to SA treatmentA: Up-regulated and down-regulated gene numbers during SA treatment; B − D: Venn diagram of total DEGs (B), up-regulated DEGs (C), and down-regulated DEGs (D) identified at different time points after SA treatment.对603个DGEs进行GO功能分类(图3:A),结果显示其共分为分子功能(Molecular function)、细胞功能(Cellar function)和生物功能(Biological function)3个大类。其中分子功能分类中的催化活性(Catalytic activity)占比最多,其次是ATP结合;在细胞功能分类中,细胞(Cell)、细胞膜(Membrane)、细胞膜构件(Membrane part)较多;生物功能分类中,细胞过程(Cellular process)和代谢过程(Metabolic process)所占比重最多。进一步对603个DEGs进行KEGG代谢通路富集分析,图3:B展示了最显著的前20个代谢通路,这些通路涉及各项生命活动。其中首先被富集的是苯乙醇苷生物合成通路(Phenylpropanoid biosynthesis),其次是淀粉和蔗糖代谢合成通路(Starch and sucrose metabolism)、植物MARK信号通路(MAPK signaling pathway plant)及RNA聚合酶通路(RNA polymerase)。这说明SA喷施对地黄块根中次生代谢物的积累产生了较大影响,且调控了碳水化合物和MAPK等多个代谢通路。
![]() 图 3 SA处理后3种比对均差异表达基因的GO分类及KEGG通路富集A:603个基因的GO分类;B:KEGG富集的前20个代谢通路。圆点大小和颜色分别表示通路中DEGs的数量和Q值范围。1:分子转导活性;2:分子载体活性;3:信号转导活性;4:结构分子活性;5:转运活性;6:转录调节活性;7:抗氧化活性;8:结合;9:分子功能调节;10:催化活性;11:膜封闭腔;12:超分子复合物;13:共质体;14:细胞连接;15:细胞组分;16:细胞外区域;17:膜组分;18:膜;19:细胞器组分;20:细胞器;21:大分子复合物;22:细胞;23:生殖过程;24:繁殖;25:解毒作用;26:多细胞生物过程;27:发育过程;28:多生物体过程;29:信号;30:定域化;31:生物调节;32:对刺激的反应;33:代谢过程;34:细胞过程;35:细胞成分组织或生物合成。Figure 3. GO classification and KEGG pathway enrichment of co-DEGs in three comparisonsA: GO classification of 603 genes; B: Top 20 enriched KEGG pathways among 603 genes. Size and color of dot represent number and scope of DEGs in pathway, respectively. 1: Molecular transducer activity; 2: Molecular carrier activity; 3: Signal transducer activity; 4: Structural molecule activity; 5: Transporter activity; 6: Transcription regulator activity; 7: Antioxidant activity; 8: Binding; 9: Molecular function regulator; 10: Catalytic activity; 11: Membrane-enclosed lumen; 12: Supramolecular complex; 13: Symplast; 14: Cell junction; 15: Cell part; 16: Extracellular region; 17: Membrane part; 18: Membrane; 19: Organelle part; 20: Organelle; 21: Macromolecular complex; 22: Cell; 23: Reproductive process; 24: Reproduction; 25: Detoxification; 26: Multicellular organismal process; 27: Developmental process; 28: Multi-organism process; 29: Signaling; 30: Localization; 31: Biological regulation; 32: Response to stimulus; 33: Metabolic process; 34: Cellular process; 35: Cellular component organization or biogenesis.
图 3 SA处理后3种比对均差异表达基因的GO分类及KEGG通路富集A:603个基因的GO分类;B:KEGG富集的前20个代谢通路。圆点大小和颜色分别表示通路中DEGs的数量和Q值范围。1:分子转导活性;2:分子载体活性;3:信号转导活性;4:结构分子活性;5:转运活性;6:转录调节活性;7:抗氧化活性;8:结合;9:分子功能调节;10:催化活性;11:膜封闭腔;12:超分子复合物;13:共质体;14:细胞连接;15:细胞组分;16:细胞外区域;17:膜组分;18:膜;19:细胞器组分;20:细胞器;21:大分子复合物;22:细胞;23:生殖过程;24:繁殖;25:解毒作用;26:多细胞生物过程;27:发育过程;28:多生物体过程;29:信号;30:定域化;31:生物调节;32:对刺激的反应;33:代谢过程;34:细胞过程;35:细胞成分组织或生物合成。Figure 3. GO classification and KEGG pathway enrichment of co-DEGs in three comparisonsA: GO classification of 603 genes; B: Top 20 enriched KEGG pathways among 603 genes. Size and color of dot represent number and scope of DEGs in pathway, respectively. 1: Molecular transducer activity; 2: Molecular carrier activity; 3: Signal transducer activity; 4: Structural molecule activity; 5: Transporter activity; 6: Transcription regulator activity; 7: Antioxidant activity; 8: Binding; 9: Molecular function regulator; 10: Catalytic activity; 11: Membrane-enclosed lumen; 12: Supramolecular complex; 13: Symplast; 14: Cell junction; 15: Cell part; 16: Extracellular region; 17: Membrane part; 18: Membrane; 19: Organelle part; 20: Organelle; 21: Macromolecular complex; 22: Cell; 23: Reproductive process; 24: Reproduction; 25: Detoxification; 26: Multicellular organismal process; 27: Developmental process; 28: Multi-organism process; 29: Signaling; 30: Localization; 31: Biological regulation; 32: Response to stimulus; 33: Metabolic process; 34: Cellular process; 35: Cellular component organization or biogenesis.2.4 毛蕊花糖苷合成相关催化酶基因表达分析
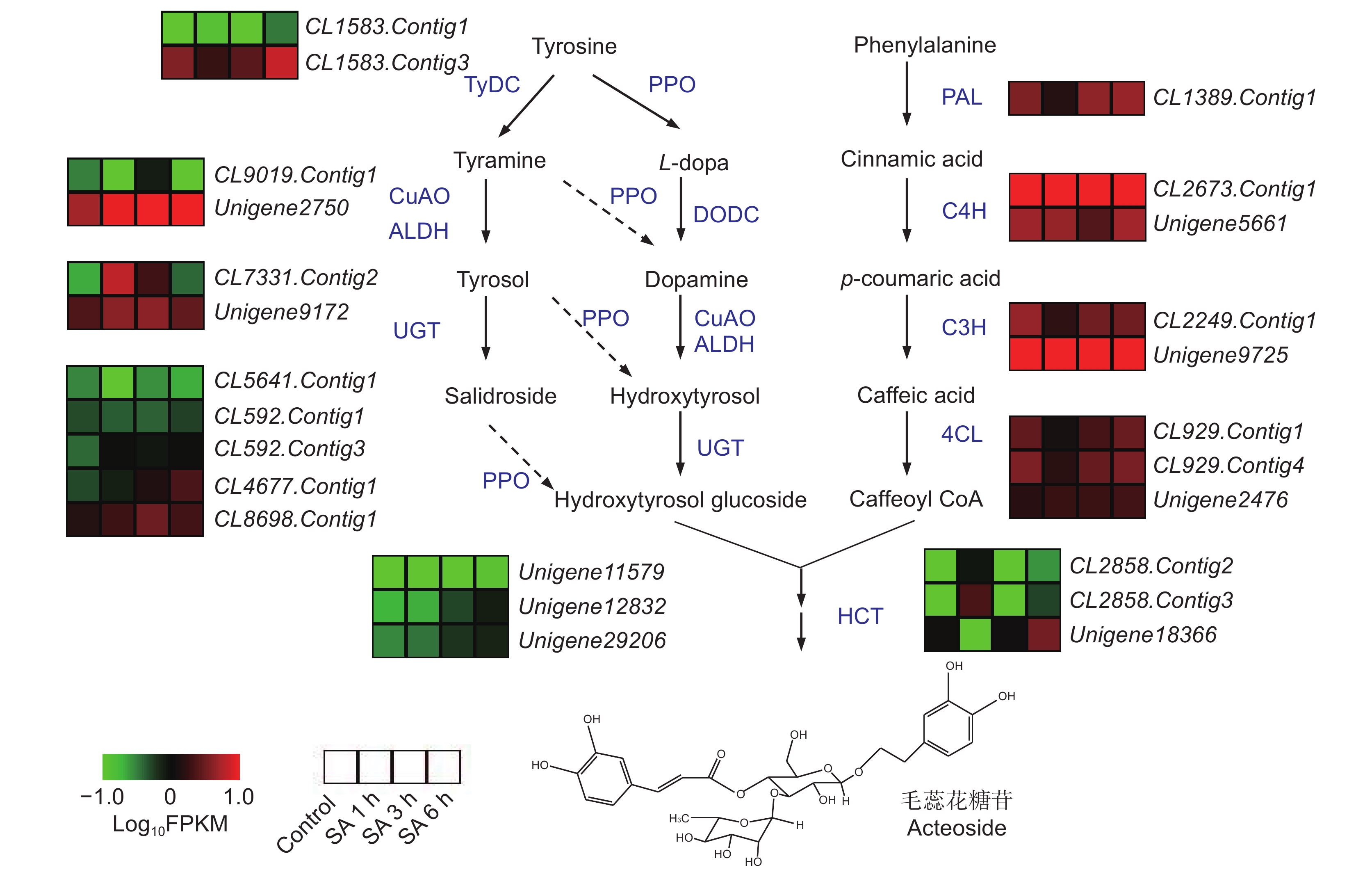
研究表明,在植物体内,毛蕊花糖苷由苯丙氨酸途径的咖啡酰辅酶A(Caffeoyl CoA)和酪氨酸途径的羟基酪醇苷(Hydroxtrosol glucoside)经缩合糖苷化后生成[8]。在地黄转录组中鉴定出可能参与毛蕊花糖苷合成的编码催化酶的基因215个,但SA处理后,地黄块根中仅有少数催化酶基因上调表达(图4)。在酪氨酸途径中,编码乙醛脱氢酶(ALDH)的基因CL7331.Contig2,在SA处理1 h和3 h后的地黄块根中表达量显著升高,另一个ALDH编码基因Unigene9172在SA处理后的表达量也有一定程度上升。编码糖苷转移酶(UGT)的基因CL4677.Contig1随着SA处理时间的延长其表达量逐渐升高,在SA处理6 h后表达量最高。编码多酚氧化酶(PPO)的两个基因Unigene12832和Unigene12832在SA处理3 h和6 h后的表达量增加较为明显。而苯丙氨酸途径的催化酶基因表达变化不明显。这说明SA处理后毛蕊花糖苷含量的增加可能主要与酪氨酸途径部分催化酶基因的表达量增加有关。
2.5 差异表达转录因子筛选
对SA处理不同时间后地黄块根中差异表达的转录因子进行分析,结果表明(表2),25种转录因子的编码基因在处理前后呈差异表达。在处理1和3 h后,下调表达的转录因子较多,处理6 h后则上调表达的转录因子较多。WRKY、MYB、bHLH、AP2-EREBP、NAC和GRAS转录因子的差异表达基因较多,其中AP2-EREBP、WRKY和MYB的差异表达基因最多,且均表现为SA处理1 h后下调的基因较多, 3 h和6 h后上调表达的基因较多。进一步分析发现,共有20个转录因子编码基因在SA处理后的3个时间点均上调表达(表3),其中NAC和AP2-EREBP基因均为4个,WRKY基因有3个,MYB、GRAS、PLATZ基因各2个,bHLH、MADS和C2C2-CO-lik基因各1个。具有调控毛蕊花糖苷合成功能的RgWRKY37编码基因CL394.Contig2在SA处理1、3、6 h后的Log2(SA处理/CK)的值分别为0.79、0.82和0.57,Log2(SA处理/CK)的值虽然小于1,但其Q-value和P-value均达到了显著水平,说明在SA处理后CL394.Contig2上调表达。
表 2 SA处理后差异表达的转录因子数Table 2. Number of differentially expressed transcription factors (TFs) after SA treatment转录因子
Transcription factorCK-vs-1 h CK-vs-3 h CK-vs-6 h 共同差异表达的基因数
Number of common DEGs下调 Down 上调 Up 下调 Down 上调 Up 下调 Down 上调 Up zf-HD 2 1 1 1 0 0 0 WRKY 11 5 8 16 5 15 5 TUB 1 0 1 1 0 0 0 Trihelix 1 0 1 0 0 0 0 Tify 1 0 3 0 3 0 1 PLATZ 0 4 0 4 1 3 2 SRS 0 0 2 0 2 0 0 OFP 2 0 3 0 1 0 0 NAC 2 8 2 6 0 8 4 MYB 15 10 5 7 6 12 3 mTERF 1 0 2 0 1 1 0 MADS 2 2 3 4 2 2 1 LOB 1 0 4 2 2 0 0 HSF 5 2 4 6 3 6 2 GRAS 1 8 0 4 0 7 2 G2-like 2 0 2 1 0 3 0 CPP 2 0 2 0 4 0 2 C2H2 3 1 8 1 3 1 2 C2C2-GATA 2 0 1 0 5 0 0 C2C2-Dof 1 1 3 0 2 1 0 C2C2-CO-like 0 1 0 2 4 3 1 bZIP 1 2 0 0 1 0 0 bHLH 12 3 15 4 5 4 2 AP2-EREBP 15 12 12 18 9 21 6 ABI3VP1 5 2 7 1 1 1 0 总数 88 62 89 78 60 88 33 表 3 SA处理后上调表达的转录因子基因Table 3. Up-regulated transcription factor genes after SA treatment转录因子
Transcription factor基因
GeneLog2(SA/CK) 功能
Function1 h 3 h 6 h AP2-EREBP CL1637.Contig3 2.82 1.29 2.42 Ethylene-responsive transcription factor ERF071 AP2-EREBP CL4501.Contig2 1.66 1.75 2.16 Pathogenesis-related genes transcriptional activator PTI6 AP2-EREBP CL7827.Contig1 1.77 3.51 4.24 Ethylene-responsive transcription factor ERF106-like AP2-EREBP Unigene2558 1.62 1.06 1.74 Ethylene-responsive transcription factor 2-like MYB CL1983.Contig1 4.55 4.19 3.12 Transcription factor TFIIIB component B''-like MYB CL4303.Contig1 3.76 2.61 3.47 Single MYB histone protein NAC CL2945.Contig2 6.82 7.15 7.51 NAC domain-containing protein 82-like isoform X1 NAC CL4851.Contig1 3.15 1.99 2.44 NAC transcription factor 29 NAC CL4851.Contig2 3.15 2.27 2.82 NAC transcription factor 29 NAC Unigene5193 2.09 1.38 2.37 NAC domain-containing protein 72 C2C2-CO-like CL5505.Contig3 2.94 2.66 4.31 Zinc finger protein CONSTANS-LIKE 4-like PLATZ CL5569.Contig1 2.31 1.49 2.53 Interleukin-1 receptor-associated kinase 4 PLATZ CL5569.Contig3 2.47 1.71 2.38 Interleukin-1 receptor-associated kinase 4 GRAS CL645.Contig2 1.93 1.65 2.91 Scarecrow-like protein 14 GRAS Unigene10453 1.03 1.03 1.08 Scarecrow-like protein 15 WRKY CL6521.Contig1 2.84 1.66 2.35 Probable WRKY transcription factor 25 WRKY CL7324.Contig3 1.13 1.59 1.21 Probable WRKY transcription factor 35 WRKY CL791.Contig6 2.59 2.28 2.29 Probable WRKY transcription factor 40 bHLH Unigene12420 2.20 2.20 2.29 Phytochrome-interacting factor 3 MADS Unigene23315 2.17 3.01 2.27 MADS-box transcription factor 2.6 qRT-PCR验证基因表达差异
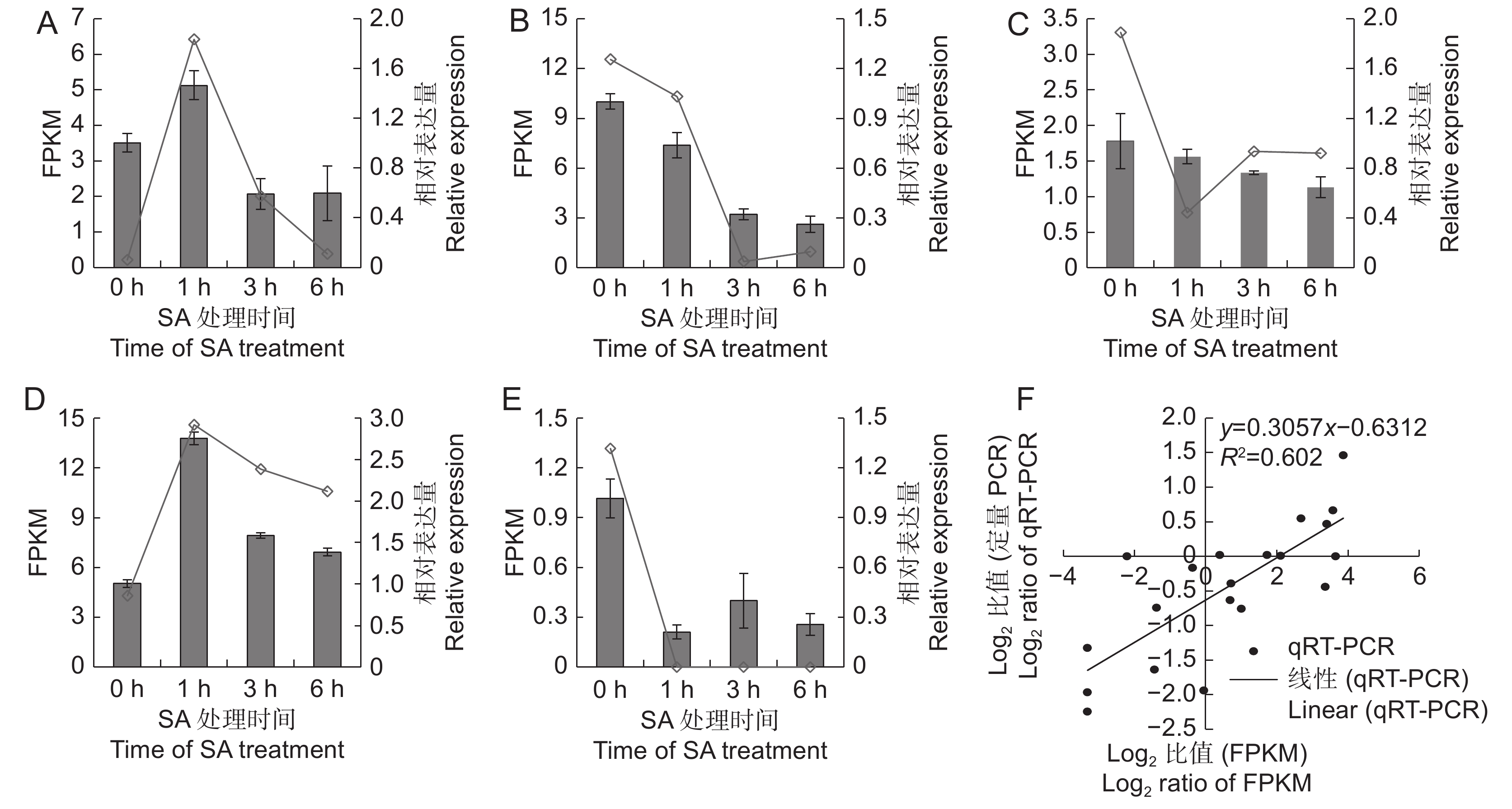
为了验证转录组测序对基因表达量分析的可靠性,随机选取CL7331.Contig2、Unigene1886、CL985.Contig1、CL5931.Contig2和CL379.Contig3等5个基因,利用qRT-PCR方法检测其在不同样本中的相对表达量。结果表明(图5),5个基因的定量结果与转录组获得的FPKM值变化趋势基本一致,其中CL7331.Contig2和CL5931.Contig2为SA处理后上调表达的基因,Unigene1886、CL985.Contig1和CL379.Contig3为SA处理后下调表达的基因。qRT-PCR与转录组测序的Pearson相关系数为0.602,相关性达显著水平,说明利用转录组测序分析SA处理后的基因表达量结果可靠。
![]() 图 5 差异表达基因的qRT-PCR验证A ~ E分别为CL7331.Contig2、Unigene1886、CL985.Contig1、CL5931.Contig2和CL379.Contig3的FPKM值与相对表达量;F:FPKM值与qRT-PCR的相关性分析。Figure 5. Validation of DEGs by qRT-PCRA–E: Represent expression and FPKM values of CL7331.Contig2, Unigene1886, CL985.Contig1, CL5931.Contig2, and CL379.Contig3; F: Correlation analysis between FPKM and qRT-PCR data.
图 5 差异表达基因的qRT-PCR验证A ~ E分别为CL7331.Contig2、Unigene1886、CL985.Contig1、CL5931.Contig2和CL379.Contig3的FPKM值与相对表达量;F:FPKM值与qRT-PCR的相关性分析。Figure 5. Validation of DEGs by qRT-PCRA–E: Represent expression and FPKM values of CL7331.Contig2, Unigene1886, CL985.Contig1, CL5931.Contig2, and CL379.Contig3; F: Correlation analysis between FPKM and qRT-PCR data.3. 讨论
植物次生代谢产物的积累既受自身遗传因素的控制,也受生长过程中生物与非生物环境条件的影响。一般而言,若药用植物的次生代谢产物在细胞中的含量相对较低,则会制约次生代谢产物的最终含量。近年来,人们常利用生物和非生物诱导子对植物进行处理,以提高植物特定次生代谢产物的生产[12]。如花生四烯酸(AA)、SA、茉莉酸甲酯(MeJA)和AgNO3均能够提高紫杉醇的含量[13]。50 µmol/L的乙烯利可以显著促进人参(Panax ginseng C. A. Meyer)根的生长和人参皂苷的积累[14]。诱导子提高苯乙醇苷含量的研究亦有报道,如外源添加Ag + 和腐胺均可以提高肉苁蓉(Cistanche deserticola Y. C. Ma)细胞培养物中松果菊苷和毛蕊花糖苷的含量[15]。本课题组前期研究发现,在地黄毛状根培养的培养基中添加25 μmol/L的SA可将毛蕊花糖苷的含量提高2.28倍[10]。本研究发现,叶面喷施100 μmol/L的SA可显著提高地黄叶片和块根中毛蕊花糖苷的含量,在块根中最高可提高1.4倍,说明在大田中叶面喷施诱导子可有效提高地黄块根中的次生代谢产物,有助于改善中药材的品质。
转录组测序分析不但可以高通量地获得基因表达的有关信息,还能够揭示基因表达与生命现象之间的内在联系,从而表征生命体的生理活动规律并确定其代谢特征[16]。目前,转录组测序不仅用于模式植物和大田作物生长发育及逆境胁迫响应关键基因的筛选[17-19],在药用植物次生代谢产物合成调控的结构基因和转录因子基因的挖掘中也有广泛应用[20-22]。由于地黄为同源四倍体物种,其基因组测序虽有报道[23],但作为参考基因组仍存在一些问题。因此,本研究利用课题组前期获得的地黄根、叶转录组为参考基因集进行分析,发现测序数据的特异匹配率偏低(50%左右),与地黄毛状根转录组测序的结果[10]类似,可能与其为同源四倍体物种有关。地黄叶片表面喷施SA后,上调表达的基因数少于下调表达,与SA处理的地黄毛状根结果[10]不同,这可能与本研究以大田地黄材料进行SA处理有关。本研究还发现,利用RNA-seq分析基因表达与qRT-PCR分析的结果相关系数仅为0.602,虽然达到显著相关,但未达到极显著相关水平,可能与地黄的基因组较大(约2.6 Gb),而采用RNA-seq测序获得的数据量较小有关。因此,对于基因组较大的物种,建议提高RNA-seq测序的深度,以获得更多的基因表达信息,提高基因表达量分析的准确性。
毛蕊花糖苷的生物合成途径目前已经比较清楚,其羟基酪醇基团来源于酪氨酸途径,咖啡酰基团来源于苯丙氨酸途径[24]。本课题组进一步推导、优化了毛蕊花糖苷的生物合成途径,认为毛蕊花糖苷是由羟基酪醇苷和咖啡酰辅酶A在莽草酸邻羟基肉桂酰转移酶(HCT)/毛蕊花糖苷合酶(AcS)和UGT的催化下合成[10]。周延清等[25] 基于地黄代谢组学分析获得了KEGG途径中的香豆酸-3-羟化酶(C3H),并克隆了其全长编码序列。李欣容等[26]根据SA处理下毛状根中催化酶基因的表达特性,鉴定并克隆了响应SA诱导的毛蕊花糖苷合酶基因RgAcS1。Yang等[27] 鉴定了4个酪氨酸脱羧酶(TyDC)基因,遗传转化发现过量表达RgTyDC2和RgTyDC4的地黄块根、纤维根、茎、嫩叶和成熟叶中的毛蕊花糖苷含量均显著高于野生型。Wang等[28]筛选了1个响应SA和H2O2诱导的WRKY转录因子基因RgWRKY37,功能研究发现RgWRKY37过量表达的毛状根转化体中毛蕊花糖苷和总苯乙醇苷的含量均显著高于对照。本研究发现,在SA处理的地黄块根中2个ALDH基因、1个UGT基因和2个PPO基因均上调表达,可能与块根中毛蕊花糖苷的含量增加有关。同时,在SA处理后的3个时间点,编码WKRY、NAC和AP2-EREBP等转录因子的20个基因均显著上调表达,其中RgWRKY37的表达量均明显增加。本研究结果为进一步探讨SA诱导毛蕊花糖苷合成的分子机理奠定了基础。
-
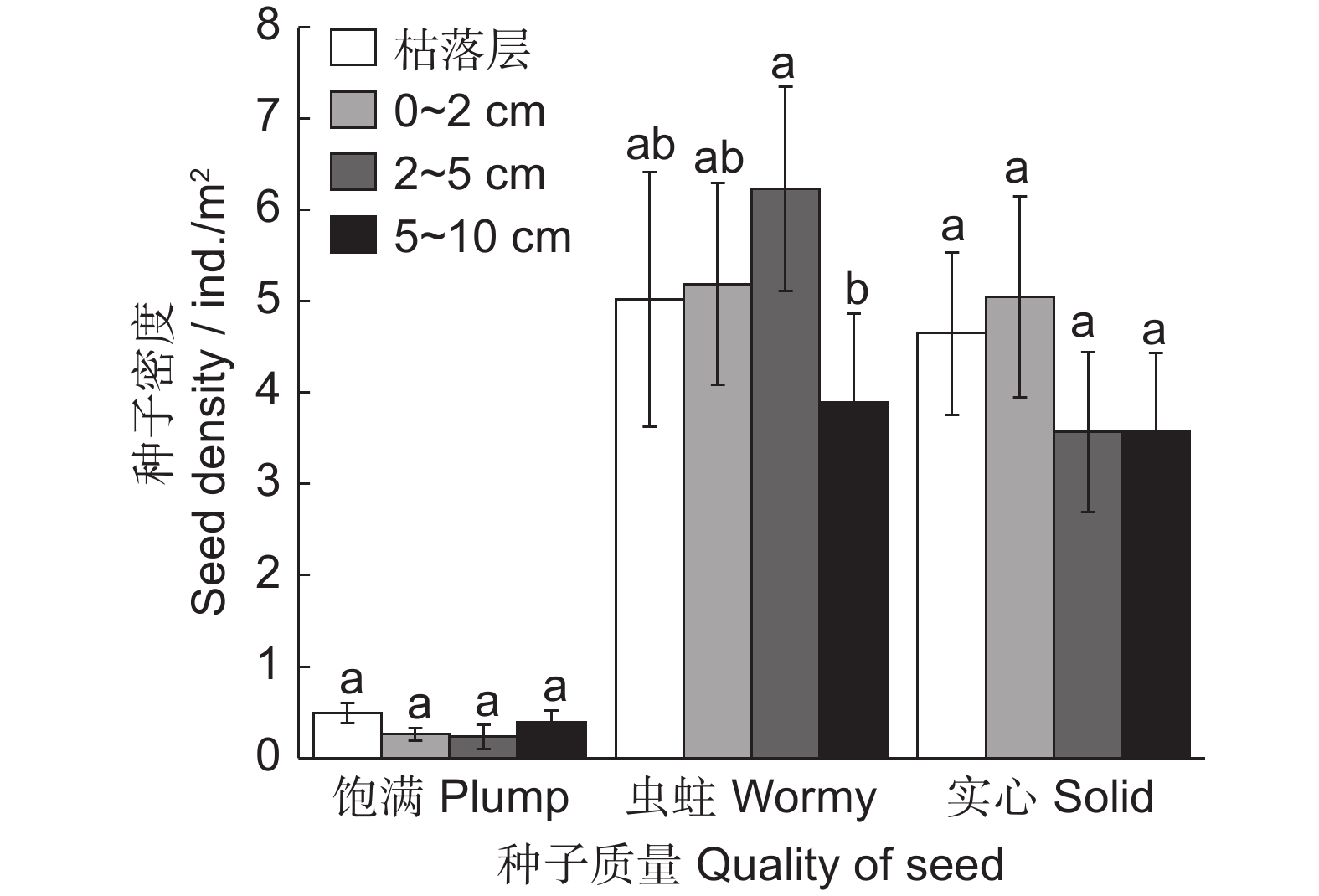
图 3 不同海拔梯度准噶尔山楂种子垂直分布特征
A:饱满种子,B:虫蛀种子,C:实心种子。大写字母分别表示同一海拔不同土层间差异显著(P < 0.05);小写字母表示不同海拔同一土层间差异显著(P < 0.05)。
Figure 3. Vertical distribution characteristics of Crataegus songarica seeds at different altitudes
A: Plump seeds, B: Wormy seeds, C: Solid seeds. Different capital letters indicate significant differences between different soil layers at the same altitude (P < 0.05). Different lowercase letters indicate significant differences between different altitudes in the same soil layer (P < 0.05).
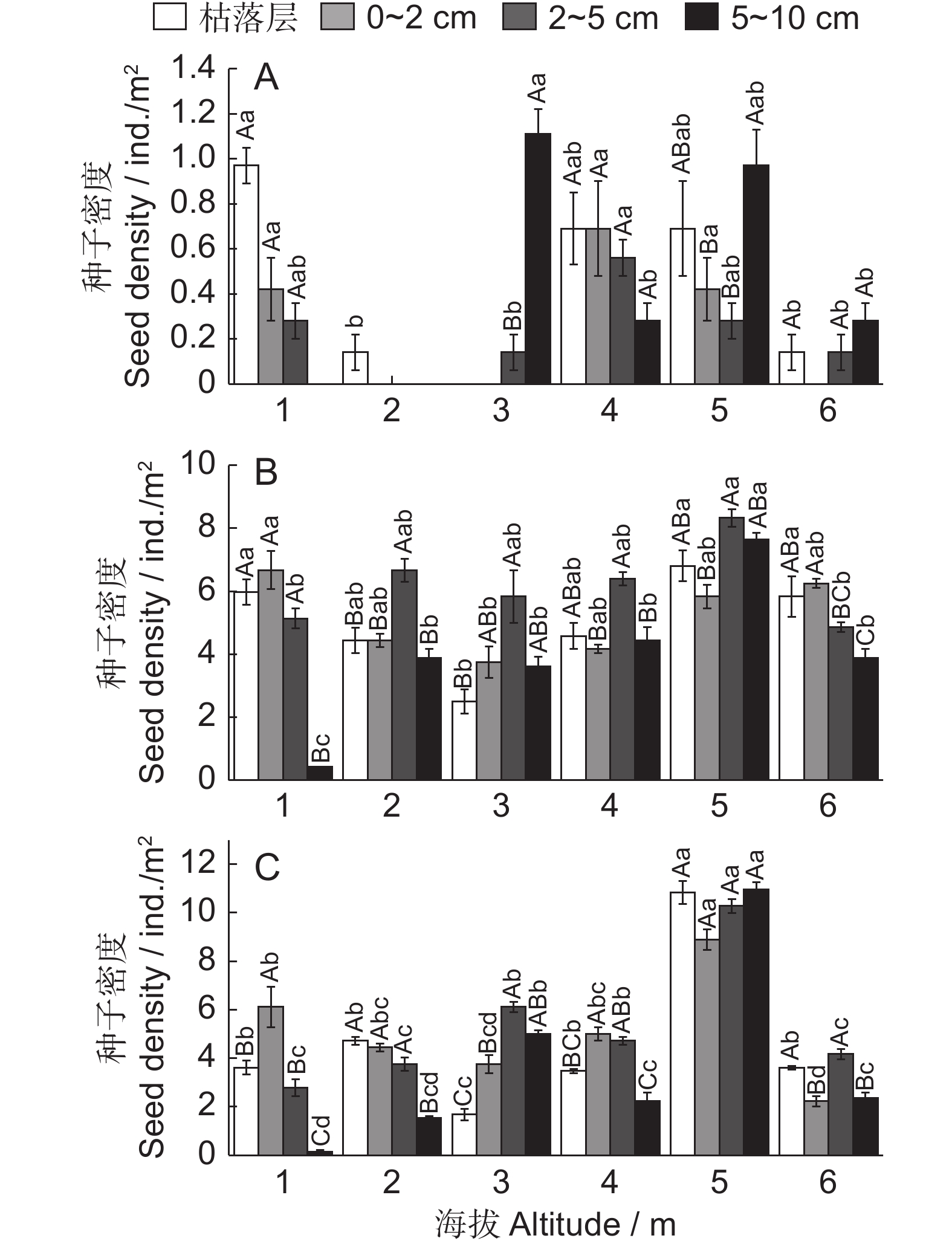
图 4 准噶尔山楂种子水平方向分布特征
A:总种子,B:饱满种子,C:虫蛀种子,D:实心种子。大写字母表示同一海拔不同方向种子间差异显著(P < 0.05);小写字母表示不同海拔同一方向间差异显著(P < 0.05)。
Figure 4. Horizontal distribution characteristics of Crataegus songarica seeds
A: Total seeds; B: Plump seeds; C: Wormy seeds; D: Solid seeds. Different capital letters indicate significant differences between seeds in different directions at the same altitude (P < 0.05). Different lowercase letters indicate significant differences between seeds in the same direction at different altitudes (P < 0.05).
表 1 不同海拔准噶尔山楂土壤种子库组成
Table 1 Composition of soil seed bank of Crataegus songarica at different altitudes
海拔梯度
Altitudinal gradient / m种子密度 Seed density / ind./m2 虫蛀 Wormy 实心 Solid 饱满 Plump 总计 Total 1000~1100 18.33 ± 0.29Abc 12.64 ± 0.17Bb 1.67 ± 0.29Cab 31.25 ± 3.06b 1100~1200 19.44 ± 0.38Abc 13.62 ± 0.53Bb 0.1 4 ± 0.10Cb 34.03 ± 2.64b 1200~1300 16.11 ± 0.58Ac 16.22 ± 1.13Ab 0.42 ± 0.14Bab 30.55 ± 4.10b 1300~1400 19.03 ± 1.09Abc 15.42 ± 0.93Bb 2.22 ± 0.45Ca 36.67 ± 2.07b 1400~1500 28.61 ± 1.76Ba 40.98 ± 3.73Aa 2.36 ± 0.71Ca 71.95 ± 3.41a 1500~1600 20.83 ± 2.65Ab 12.36 ± 2 .39Bb 0.28 ± 0.19Cb 33.75 ± 5.08b 百分比 / % 50.83 46.22 2.95 注:大写字母表示同一海拔不同类种子密度间存在显著差异(P < 0.05);小写字母表示不同海拔同类种子密度间存在显著差异(P < 0.05)。 Notes: Different capital letters represent significant differences between different seeds at the same altitude (P < 0.05). Different lowercase letters represent significant differences between the same seeds at different altitudes (P < 0.05). 表 2 不同海拔梯度内准噶尔山楂种子距离分布特征
Table 2 Distance distribution characteristics of Crataegus songarica seeds at different altitudinal gradients
海拔梯度
Altitudinal gradient / m距离
Distance / m种子密度 Seed density / ind./m2 虫蛀 Wormy 实心 Solid 饱满 Plump 1000~1100 1 9.31 ± 0.92Aa 6.39 ± 0.47Ab 0.42 ± 0.3Bc 2 5.83 ± 0.52Ba 3.89 ± 0.24Bb 0.97 ± 0.11Ac 3 2.5 ± 0.50Ca 2.5 ± 0.61ABa 0.28 ± 0.01Bb 4 0.69 ± 0.04Ca 0.14 ± 0.10Cb 0 5 0 0 0 1100~1200 1 10.56 ± 0.98Aa 7.64 ± 0.52Aa 0 2 5.69 ± 0.13Ba 3.89 ± 0.09Bb 0.14 ± 0.10c 3 2.92 ± 0.05Ca 0.14 ± 0.10Ca 0 4 0.14 ± 0.10Da 0.14 ± 0.10Ca 0 5 0.14 ± 0.10Da 0.14 ± 0.10Ca 0 1200~1300 1 5.97 ± 0.34Aa 5.83 ± 0.54Aa 0.14 ± 0.10Ab 2 4.31 ± 0.32Ba 3.19 ± 0.07Ba 0.14 ± 0.10Ab 3 3.33 ± 0.32Ba 1.94 ± 0.19Bb 0 4 1.11 ± 0.17Cb 3.19 ± 0.17Ba 0.14 ± 0.10Ac 5 1.39 ± 0.18Ca 3.19 ± 0.17Ba 0 1300~1400 1 7.36 ± 0.93Aa 7.36 ± 0.93Aa 1.25 ± 0.12Ac 2 5.97 ± 0.56Aa 5.97 ± 0.93Aa 0.42 ± 0.04Bb 3 4.17 ± 08Ba 3.33 ± 0.09Ba 0.56 ± 0.11Bb 4 2.22 ± 0.06Ca 2.22 ± 0.06Ba 0 5 0 0 0 1400~1500 1 13.19 ± 0.98Ab 21.67 ± 1.22Aa 0.97 ± 0.09Ac 2 6.39 ± 0.78Bb 9.17 ± 0.56Ba 0.42 ± 0.02Bc 3 5.28 ± 0.54Ba 5.14 ± 0.34Ba 0.42 ± 0.11Bb 4 2.36 ± 0.21BCa 2.08 ± 0.21Ba 0.14 ± 0.17Bb 5 0.42 ± 0.03Ca 1.53 ± 0.15Ba 0.14 ± 0.10Ba 1500~1600 1 8.61 ± 0.88Aa 4.03 ± 0.54Ab 0 2 4.44 ± 0.54Ba 1.39 ± 0.33Bb 0.14 ± 0.10c 3 4.17 ± 0.33Ba 2.36 ± 0.45ABb 0 4 2.64 ± 0.81Ca 3.33 ± 0.33Aa 0 5 1.67 ± 0.22Ca 0.97 ± 0.09Ca 0 注:大写字母表示同一海拔不同距离相同种子间有显著差异(P < 0.05);小写字母表示同一海拔相同距离不同种子间有显著差异(P < 0.05)。 Notes: Different capital letters indicate significant differences between the same seeds at the same altitude and different distance (P < 0.05). Different lowercase letters indicate significant differences between seeds at the same altitude and distance (P < 0.05). 表 3 准噶尔山楂幼苗分布特征
Table 3 Seedling characteristics of Crataegus songarica
海拔梯度
Altitudinal gradient / m距离
Distance / m株高
Plant height / cm基径
Base diameter / mm实生苗
Seedling萌生苗
Sprout每平方的苗
Seedling / m21000~1100 1.28 ± 0.59 7.97 ± 0.81 1.04 ± 0.04 0 6 0.27 1100~1200 1.08 ± 0.17 6.92 ± 0.81 1.05 ± 0.04 2 8 0.68 1200~1300 1.27 ± 0.32 8.26 ± 0.51 1.05 ± 0.04 1 10 0.48 1300~1400 0.74 ± 0.11 5.48 ± 0.34 1.03 ± 0.03 0 7 0.30 1400~1500 0.86 ± 0.08 6.30 ± 0.41 0.87 ± 0.06 1 8 0.19 1500~1600 2.24 ± 0.72 7.25 ± 0.60 1.05 ± 0.05 1 7 0.22 -
[1] 高郯,李照青,卢杰,李江荣,郑维列. 西藏工布自然保护区高山松林土壤种子库空间分布动态特征[J]. 林业科学研究,2021,34(2):158−165. Gao T,Li ZQ,Lu J,Li JR,Zheng WL. Study on spatial distribution dynamic characteristics of soil seed bank of Pinus densata forest in Gongbu Nature Reserve,Tibet[J]. Forest Research,2021,34 (2):158−165.
[2] 刘进娣,马红彬,周瑶,马菁,沈艳,等. 轮牧时间对荒漠草原土壤种子库特性的影响[J]. 应用生态学报,2021,32(7):2378−2388. Liu JD,Ma HB,Zhou Y,Ma J,Shen Y,et al. Effects of rotation grazing time on the characteristics of soil seed bank in desert steppe[J]. Chinese Journal of Applied Ecology,2021,32 (7):2378−2388.
[3] Chalermsri A,Ampornpan LA,Purahong W. Seed rain,soil seed bank,and seedling emergence indicate limited potential for self-recovery in a highly disturbed,tropical,mixed deciduous forest[J]. Plants,2020,9 (10):1391. doi: 10.3390/plants9101391
[4] 邢旭明,马晓东,张元明. 古尔班通古特沙漠生物土壤结皮对土壤种子库多样性与分布特征的影响[J]. 生态学杂志,2016,35(3):612−620. Xing XM,Ma XD,Zhang YM. Effects of biological soil crusts on soil seed bank diversity and distribution characteristics in Gurbantunggut Desert[J]. Chinese Journal of Ecology,2016,35 (3):612−620.
[5] Williams LK,Kristiansen P,Sindel BM,Wilson SC,Shaw JD. Quantifying the seed bank of an invasive grass in the sub-Antarctic:seed density,depth,persistence and viability[J]. Biol Invasions,2016,18 (7):2093−2106. doi: 10.1007/s10530-016-1154-x
[6] Fernanda MG,Clemir CDO,Roberta DRM,Rafael CDC,Maria IBL,Loiola MIB. Relationships between soil seed bank composition and standing vegetation along chronosequences in a tropical dry forest in north-eastern Brazil[J]. J Trop Ecol,2019,35 (4):173−184. doi: 10.1017/S0266467419000130
[7] 朱晨曦,刘志刚,王昌辉,王大洋,郭思,等. 土壤种子库特征及与地上植被的关系:以福建省三明市杉木人工林为例[J]. 中国环境科学,2019,39(10):4416−4423. Zhu CX,Liu ZG,Wang CH,Wang DY,Guo S,et al. Characteristics of soil seed bank and its relationship with aboveground vegetation:a case study of Chinese fir plantations in Sanming City,Fujian Province[J]. China Environmental Science,2019,39 (10):4416−4423.
[8] 蔡杰,张挺,刘成,张桥蓉,郭永杰,杨湘云. 野生植物种子采集技术规范[J]. 植物分类与资源学报,2013,35(3):221−233. Cai J,Zhang T,Liu C,Zhang QR,Guo YJ,Yang XY. Synopsis of technical standards for collecting seeds from wild plants[J]. Plant Diversity and Resources,2013,35 (3):221−233.
[9] 刘影,赵玉,闫俊杰,李海冰,丛桂芝. 新疆野生樱桃李天然林土壤种子库特征[J]. 干旱区研究,2013,30(4):666−673. Liu Y,Zhao Y,Yan JJ,Li HB,Cong GZ. Soil seed bank under natural forest of Prunus divaricata in Xinjiang,China[J]. Arid Zone Research,2013,30 (4):666−673.
[10] 邹林林. 不同海拔梯度蒙古扁桃种子库的研究[D]. 呼和浩特: 内蒙古师范大学, 2009: 1-55. [11] 李照青,高郯,张铎,卢杰. 西藏林芝高山松土壤种子库空间分布特征研究[J]. 西北林学院学报,2019,34(4):43−48. Li ZQ,Gao T,Zhang D,Lu J. Spatial distribution characteristics of soil seed bank of Pinus densata in Linzhi,Tibet[J]. Journal of Northwest Forestry University,2019,34 (4):43−48.
[12] 田晓萍,马力,占玉芳. 祁连山祁连圆柏土壤种子库海拔梯度分布格局[J]. 山地学报,2019,37(5):662−668. doi: 10.16089/j.cnki.1008-2786.000457 Tian XP,Ma L,Zhan YF. Distribution patterns of soil seed bank of Sabina przewalskii along altitudinal gradient in the Qilian Mountains,China[J]. Mountain Research,2019,37 (5):662−668. doi: 10.16089/j.cnki.1008-2786.000457
[13] 谭向前,陈芳清,王稷,熊丹伟,许建新. 川西山区自然边坡土壤种子库随海拔梯度的变化[J]. 山地学报,2019,37(4):508−517. Tan XQ,Chen FQ,Wang J,Xiong DW,Xu JX. Variations of soil seed bank of natural slopes in the western Sichuan mountainous region along altitude gradient[J]. Mountain Research,2019,37 (4):508−517.
[14] 张敏,宋晓阳. 热带森林群落土壤种子库对海拔梯度的响应[J]. 生态学杂志,2015,34(9):2390−2400. Zhang M,Song XY. Responses of soil seed banks in tropical forests to an elevational gradient[J]. Chinese Journal of Ecology,2015,34 (9):2390−2400.
[15] 范贺娟,来风兵,曹家睿,陈蜀江,许超宗. 天山野果林区滑坡景观时空演变及生态风险预测[J]. 山地学报,2020,38(2):231−240. Fan HJ,Lai FB,Cao JR,Chen SJ,Xu CZ. Spatio-temporal evolution and ecological risk prediction of landslide landscape in the Tianshan wild fruit forest area[J]. Mountain Research,2020,38 (2):231−240.
[16] 方紫妍,李林瑜,艾克拜尔·毛拉,周龙,陆彪. 人为干扰对西天山野果林群落结构和物种多样性的影响[J]. 水土保持通报,2019,39(2):267−274. Fang ZY,Li LY,Aikebaier·Maola,Zhou L,Lu B. Effects of human disturbance on plant diversity of wild fruit forests in western Tianshan Mountain[J]. Bulletin of Soil and Water Conservation,2019,39 (2):267−274.
[17] 阎国荣,张立运,许正. 天山野果林生态系统受损现状及其保护[J]. 干旱区研究,1999,16(4):1−4. Yan GR,Zhang LY,Xu Z. The suffer losses for wild fruits forest ecosystem of Tianshan Mts in Xinjiang and its conservation[J]. Arid Zone Research,1999,16 (4):1−4.
[18] 杨蕾,吕海英,李进,马雪,艾克拜尔·依米提. 新疆天山野果林准噶尔山楂种群结构与动态分析[J]. 西北植物学报,2018,38(12):2314−2323. Yang L,Lü HY,Li J,Ma X,Akbar · Yimit. Structure and dynamic analysis of Crataegus songarica K. Koch population in Tianshan wild fruit forest of Xinjiang[J]. Acta Botanica Boreali-Occidentalia Sinica,2018,38 (12):2314−2323.
[19] 吕海英,周露露,李进,张瑾. 准噶尔山楂果实色素提取工艺研究[J]. 安徽农学通报,2011,17(9):25−27. Lü HY,Zhou LL,Li J,Zhang J. The studies on extracting technology of pigments from Crataegus Songorica K. Koch[J]. Anhui Agricultural Science Bulletin,2011,17 (9):25−27.
[20] 盛芳,陈淑英,田嘉,李鹏,秦雪,等. 新疆准噶尔山楂不同居群的遗传多样性[J]. 生物多样性,2017,25(5):518−530. doi: 10.17520/biods.2016369 Sheng F,Chen SY,Tian J,Li P,Qin X,et al. Genetic diversity of Crataegus songorica in Xinjiang[J]. Biodiversity Science,2017,25 (5):518−530. doi: 10.17520/biods.2016369
[21] 张侠,李进,吕海英,李志成,周燕荣,赵颖. 准噶尔山楂种壳、种皮、种胚特性与种子休眠的关系[J]. 植物生理学报,2014,50(6):867−874. Zhang X,Li J,Lü HY,Li ZC,Zhou YR,Zhao Y. Relationship between characteristic of Crataegus songorica husk,seed coat,embryo and seed dormancy[J]. Plant Physiology Journal,2014,50 (6):867−874.
[22] 刘欢,廖康,刘娟,赵世荣,孙琪,曹倩. 新疆野生山楂资源遗传多样性及亲缘关系的ISSR分析[J]. 经济林研究,2016,34(2):19−23. Liu H,Liao K,Liu J,Zhao SR,Sun Q,Cao Q. Analysis of genetic diversity and genetic relationship of wild hawthorn resources in Xinjiang by ISSR markers[J]. Nonwood Forest Research,2016,34 (2):19−23.
[23] 尚天翠,刘影,赵玉. 新疆野生樱桃李林自然保护区不同海拔梯度土壤养分特征及相关性分析[J]. 中国农业科技导报,2018,20(8):119−127. Shang TC,Liu Y,Zhao Y. Nutrient Characteristics and correlation analysis of soil under Prunus divaricata in Xinjiang[J]. Journal of Agricultural Science and Technology,2018,20 (8):119−127.
[24] 林培均, 崔乃然. 天山野果林资源-伊犁野果林综合研究[M]. 北京: 中国林业出版社, 2000: 22-24. [25] 刘影,张相锋,赵玉,甘宇平. 新疆濒危野生樱桃李的种群结构与动态[J]. 生态学杂志,2013,32(7):1762−1769. Liu Y,Zhang XF,Zhao Y,Gan YP. Population structure and its dynamics of wild Prunus divaricata in Xinjiang,Northwest China[J]. Chinese Journal of Ecology,2013,32 (7):1762−1769.
[26] 赵玉,刘影,尚天翠,刘波. 新疆野生樱桃李在不同微生境中的根蘖繁殖特性[J]. 干旱区研究,2015,32(5):947−952. Zhao Y,Liu Y,Shang TC,Liu B. Root sucker propagation of wild Prunus divaricata in different micro-habitats in Xinjiang,China[J]. Arid Zone Research,2015,32 (5):947−952.
[27] 毛君竹,郑卫国,王定跃,曾鹏飞,王业春. 土壤种子库在生态园林工程中的应用潜力研究[J]. 中国园林,2020,36(9):122−126. doi: 10.19775/j.cla.2020.09.0122 Mao JZ,Zheng WG,Wang DY,Zeng PF,Wang YC. Research on the application potential of soil seed bank in ecological landscape engineering[J]. Chinese Landscape Architecture,2020,36 (9):122−126. doi: 10.19775/j.cla.2020.09.0122
[28] 卢彦磊,张文辉,杨斌,王亚楠. 秦岭中段不同坡向锐齿栎种子雨、土壤种子库与幼苗更新[J]. 应用生态学报,2019,30(6):1965−1973. Lu YL,Zhang WH,Yang B,Wang YN. Seed rain,soil seed bank and seedling regeneration of Quercus aliena var. acureserrata in different slope directions on the middle Qinling Mountains,China[J]. Chinese Journal of Applied Ecology,2019,30 (6):1965−1973.
[29] 白文娟,章家恩,全国明. 土壤种子库研究的热点问题及发展趋向[J]. 土壤,2012,44(4):562−569. Bai WJ,Zhang JE,Quan GM. Hot topics and developing trends in soil seed bank[J]. Soils,2012,44 (4):562−569.
[30] 张玲,方精云. 太白山南坡土壤种子库的物种组成与优势成分的垂直分布格局[J]. 生物多样性,2004,12(1):123−130. doi: 10.17520/biods.2004015 Zhang L,Fang JY. Composition and dominant species of soil seed bank along an altitudinal gradient in Mt. Taibai,Qinling Mountains[J]. Biodiversity Science,2004,12 (1):123−130. doi: 10.17520/biods.2004015
[31] 刘颖,贺静雯,李松阳,余杭,吴建召,等. 蒋家沟流域不同海拔梯度的土壤种子库与地上植被的关系[J]. 西南林业大学学报,2021,41(2):54−67. Liu Y,He JW,Li SY,Yu H,Wu JZ,et al. Relationship between soil seed bank and aboveground vegetation along an altitude gradient in the Jiangjia Gully[J]. Journal of Southwest Forestry University,2021,41 (2):54−67.
[32] Maun MA. Adaptations enhancing survival and establishment of seedlings on coastal dune systems[J]. Vegetatio,1994,111 (1):59−70. doi: 10.1007/BF00045577
[33] 郭连金,徐卫红,房会普,肖志鹏,田玉清,等. 不同年龄香果树种子雨和种子库及其更新特征[J]. 西北植物学报,2016,36(11):2273−2282. Guo LJ,Xu WH,Fang HP,Xiao ZP,Tian YQ,et al. Seed rain,seed bank and natural regeneration of Emmenopterys henryi in different age classes[J]. Acta Botanica Boreali-Occidentalia Sinica,2016,36 (11):2273−2282.
[34] 李林瑜,方紫妍,艾克拜尔·毛拉,周龙,陆彪. 西天山野果林不同居群黑果小檗土壤种子库及幼苗更新研究[J]. 植物科学学报,2018,36(4):534−540. Li LY,Fang ZY,Aikebaier · Maola,Zhou L,Lu B. Research on the soil seed bank and seedling renewal of different populations of Berberis atrocarpa in the western Tianshan wild fruit forest[J]. Plant Science Journal,2018,36 (4):534−540.
[35] Gasparin E,Faria JMR,José AC,Tonetti OAO,de Melo RA,Hilhorst HWM. Viability of recalcitrant Araucaria angustifolia seeds in storage and in a soil seed bank[J]. J For Res,2020,31 (6):2413−2422. doi: 10.1007/s11676-019-01001-z
[36] 陈本学,李雁冰,范少辉,刘广路,申景昕. 海南甘什岭白藤土壤种子库特征及幼苗更新能力[J]. 生态学杂志,2020,39(4):1091−1100. Chen BX,Li YB,Fan SH,Liu GL,Shen JX. Seed bank and seedling regeneration of Calamus tetradactylus in Ganzhaling,Hainan Province[J]. Chinese Journal of Ecology,2020,39 (4):1091−1100.
[37] 吴春燕,陈永富,陈巧,洪小江,韩文涛,李晓成. 海南霸王岭陆均松种子雨和土壤种子库特征[J]. 热带亚热带植物学报,2018,26(1):13−23. Wu CY,Chen YF,Chen Q,Hong XJ,Han WT,Li XC. Characteristics of seed rain and soil seed bank of Dacrydium pierrei in Bawangling,Hainan[J]. Journal of Tropical and Subtropical Botany,2018,26 (1):13−23.
[38] Nathan R,Safriel UN,Noy-Meir I,Schiller G. Spatiotemporal variation in seed dispersal and recruitment near and far from Pinus halepensis trees[J]. Ecology,2000,81 (8):2156−2169. doi: 10.1890/0012-9658(2000)081[2156:SVISDA]2.0.CO;2
[39] 帕瑞,董连新,张银来,牟畅. 新疆变色石竹土壤种子库特征及其对种子萌发的影响[J]. 新疆农业大学学报,2016,39(6):458−462. Pa R,Dong LX,Zhang YL,Mu C. Characteristics of soil seed bank of Dianthus versicolor and their effects on seed germination[J]. Journal of Xinjiang Agricultural University,2016,39 (6):458−462.
[40] 金屿淞,李慧仁,张培林. 天然偃松土壤种子库空间分布研究[J]. 林业调查规划,2015,40(4):30−33. Jin YS,Li HR,Zhang PL. Soil seed bank spatial distribution of natural Pinus pumila[J]. Forest Inventory and Planning,2015,40 (4):30−33.
[41] Baskin CC, Baskin JM. Seeds: Ecology, Biogeography, and Evolution of Dormancy and Germination[M]. 2nd ed. Amsterdam: Elsevier, 2014: 1-10.
[42] 许建伟,沈海龙,张秀亮,张鹏. 我国东北东部林区花楸树的天然更新特征[J]. 应用生态学报,2010,21(1):9−15. Xu JW,Shen HL,Zhang XL,Zhang P. Natural regeneration characteristics of Sorbus pohuashanensis in forest region of eastern Northeast China[J]. Chinese Journal of Applied Ecology,2010,21 (1):9−15.
-
期刊类型引用(0)
其他类型引用(1)



 下载:
下载: