Changes in texture and color during chestnut (Castanea mollissima Blu.) water loss based on LF-NMR
-
摘要:
板栗(Castanea mollissima Blu.)果实中的水分组成在其生理代谢及品质变化过程中具有重要作用。本研究以贵州黔西南望谟县板栗为实验材料,利用低场核磁共振技术,对不同水分含量(48%、38%、28%、18%)的板栗果中氢核的横向弛豫衰减信号进行测试,并利用 SIRT 模型对数据进行反演,得出横向弛豫时间T2 的反演数据。采用自旋回波脉冲序列对板栗果的质子密度加权成像;使用物性测试仪分析质构特性,利用色差仪分析板栗失水过程中果肉颜色的变化。结果显示,自然失水改变了板栗果中水分的结合状态,水分发生明显迁移,自由水和不易流动水的信号幅值随失水程度的加剧而逐渐减弱。不同含水率板栗的反演峰总面积不同,随着含水率的增加,核磁共振信号增强,峰面积增大,两者具有显著的相关性。核磁共振成像技术通过图片明暗不同,可直观反映不同阶段的水分含量。板栗果实自然贮藏过程中发生石灰化,果实质地发生硬化,挤压咀嚼时抵抗力增大,失水初期内聚性和弹性变化不显著,后期下降;粘附性前期降低,但后期变化不明显;板栗失水初期果肉发生氧化,颜色逐渐呈暗红色,失水后期石灰化较为严重,果肉颜色变白,亮度增加。本研究结果可为板栗加工过程中的水分迁移机制探讨以及产品的品质控制提供参考。
Abstract:The water composition in chestnut fruit plays an important role in physiological metabolism and quality changes. In this study, Chinese chestnuts (Castanea mollissima Blu.) from Wangmo County in Southwest Guizhou Province, China, were used as test material. Low-field nuclear magnetic resonance (NMR) technology was used to test the transverse relaxation decay signal of hydrogen nuclei in chestnut fruit with different moisture contents (48%, 38%, 28%, 18%). The SIRT model was used to obtain inversion data of the transverse relaxation time (T2). Nuclear magnetic resonance images (MRI) were obtained by spin echo (SE) imaging, while texture analysis and colorimetry were employed to assess textural and color attributes of the pulp, respectively. Results showed that natural water loss changed the binding state of water in chestnut fruit, leading to significant water migration and gradual weakening of free and immobile water signal amplitudes with increasing water loss. The total inversion peak area of chestnuts with different moisture content differed. With increasing water content, the NMR signal and peak area both increased, showing significant correlation. NMR imaging enabled direct visualization of water content in different stages based on light and dark imaging features. The chestnut flesh underwent calcification during natural storage, with hardened fruit texture, increased resistance to extrusion and chewing, and decreased cohesiveness and springiness (in the later stage). Adhesiveness exhibited an initial decrease, with no significant variation in the later stage. In the early stage of water loss, fruit pulp underwent oxidization, causing a gradual change to a dark red color. In the late stage of water loss, the chestnut fruit underwent severe calcification, and the pulp turned white with increased brightness. These results provide a reference for understanding the mechanism underlying moisture migration and product quality control in the processing of fresh C. mollissima fruit.
-
正常的雌雄配子育性是植物保证后代繁殖的关键因素。对于农作物而言,雌雄配子育性还决定了作物的结实率和产量[1]。雄性不育既是植物最重要的质量性状之一,也是研究水稻(Oryza sativa L.)、小麦(Triticum aestivum L.)、玉米(Zea mays L.)等重要农作物杂种优势利用的基础。目前在水稻、玉米、小麦等作物中利用“三系杂交”的育种方法将雄性不育应用于育种中,极大提高了作物的产量[1-3]。植物雄性育性调控机制已成为近年来杂种优势利用的热门研究方向。
花药和花粉的正常发育是植物雄性繁殖成功的先决条件。从雄蕊原基的形成到花粉粒成熟,直至花药开裂散粉,花药发育受到一系列精细化生物学过程的调控[4]。雄蕊原基细胞经过数轮细胞地分裂和分化,由外至内形成由表皮层、内皮层、中间层和绒毡层4层体细胞包围着花粉母细胞的花药结构。花粉母细胞位于花药室中间,经过减数分裂形成小孢子。小孢子又经过两次不均等的有丝分裂形成成熟的花粉[5]。
1. 植物花药角质层和花粉壁的主要成分
花药和花粉表面分别被花药角质层和花粉壁覆盖,对环境和生物胁迫具有保护作用。花药角质层主要由角质和蜡质组成,角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质围绕在角质的表面,主要由C16 ~ C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。覆盖在成熟花粉粒表面的花粉壁可保护花粉粒不受外界生物或者非生物胁迫损伤,而且能帮助花粉与柱头识别,促进花粉传播[8]。成熟花粉粒的花粉壁由花粉外壁(Exine)、花粉内壁(Intine)和含油层(Tryphine)3层结构组成。花粉壁是一种成分非常复杂的胞外细胞壁基质。目前的研究表明,花粉外壁外层的主要成分是孢粉素,由饱和长链脂肪酸前体或饱和长脂肪链前体经过复杂的生物聚合组成[8, 9]。花粉内壁的成分与普通的细胞壁类似,主要由纤维素、半纤维素和果胶聚合物组成[10]。花粉包被(Pollen coat)或含油层,主要由复杂的脂质、蜡酯、类黄酮、羟肉桂酰基亚精胺代谢产物和蛋白质组成[10]。
角质、蜡质和孢粉素分别是形成花药角质层和花粉外壁的主要成分。研究表明,它们的脂质前体在花药绒毡层细胞中合成,然后被分别转运到花药表面和小孢子表面沉积。前期科学家们通过正向遗传学的手段,分析花药角质层和花粉壁发育缺陷的突变体,鉴定得到一系列蛋白,包括脂质合成酶基因、脂质转运蛋白、转录因子和ABCG转运蛋白等[8, 10, 11]。随着研究的不断深入,大量ABCG转运蛋白被报道参与植物雄性育性调控,本文将系统阐述ABCG转运蛋白参与植物雄性育性调控的功能与机制。
2. ABC转运蛋白的结构特点与分类
ABC转运蛋白又名ATP(Adenosine triphosphate)结合盒式转运蛋白,属于最大的转运蛋白家族。它们广泛存在于微生物到高等植物甚至人类中[12]。ABC转运蛋白属于多结构域的跨膜蛋白,它通过利用自身ATP结合结构域,在Mg2 + 参与下水解ATP获得能量来转运分子,如异生素、激素、糖、氨基酸和离子等[13, 14]。
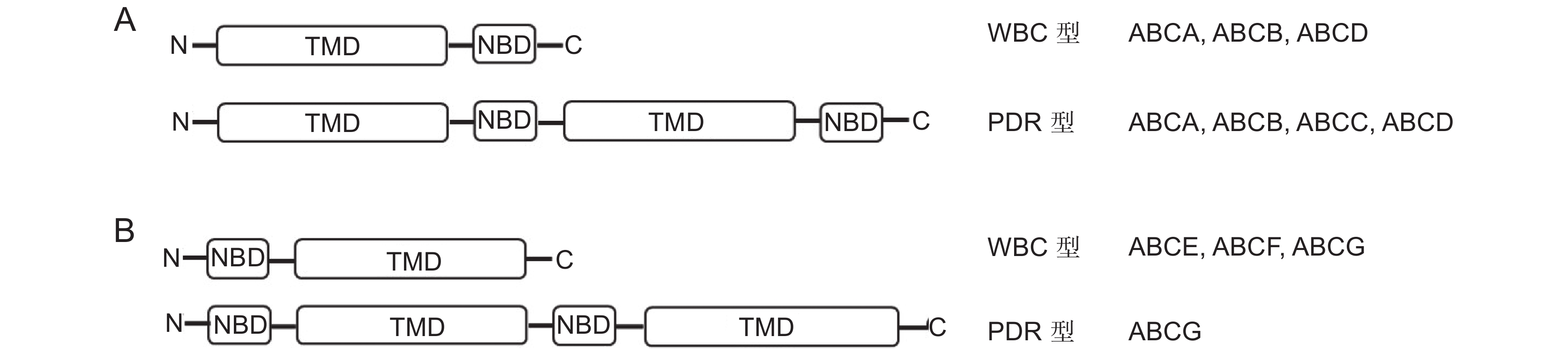
ABC转运蛋白由4个核心结构域组成:两个核苷酸结合结构域(Nucleotide-binding domain,NBD)和两个跨膜结构域(Transmembrane domain,TMD)(图1 :A、B)。根据NBD和TMD的组成可将ABC转运蛋白分为两类,一类是WBC (White/brown complex,WBC)型,其结构包含一个NBD和一个TMD,称为半分子(Half-size)转运蛋白,该类蛋白需要与自身或另外一个半分子转运蛋白结合,形成同源或异源二聚体蛋白发挥转运功能;另一类是PDR(Pleiotropic drug resistance,PDR)型,其结构包含两个NBD和两个TMD,称为全分子(Full-size)转运蛋白,可以单独发挥转运功能[12, 15]。值得一提的是,与其他真核生物ABC转运蛋白不同,植物半分子转运蛋白除了可形成同源二聚体外,还可以与另外的半分子转运蛋白形成异源二聚体[16]。
ABC转运蛋白的NBD和TMD结构域的排布可以是正向(TMD在前,NBD在后,图1:A),也可以是反向(TMD在后,NBD在前,图1:B)。在高等植物中,根据ABC转运蛋白遗传进化特征可分为8个亚族,分别是ABCA(ATP-binding cassette A transporter)至ABCI(ATP-binding cassette Ⅰ transporter),其中ABCH(ATP-binding cassette H transporter)转运蛋白在植物中不存在[17]。ABCA至ABCD(ATP-binding cassette D transporter)亚族蛋白由于TMD位于NBD之前,属于前向转运体[18]。ABCG亚族由于NBD位于TMD之前,属于反向转运体[18, 19]。
植物8个ABC转运蛋白亚族中,ABCG转运蛋白属于最大的一个亚族。在水稻、玉米和拟南芥(Arabidopsis thaliana (L.) Heynh.)中分别含有50、54和43个成员,其蛋白功能复杂多样[20]。其中拟南芥ABCG蛋白亚族包含28个半分子转运蛋白和15个全分子转运蛋白[17, 21]。随着研究的不断深入,ABCG转运蛋白被报道在植物生殖器官发育、激素运输、角质层形成、次生代谢产物分泌和生物或非生物胁迫响应等方面发挥重要作用[15, 22]。其中,ABCG转运蛋白主要是通过调控植物花粉壁的发育和花药角质层的形成来参与植物雄性育性发育过程[23]。
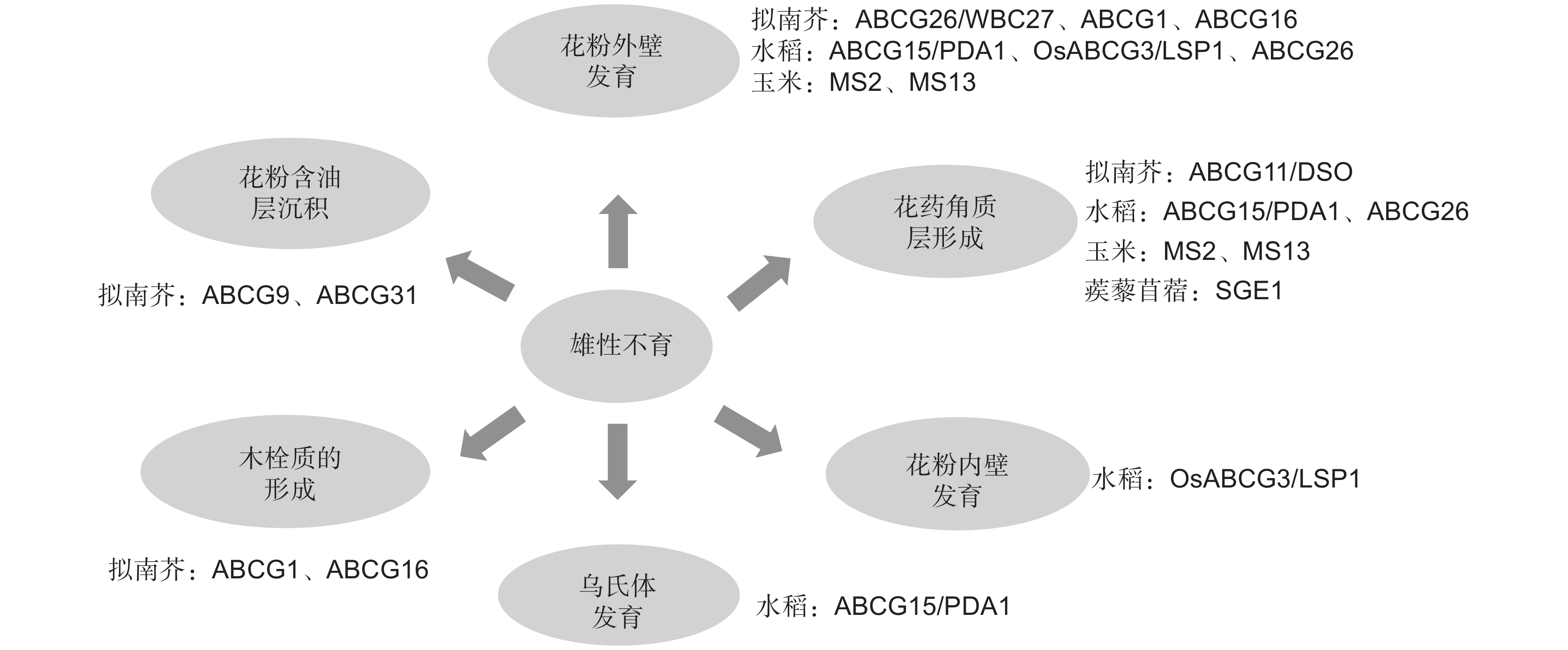
3. ABCG转运蛋白参与调控植物雄性不育的研究现状
3.1 参与调控花粉壁发育
近年来ABCG转运蛋白被多次研究报道参与转运由绒毡层产生的脂类、酚类、其他孢粉素前体物质以及含油层物质用于花粉壁形成[24]。早期研究发现,拟南芥AtABCG26基因与花粉外壁形成过程中多聚酮化合物的运输相关,该基因功能丧失后会导致植物育性显著降低[25-28]。水稻OsABCG15,又称为PDA1(Post-meitotic deficient anther 1),是AtABCG26的同源基因。pda1突变体由于乌氏体及花粉外壁缺失而导致小孢子败育[29, 30]。最近在玉米中首次报道ZmMS2(Zea mays male sterile2)参与调控花药发育,ZmMS2是OsABCG15和AtABCG26的同源基因,该基因突变后导致小孢子外壁发育不正常[31]。值得一提的是,水稻ABCG15基因突变后,突变体除了不能形成有功能的花粉外壁,其花药角质层发育也存在缺陷。但是拟南芥abcg26突变体的花药角质层发育正常。由此可推测水稻ABCG15可能与多个ABCG半分子转运蛋白相互作用,以运输不同的底物用于花粉外壁和花药角质层的形成。另外,Xu等[32]研究发现,拟南芥中一个bHLH转录因子AMS可以直接结合ABCG26基因启动子上的E-boxes,直接调控ABCG26基因的表达,从而影响花粉外壁的发育。但是目前尚未有研究报道水稻OsABCG15和玉米ZmMS2是否受到转录因子的调控。
早期研究报道拟南芥ABCG1和ABCG16基因参与木栓质和花粉壁细胞外屏障形成。abcg1 abcg16双突变体育性下降,花粉粒干瘪[33, 34]。水稻OsABCG3/LSP1(Less and shrunken pollen 1)是拟南芥ABCG1和ABCG16的同源基因,近期研究发现OsABCG3/LSP1可以转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失,最终导致植株完全雄性不育[35, 36]。以上研究成果提示,ABCG转运蛋白在不同物种中参与转运花粉壁发育前体物质的功能具有保守性。
此外,ABCG转运蛋白可同时转运多种底物用于植物生长和生殖发育。最新的研究发现,ABCG1和ABCG16除参与转运木栓质和孢粉素前体物质用于花粉发育外,还可影响拟南芥生殖器官中生长素的信号传导。abcg1abcg16双突变体雌蕊中花粉管生长受阻与生长素分布和生长素流动减少有关,此表型可以通过在雌蕊中添加外源生长素得到部分恢复[37]。值得一提的是,目前绝大部分参与植物雄性生殖器官发育的ABCG转运蛋白均属于半分子转运蛋白,关于ABCG全分子转运蛋白参与花药发育的研究报道极少。Choi等[38]研究发现,拟南芥ABCG半分子转运蛋白AtABCG9和ABCG全分子转运蛋白AtABCG31协同参与花粉壁合成。AtABCG9和AtABCG31在绒毡层中高表达,主要通过将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积,abcg9abcg31双突变体的花粉活力严重下降。
3.2 参与调控花药角质层发育
花药角质层可保护雄配子体免受外界环境影响[39]。角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质主要围绕在角质基质的表面,由C16~C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。
近年来,ABCG转运蛋白被报道参与转运植物角质和蜡质前体从而调控植物发育。Pighin等[40]的研究表明,拟南芥ABCG12/CER5(ECERIFERUM 5)主要从表皮细胞内转运蜡质前体至细胞表面。AtABCG12/CER5基因突变后,突变体茎秆表皮蜡质含量显著降低[40]。拟南芥ABCG11/DSO主要参与转运长链脂肪酸和超长链脂肪酸,该基因突变后,突变体不仅茎秆表面蜡质和角质含量显著性下降,而且突变体花器官脂质沉积和根软木质沉积均下降,突变体植株育性严重受到影响[41, 42]。进一步研究发现,ABCG11自身能形成同源二聚体,也能与ABCG12形成异源二聚体,但是ABCG12不能形成同源二聚体[16]。
与孢粉素前体或脂类物质从绒毡层细胞运输到花药室参与花粉壁的形成相比,绒毡层细胞产生的孢粉素前体或脂类物质如何被运输到花药表面用于花药角质层形成的研究报道较少。水稻ABCG半分子转运蛋白OsABCG26定位于花药表皮、内皮层和Stage 9期的绒毡层中,可将脂质分子从绒毡层转运到花药壁,供角质层发育需要。在osabcg26突变体中可以观察到大量电子致密的脂质颗粒包裹体沿着绒毡层细胞室壁连接至中间层,该现象提示OsABCG26可能主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。OsABCG26突变后会导致转运受阻,从而影响角质层形成,导致花粉败育[23, 43]。与OsABCG26蛋白不同,OsABCG15蛋白只定位于绒毡层内侧,并以极性方式面对花药室,因此被认为主要参与花粉外壁形成过程中脂质前体的分配[23]。由于osabcg26osabcg15双突变体的表型能减轻osabcg15单突变体表型,因此推测水稻OsABCG26和OsABCG15是协同调控雄性生殖发育的[23]。
ABCG转运蛋白作为植物大蛋白家族,通过介导脂质代谢,特别是脂质和酚类物质前体在花药层细胞两侧转运以形成花粉发育最重要的两个保护屏障——花粉壁和花药角质层。目前ABCG半分子转运蛋白参与花药发育的研究大部分只停留在表型上的观察,具体的分子机制尚未明确。Zhu等[44]首次研究报道蒺藜苜蓿(Medicago truncatula Gaertn.)ABCG转运蛋白SGE1(Stigma exsertion1)可通过影响花器官中蜡质和角质等长链脂肪酸的运输导致雌雄蕊隔离,形成柱头外露型雄性不育材料。SGE1蛋白可与另一个半分子转运蛋白MtABCG13相互作用,形成一个有功能的异源二聚体。对ABCG蛋白的功能进行深入研究,将有助于阐明其在植物雄性生殖器官发育中的分子机制。
近期,Fang等[45]首次报道玉米一个雄性不育新基因ZmMS13在花药和花粉发育的前期(Stage 5)、中期(Stage 8b)和后期(Stage 10)具有3个表达峰,分别受转录因子ZmbHLH122、ZmMYB84和ZmMYB33-1/-2调控,从而分别影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成。该研究首次发现ABCG基因多峰值表达受不同转录因子调控,并阐明其具体的分子机理,拓展了植物ABCG转运蛋白的生物学功能。
表1汇总了目前在玉米、拟南芥和水稻中报道的ABCG转运蛋白参与植物雄性育性调控的研究进展。
表 1 参与植物雄性育性调控的ABCG转运蛋白Table 1. ABCG transporters involved in regulation of plant male fertility物种
Species基因名称
Gene name转运蛋白类型
Transport protein type具体功能
Functions文献
References拟南芥
Arabidopsis thaliana (L.) Heynh.ABCG26/
WBC27半分子 参与花粉外壁形成过程中多聚酮化合物的运输,该基因突变后,花粉外壁发育异常,植株育性显著下降 [25-28] 水稻Oryza sativa L. ABCG15/
PDA1半分子 参与花药角质层、乌氏体及花粉外壁发育 [29, 30] 玉米Zea mays L. MS2 半分子 参与花粉外壁发育,GC-MS分析结果显示ms2突变体花药角质和蜡质单体显著下降 [31] 拟南芥 ABCG1 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 拟南芥 ABCG16 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 水稻 OsABCG3/
LSP1半分子 参与转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失 [35, 36] 拟南芥 ABCG9 半分子 与ABCG31协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG31 全分子 与ABCG9协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG12/
CER5半分子 参与从表皮细胞内转运蜡质前体至细胞表面 [40] 拟南芥 ABCG11/
DSO半分子 转运长链脂肪酸和超长链脂肪酸 [41, 42] 水稻 ABCG26 半分子 主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。该基因突变后,突变体花粉外壁及花药角质层发育存在缺陷,还可以影响花粉管伸长 [23, 43] 蒺藜苜蓿
Medicago truncatula Gaertn.SGE1 半分子 影响蒺藜苜蓿花器官中蜡质和角质等长链脂肪酸的运输 [44] 玉米 ZmMS13 半分子 影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成 [45] 拟南芥 ABCG28 半分子 将多胺和活性氧定位于正在生长的花粉管尖端 [46] 最新的研究发现,拟南芥AtABCG28在成熟花粉和生长的花粉管中特异表达,该蛋白定位于分泌囊泡膜上。当AtABCG28基因突变后,花粉管生长缺陷,无法将多胺和活性氧定位于正在生长的花粉管尖端,植株表现为完全雄性不育[46]。图2总结和归纳了目前研究中主要的ABCG转运蛋白参与植物雄性育性调控的具体功能。
4. 展望
ABCG作为ABC转运蛋白最大的一个亚族,参与植物发育中各种生理过程。本文首先概述了植物花药角质层和花粉壁的主要成分,其次总结了ABC转运蛋白的结构特点,最后重点阐述ABCG转运蛋白参与调控植物花药和花粉发育的具体功能。随着研究不断深入,ABCG转运蛋白参与植物雄性育性调控的功能不再局限于调控花药角质层和花粉外壁的发育。
虽然ABCG转运蛋白的研究报道较多,但是其具体转运的底物尚未研究清楚。目前对于ABCG转运蛋白功能的研究主要采用反向遗传学的方法,通过气相色谱-质谱联用仪(GC-MS)分析ABCG突变体和野生型的特定部位组织的代谢产物差异,对ABCG转运蛋白的底物或者底物类别做出合理的猜测。目前在拟南芥、水稻、玉米等植物中大部分的ABCG转运蛋白底物均是该方法预测的[23, 38, 45]。此外,根据ABCG转运蛋白的特点,目前最直接有效的ABCG转运底物鉴定方法是通过一个转运实验以严格的ATP依赖的方式证明其跨膜转运活性。该转运实验的先决条件是将ABCG转运蛋白在适当的系统中进行过表达,如烟草(Nicotiana tabacum L.)原生质体系统或者酵母菌株(YMM12和BY-2)细胞系[20]。目前拟南芥ABCG转运蛋白的底物可通过体内同位素标记实验进行检测。例如,通过烟草原生质体系统构建的转运实验鉴定拟南芥ABCG11和ABCG32可以转运10,16-二羟基、C16∶0-2甘油和W-OH C16∶0等角质前体用于植物角质层形成[22]。但是用同位素标记进行实验鉴定ABCG转运蛋白的底物非常耗时,且许多同位素化合物尚未商业化,因此阻碍了该技术的利用。除此之外,基于使用双光子显微镜的研究结果表明,聚酮化合物是拟南芥ABCG26的底物。当AtABCG26基因突变后,突变体在绒毡层细胞中积累了大的荧光液泡,小孢子中的荧光丧失。当AtABCG26基因和编码孢粉素聚酮化合物生物合成代谢基因构建双突变体(atabcg26 acos5(acyl coenzyme A synthetase5)、atabcg26 tkpr1)以及三突变体(atabcg26 pksa(polyketide synthase a) pksb),这些双突变体和三突变体花药绒毡层细胞并未观察到荧光液泡内含物[28]。因此,可以推测AtABCG26将聚酮化合物从绒毡层细胞转运到花粉壁形成孢粉素骨架。
目前ABCG家族蛋白参与植物花药发育的报道集中于对ABCG半分子转运蛋白的研究。ABCG半分子转运蛋白需要通过同源或者异源二聚体的方式形成一个有功能的ABCG转运蛋白。通过寻找与其他ABCG共表达的基因,或者通过酵母筛库,或者质谱等方式鉴定ABCG转运蛋白的潜在伴侣,并研究其分子生物学功能,可拓宽ABCG转运蛋白参与植物雄性育性调控的具体分子机制。由于ABCG转运蛋白在不同植物中具有保守性,因此其同源基因在其他作物中可能也发挥类似的作用,通过反向遗传学的方法,例如利用基因编辑,可加深我们对ABCG转运蛋白在多种植物中的功能机制的了解。而所获得的雄性不育等优良性状的突变系在杂交作物育种和种子生产中具有广泛的应用前景。
-
表 1 失水过程中2种状态水峰积分面积变化
Table 1 Changes in peak integral areas of different water types during water loss
水分含量
Moisture content / %水峰积分面积 Water peak integral area 总面积
Total area (A)结合水
Bound water (A21)不易流动水
Immobile water ( A22)自由水
Free water (A23)48 6452.06±52.27a 803.95±5.32Bc 5545.63±40.21Aa 141.25±11.32C 38 4443.92±33.65b 686.37±4.36Bd 3635.42±28.95Ab 102.49±9.68C 28 2870.86±19.85c 2798.33±22.36a 72.53±4.87c - 18 1823.91±15.78d 1780.41±6.57b 43.50±3.52d - 注:表中数据为平均值±标准差,同列不同小写字母表示不同水分含量下差异显著(P<0.05),同行不同大写字母表示相同水分含量下差异显著(P<0.05)。 Notes: Values are Means ± Standard error. Different lowercase letters in the same column indicate significant difference (P<0.05) under different moisture content; different capital letters in the same row indicate significant difference (P<0.05) under the same moisture content. 表 2 失水过程中横向弛豫时间变化
Table 2 Changes in transverse relaxation time during water loss
水分类型 Water type 横向弛豫时间 Transverse relaxation time / ms 水分含量 48% 水分含量38% 水分含量28% 水分含量18% 结合水(T21) 起始点 0.47±0.05a 0.46±0.03a 0.37±0.04a 0.37±0.10a 峰点 1.21±0.10c 1.27±0.15c 2.41±1.46a 1.72±0.66b 结束点 2.79±0.33c 2.28±0.39c 16.66±5.05a 6.35±3.39b 不易流动水(T22) 起始点 3.22±0.54c 2.44±0.41c 22.14±7.33a 10.19±3.18b 峰点 14.08±1.58c 9.46±0.63d 42.40±11.77a 20.23±5.39b 结束点 52.00±10.16b 28.20±3.21c 66.22±18.61a 30.07±8.42c 自由水 (T23) 起始点 66.57±9.23 39.71±2.54 - - 峰点 160.12±33.49 70.83±4.74 - - 结束点 345.36±53.65 100.71±12.21 - - 注:表中数据为平均值 ± 标准差,同行不同小写字母表示不同水分含量下差异显著(P<0.05) Notes: Values are Means ± Standard error. Different lowercase letters in the same row indicate significant difference under different moisture content (P<0.05). -
[1] 段振军. 失水梯度对板栗贮藏过程中生理生化变化规律的影响[D]. 杨凌: 西北农林科技大学, 2008: 1−20. [2] 张乐,赵守涣,王赵改,史冠莹,王晓敏,等. 板栗微波真空干燥特性及干燥工艺研究[J]. 食品与机械,2018,34(4):206−210. Zhang L,Zhao SH,Wang ZG,Shi GY,Wang XM,et al. Microwave-vacuum drying characteristics and drying process of Chinese chestnut[J]. Food & Machinery,2018,34(4):206−210.
[3] 郑传祥. 板栗干燥特性及干燥机的开发研究[J]. 中国粮油学报,2001,16(5):55−58. Zheng CX. Chestnut's drying character and chestnut dryer[J]. Journal of the Chinese Cereals and Oils Association,2001,16(5):55−58.
[4] 宋珊珊,耿阳阳,冯涛池,胡伯凯,刘亚娜,等. 基于低场核磁共振分析与成像探究贮藏过程中板栗水分迁移对其质构变化的影响[J]. 食品工业科技,2020,41(24):44−49. Song SS,Geng YY,Feng TC,Hu BK,Liu YN,et al. Based on the analysis and imaging of low field nuclear magnetic resonance,explore the influence of chestnut moisture migration to the change of its texture in the storage process[J]. Science and Technology of Food Industry,2020,41(24):44−49.
[5] Xu FF,Jin X,Zhang L,Chen XD. Investigation on water status and distribution in broccoli and the effects of drying on water status using NMR and MRI methods[J]. Food Res Int,2017,96:191−197. doi: 10.1016/j.foodres.2017.03.041
[6] Monakhova YB,Kuballa T,Tschiersch C,Diehl BWK. Rapid NMR determination of inorganic cations in food matrices:application to mineral water[J]. Food Chem,2017,221:1828−1833. doi: 10.1016/j.foodchem.2016.10.095
[7] Wang S,Xiang W,Fan HZ,Xie J,Qian YF. Study on the mobility of water and its correlation with the spoilage process of salmon (Salmo solar) stored at 0 and 4°C by low-field nuclear magnetic resonance (LF NMR 1H)[J]. J Food Sci Technol,2018,55(1):173−182. doi: 10.1007/s13197-017-2880-5
[8] Meng WJ,Xu XN,Cheng KK,Xu JJ,Shen GP,et al. Geographical origin discrimination of oolong tea (TieGuanYin,Camellia sinensis (L.) O. Kuntze) using proton nuclear magnetic resonance spectroscopy and near-infrared spectroscopy[J]. Food Anal Methods,2017,10(11):3508−3522. doi: 10.1007/s12161-017-0920-4
[9] Kim H,Padmakshan D,Li YD,Rencoret J,Hatfield RD,et al. Characterization and elimination of undesirable protein residues in plant cell wall materials for enhancing lignin analysis by solution-state nuclear magnetic resonance spectroscopy[J]. Biomacromolecules,2017,18(12):4184−4195. doi: 10.1021/acs.biomac.7b01223
[10] Tan ZL,Reyes-Suarez E,Indrasena W,Kralovec JA. Novel approach to study fish oil oxidation using 1H nuclear magnetic resonance spectroscopy[J]. J Funct Foods,2017,36(9):310−316.
[11] Nishinari K,Fang YP. Perception and measurement of food texture:solid foods[J]. J Texture Stud,2018,49(2):160−201. doi: 10.1111/jtxs.12327
[12] Da Silva Costa RA,Bonomo RCF,Rodrigues LB,Santos LS,Veloso CM. Improvement of texture properties and syneresis of arrowroot (Maranta arundinacea) starch gels by using hydrocolloids (guar gum and xanthan gum)[J]. J Sci Food Agric,2020,100(7):3204−3211. doi: 10.1002/jsfa.10356
[13] Ospina-Casas KG,Laguado-Escobar DA,Narváez-Cuenca CE. Using a mixture of hydrocolloids to mimic texture and rheological properties of a massive consumption food product[J]. J Food Proc Preserv,2022,46(4):e16440.
[14] Szeleszczuk Ł,Pisklak DM,Wawer I. Analysis of water in the chicken eggshell using the 1H magic angle spinning nuclear magnetic resonance spectroscopy[J]. Braz J Poult Sci,2016,18(S2):27−32.
[15] Santos PM,Pereira-Filho ER,Colnago LA. Detection and quantification of milk adulteration using time domain nuclear magnetic resonance (TD-NMR)[J]. Microchem J,2016,124:15−19. doi: 10.1016/j.microc.2015.07.013
[16] Wang RY,Liu KJ,Wang XL,Tan MQ. Detection of sesame oil adulteration using low-field nuclear magnetic resonance and chemometrics[J]. Int J Food Eng,2019,15(7):20180349. doi: 10.1515/ijfe-2018-0349
[17] Wang SH,Lai GY,Lin JZ,Xia F,Ding ZN,et al. Rapid detection of adulteration in extra virgin olive oil by low-field nuclear magnetic resonance combined with pattern recognition[J]. Food Anal Methods,2021,14(7):1322−1335. doi: 10.1007/s12161-021-01973-x
[18] Fortier-McGill B,Majumdar RD,Lam L,Soong R,Liaghati-Mobarhan Y,et al. Comprehensive multiphase (CMP) NMR monitoring of the structural changes and molecular flux within a growing seed[J]. J Agric Food Chem,2017,65(32):6779−6788. doi: 10.1021/acs.jafc.7b02421
[19] 牟红梅,何建强,邢建军,要世瑾,唐燕,等. 小麦灌浆过程籽粒水分变化的核磁共振检测[J]. 农业工程学报,2016,32(8):98−104. doi: 10.11975/j.issn.1002-6819.2016.08.014 Mou HM,He JQ,Xing JJ,Yao SJ,Tang Y,et al. Water changes in wheat spike during grain filling stage investigated by nuclear magnetic resonance[J]. Transactions of the Chinese Society of Agricultural Engineering,2016,32(8):98−104. doi: 10.11975/j.issn.1002-6819.2016.08.014
[20] Phinney DM,Frelka JC,Wickramasinghe A,Heldman DR. Effect of freezing rate and microwave thawing on texture and microstructural properties of potato (Solanum tuberosum)[J]. J Food Sci,2017,82(4):933−938. doi: 10.1111/1750-3841.13690
[21] CurtiCA,Vidal PM,Curti RN,Ramón AN. Chemical characterization,texture and consumer acceptability of yogurts supplemented with quinoa flour[J]. Food Sci Technol,2017,37(4):627−631. doi: 10.1590/1678-457x.27716
[22] Pu DD,Duan W,Huang Y,Zhang LL,Sun BG,et al. Characterization of the dynamic texture perception and the impact factors on the bolus texture changes during oral processing[J]. Food Chem,2021,339:128078. doi: 10.1016/j.foodchem.2020.128078
[23] Christianson ML,Niklas KJ. Patterns of diversity in leaves from canopies of Ginkgo biloba are revealed using specific leaf area as a morphological character[J]. Am J Bot,2011,98(7):1068−1076. doi: 10.3732/ajb.1000452
[24] Damerau A,Ahonen E,Kortesniemi M,Puganen A,Tarvainen M,et al. Evaluation of the composition and oxidative status of omega-3 fatty acid supplements on the Finnish market using NMR and SPME-GC–MS in comparison with conventional methods[J]. Food Chem,2020,330:127194. doi: 10.1016/j.foodchem.2020.127194
[25] Deng RX,Seimys A,Mars M,Janssen AEM,Smeets PAM. Monitoring pH and whey protein digestion by TD-NMR and MRI in a novel semi-dynamic in vitro gastric simulator (MR-GAS)[J]. Food Hydrocolloids,2022,125:107393. doi: 10.1016/j.foodhyd.2021.107393
[26] Dong X,Zhang T,Cheng SS,He X,Wang HT,et al. Water and lipid migration in salted duck eggs during storage with different packaging conditions as studied using LF-NMR and MRI techniques[J]. J Food Sci,2022,87(5):2009−2017. doi: 10.1111/1750-3841.16139
[27] 陈伟,陈建设. 食品的质构及其性质[J]. 中国食品学报,2021,21(1):377−384. Chen W,Chen JS. Food texture and properties[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(1):377−384.
[28] Moens LG,Plas K,van Ceunebroeck JC,van Loey AM,Hendrickx MEG. Effect of pulsed electric field,mild thermal pretreatment and calcium on texture changes of potato (Solanum tuberosum L.) during subsequent cooking[J]. Innovative Food Sci Emerging Technol,2021,74:102830. doi: 10.1016/j.ifset.2021.102830
[29] Latoch A. Effect of meat marinating in kefir,yoghurt and buttermilk on the texture and color of pork steaks cooked sous-vide[J]. Ann Agric Sci,2020,65(2):129−136. doi: 10.1016/j.aoas.2020.07.003
[30] Imahori Y,Bai JH,Ford BL,Baldwin EA. Effect of storage temperature on chilling injury and activity of antioxidant enzymes in carambola "Arkin" fruit[J]. J Food Process Preserv,2020,45(2):e15178.
[31] Horigane AK,Suzuki K,Yoshida M. Moisture distribution in rice grains used for sake brewing analyzed by magnetic resonance imaging[J]. J Cereal Sci,2014,60(1):193−201. doi: 10.1016/j.jcs.2014.02.011
[32] 顾采琴,赖雅平,朱冬雪,刘鹏,曾庆祝. 不同石灰化程度板栗中淀粉代谢及蔗糖含量变化[J]. 中国农业科学,2013,46(8):1676−1681. Gu CQ,Lai YP,Zhu DX,Liu P,Zeng QZ. Changes of the metabolism of starch and sucrose content in chestnuts at different degrees of calcification[J]. Scientia Agricultura Sinica,2013,46(8):1676−1681.



 下载:
下载: