Effects of soil nitrogen addition on photosynthetic limitations in Fraxinus mandshurica Rupr. and Quercus mongolica Fish. ex Ledeb
-
摘要:
本文以试验地常年大气氮(N)沉降量(23 kg·ha−1·year−1)为依据,设计了低度(LN,23 kg·ha−1·year−1)、中度(MN,46 kg·ha−1·year−1)和高度(HN,69 kg·ha−1·year−1)3种氮添加水平以模拟大气氮沉降,以无氮添加处理为对照(CK),探究过度氮沉降对森林阔叶树种水曲柳(Fraxinus mandshurica Rupr.)和蒙古栎(Quercus mongolica Fish. ex Ledeb)的生理生态效应。结果显示:(1)两树种CO2扩散性限制作用(即气孔限制lsc和叶肉限制lm)在氮添加后减弱,而后随氮量的增加先减弱后增强;其生化限制lb则在氮添加后增强,后随氮量增加先增强后减弱;(2)3种光合限制作用均在MN下达到最值, 中度土壤氮添加量对植株光合的促进效应最高;(3)土壤氮添加期间植株光合能力的增强主要源于CO2扩散性限制作用的减弱,而gsc变化(即lsc)为扩散性限制的主角作用因子;(4)3种光合限制作用(lsc、lm和lb)在不同生长期(7月和8月)均未表现出显著差异,表明lsc的光合主角限制“角色”无季节性差异;(5)一定范围内的土壤氮添加不会对植株的水分利用潜力产生显著影响。
Abstract:Based on natural nitrogen deposition in the field (23 kg·ha−1·year−1), this research employed low (LN, 23 kg·ha−1·year−1), moderate (MN, 46 kg·ha−1·year−1), and high (HN, 69 kg·ha−1·year−1) nitrogen levels to simulate natural nitrogen deposition, using no nitrogen addition used as a control (CK). The goal was to explore the physiological and ecological effects of excessive nitrogen deposition on two broad-leaved forest species, i.e., Manchurian ash (Fraxinus mandshurica Rupr.) and Mongolian oak (Quercus mongolica Fish. ex Ledeb). Results showed that 1) CO2 diffusional limitations (i.e., stomatal limitation, lsc, mesophyll limitation, lm) of both species decreased by more than 10% after nitrogen addition, then increased with increasing nitrogen supply, while biochemical limitation (lb) increased by more than 10% after nitrogen addition, then decreased with increasing nitrogen supply. 2) Both lsc and lm reached minimum values of 18.4% and 18.0% (Manchurian ash-August), 21.6% and 19.7% (Mongolian oak-July), and 21.6% and 20.1% (Mongolian oak-August), while lb reached a maximum value of 63.6% (Manchurian ash-August) and 59.7% and 58.3% (Mongolian oak-July and August) under MN treatment, indicating that soil nitrogen addition of 46 kg·ha-1·year-1 had the greatest photosynthesis-promoting effect. 3) The enhancement of plant photosynthetic capacity during soil nitrogen supply predominantly resulted from the weakening of CO2 diffusional limitations, in which stomatal conductance to CO2 (gsc, i.e., lsc) was the primary limiting factor affecting plant photosynthesis. 4) The three photosynthetic limitations (lsc, lm, and lb) did not show any significant differences between July and August, indicating that the primary photosynthetic role of lsc may lack seasonal variation. 5) Soil nitrogen addition within a certain content range did not significantly affect the water use potential of plants.
-
在光合作用过程中,外界CO2(此时的CO2浓度称为大气CO2浓度,Ca)扩散进入叶绿体首先要克服边界层阻力到达叶片表面(此时的CO2浓度称为表面CO2浓度,Cs),然后克服气孔阻力到达气孔下腔(此时的CO2浓度称为胞间CO2浓度,Ci),再继续扩散至细胞壁周围,最后依次克服叶肉细胞壁、细胞膜、细胞质、叶绿体膜和叶绿体基质阻力到达1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)结合位点参与碳同化(此时的CO2浓度称为叶绿体CO2浓度,Cc)[1]。生理学上,将气孔对CO2传输的阻力称为气孔阻力(Stomatal resistance to CO2, rsc),CO2从气孔下腔到达1,5-二磷酸核酮糖(RuBP)羧化位点过程中所受到的阻力称为叶肉细胞阻力(简称叶肉阻力,Mesophyll resistance to CO2, rm),CO2克服这两大阻力的能力分别称为气孔导度(Stomatal conductance to CO2, gsc)和叶肉细胞导度(简称叶肉导度,Mesophyll conductance to CO2, gm)[1],二者合称为叶片CO2扩散导度。将gsc和gm变化对植株光合同化能力的限制分别称为气孔限制(Stomatal limitation, lsc)和叶肉限制(Mesophyll limitation, lm),二者合称为CO2扩散性限制作用。此外,CO2在叶片内传输过程中还会受到相关生化指标(如酶含量及活性)和酶促反应效率的限制,该部分限制作用统称为生物化学限制(简称生化限制,Biochemical limitation, lb)。上述3种光合限制作用(lsc、lm和lb)对植株饱和光下碳同化产生的光合贡献分别为气孔贡献率(SCL)、叶肉贡献率(MCL)和生化贡献率(BL)。有研究表明,这3大贡献率会随着外界环境条件的改变而发生显著变化[2-4]。
氮(N)作为影响植株光合生理的重要生态因子,通常会对植株光合及CO2扩散产生正效应[5-9],即植株光合效率、gsc以及gm均随土壤氮的增加而升高。少、中量土壤氮添加(23 ~ 46 kg·ha−1·year−1)能够显著提高水曲柳(Fraxinus mandshurica Rupr.)和蒙古栎(Quercus mongolica Fish. ex Ledeb)植株的gsc和gm,但这一正效应在高度氮添加(69 kg·ha−1·year−1)下被减弱[10]。可见,土壤氮素对CO2扩散的促进作用也存在阈值(如69 kg·ha−1·year−1)。超过该阈值后,氮的促进作用会减弱,乃至转为抑制作用。近一个世纪以来,随着化石燃料的大量使用以及农牧业的快速发展,大气氮沉降量增加,对植物个体及生态系统均产生了严重的氮负荷。模型模拟结果表明,从1986-2050年间,全球氮沉降分布范围在不断扩大,氮沉降量也呈现逐渐增加的趋势[11],到2030年全球氮沉降量将达到每年105 Tg[12]。因此,探究植物的氮响应机制有助于深化对过度氮沉降下植物生存策略的认识,并能在今后的生产实践中有针对性地提高植物在高氮下的适应能力。然而,当前有关CO2扩散氮效应的研究多集中在对其扩散导度的揭示,缺乏对基于该导度的光合限制因子的氮响应机制分析,且对氮含量变化下光合主导限制因子“角色”的界定不够清晰。
基于此,本文选取我国保存最完整的长白山原始森林生态系统作为研究区域,以其优势树种水曲柳和蒙古栎为实验材料,设计了3种氮添加水平的土培实验以模拟大气氮沉降。本研究以CO2在叶片内的扩散为切入点,具体探究不同土壤氮添加量(23、46、69 kg·ha−1·year−1)对两树种气孔(lsc)、叶肉(lm)及生化(lb)3种光合限制因子的生理生态效应,并结合叶片水分利用效率参数对这一效应进行机理分析。
1. 材料与方法
1.1 实验材料与实验设计
本实验在吉林长白山森林生态系统国家野外科学观测研究站内进行,位于吉林省延边朝鲜族自治州二道白河镇(42°24′N,128°06′E),海拔738 m。该地区降水状况良好,年均降水量632.8~782.4 mm,年平均气温3.6 ℃,年均氮沉降量23 kg·ha−1·year−1。
选取5年生水曲柳和蒙古栎幼树为实验材料,将其移栽入容积为29.28 L(高30.0 cm,直径34.3 cm)的花盆中,盆内装填27 L采集于原始阔叶红松林的表层土(0~10 cm)。所选幼树均长势良好,生长指标相近,平均树高约1.6 m,平均基径约2 cm,幼树根系通过花盆托与盆外土壤阻隔开。为消除自然氮沉降对实验结果的干扰,所有盆栽植株均置于遮雨棚内,棚顶覆盖透光率为95%的透明塑料膜,并对所有盆栽植株进行充分灌溉以消除土壤水分胁迫的影响。
实验设计了低度(LN)、中度(MN)和高度(HN)3种氮添加水平以模拟大气沉降,以无氮添加处理为对照(CK),4种氮添加量分别为0、23、46和69 kg·ha−1·year−1。采用尿素进行氮添加,分别于5、7、9月初将其水溶液均匀喷洒于植株根际土周围。每个处理设置5个重复,期间所有植株均充分浇水,以消除水分亏缺的影响。
1.2 研究方法
1.2.1 气体交换与叶绿素荧光测定
选取新生完全舒展叶,借助配备有荧光叶室(Li-6400-40,Li-Cor,美国)的便携式光合测定仪(Li-6400XT,Li-Cor,美国USA)测定饱和光下的光合-荧光值。期间,叶室环境分别设定为叶温25 ℃,相对湿度(60 ± 5)%,叶片水气压亏缺(VPD)值1.4 kPa。以300 μmol/s的流速向叶片提供400 µmol/mol的CO2,借助红蓝光源向叶片提供1200 µmol·m−2·s−1的活化光(PPFD),其红蓝光配比为90∶10。叶片经25 ~ 30 min的光适应,待其光合稳定后,记录气体交换参数、稳态荧光值(Fs)以及7800 µmol·m−2·s−1下的最大荧光值(Fm)[13]。依据Genty 等 [14]的报道,叶片的光系统Ⅱ光化学效率(ΦPSⅡ)计算公式如下:
ΦPSⅡ=(Fm−Fs)/Fm (1) 叶片光合电子传递速率(ETR)计算公式为:
{\rm{ETR}} = Φ_{{\text{PS}}{\text{Ⅱ}}}\times {\rm{PPFD}}\times αβ (2) 式中,α为叶片吸收系数;β为叶片吸收的活化光在光系统Ⅰ(PSⅠ)和光系统Ⅱ(PSⅡ)间的分配比率,文中αβ依据文献方法进行校正[15]。
利用“可变J变量法”计算植株叶肉导度(gm)[16]:
\begin{split} g_{m} =& P_{{\rm{n}}}/(C_{{\rm{i}}} - (Γ^{*}(ETR + 8(P_{{\rm{n}}} + R_{d})))/ \\ &(ETR - 4(P_{{\rm{n}}} + R_{{\rm{d}}}))) \end{split} (3) Γ^{*} = C_{{\rm{i}}}^{*} + R_{{\rm{d}}}/g_{{\rm{m}}} (4) 式中,Pn为净光合速率;Ci为胞间CO2浓度,直接由气体交换测得;Γ*为不含光呼吸的CO2补偿点,Ci*为CO2光补偿点,Rd为线粒体呼吸速率,即暗呼吸速率 ,本研究中的Ci*和Rd利用前人报道的方法进行测定[17]。
1.2.2 光合限制作用分析
依据Grassi 和 Magnani[18]以及Wang等[19]的报道,叶片饱和光下的碳同化能力等同于其气孔导度(gsc)、叶肉导度(gm)和生化能力(即最大羧化速率,Vcmax)变化之和,其计算公式如下:
\begin{split} dP_{{\rm{n}}}/P_{{\rm{n}}} = \;&SC_{{\rm{L}}} + MC_{{\rm{L}}} + B_{{\rm{L}}} = l_{{\rm{sc}}}\times {\rm{d}}g_{{\rm{sc}}}/g_{{\rm{sc}}} + l_{{\rm{m}}}\times \\ &{\rm{d}}g_{{\rm{m}}}/g_{{\rm{m}}} + l_{{\rm{b}}}\times {\rm{d}}V_{{\rm{cmax}}}/V_{{\rm{cmax}}}\\[-10pt] \end{split} (5) \begin{split} l_{{\rm{sc}}} =&\; (g_{{\rm{tot}}}/g_{{\rm{sc}}}\times \partial P_{{\rm{n}}}/\partial C_{{\rm{c}}})/(g_{{\rm{tot}}} + \partial P_{{\rm{n}}}/\partial C_{{\rm{c}}}) \\ l_{{\rm{m}}} =& \;(g_{{\rm{tot}}}/g_{{\rm{m}}}\times \partial P_{{\rm{n}}}/\partial C_{{\rm{c}}})/(g_{{\rm{tot}}} + \partial P_{{\rm{n}}}/\partial C_{{\rm{c}}}) \\ l_{{\rm{b}}} =& \;g_{{\rm{tot}}}/(g_{{\rm{tot}}} + \partial P_{{\rm{n}}}/\partial C_{{\rm{c}}}) \end{split} (6) 式中,lsc、lm和lb分别为植株gsc、gm及其生化能力产生的光合限制作用(0 < li < 1,i = sc,m,b);SCL、MCL和BL依次为gsc、gm及生化能力对植株饱和光下碳同化的相对贡献率,其中gsc和gm的贡献率合称为叶片扩散性限制光合贡献率(DL,DL = SCL + MCL)[18];gtot为叶片CO2扩散总导度,其计算公式如下:
g_{{\rm{tot}}} = 1/(1/g_{{\rm{sc}}} + 1/g_{{\rm{m}}}) (7) g_{{\rm{sc}}} = g_{{\rm{sw}}}/1.6 (8) 式中,gsw为叶片气孔对水蒸气的导度,直接由光合测定获得;1.6是大气中水蒸气和CO2的扩散率比值。
植株gsc、gm及其羧化能力(即Vcmax)的相对变化按公式(9)进行计算:
dx/x = (x_{{\rm{ref}}}- x)/x_{{\rm{ref}}} (9) 式中,x分别代表gsc、gm或Vcmax,xref代表x的对照值。
借助单点法[20, 21],利用Pn、gsc和gm数据根据如下公式计算植株Vcmax:
V_{{\rm{cmax}}} = (P_{{\rm{n}}} + R_{{\rm{d}}})(C_{{\rm{c}}} + K_{{\rm{m}}})/(C_{{\rm{c}}} - Γ^{*}) (10) K_{{\rm{m}}} = K_{{\rm{c}}}(1 + O/K_{{\rm{o}}}) (11) C_{{\rm{c}}} = C_{{\rm{i}}} − P_{{\rm{n}}}/g_{{\rm{m}}} (12) 式中,Km是Rubisco羧化/氧化的有效米氏常数;Kc和Ko分别为CO2和O2的有效米氏常数;O是Rubisco处的O2浓度。常温(即25 ℃)下,Kc、Ko和O值分别为302 μmol/mol、198 mmol/mol和256 mmol/mol [22]。
∂Pn/∂Cc依据公式(13)进行计算:
\partial P_{{\rm{n}}}/\partial C_{{\rm{c}}} = V_{{\rm{cmax}}}(K_{{\rm{m}}} + \Gamma^{*})/(C_{{\rm{c}}} + K_{{\rm{m}}})^{2} (13) 1.2.3 叶片潜在水分利用效率计算
在叶片水平上,植株潜在水分利用效率(WUEi)被定义为叶片Pn与gsw的比值[23],计算公式如下:
WUE_{{\rm{i}}} = P_{{\rm{n}}}/g_{{\rm{sw}}} (14) 1.2.4 叶片解剖结构观测
从新生完全舒展叶片剪取4.0 mm × 1.5 mm的样本,用FAA固定液(50%乙醇∶甲醛∶冰醋酸 = 90∶5∶5)进行固定,然后进行乙醇梯度脱水,梯度浓度及脱水时长依次为:30%乙醇30 min,50%乙醇30 min,70%乙醇30 min,85%乙醇30 min,95%乙醇1 h,100%乙醇1 h,之后经过100%乙醇脱水1 h,再依次进行石蜡制片、切片(8 μm厚)、番红-固绿对染。最后,利用光学显微镜(DM2500,徕卡,德国)进行叶片解剖结构观测。另垂直叶脉于叶片中部剪取大小约为4 mm × 1.2 mm的样本,用戊二醛溶液(2.5%,pH = 7.0,用0.1 mol/L磷酸缓冲液配制)固定,置于4 ℃固定2 h以上,并保存于冰箱中;然后用0.1 mol/L pH = 7.2的磷酸盐缓冲液冲洗2~3遍,再进行乙醇溶液的梯度脱水,乙醇浓度分别为50%、70%、90%和100%,每次脱水时间为5~10 min,脱水结束后,用乙醇-叔丁醇溶液(1∶1,V/V,下同)置换20 min,最后用100%叔丁醇置换两次,每次20 min;之后用100%叔丁醇冷冻干燥1~2 h。利用环境扫描电镜(Quanta-250,FEI,美国)观测叶片的气孔形态。
1.3 数据处理
使用SPSS 17.0软件对不同处理间lsc、lm和lb的正态性和方差齐性进行单因素方差分析。同时,进行Pn与gsc和gm间的回归分析,拟合叶片WUEi与lsc、lm和lb间的相关关系,使用最小显著性差异法(LSD)对指标均值进行多重比较分析(P < 0.05或P < 0.01)。图表中数据为平均值 ± 标准差。
2. 结果与分析
2.1 光合限制作用随土壤氮含量的变化
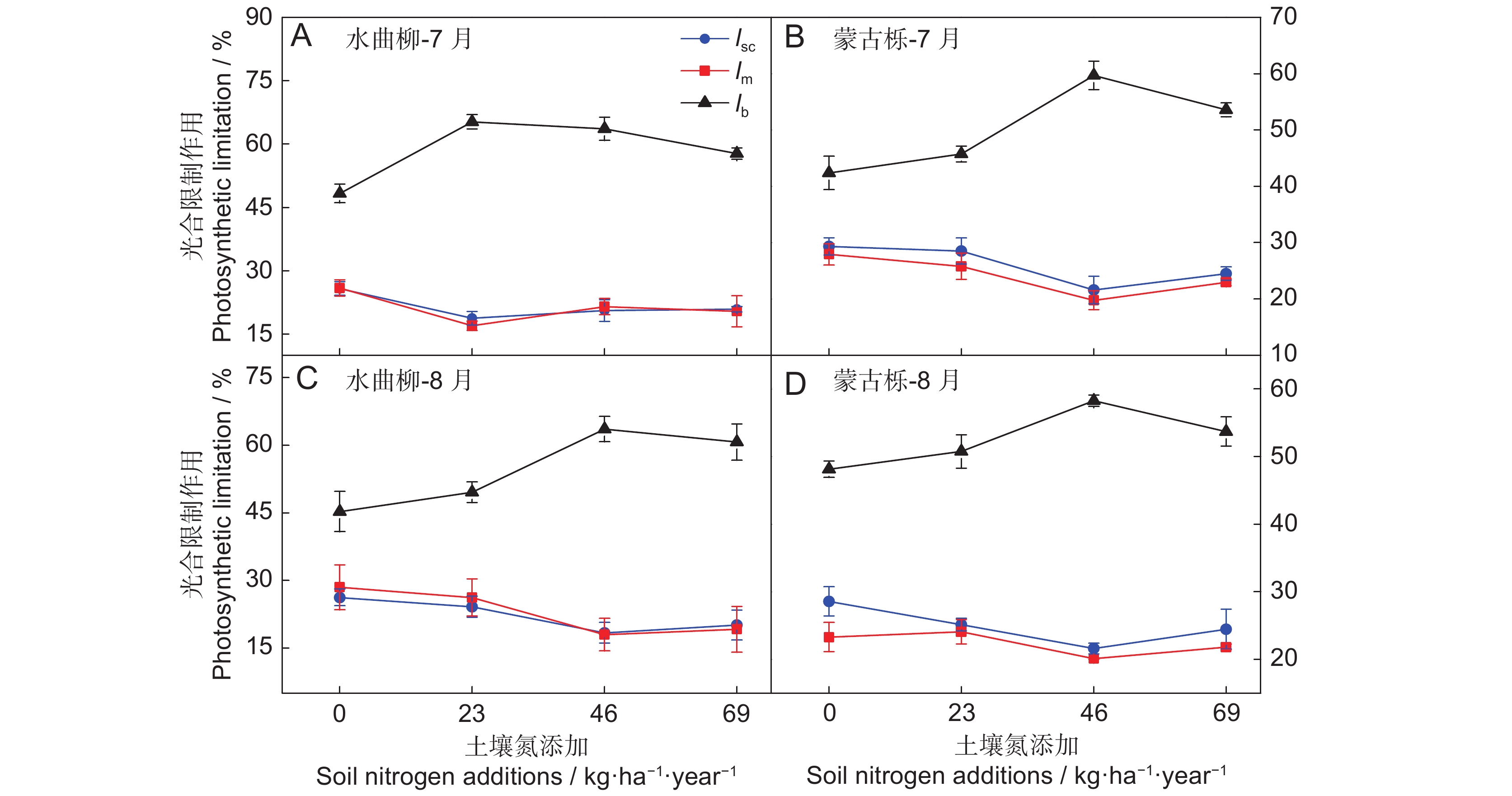
水曲柳和蒙古栎植株光合限制作用(lsc、lm和lb)随土壤氮含量的变化如图1所示。从图中看出,3种光合限制作用对土壤氮添加表现出不同的响应。lsc和lm大小相近,在3种氮添加处理(LN、MN和HN)下的值均低于对照(CK),且降幅整体大于10%,而后均随氮添加的增加先降低后升高,除水曲柳植株7月的lsc和lm在LN下最小外,二者的最小光合限制作用均出现在MN下。lb作为限制植株光合碳同化的重要生化因子,在氮添加后增大,增幅整体高于10%,后随土壤氮含量增加先增加后减小,在MN下达到最大值63.6%(水曲柳,8月)、59.7%和58.3%(蒙古栎,7月和8月),而水曲柳7月lb最大值(65.3%)出现在LN下,此时的光合限制作用最大。综合上述变化,叶片CO2的扩散性限制(即lsc和lm)与土壤氮添加强度具有一定的负相关,即在一定范围内,土壤氮添加量越大,CO2扩散性限制越小,但土壤氮添加却显著提高了叶片生化能力变化对植株光合的限制作用。另外,在不同的生长时期(7月和8月),两树种植株的光合限制作用(lsc、lm和lb)并未表现出明显的季节性差异。
![]() 图 1 水曲柳(A、C)和蒙古栎(B、D)相对限制作用对土壤氮含量变化的响应lsc为气孔限制,lm为叶肉限制,lb为生化限制。CK为对照(0 kg·ha−1·year−1),LN为低氮添加(23 kg·ha−1·year−1),MN为中氮添加(46 kg·ha−1·year−1),HN为高氮添加(69 kg·ha−1·year−1)。下同。Figure 1. Reponses to relative limitations of soil nitrogen content in Fraxinus mandshurica (A, C) and Quercus mongolica (B, D) saplingslsc, stomatal limitation; lm, mesophyll limitation; lb, biochemical limitation. CK, control (0 kg·ha−1·year−1); LN, low nitrogen addition (23 kg·ha−1·year−1); MN, medium nitrogen addition (46 kg·ha−1·year−1); HN, high nitrogen addition (69 kg·ha−1·year−1). Same below.
图 1 水曲柳(A、C)和蒙古栎(B、D)相对限制作用对土壤氮含量变化的响应lsc为气孔限制,lm为叶肉限制,lb为生化限制。CK为对照(0 kg·ha−1·year−1),LN为低氮添加(23 kg·ha−1·year−1),MN为中氮添加(46 kg·ha−1·year−1),HN为高氮添加(69 kg·ha−1·year−1)。下同。Figure 1. Reponses to relative limitations of soil nitrogen content in Fraxinus mandshurica (A, C) and Quercus mongolica (B, D) saplingslsc, stomatal limitation; lm, mesophyll limitation; lb, biochemical limitation. CK, control (0 kg·ha−1·year−1); LN, low nitrogen addition (23 kg·ha−1·year−1); MN, medium nitrogen addition (46 kg·ha−1·year−1); HN, high nitrogen addition (69 kg·ha−1·year−1). Same below.2.2 CO2扩散导度及生化能力对饱和光下碳同化的相对贡献率
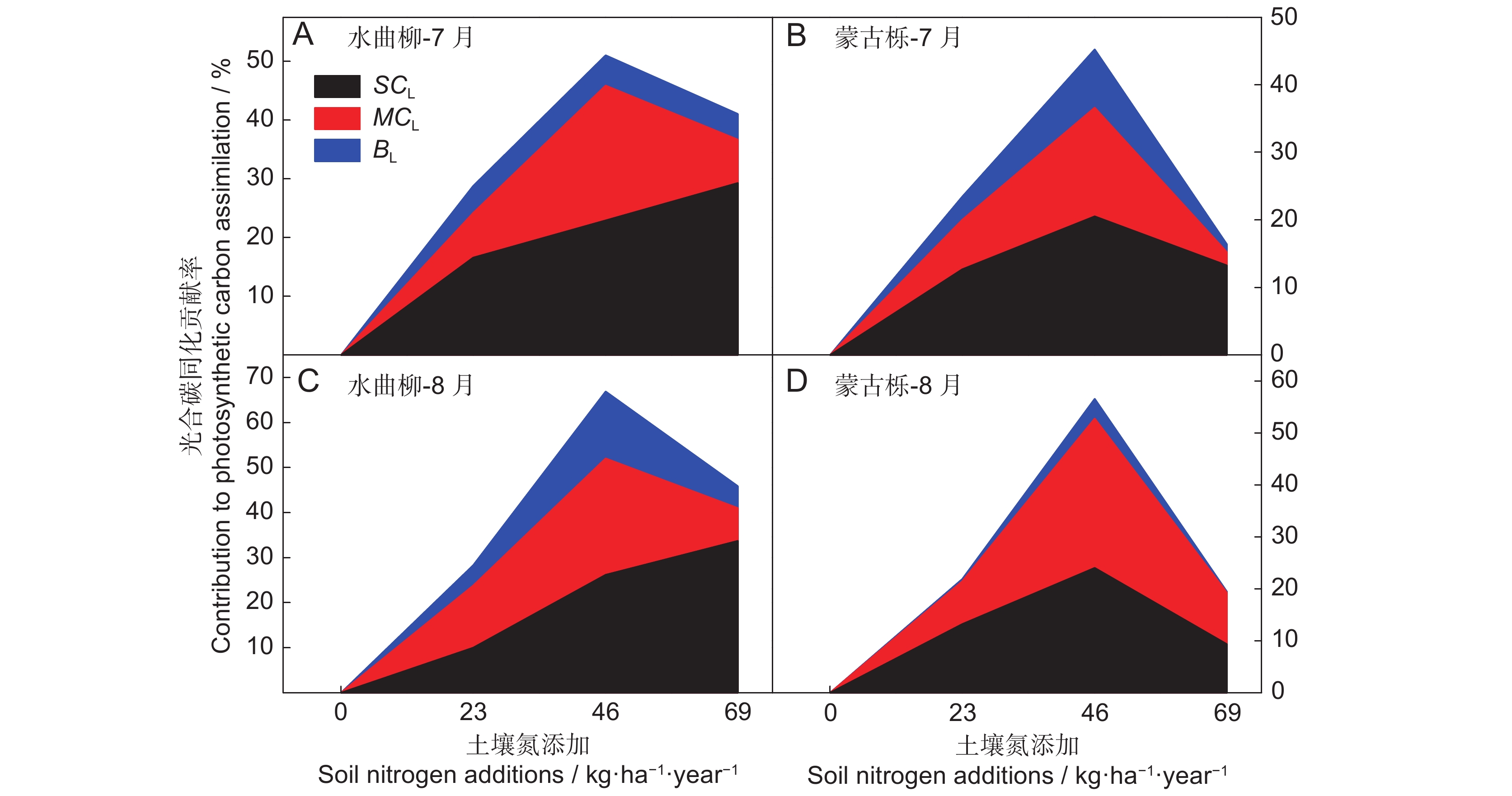
土壤氮添加期间,水曲柳和蒙古栎叶片CO2扩散导度(gsc、gm)及其生化能力变化对饱和光下碳同化的相对贡献率(即SCL、MCL和BL)如图2所示。由图可见,土壤氮添加后,SCL、MCL和BL均上升,其中,水曲柳SCL随土壤添加持续上升,在HN下达到最大值,而水曲柳的MCL和BL以及蒙古栎的3种相对贡献率则随土壤氮添加先上升后下降,均在MN下达到最大值。植株SCL、MCL和BL在7月和8月间没有明显的季节性规律,但表现出一定的树种差异性,CO2扩散导度及生化能力变化对水曲柳的碳同化相对贡献率高于蒙古栎。
![]() 图 2 水曲柳(A、C)和蒙古栎(B、D)gsc、gm及生化能力对植株饱和光下碳同化相对贡献率随土壤氮含量的变化SCL为gsc对叶片dPn/Pn的贡献值,MCL为gm对叶片dPn/Pn的贡献值,BL为生化能力对叶片dPn/Pn的贡献值。Figure 2. Changes in contributions of gsc, gm, and biochemical capacity to light-saturated carbon assimilation (dPn/Pn) with soil nitrogen addition in Fraxinus mandshurica (A, C) and Quercus mongolica (B, D) saplingsSCL, contribution of gsc to dPn/Pn; MCL, contribution of gm to dPn/Pn; BL, contribution of biochemical capacity to dPn/Pn.
图 2 水曲柳(A、C)和蒙古栎(B、D)gsc、gm及生化能力对植株饱和光下碳同化相对贡献率随土壤氮含量的变化SCL为gsc对叶片dPn/Pn的贡献值,MCL为gm对叶片dPn/Pn的贡献值,BL为生化能力对叶片dPn/Pn的贡献值。Figure 2. Changes in contributions of gsc, gm, and biochemical capacity to light-saturated carbon assimilation (dPn/Pn) with soil nitrogen addition in Fraxinus mandshurica (A, C) and Quercus mongolica (B, D) saplingsSCL, contribution of gsc to dPn/Pn; MCL, contribution of gm to dPn/Pn; BL, contribution of biochemical capacity to dPn/Pn.2.3 叶片水分利用效率对植株光合限制作用的影响
2.3.1 叶片水分利用效率的氮响应
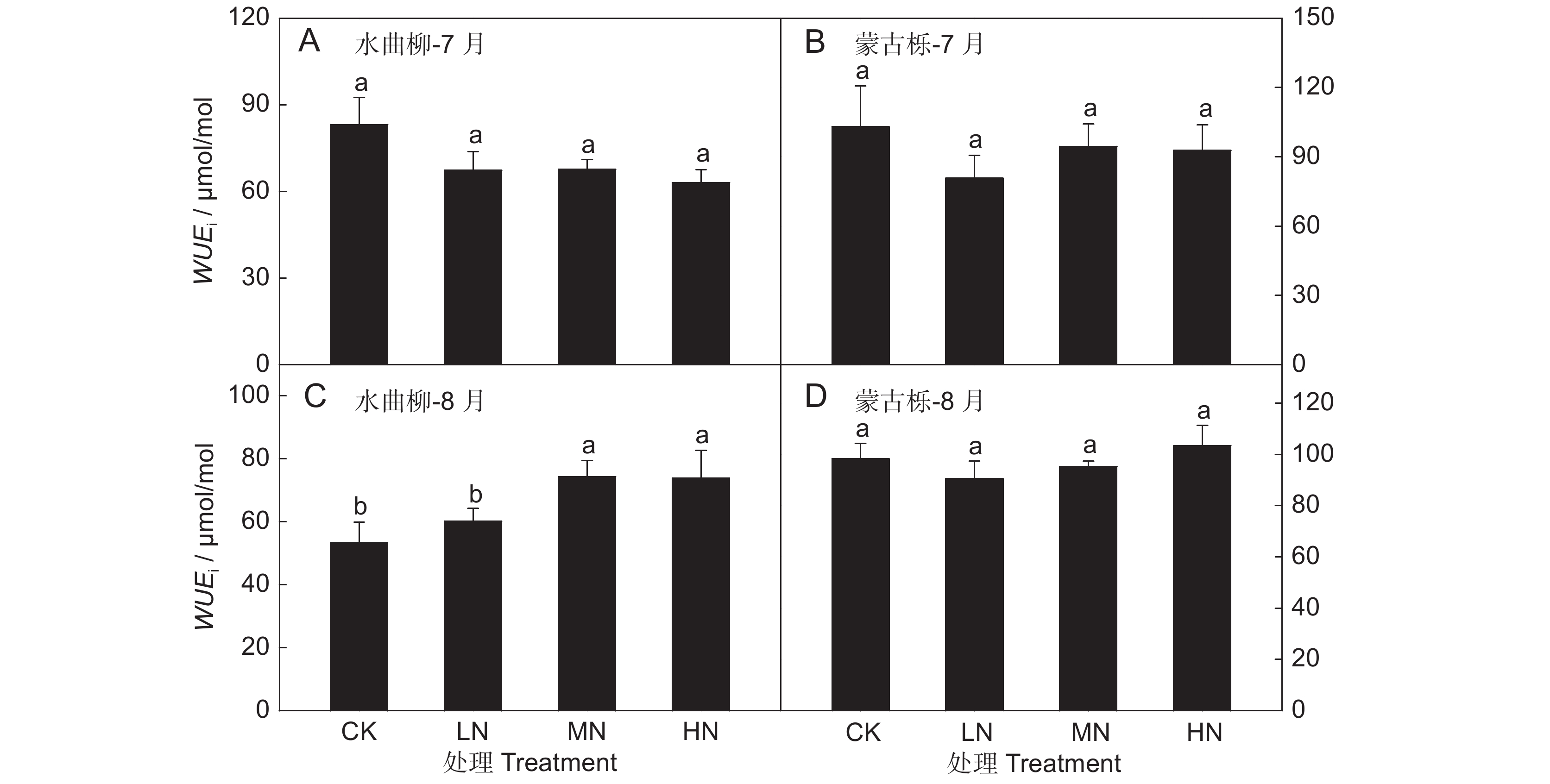
土壤氮添加对植株水分利用能力也产生了一定影响,但效应不显著。图3为水曲柳和蒙古栎叶片潜在水分利用效率(WUEi)对土壤氮含量变化的响应。可以看出,7月份叶片WUEi均随土壤氮添加减小,尤以水曲柳叶片降低趋势最明显(图3:A);进入8月份,植株水分利用能力对土壤氮含量变化表现出树种间差异性,水曲柳叶片WUEi随土壤氮添加增大,且中、高度氮添加处理与低度及对照处理下的WUEi值表现出显著差异(P < 0.05)(图3:C),而蒙古栎叶片WUEi则随土壤氮添加先减小后增大(图3:D),不同处理间差异不显著。上述结果表明,土壤氮含量变化对长白山地区主要阔叶树种的叶片水分利用能力影响较小。
2.3.2 叶片水分利用效率与光合限制作用的关系
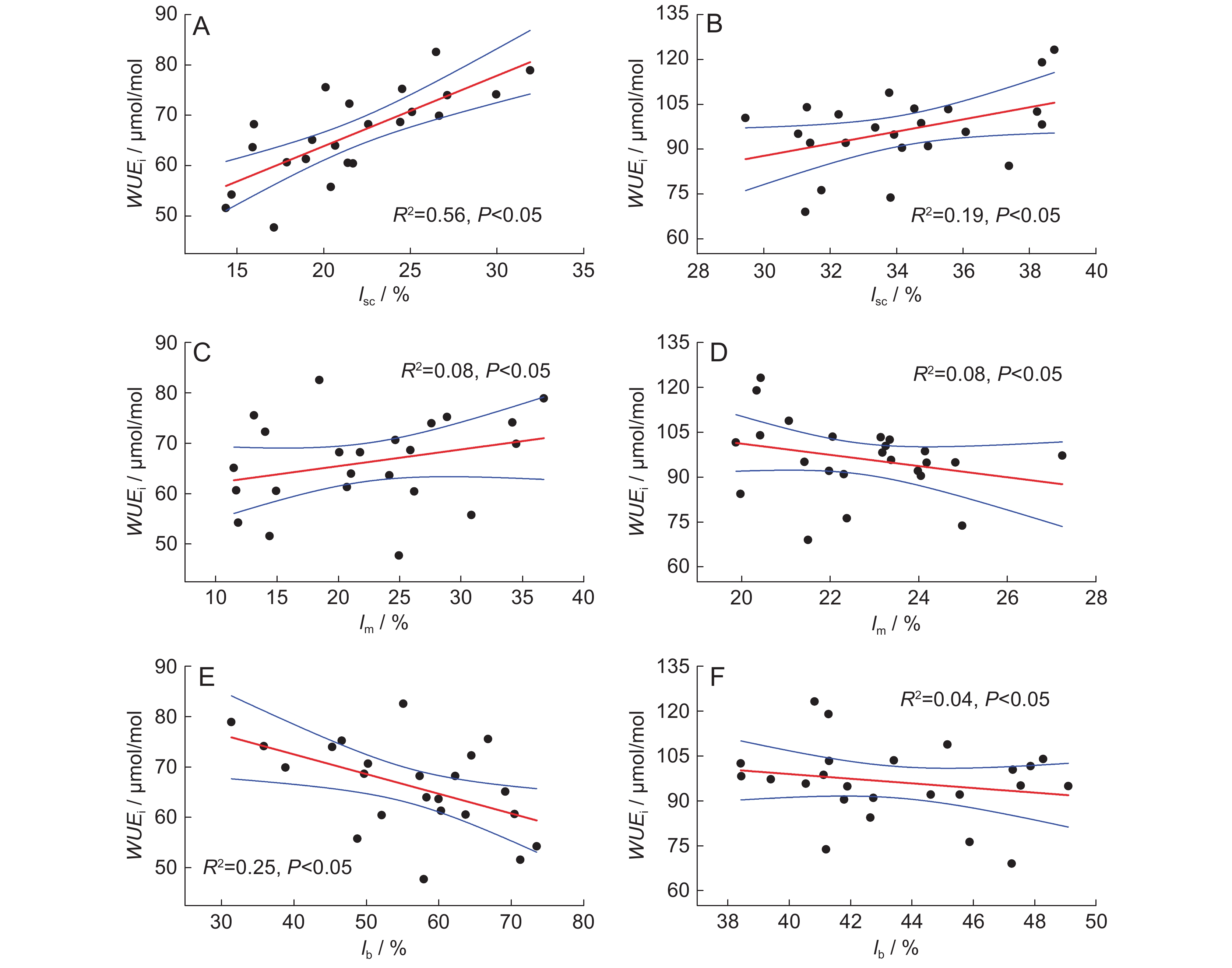
虽然土壤氮添加并未对叶片水分利用能力产生显著影响,但氮添加期间植株WUEi仍与其光合限制作用显著相关(图4)。氮添加期间,两树种叶片WUEi与lsc呈正相关(图4:A、B),与lb呈负相关(图4:E、F),表明WUEi与气孔导度(gsc)呈负相关,而植株生化反应能力越强,其水分利用效率越高,即除气体扩散外的其他生理生化过程会增强叶片水分利用能力。不同于lsc和lb,WUEi与lm的拟合关系在两个树种间有差异,水曲柳WUEi与lm呈正相关(图4:C),而蒙古栎WUEi则与lm呈负相关(图4:D),表明土壤氮添加期间植株gm变化对叶片水分利用能力的影响不明确,其效应会随着物种的不同而异。
2.3.3 叶片解剖结构变化
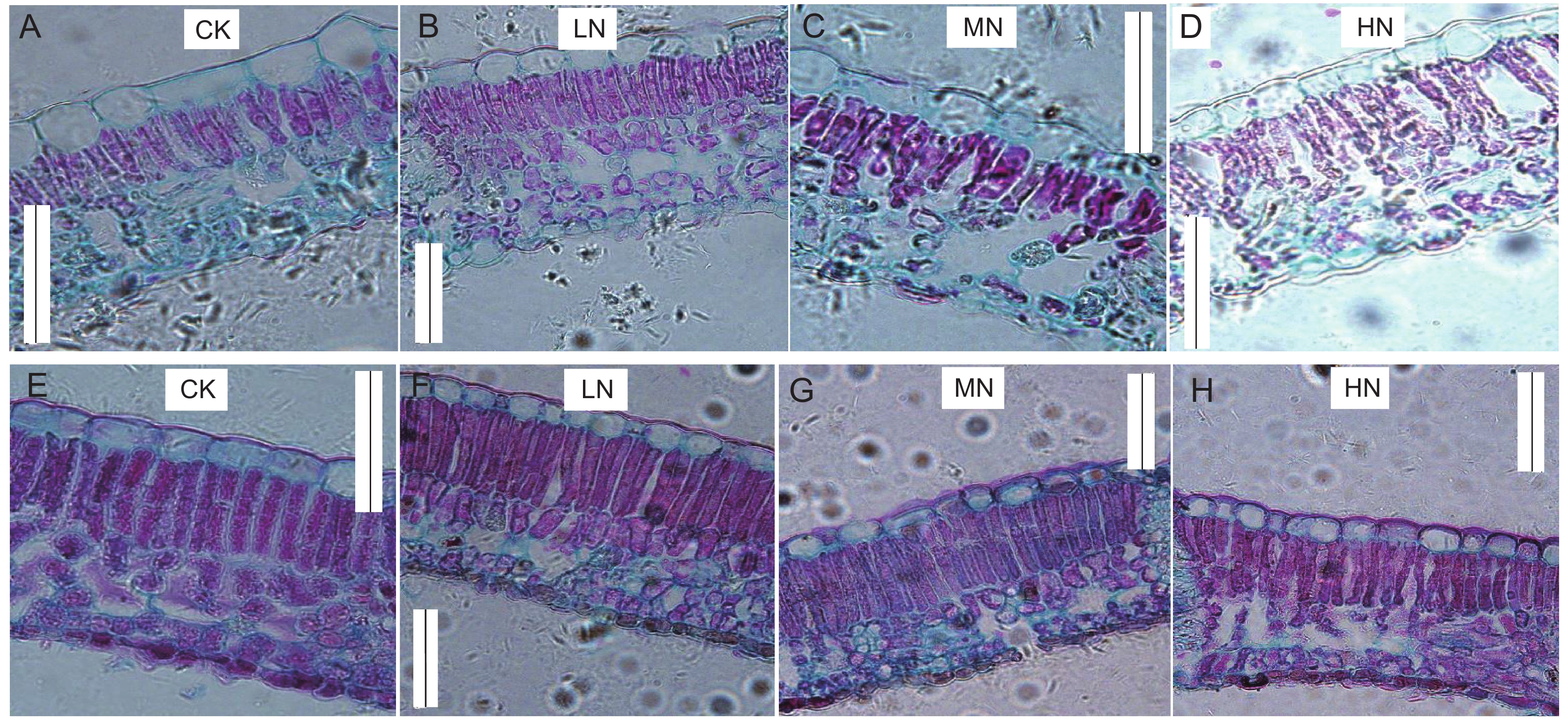
土壤氮添加对植株叶片解剖结构影响显著,如图5、图6所示。从CK到MN,气孔开度明显增大,但在HN下显著减小(图5:D、H)。另外,相较对照,土壤氮添加后叶片栅栏组织和海绵组织叶肉细胞排列紧密程度及体积均有一定的增加,尤在MN下最为显著(图6:C、G),但在HN下两树种叶肉细胞体积均出现一定的减小。相较水曲柳,蒙古栎叶肉细胞在土壤氮添加后排列更加紧密,HN下的细胞萎缩程度更低。
3. 讨论
3.1 植株光合增强主要源于CO2扩散性限制作用的减弱
早前的研究结果均显示土壤氮添加对植株净光合速率(Pn)和CO2扩散导度(gsc和gm)具有正效应[6, 8, 10, 24, 25],但这一正效应主要源于哪种光合限制作用的减弱尚未见报道。本文对土壤氮添加期间3种光合限制因子的变化及其在提高植株光合中的主次“角色”进行了分析。发现土壤氮添加后水曲柳和蒙古栎的CO2扩散性限制作用(lsc和lm)均减弱,而非扩散性限制作用(lb)则显著增强;此外,土壤氮添加下gsc和gm变化对叶片饱和光下碳同化(dPn/Pn)的相对贡献率(SCL和MCL)也远大于其他生化过程变化的贡献率(BL)。因此,土壤氮添加增强植株光合能力的正效应主要源于叶片CO2扩散导度的增加,而非生化代谢能力的增强,即叶片CO2扩散性限制应为土壤氮添加期间植株光合的主导限制因子,这与前人的研究结果一致[20, 26-28]。
此外,CO2扩散性限制作用减弱对植株光合增强的正效应也在叶片及气孔的解剖结构上得到了体现。本研究中,土壤氮添加后气孔及叶肉细胞的形态均发生了显著变化,从CK到MN气孔开口增大,但在HN下减小,表明土壤氮添加能够促进气孔张开,从而减小气孔阻力,降低气孔限制作用lsc,但这种效应也存在阈值。此外,与对照相比,氮添加植株的叶肉细胞萎缩,排列更加紧密,从而增加了细胞间隙和CO2分子的扩散空间。
另据我们的早期研究结果[10],土壤氮添加后气孔开度分别由17.57 µm2增加至19.74 µm2(水曲柳),由12.78 µm2增加至16.52 µm2(蒙古栎),叶肉细胞厚度及其面向细胞间隙的面积也均增大,这不仅降低了CO2的扩散阻力,也增加了其在气孔及叶肉细胞的传输路径,扩大了与叶肉细胞的接触面积,使更多的CO2能够被协助扩散或主动运输进叶肉细胞,进而参与光合的碳同化[29]。此外,作为介导CO2传输的载体蛋白,水通道蛋白和碳酸酐酶的活性均在氮添加后上升[10],极大地提高了酶的催化效率,也显著增加了细胞膜及叶绿体的膜透性[3, 30],催化更多的底物CO2传输到RuBP羧化位点。因此,虽然土壤氮添加在一定程度上增强了酶的生化活性,但该期间植株光合作用的增强仍很大程度上源于CO2扩散导度的增加以及扩散性限制作用的减弱。
3.2 gsc变化是土壤氮添加期间植株光合的主导限制因子
水曲柳和蒙古栎在土壤氮添加期间的植株光合能力增强主要源于CO2扩散性限制作用的减弱。那么,lsc和lm究竟是谁在发挥主要作用呢?本文将两种扩散性限制作用进行定量分析发现,土壤氮添加后,lsc和lm无论在数值上还是较对照的降幅上均非常接近,难辨主次,但二者对植株饱和光下碳同化的相对贡献率却存在显著差异。水曲柳SCL随土壤氮添加持续升高,但其MCL却先升高后降低,在不同处理下SCL均大于MCL;而蒙古栎SCL和MCL虽随氮添加表现出相似的变化趋势,但不同处理下的SCL也均大于MCL。这表明土壤氮添加后gsc增加所产生的强光合贡献率远大于同期gm增加的光合贡献率,即土壤氮添加对植株光合的正效应主要源于gsc的增加。因此,从光合限制因子的角度看,气孔限制作用lsc是土壤氮添加期间植株光合效率变化的主要限制因子。这与我们前期对土壤水含量变化期间植株光合主导限制因子的结论一致[31]。 Barbour 和 Kaiser [32]的研究也得到了相似的结论,即土壤干旱期间气孔限制增加更明显,对光合的限制作用更强。
另外,叶片潜在水分利用效率(WUEi)反映了植株的水分利用潜力,其与植株光合及CO2扩散显著相关[32, 33]。有研究发现,叶片WUEi与gsc的相关性强于gm[32]。我们先前的研究也发现了lsc对土壤干旱及复水期间植株水分利用效率变化的主导作用[28]。本研究中,WUEi虽未随土壤氮添加出现显著变化,但整体却呈降低趋势,与3种光合限制因子表现出显著的相关关系,并与lsc呈正相关。土壤氮添加期间lsc的减弱(即gsc的增大)降低了气孔对CO2和水蒸气的扩散阻力,而CO2的扩散阻力是水蒸气的0.64倍[34],因此,该期间叶片蒸腾速率比光合速率上升的快,使得更多的水分透过气孔散失掉,从而降低WUEi,这也进一步揭示了gsc的光合主导地位。然而,Sáez 等[35]在探究温度及土壤含水量对两种南极植物碳同化能力的影响时发现,两种环境胁迫下gm(而非gsc)的变化(即lm)是植株光合的最大限制因子,这与本研究结论相悖。可见,gsc和gm变化(即lsc和lm)均能在一定程度上对植株的光合碳同化产生重要限制[18, 26, 36],但二者 “角色” 的主次会随种类及环境条件的不同而异。
4. 结论
土壤氮添加对水曲柳和蒙古栎植株的光合限制作用均产生显著影响。具体表现为:(1)与对照相比,氮添加植株lsc和lm降低,降幅整体均大于10%,后随土壤氮添加先降低后升高,在MN下最小; lb则在氮添加后增大,增幅整体高于10%,后随土壤氮添加先增大后减小,并在MN下达到最大值,即MN的土壤氮添加量对植株光合的促进作用最大。(2)土壤氮添加期间植株光合能力的增强主要源于CO2扩散性限制作用的减弱, gsc变化(即lsc)是扩散性限制的主要作用因子。(3)3种光合限制作用在不同生长期未表现出显著差异,表明lsc的光合主要限制“角色”无季节性差异。此外,一定范围内(< 69 kg·ha−1·year−1)的土壤氮添加并不会对植株水分利用潜力产生显著影响。
-
图 1 水曲柳(A、C)和蒙古栎(B、D)相对限制作用对土壤氮含量变化的响应
lsc为气孔限制,lm为叶肉限制,lb为生化限制。CK为对照(0 kg·ha−1·year−1),LN为低氮添加(23 kg·ha−1·year−1),MN为中氮添加(46 kg·ha−1·year−1),HN为高氮添加(69 kg·ha−1·year−1)。下同。
Figure 1. Reponses to relative limitations of soil nitrogen content in Fraxinus mandshurica (A, C) and Quercus mongolica (B, D) saplings
lsc, stomatal limitation; lm, mesophyll limitation; lb, biochemical limitation. CK, control (0 kg·ha−1·year−1); LN, low nitrogen addition (23 kg·ha−1·year−1); MN, medium nitrogen addition (46 kg·ha−1·year−1); HN, high nitrogen addition (69 kg·ha−1·year−1). Same below.
图 2 水曲柳(A、C)和蒙古栎(B、D)gsc、gm及生化能力对植株饱和光下碳同化相对贡献率随土壤氮含量的变化
SCL为gsc对叶片dPn/Pn的贡献值,MCL为gm对叶片dPn/Pn的贡献值,BL为生化能力对叶片dPn/Pn的贡献值。
Figure 2. Changes in contributions of gsc, gm, and biochemical capacity to light-saturated carbon assimilation (dPn/Pn) with soil nitrogen addition in Fraxinus mandshurica (A, C) and Quercus mongolica (B, D) saplings
SCL, contribution of gsc to dPn/Pn; MCL, contribution of gm to dPn/Pn; BL, contribution of biochemical capacity to dPn/Pn.
-
[1] Flexas J,Ribas-Carbó M,Diaz-Espejo A,Galmés J,Medrano H. Mesophyll conductance to CO2:current knowledge and future prospects[J]. Plant Cell Environ,2008,31 (5):602−621. doi: 10.1111/j.1365-3040.2007.01757.x
[2] Perez-Martin A,Michelazzo C,Torres-Ruiz JM,Flexas J,Fernández JE,et al. Regulation of photosynthesis and stomatal and mesophyll conductance under water stress and recovery in olive trees:correlation with gene expression of carbonic anhydrase and aquaporins[J]. J Exp Bot,2014,65 (12):3143−3156. doi: 10.1093/jxb/eru160
[3] Han JM,Lei ZY,Flexas J,Zhang YJ,Carriquí M,et al. Mesophyll conductance in cotton bracts:anatomically determined internal CO2 diffusion constraints on photosynthesis[J]. J Exp Bot,2018,69 (22):5433−5443.
[4] Zhu K,Yuan FH,Wang AZ,Yang H,Guan DX,et al. Effects of soil rewatering on mesophyll and stomatal conductance and the associated mechanisms involving leaf anatomy and some physiological activities in Manchurian ash and Mongolian oak in the Changbai Mountains[J]. Plant Physiol Biochem,2019,144:22−34. doi: 10.1016/j.plaphy.2019.09.025
[5] Liu ZJ,Dickmann DI. Effects of water and nitrogen interaction on net photosynthesis,stomatal conductance,and water use-efficiency in two hybrid poplar clones[J]. Physiol Plant,1996,97 (3):507−512. doi: 10.1111/j.1399-3054.1996.tb00510.x
[6] Yamori W,Nagai T,Makino A. The rate-limiting step for CO2 assimilation at different temperatures is influenced by the leaf nitrogen content in several C3 crop species[J]. Plant Cell Environ,2011,34 (5):764−777. doi: 10.1111/j.1365-3040.2011.02280.x
[7] Li Y,Ren BB,Yang XX,Xu GH,Shen QR,Guo SW. Chloroplast downsizing under nitrate nutrition restrained mesophyll conductance and photosynthesis in rice (Oryza sativa L. ) under drought conditions[J]. Plant Cell Physiol,2012,53 (5):892−900. doi: 10.1093/pcp/pcs032
[8] Xiong DL,Liu X,Liu LM,Douthe C,Li Y,et al. Rapid responses of mesophyll conductance to changes of CO2 concentration,temperature and irradiance are affected by N supplements in rice[J]. Plant Cell Environ,2015,38 (12):2541−2550. doi: 10.1111/pce.12558
[9] Eller F,Jensen K,Reisdorff C. Nighttime stomatal conductance differs with nutrient availability in two temperate floodplain tree species[J]. Tree Physiol,2017,37 (4):428−440.
[10] Zhu K,Wang AZ,Wu JB,Yuan FH,Guan DX,et al. Effects of nitrogen additions on mesophyll and stomatal conductance in Manchurian ash and Mongolian oak[J]. Sci Rep,2020,10:10038. doi: 10.1038/s41598-020-66886-x
[11] Galloway JN,Dentener FJ,Capone DG,Boyer EW,Howarth RW,et al. Nitrogen cycles:past,present,and future[J]. Biogeochemistry,2004,70 (2):153−226. doi: 10.1007/s10533-004-0370-0
[12] Zheng XH,Fu CB,Xu XK,Yan XD,Huang Y,et al. The Asian nitrogen cycle case study[J]. AMBIO,2002,31 (2):79−87. doi: 10.1579/0044-7447-31.2.79
[13] Loriaux SD,Avenson TJ,Welles JM,Mcdermitt DK,Eckles RD,et al. Closing in on maximum yield of chlorophyll fluorescence using a single multiphase flash of sub-saturating intensity[J]. Plant Cell Environ,2013,36 (10):1755−1770. doi: 10.1111/pce.12115
[14] Genty B,Briantais JM,Baker NR. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochim Biophys Acta Gen Subj,1989,990 (1):87−92. doi: 10.1016/S0304-4165(89)80016-9
[15] Valentini R,Epron D,Angelis P,Matteucci G,Dreyer E. In situ estimation of net CO2 assimilation,photosynthetic electron flow and photorespiration in Turkey oak (Q. cerris L. ) leaves:diurnal cycles under different levels of water supply[J]. Plant Cell Environ,1995,18 (6):631−640. doi: 10.1111/j.1365-3040.1995.tb00564.x
[16] Harley PC,Loreto F,Di Marco G,Sharkey TD. Theoretical considerations when estimating the mesophyll conductance to CO2 flux by analysis of the response of photosynthesis to CO2[J]. Plant Physiol,1992,98 (4):1429−1436. doi: 10.1104/pp.98.4.1429
[17] Walker BJ,Skabelund DC,Busch FA,Ort DR. An improved approach for measuring the impact of multiple CO2 conductances on the apparent photorespiratory CO2 compensation point through slope-intercept regression[J]. Plant Cell Environ,2016,39 (6):1198−1203. doi: 10.1111/pce.12722
[18] Grassi G,Magnani F. Stomatal,mesophyll conductance and biochemical limitations to photosynthesis as affected by drought and leaf ontogeny in ash and oak trees[J]. Plant Cell Environ,2005,28 (7):834−849. doi: 10.1111/j.1365-3040.2005.01333.x
[19] Wang XX,Du TT,Huang JL,Peng SB,Xiong DL. Leaf hydraulic vulnerability triggers the decline in stomatal and mesophyll conductance during drought in rice[J]. J Exp Bot,2018,69 (16):4033−4045. doi: 10.1093/jxb/ery188
[20] Flexas J,Barón M,Bota J,Ducruet JM,Gallé A,et al. Photosynthesis limitations during water stress acclimation and recovery in the drought-adapted Vitis hybrid Richter-110 (V. berlandieri × V. rupestris)[J]. J Exp Bot,2009,60 (8):2361−2377. doi: 10.1093/jxb/erp069
[21] Cano FJ,López R,Warren CR. Implications of the mesophyll conductance to CO2 for photosynthesis and water-use efficiency during long-term water stress and recovery in two contrasting Eucalyptus species[J]. Plant Cell Environ,2014,37 (11):2470−2490. doi: 10.1111/pce.12325
[22] Von Caemmerer S,Evans JR,Hudson GS,Andrews TJ. The kinetics of ribulose-1,5-bisphosphate carboxylase/oxygenase in vivo inferred from measurements of photosynthesis in leaves of transgenic tobacco[J]. Planta,1994,195:88−97. doi: 10.1007/BF00206296
[23] Osmond CB, Björkman O, Anderson DJ. Physiological Processes in Plant Ecology: Toward a Synthesis with Atriplex[M]. Berlin: Springer, 1980: 468.
[24] Bown HE,Watt MS,Mason EG,Clinton PW,Whitehead D. The influence of nitrogen and phosphorus supply and genotype on mesophyll conductance limitations to photosynthesis in Pinus radiata[J]. Tree Physiol,2009,29 (9):1143−1151. doi: 10.1093/treephys/tpp051
[25] Li Y,Gao YX,Xu XM,Shen QR,Guo SW. Light-saturated photosynthetic rate in high-nitrogen rice (Oryza sativa L. ) leaves is related to chloroplastic CO2 concentration[J]. J Exp Bot,2009,60 (8):2351−2360. doi: 10.1093/jxb/erp127
[26] Galmés J,Medrano H,Flexas J. Photosynthetic limitations in response to water stress and recovery in Mediterranean plants with different growth forms[J]. New Phytol,2007,175 (1):81−93. doi: 10.1111/j.1469-8137.2007.02087.x
[27] Wang XX,Wang WC,Huang JL,Peng SB,Xiong DL. Diffusional conductance to CO2 is the key limitation to photosynthesis in salt-stressed leaves of rice (Oryza sativa)[J]. Physiol Plantarum,2018,163 (1):45−58. doi: 10.1111/ppl.12653
[28] Zhu LL,Li HC,Thorpe MR,Hocart CH,Song X. Stomatal and mesophyll conductance are dominant limitations to photosynthesis in response to heat stress during severe drought in a temperate and a tropical tree species[J]. Trees,2021,35 (5):1613−1626. doi: 10.1007/s00468-021-02140-9
[29] 张继澍, 胡景江, 王玉国, 张少英, 宋纯鹏. 植物生理学[M]. 北京: 高等教育出版社, 2006: 112-120. [30] Perez-Martin A,Torres-Ruiz JM,Flexas J,Fernández JE,Diaz-Espejo A. Physiological and genetic response of olive leaves to water stress and recovery:implications of mesophyll conductance and genetic expression of aquaporins and carbonic anhydrase[J]. Acta Hortic,2011,922 (922):99−105.
[31] Zhu K,Yuan FH,Wang AZ,Wu JB,Guan DX,et al. Stomatal,mesophyll and biochemical limitations to soil drought and rewatering in relation to intrinsic water-use efficiency in Manchurian ash and Mongolian oak[J]. Photosynthetica,2021,59 (1):49−60. doi: 10.32615/ps.2020.084
[32] Barbour MM,Kaiser BN. The response of mesophyll conductance to nitrogen and water availability differs between wheat genotypes[J]. Plant Sci,2016,251:119−127. doi: 10.1016/j.plantsci.2016.03.012
[33] Tomás M,Medrano H,Brugnoli E,Escalona JM,Martorell S,et al. Variability of mesophyll conductance in grapevine cultivars under water stress conditions in relation to leaf anatomy and water use efficiency[J]. Aust J Grape Wine Res,2014,20 (2):272−280. doi: 10.1111/ajgw.12069
[34] 蒋高明,何维明. 毛乌素沙地若干植物光合作用、蒸腾作用和水分利用效率种间及生境间差异(英文)[J]. 植物学报,1999,41(10):1114−1124. Jiang GM,He WM. Species- and habitat-variability of photosynthesis,transpiration and water use efficiency of different plant species in Maowusu sand area[J]. Acta Botanica Sinica,1999,41 (10):1114−1124.
[35] Sáez PL,Galmés J,Ramírez CF,Poblete L,Rivera BK,et al. Mesophyll conductance to CO2 is the most significant limitation to photosynthesis at different temperatures and water availabilities in Antarctic vascular species[J]. Environ Exp Bot,2018,156:279−287. doi: 10.1016/j.envexpbot.2018.09.008
[36] Aranda I,Rodríguez-Calcerrada J,Robson TM,Cano FJ,Alté L,Sánchez-Gómez D. Stomatal and non-stomatal limitations on leaf carbon assimilation in beech (Fagus sylvatica L. ) seedlings under natural conditions[J]. For Syst,2012,21 (3):405−417.
-
期刊类型引用(1)
1. 龙桂根,黄芝云,吴南生,冯胜,冯超,丁菲,金松松,何利人,王勇,陈玲. 南酸枣种质资源果实性状变异和综合评价. 热带亚热带植物学报. 2024(06): 781-790 .  百度学术
百度学术
其他类型引用(3)



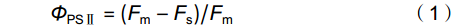

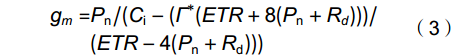

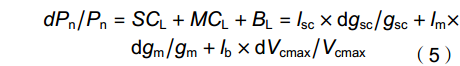
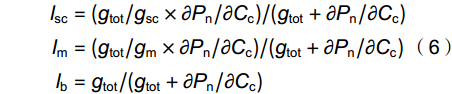
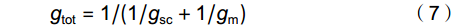

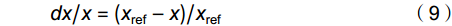
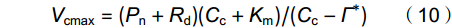
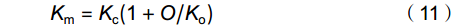

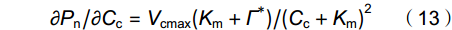

 下载:
下载: