Effects of plant functional groups removal on soil fungal community structure and diversity in an alpine meadow on the Qinghai-Tibet Plateau
-
摘要:
为研究植物多样性丧失对土壤真菌群落的影响,本研究在青藏高原高寒草甸进行了为期3年的植物功能群移除实验,实验共设置5个处理:不移除任何植物功能群(CK)、移除豆科和杂类草而保留禾状草、移除禾状草和杂类草而保留豆科、移除禾状草和豆科而保留杂类草以及移除所有功能群。本研究分析了高寒草甸不同植物功能群移除对根系性质、土壤理化性质的影响,并利用高通量基因测序技术分析了不同处理对土壤真菌群落结构和多样性的影响。结果显示,不同处理下均以子囊菌门、被孢霉门、担子菌门为优势类群,占土壤真菌群落的90%以上。土壤真菌群落结构和多样性在不同植物移除处理下变化不显著。球囊菌门的相对丰度在保留杂类草、保留豆科的处理中显著高于对照。捕虫霉门的相对丰度在保留豆科处理中显著高于其他处理。不同处理下土壤真菌优势功能类群为土壤腐生营养型。丛枝菌根真菌相对丰度在保留禾状草、保留豆科处理中显著高于对照。地衣寄生菌/腐生菌的相对丰度在保留杂类草处理中显著高于移除所有植物功能群处理。利用Mantel test检验,未发现土壤真菌群落结构和功能与环境因子具有显著相关性。土壤真菌丰富度与根系生物量、根系碳氮比、可溶性有机碳含量呈负相关关系。研究结果说明,青藏高原高寒草甸植物移除3年后,土壤真菌群落结构发生改变,但并未对真菌群落多样性指数产生显著影响。
Abstract:To investigate the effect of plant diversity on soil fungal communities, we conducted a three-year experiment in an alpine meadows on the Qinghai-Tibet Plateau. The experiment included five treatments: no removal, legume and forb removal, graminoid and forb removal, graminoid and legume removal, and all removal. We analyzed soil fungal abundance and diversity using high-throughput sequencing, and measured root and soil properties. Results showed that Ascomycota, Mortierellomycota, and Basidiomycota were the dominant fungal phyla in the different treatments, accounting for more than 90%. There were no significant differences in composition and alpha diversity indices of the fungal communities under different treatments. The relative abundance of Glomeromycota was increased under graminoid and forb removal and graminoid and legume removal. Compared to the other treatments, the removal of graminoids and forbs increased the relative abundance of Zoopagomycota. The dominant fungal functional group was soil saprotroph fungi in all treatments. The relative abundance of arbuscular mycorrhizal fungi was increased under legume and forb removal and graminoid and forb removal. Compared with the removal of all, the removal of graminoids and legumes increased the relative abundance of lichen parasites/saprotroph fungi. The Mantel test showed no clear correlation between soil fungal community composition and function and environmental factors. Soil fungal richness indices were negatively affected by the increase in root biomass, root carbon:nitrogen (C:N), and dissolved organic carbon. Overall, our results indicate that the removal of plant functional groups in alpine meadows on the Qinghai-Tibet Plateau has a significant effect on soil fungal community structure but not on fungal community diversity.
-
Keywords:
- Alpine meadow /
- Plant functional group removal /
- Soil fungi /
- Plant-soil interaction
-
土壤重金属污染是各方关注的严重环境问题之一。根据2014年《全国土壤重金属污染状况调查公报》,我国约有2 000万公顷耕地受到了重金属污染,其中330万公顷的污染程度达到了中度或重度污染。江西是我国矿产资源大省,铜资源在全国具有重要地位,长期的矿业开采、选矿、冶炼等产生的“三废”不断排放到周围环境,造成周边农田土壤铜污染严重,对农产品安全和人类身体健康都造成了极大的威胁[1]。以江西德兴铜矿区为例,周边土壤存在不同程度的铜污染,在919份调查样品中,铜含量位于50~400 mg/kg的有171个,含量大于400 mg/kg有18个,土壤最高铜含量可达1825 mg/kg,远大于中国土壤环境质量标准的三级标准(400 mg/kg)[2, 3],铜污染土壤的治理逐渐成为一个亟待解决的问题。植物修复(Phytoremediation)是一种新兴的土壤重金属净化技术[4],具有成本低廉、修复面积广、操作方便、二次污染易控制,美化植被环境等优点[5]。目前,关于修复植物的筛选多集中在草本植物,但草本生物量小、生长速度慢且很难进行机械收获作业,不适宜开展大面积污染土壤的修复[6],且农作物和草类等所吸收的重金属大多存在进入食物链或二次污染的风险,因此在实际修复应用中受到限制。当前,寻找生物量大、适应性强、观赏价值高且耐重金属的植物十分具有现实意义[7,8]。木本植物对重金属具有较强的耐性和一定的固定、吸收、累积能力,且其发达的深根系可使土壤中重金属移动性降低,降低其迁移和生物毒性,改善土壤质量等,引起研究人员的广泛关注[9]。
樟树(Cinnamomum camphora (L.) Presl)是重要的木本经济树种,樟脑、樟油等提取物是医药、化工、香料、防腐、农药的重要原料。樟树具有根系发达、生长迅速、生物量大、适应性强等优点,对重金属污染环境有较强的适应能力,15种常见乔木中,樟树对重金属的综合富集系数最高,对土壤中铜、锌和镉的富集能力均较强[10],在铜为主要污染源的土壤植物修复中有着较大的应用潜力。因此,樟树具有土壤修复收益型植物潜力。项目组前期将全国范围内收集的9个种源68个家系的樟树实生苗种植在以铜污染为主的江西德兴铜矿周边的水龙山实验修复基地,经过3年的跟踪调查,有12个家系适应性表现良好,成活率和保存率均较高,说明部分樟树具有较好的耐铜性,但樟树对铜离子的生理生化响应及富集转运特性还不清楚。本项目以前期筛选出的耐铜樟树为实验材料,通过盆栽实验研究不同浓度铜处理对樟树生长和生理指标的影响及铜的富集转运特性,探明耐铜樟树抵御铜毒性的生理生化机制,以期为樟树用于铜污染土壤修复提供科学依据。
1. 材料与方法
1.1 实验材料
实验于2021年7月在江西省科学院生物资源研究所人工气候室进行。实验地位于南昌市(28°41'N,115°59'E),实验材料为前期筛选出的耐铜樟树材料。收集同一单株的种子,将种子去果肉并反复搓洗干净,室内沙藏,于第2年春天播种,筛选长势一致的樟树幼苗统一移栽至事先准备好的基质中(红壤土∶细沙∶泥炭=1∶1∶1),栽培盆大小为上口径20 cm,底径14 cm,高14 cm,每盆基质重2.5 kg。经过3个月的缓苗,选取生长较好、高度一致的幼苗,采用随机区组设计,进行铜胁迫处理。
1.2 实验方法
以CuSO4·5H2O 为铜来源,配制铜浓度为100 g/kg的母液,处理前1周各栽培盆开始控水,至处理时各盆中基质均为干燥状态,处理时将各处理浓度所需母液用蒸馏水稀释至550 mL,缓缓浇灌至栽培盆中(经实验前反复验证,550 mL可以保证栽培盆内基质完全浸湿,且托盘里几乎没有多余水分流出),处理浓度分别为:0、50、150、300、600、900、1200 mg/kg(以基质重计算纯铜含量),每个处理4个重复。采样时间为处理60 d,每株选取3~4片嫩叶(枝条顶部开始倒数第 3~4 片叶)为待测材料,以锡箔纸包好,迅速投入液氮罐中,带回实验室放入−80 ℃冰箱保存,用于生理指标的测定;另准确称取0.1 g新鲜叶片,剪碎,放入事先准备好的装有95%乙醇的离心管中,黑暗处理,并放在摇床上震荡处理3 d,至叶片完全透明为止,用于色素含量的测定;最后将各处理单株分地上地下保存,放烘箱105 ℃杀青30 min,再70 ℃烘干至恒重测定干物质量,每株分别准确称取0.2 g根、茎、叶的研磨粉,微波消解,采用ICP-MS测定不同器官中铜含量。
1.3 生理指标测定
生理指标检测均参考施海涛[11]的方法。氯化硝基四氮唑蓝(NBT)光还原法测超氧化物歧化酶(SOD)活性;愈创木酚氧化法测过氧化物酶(POD)活性;高锰酸钾滴定法测过氧化氢酶(CAT)活性;烟酰胺腺嘌呤二核苷酸磷酸还原反应法测谷胱甘肽还原酶(GR)活性;硫代巴比妥酸比色法测丙二醛(MDA)含量;茚三酮比色法间接测定游离脯氨酸(Pro))含量;蒽酮比色法测定可溶性糖含量;考马斯亮蓝法测定可溶性蛋白含量。硫酸钛反应法测定过氧化氢(H2O2)含量,2-硝基苯甲酸反应法测谷胱甘肽(GSH)含量。所用试剂盒均由南京建成生物工程研究所提供,具体操作步骤按照相关说明书进行。
1.4 数据处理
所有指标的测定均进行4次生物学重复,最后结果采用平均值±标准差表示,采用SPSS 25软件作图并进行单因素方差分析(One-way ANOVA)。
2. 结果与分析
2.1 铜胁迫对樟树生长与生物量积累的影响
如图1所示,在铜胁迫浓度小于600 mg/kg时,樟树都可以很好地存活,根系和叶片均没有明显变化。其中150 mg/kg铜处理时,樟树长势最好,茎秆粗壮,叶片颜色墨绿。铜胁迫浓度为900 mg/kg时,叶片没有明显变化,部分根系开始出现褐化,根系的数量开始减少,但处理2个月后有新根萌出,可见900 mg/kg处理时,樟树依然可以存活。当处理浓度为1 200 mg/kg时,部分叶片开始萎蔫,根系褐化严重,且根系数量减少明显,也没有新根长出。因此在1 200 mg/kg铜处理下,樟树生长抑制及损害明显。
生物量干质量的结果与生长观察一致(表1),150 mg/kg处理时可以促进樟树的生长,其地上和根系干质量均高于其他处理,900 mg/kg处理时,地上干质量没有降低,反而高于对照组,但差异不显著(P>0.05);根系干质量稍有降低,差异也不显著(P>0.05)。1 200 mg/kg处理时,樟树的地上和根系干质量均低于其他各处理,且与150 mg/kg处理时差异显著(P<0.05),与其他处理差异不显著(P>0.05)。
表 1 不同浓度铜处理下樟树地上和根系生物量(干质量)的测定Table 1. Determination of aboveground and root biomass (dry mass) of Cinnamomum camphora treated with different concentrations of copper处理
Treatments / mg/kg地上质量
Dry mass of shoot / g根质量
Dry mass of root / g0 7.98±2.87bc 3.81±1.18ab 50 7.85±2.54bc 3.59±0.67ab 150 9.59±3.08a 4.53±1.35a 300 9.18±1.57ab 3.62±0.53ab 600 7.61±1.14bc 3.49±0.50ab 900 8.33±0.91bc 3.11±0.60b 1200 6.82±1.44c 2.97±0.90b 注:数据均为平均值±标准差,小写字母表示不同处理间在P<0.05水平上差异显著(n=4)。下同。 Notes: All data in the table are average values±standard deviation (SD). Lowercase letters after data in the same row indicate significant differences between different treatments at P<0.05 level (n=4). Same below. 2.2 铜胁迫对樟树光合色素含量的影响
研究结果显示,叶绿素a、b及类胡萝卜素的含量均随着铜浓度的升高而降低。处理浓度为1200 mg/kg时,叶绿素a、b的含量均降至最低,显著低于其他各处理(P<0.05,图2);900 mg/kg处理时,叶绿素a、b的含量与300、600 mg/kg处理的差异均不显著(P>0.05),但与CK、50、150 mg/kg 处理时差异显著(P<0.05)。50、150、300、600 mg/kg 4种处理间的叶绿素a与叶绿素b差异均不显著(P>0.05)。类胡萝卜素含量的变化趋势与叶绿素a、b的变化趋势大致相同,也表现出随处理浓度的升高而降低的趋势,1 200 mg/kg处理时,类胡萝卜素含量最低,但与50、600、900 mg/kg 3个处理的差异不显著(P>0.05),与CK、150、300 mg/kg处理的差异显著(P<0.05)。
![]() 图 2 不同浓度铜处理60 d叶片中叶绿素a、b及类胡萝卜素含量的测定不同小写字母表示处理间在 P<0.05水平差异显著。下同。Figure 2. Determination of chlorophyll a, chlorophyll b, and carotenoid in Cinnamomum camphora leaves treated with different concentrations of copper for 60 dDifferent lowercase letters indicate significant differences between different treatments at P<0.05 level. Same below.
图 2 不同浓度铜处理60 d叶片中叶绿素a、b及类胡萝卜素含量的测定不同小写字母表示处理间在 P<0.05水平差异显著。下同。Figure 2. Determination of chlorophyll a, chlorophyll b, and carotenoid in Cinnamomum camphora leaves treated with different concentrations of copper for 60 dDifferent lowercase letters indicate significant differences between different treatments at P<0.05 level. Same below.2.3 铜胁迫对樟树抗氧化酶系统的影响
不同铜浓度影响樟树抗氧化酶系统的分析结果表明(图3),CAT活性在150 mg/kg时最低,与CK、50、600、900、1 200 mg/kg处理的差异显著(P<0.05;图3:A), CK和1 200 mg/kg两个处理时CAT活性最高,但与50、600、900 mg/kg处理间的差异不显著(P>0.05)。POD活性在CK、150、900 mg/kg处理时最高,显著高于300和600 mg/kg两个处理,600 mg/kg处理时的POD活性最低(图3:B)。SOD活性最高的是CK和150 mg/kg两个处理,显著高于300、600 mg/kg处理,与其他处理间的差异不显著(图3:C)。谷胱甘肽还原酶(GR)活性有随着处理浓度的升高逐渐降低的趋势,CK和50 mg/kg处理的GR活性最高,1 200 mg/kg处理时,活性最低,与CK、50、150、300、600 mg/kg处理差异显著,但与900 mg/kg处理的差异不显著(图3:D)
2.4 铜胁迫对樟树渗透调节物质含量及抗逆性指标的影响
GSH作为植物体内重要的抗氧化剂和自由基清除剂,有随着处理浓度的升高而逐渐升高的趋势(图4:A)。渗透调节物质脯氨酸和可溶性糖含量均在1 200 mg/kg 处理时显著高于其他处理(P<0.05),其他处理间没有显著差异(P>0.05;图4:B、C)。可溶性蛋白在900和1 200 mg/kg 处理时显著高于其他处理,其他处理间差异不显著(图4:D)。随着铜浓度的升高,抗逆性指标MDA表现出逐渐升高的趋势(图4:E);H2O2浓度在CK和1 200 mg/kg两个处理时达到最高水平,显著高于50、150、300、600 mg/kg处理,与900 mg/kg处理的差异不显著(图4:F)。
2.5 铜胁迫对樟树不同组织铜浓度的影响
由表2可知,随着铜浓度的增加,根、茎、叶等不同组织的铜含量也逐渐升高,但与CK相比,处理浓度为50和150 mg/kg时,差异没有达到显著水平(P>0.05)。当处理浓度在300 mg/kg以上时,樟树叶、茎和根的铜含量均显著高于对照,但叶、茎的增幅显著低于根,与对照处理相比,300、600、900、1 200 mg/kg处理的叶片铜含量分别增加了1.73、1.80、1.74和2.12倍,茎部铜含量分别增加了1.42、1.45、1.35和2.02倍,而根部铜含量则分别增加了4.45、3.95、15.72和22.17倍。随着铜浓度的增加,铜离子由根系向叶片的转移率IF(Leaf/Root)由对照处理的0.078逐渐降至1 200 mg/kg处理时的0.007;铜离子由根系向茎的转移率IF(Stem/Root)由对照处理的0.06逐渐降至1 200 mg/kg处理时的0.005。樟树各器官铜含量的大小顺序为根>叶>茎,樟树主要将铜富集在根系,往地上茎和叶的转移率很低,且随着铜浓度的增大,往地上茎和叶的转移率也显著降低。
表 2 不同铜浓度处理下樟树不同部位铜含量及铜转移率的测定Table 2. Effects of different concentrations of copper on copper content and transfer rate in different parts of Cinnamomum camphora处理
Treatments /
mg/kg叶铜含量
Leaf Cu /
mg/kg茎铜含量
Stem Cu /
mg/kg根铜含量
Root Cu /
mg/kg铜转运
(叶/根)
IF (Leaf/Root)铜转运
(茎/根)
IF (Stem/Root)0 1.91±0.13c 1.46±0.29c 24.46±1.34d 0.078±0.005a 0.060±0.011a 50 1.72±0.01c 1.09±0.13c 25.20±1.28d 0.068±0.004b 0.044±0.007b 150 1.96±0.45c 1.40±0.23c 28.80±3.16d 0.067±0.009b 0.049±0.011ab 300 3.32±0.43b 2.08±0.24b 108.95±13.01c 0.031±0.002c 0.019±0.003c 600 3.44±0.37b 2.12±0.41b 96.67±11.71c 0.036±0.008c 0.022±0.006c 900 3.33±0.66b 1.97±0.36b 384.44±34.11b 0.009±0.002d 0.005±0.001d 1 200 4.06±0.53a 2.95±0.01a 542.27±51.01a 0.007±0.001d 0.005±0.001d 3. 讨论
3.1 铜胁迫对樟树生长的影响
樟树是重要的木本经济树种,茎叶是精油提取的主要器官,若能将樟树用于铜污染土壤修复中,不仅能改善生态环境,还可以实现收益,同时具有经济和生态效益。研究发现,樟树对铜污染有较好的适应能力[12, 13],在铜污染土壤的植物修复中应用潜力较大[14, 15]。本研究中,樟树对铜胁迫表现出“低促高抑”的变化趋势,一定浓度的铜(150 mg/kg)促进樟树的生长,其地上和根系生物量均高于其他处理,900 mg/kg处理时,樟树地上干质量没有降低,根系干重稍有降低,当处理浓度为1 200 mg/kg时,樟树的地上和根系干质量均降低。生长状况是反映植物对重金属耐受程度的直观指标[7],过量铜抑制植物生长曾多次被文献报道,例如,当Cu2+浓度高于20 μmol/L时,小白菜(Brassica campestris L. ssp. chinensis Makino)和芥菜(Brassica juncea L. Czern. et Coss.)的根、茎、叶生物量均随着铜浓度的升高而显著降低,铜胁迫抑制了小白菜和芥菜的生长[16, 17];玉米(Zea mays L.)幼苗的铜胁迫处理表明,Cu2+浓度为5 μmol/L时玉米幼苗的生长即受到抑制,随着胁迫浓度的升高,玉米幼苗地上和地下生物量均显著降低[18]。
光合作用是植物获取能量的重要途径,植物的能量含量与光合作用密切相关,叶绿素含量是反映植物耐受逆境胁迫的重要指标之一[19],本研究中叶绿素a、b及类胡萝卜素的含量均有随着铜处理浓度的升高而降低的趋势,与袁霞等[20]、李炎林等[21]的研究结果一致。当铜浓度为900 mg/kg时,叶绿素含量与其他低浓度处理差异均不显著;当铜浓度为1 200 mg/kg时,叶绿素含量则显著低于其他各处理。原因可能是重金属胁迫下,植物叶绿体膜结构受到一定程度的破坏,叶绿体开始降解,且叶绿体内的光合酶合成受抑制,叶片气孔关闭,光合作用强度降低[22],植物的生物量积累减少,生长受到抑制。
3.2 铜胁迫对樟树生理生化反应的影响
铜胁迫导致叶绿素含量降低及生长受抑制的主要原因是细胞内活性氧(ROS)含量不断增加并积累[23, 24]。低浓度的重金属可以激活植物的抗氧化应急系统,诱导 SOD、POD和CAT活性升高,以清除体内的活性氧[25],高浓度的 ROS则破坏细胞膜、核酸和叶绿素等关键成分,造成氧化损伤,影响植物的正常发育[26, 27]。MDA是细胞膜脂过氧化的产物,含量的高低反映了植物细胞膜脂过氧化的程度以及抗逆能力的强弱[25],MDA含量越高,植物细胞膜脂过氧化程度越高,ROS引起的细胞损伤越大[28]。本研究中MDA含量有随着铜处理浓度的升高而升高的趋势,900和1 200 mg/kg两个浓度处理时,MDA的含量显著高于其他各处理,说明高浓度铜胁迫对樟树细胞造成一定程度损伤。
可溶性蛋白、可溶性糖和游离脯氨酸作为植物体内重要的渗透调节物质,其含量的变化也是植物抗逆性强弱的重要反映。可溶性蛋白是植物细胞中含量最丰富的生物大分子之一,是植物结构和功能的重要物质基础,含量越高说明生理生化反应和代谢活动越强[29, 30]。本研究中,可溶性蛋白在铜浓度小于600 mg/kg时含量相对稳定,在900和1 200 mg/kg两个高浓度处理时,蛋白含量显著高于其他各处理,说明900和1 200 mg/kg两个浓度处理时,樟树的生理生化和代谢活动显著增强。游离脯氨酸既是渗透调节剂,又可作为自由基清除体内的重金属,其含量的增加可提高植物细胞液的浓度,维持细胞内外渗透压的平衡,保障细胞膜的结构稳定[31]。可溶性糖在维持细胞膜稳定、细胞扩张、酶活性和植株光合作用等方面起着重要作用[32],植物在逆境中可以通过增加可溶性糖等的含量来调节细胞的渗透压,提高对逆境的适应能力[33]。本研究中游离脯氨酸和可溶性糖的含量均在1 200 mg/kg处理时达到最高水平,显著高于其他各处理,900 mg/kg处理和其他低浓度处理的差异不显著,说明900 mg/kg处理时,细胞的内环境相对稳定。
植物抵抗重金属的能力与体内抗氧化酶系统的活性密切相关。POD、 CAT 与 SOD 协同作用,能够有效清除胁迫产生的活性氧,减少对植物细胞的危害,保证植物的正常生长[34]。过氧化氢是在铜胁迫下产生的活性氧物质,能直接或间接氧化细胞内的核酸、蛋白质等生物大分子,破坏细胞膜结构,从而加速细胞老化和解体,POD通过催化过氧化氢分解成无毒害的水和氧气,使植物体内的自由基保持在较低水平,从而避免对植物造成氧化伤害[35,36]。本研究中,不同铜处理后SOD、POD 和 CAT 酶的活性没有显著升高,过氧化氢的含量也相对稳定,在900 mg/kg处理时,其含量与对照差异不显著,说明该处理浓度没有超出樟树的自身调节能力,樟树可以有效抵抗铜的毒害作用。
3.3 铜胁迫对樟树不同器官铜含量的影响
植物对重金属的富集和转运能力是评价其耐受性的重要指标,与根系吸收及根系向地上部转运能力密切相关[9, 37]。本研究中,樟树主要将铜富集在根系,往地上茎和叶的转移率很低,且随着铜浓度的增加,往地上茎和叶的转移率逐渐降低,减轻了过量铜对樟树地上组织的毒害作用,与朱宇恩等[38]的研究结果一致。研究发现,植物主要通过两种途径抵抗铜的毒害作用:一是减少铜从根向地上部的转移,铜离子进入根系后,更多的集中在根系,从而降低铜对植物地上部的毒性;二是将铜离子集中在对铜毒性不太敏感的组织或部位固定起来,以减少铜在植物细胞中的转移,主要方式有将铜离子结合在细胞壁上或者转移到液泡中[39],或者利用植物体内的螯合剂与铜离子结合,形成对植物毒性较小或无毒的螯合物[40]。GSH为植物螯合剂(PCs)的合成提供合成前体,GR能够还原氧化型谷胱甘肽(GSSG)生成还原型谷胱甘肽(GSH),维持细胞内充足的GSH水平[41]。 本研究中,GSH含量有随着铜浓度的升高而升高的趋势,在900和1 200 mg/kg两个高浓度处理时,显著高于其他各处理;GR活性则在CK和50 mg/kg处理时活性最高,且随着处理浓度的升高逐渐降低,1 200 mg/kg处理时活性最低,推测GR被大量消耗,以合成更多的GSH参与植物螯合剂的合成并螯合过量铜离子。 但目前为止,樟树根系对铜离子的耐受策略及其分子调控机制还不清楚,深入探究樟树根系对铜离子的耐受和转运机制,是我们下一步要重点研究的内容。
-
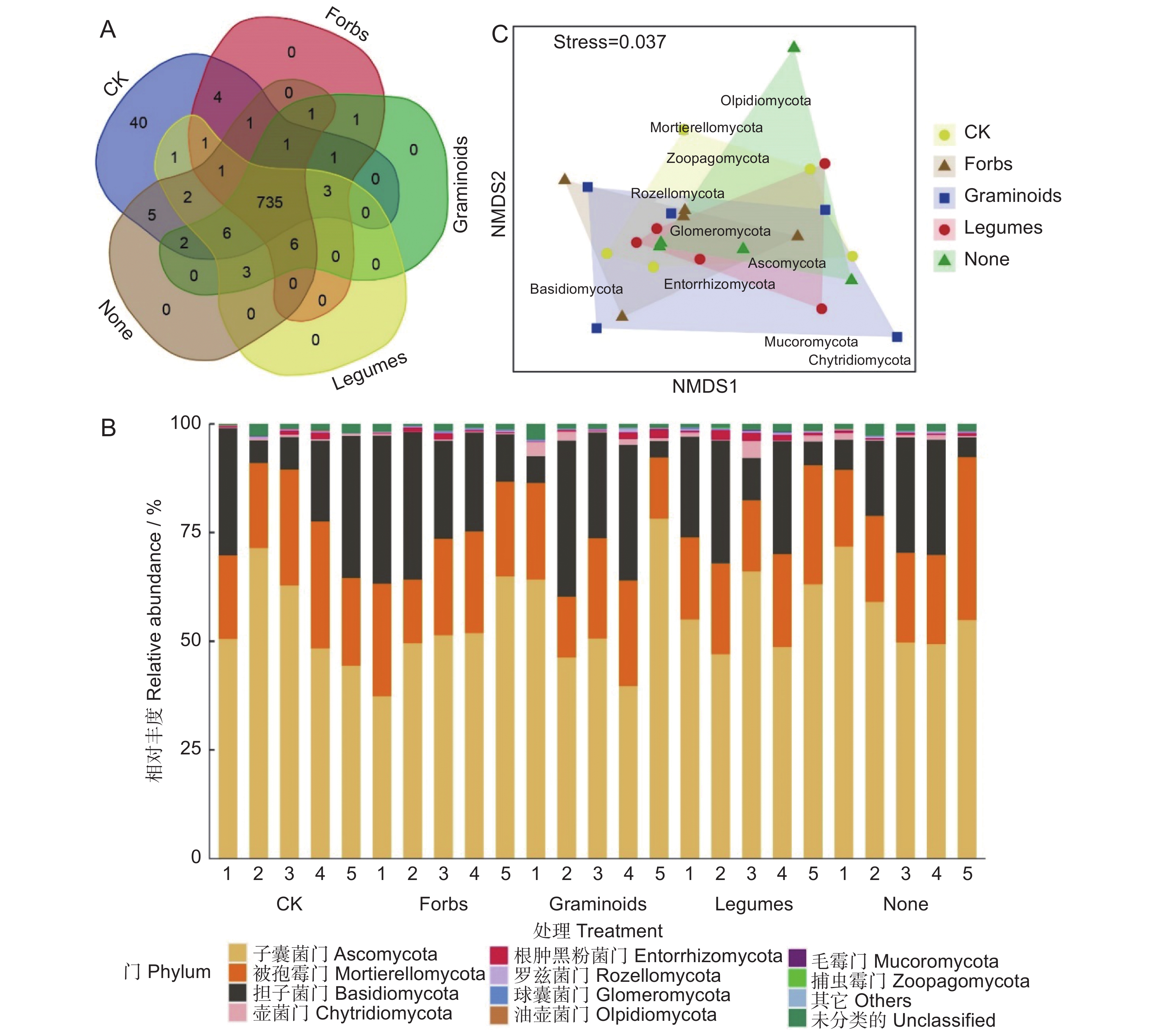
图 2 不同植物功能群移除下土壤真菌群落结构组成
A:不同处理土壤真菌OTUs的Venn图;B:不同样品的门水平土壤真菌群落结构组成;C:不同处理下门水平的土壤真菌群落NMDS图。CK:不移除;Forbs:移除禾状草和豆科而保留杂类草;Graminoids:移除豆科和杂类草而保留禾状草;Legumes:移除禾状草和杂类草而保留豆科;None:移除所有植物功能群。
Figure 2. Soil fungal community composition under removal of different plant functional groups
A: Venn diagram of soil fungal OTUs in different treatments; B: Phylum-level soil fungal community composition in different samples; C: NMDS diagram of phylum-level soil fungal community in different treatments. CK: No removals; Forbs: Removal of graminoids and legumes; Graminoids: Removal of legumes and forbs; Legumes: Removal of graminoids and forbs; None: Removal of all.
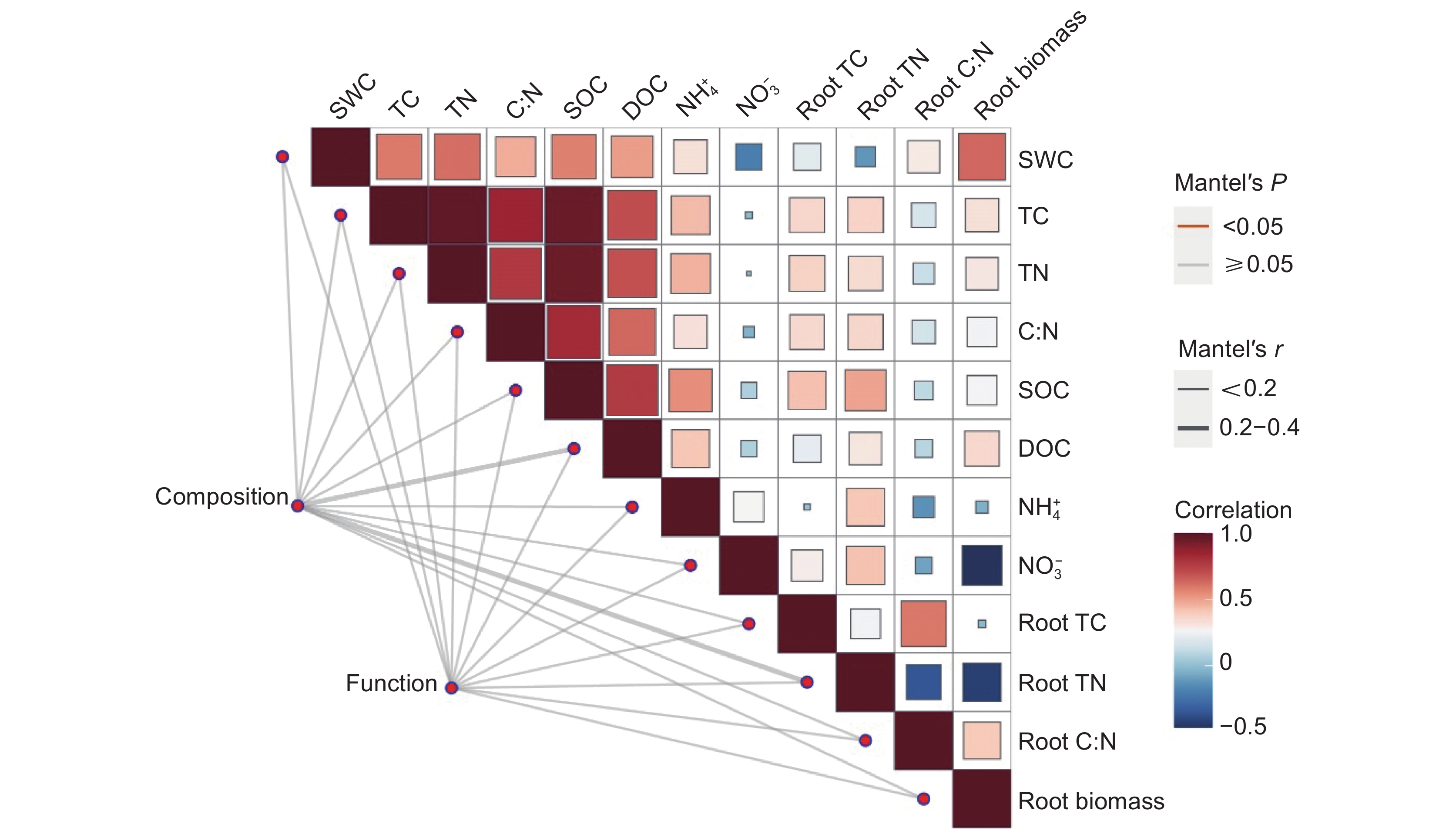
图 3 环境因子对土壤真菌群落结构和功能的影响(Mantel test)
SWC:土壤含水率;TC:总碳;TN:总氮;C:N:碳氮比;SOC:土壤有机碳;DOC:可溶性有机碳;NH+4-N:铵态氮;NO−3-N:硝态氮;Root TC:根总碳;Root TN:根总氮;Root C:N:根系碳氮比;Root biomass:根系生物量。下同。
Figure 3. Effects of environmental factors on soil fungal community composition and function
SWC: Soil water content; TC: Total carbon; TN: Total nitrogen; C:N: Carbon-to-nitrogen ratio; SOC: Soil organic carbon; DOC: Dissolved organic carbon; NH+4-N: Ammonium nitrogen; NO−3-N: Nitrate nitrogen. Root TC: Root total carbon; Root TN: Root total nitrogen; Root C:N: Root carbon-to-nitrogen ratio. Same below.
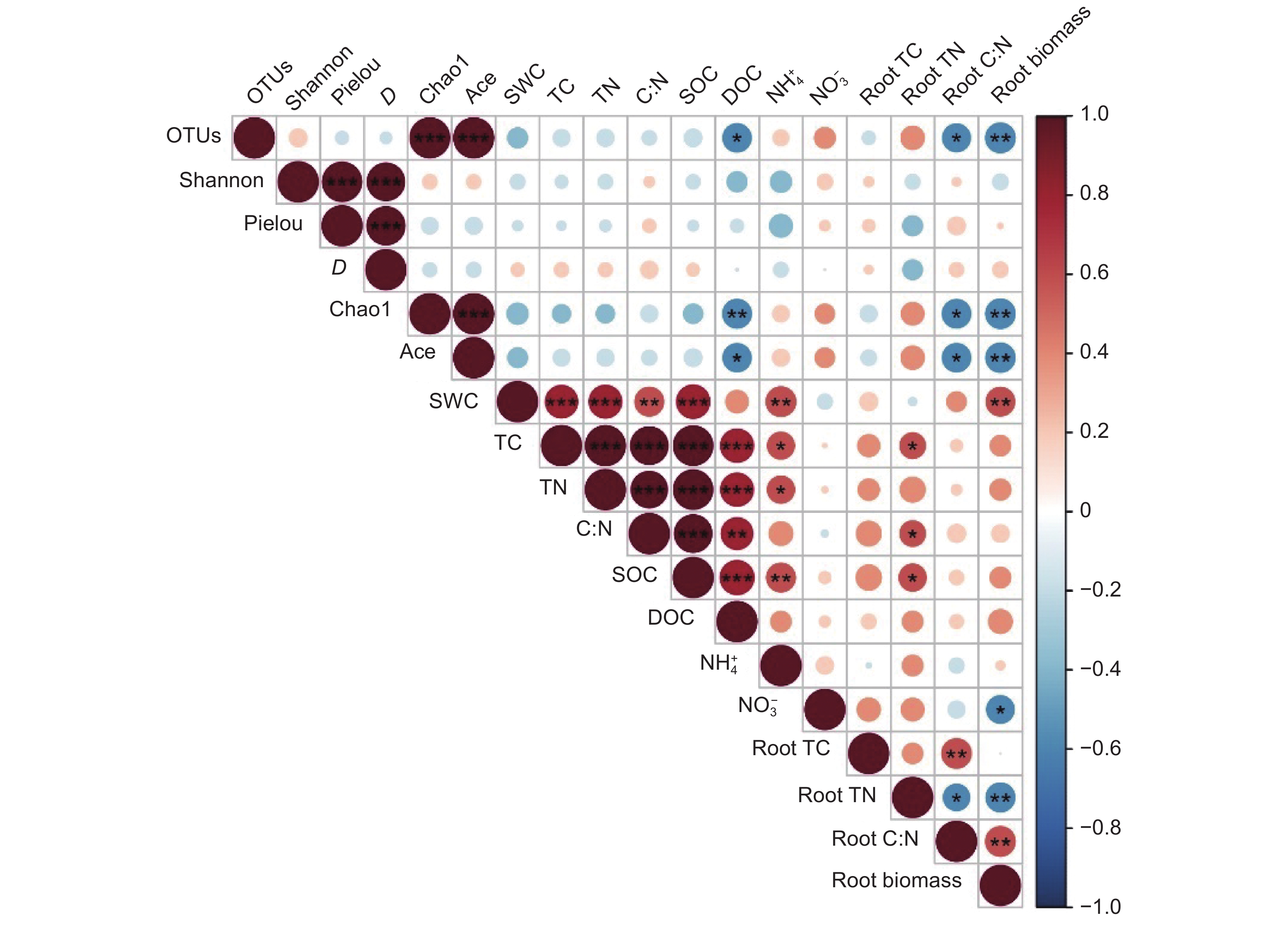
图 4 土壤真菌多样性与环境因子相关性分析
OTUs:操作分类单位;Shannon:香农指数;Pielou:均匀度指数; D:辛普森指数;Chao1:描述样品中所含OTUs数目的指数;Ace:样本中物种组成的丰富度和均匀度。
Figure 4. Correlation of soil fungal diversity and environmental factors
OTUs: Operational taxonomic units; Shannon: Shannon-Wiener index; Pielou: Pielou’s evenness index; D: Simpson index; Chao1: An index describing the number of OTUs contained in a sample; Ace: An index describing the richness and evenness of species composition in a sample.
表 1 不同植物功能群移除下根系性质
Table 1 Root properties under removal of different plant functional groups
指标Index CK Forbs Graminoids Legumes None 根总碳 / g/kg 332.0 ± 6.0a 275.6 ± 7.8a 279.1 ± 31.1a 271.2 ± 29.4a 300.3 ± 27.0a 根总氮 / g/kg 8.91 ± 0.85a 8.63 ± 0.74a 8.14 ± 0.25a 9.04 ± 0.65a 9.43 ± 0.49a 根系碳氮比 34.04 ± 5.44a 32.85 ± 2.76a 34.59 ± 4.35a 30.13 ± 2.81a 31.80 ± 2.13a 根系生物量 / kg/m2 0.68 ± 0.23a 0.85 ± 0.20a 0.77 ± 0.12a 0.72 ± 0.16a 0.54 ± 0.15a 注:同行不同小写字母表示在0.05水平上差异显著。CK:不移除;Forbs:移除禾状草和豆科而保留杂类草;Graminoids:移除豆科和杂类草而保留禾状草;Legumes:移除禾状草和杂类草而保留豆科;None:移除所有植物功能群。下同。 Notes: Different lowercase letters in the same row indicate significant differences at the 0.05 level. CK: No removals; Forbs: Removal of graminoids and legumes; Graminoids: Removal of legumes and forbs; Legumes: Removal of graminoids and forbs; None: Removal of all. Same below. 表 2 不同植物功能群移除下土壤理化性质
Table 2 Soil properties under removal of different plant functional groups
指标Index CK Forbs Graminoids Legumes None 土壤含水率 / % 54.72 ± 2.18a 55.10 ± 5.30a 54.91 ± 3.92a 50.80 ± 5.10a 51.86 ± 4.87a 总碳 / g/kg 65.05 ± 3.50a 67.44 ± 5.89a 60.38 ± 4.65a 64.97 ± 6.68a 61.19 ± 5.66a 总氮 / g/kg 5.85 ± 0.25a 6.08 ± 0.45a 5.53 ± 0.36a 5.82 ± 0.48a 5.56 ± 0.43a 碳氮比 11.09 ± 0.14a 11.06 ± 0.16a 10.89 ± 0.19a 11.09 ± 0.24a 10.96 ± 0.18a 土壤有机碳 / g/kg 67.72 ± 3.34a 67.15 ± 5.43a 60.60 ± 4.97a 63.01 ± 5.60a 62.43 ± 5.92a 可溶性有机碳 / mg/kg 309.4 ± 19.8a 309.1 ± 25.4a 263.9 ± 15.0a 286.2 ± 14.5a 269.3 ± 11.3a 铵态氮 / mg/kg 8.79 ± 1.16a 9.33 ± 0.45a 9.80 ± 1.88a 8.45 ± 1.58a 9.55 ± 1.23a 硝态氮 / mg/kg 6.10 ± 0.94a 5.22 ± 0.68a 4.76 ± 0.32a 4.14 ± 0.60a 6.62 ± 0.99a 表 3 不同植物功能群移除下门水平土壤真菌相对丰度 / %
Table 3 Relative abundance of soil fungi at the phylum level under removal of different plant functional groups / %
门Phylum CK Forbs Graminoids Legumes None 子囊菌门 55.49 ± 5.04a 51.01 ± 4.37a 55.78 ± 6.89a 55.97 ± 3.79a 56.97 ± 4.11a 被孢霉门 22.98 ± 2.07a 21.58 ± 1.88a 19.53 ± 2.27a 20.97 ± 1.83a 23.17 ± 3.61a 担子菌门 18.67 ± 5.55a 24.84 ± 4.32a 20.27 ± 6.52a 18.51 ± 4.59a 16.38 ± 4.66a 壶菌门 0.39 ± 0.06a 0.24 ± 0.06a 1.54 ± 0.52a 1.35 ± 0.69a 0.78 ± 0.26a 根肿黑粉菌门 0.53 ± 0.28a 0.65 ± 0.23a 0.83 ± 0.40a 1.27 ± 0.37a 0.43 ± 0.07a 罗兹菌门 0.16 ± 0.06a 0.18 ± 0.01a 0.28 ± 0.14a 0.30 ± 0.04a 0.27 ± 0.06a 球囊菌门 0.05 ± 0.02b 0.19 ± 0.04a 0.17 ± 0.02ab 0.18 ± 0.05a 0.11 ± 0.02ab 油壶菌门 0.15 ± 0.05a 0.08 ± 0.02a 0.08 ± 0.02a 0.06 ± 0.01a 0.12 ± 0.02a 毛霉门 0.06 ± 0.01a 0.03 ± 0.01a 0.03 ± 0.01a 0.10 ± 0.04a 0.02 ± 0.00a 捕虫霉门 0.01 ± 0.00b 0.01 ± 0.00b 0.01 ± 0.00b 0.03 ± 0.01a 0.01 ± 0.00b 表 4 不同植物功能群移除下土壤真菌多样性
Table 4 Soil fungal diversity under removal of different plant functional groups
指数Index CK Forbs Graminoids Legumes None OTUs 585.2 ± 47.2a 633 ± 39.7a 664.8 ± 7.2a 660 ± 11.7a 671.6 ± 6.1a H 4.19 ± 0.20a 4.13 ± 0.11a 4.10 ± 0.12a 4.18 ± 0.10a 4.26 ± 0.07a Pielou 0.66 ± 0.03a 0.64 ± 0.01a 0.63 ± 0.02a 0.64 ± 0.01a 0.66 ± 0.01a D 0.96 ± 0.01a 0.95 ± 0.01a 0.94 ± 0.01a 0.95 ± 0.01a 0.95 ± 0.01a Chao1 617.57 ± 45.20a 672.76 ± 34.79a 699.08 ± 9.69a 698.73 ± 8.42a 699.74 ± 3.97a Ace 613.88 ± 44.54a 661.72 ± 37.37a 697.51 ± 8.34a 693.77 ± 8.52a 696.92 ± 4.74a 注:OTUs,操作分类单位;Ace,样本中物种组成的丰富度和均匀度;Chao1,描述样品中所含OTUs数目的指数;D,辛普森指数;Pielou,均匀度指数; H,香农指数。 Notes: OTUs, operational taxonomic units; Ace index, species composition richness and evenness in a sample; Chao1 index, number of OTUs in a sample; D, Simpson index; Pielou, Pielou’s evenness index; H, Shannon-Wiener index. 表 5 不同植物功能群移除下土壤真菌功能类群相对丰度 / %
Table 5 Relative abundance of soil fungal functional groups under removal of different plant functional groups / %
功能类群 Functional group CK Forbs Graminoids Legumes None 动物寄生真菌/病原菌 6.75 ± 3.09a 7.97 ± 3.28a 3.19 ± 0.46a 3.48 ± 0.60a 5.73 ± 2.23a 丛枝菌根真菌 0.10 ± 0.03b 0.31 ± 0.07ab 0.32 ± 0.03a 0.33 ± 0.09a 0.22 ± 0.04ab 粪腐生真菌 7.25 ± 1.12a 3.11 ± 1.38a 4.19 ± 1.38a 5.32 ± 4.02a 4.26 ± 0.61a 外生菌根真菌 6.75 ± 5.17a 0.10 ± 0.03a 0.12 ± 0.05a 0.13 ± 0.03a 0.23 ± 0.13a 内生真菌 0.36 ± 0.06a 0.49 ± 0.21a 0.42 ± 0.07a 0.39 ± 0.08a 0.78 ± 0.11a 真菌寄生菌 1.61 ± 0.62a 0.44 ± 0.05a 0.99 ± 0.25a 0.92 ± 0.39a 1.15 ± 0.45a 叶腐生菌 5.15 ± 0.67a 3.44 ± 0.42a 9.50 ± 3.62a 5.72 ± 1.83a 7.00 ± 1.15a 地衣寄生菌/腐生菌 1.15 ± 0.40ab 1.53 ± 0.49a 0.47 ± 0.10ab 0.81 ± 0.24ab 0.28 ± 0.06b 兰花菌根真菌 0.08 ± 0.04a 0.09 ± 0.05a 0.22 ± 0.07a 0.17 ± 0.09a 0.10 ± 0.06a 植物病原菌/腐生菌 8.15 ± 2.10a 5.24 ± 0.48a 5.87 ± 0.74a 9.37 ± 1.65a 8.76 ± 1.80a 土壤腐生菌 35.64 ± 2.13a 36.85 ± 4.02a 44.49 ± 5.56a 41.82 ± 5.81a 37.26 ± 4.39a 木质腐生菌 2.34 ± 0.23a 2.30 ± 0.27a 3.33 ± 0.80a 3.53 ± 0.69a 3.81 ± 0.69a 未定义腐生菌 24.67 ± 4.47a 38.14 ± 5.48a 26.90 ± 8.90a 28.01 ± 5.38a 30.42 ± 6.67a -
[1] Myers N,Mittermeier RA,Mittermeier CG,da Fonseca GAB,Kent J. Biodiversity hotspots for conservation priorities[J]. Nature,2000,403 (6772):853−858. doi: 10.1038/35002501
[2] 徐满厚,刘敏,翟大彤,薛娴,彭飞,尤全刚. 青藏高原高寒草甸生物量动态变化及与环境因子的关系——基于模拟增温实验[J]. 生态学报,2016,36(18):5759−5767. Xu MH,Liu M,Zhai DT,Xue X,Peng F,You QG. Dynamic changes in biomass and its relationship with environmental factors in analpine meadow on the Qinghai-Tibetan Plateau,based on simulated warming experiments[J]. Acta Ecologica Sinica,2016,36 (18):5759−5767.
[3] 姜林,胡骥,杨振安,詹伟,赵川,等. 植物功能群去除对高寒草甸群落结构、多样性及生产力的影响[J]. 生态学报,2021,41(4):1402−1411. Jiang L,Hu J,Yang ZA,Zhan W,Zhao C,et al. Effects of plant functional group removal on community structure,diversity and production in Alpine meadow[J]. Acta Ecologica Sinica,2021,41 (4):1402−1411.
[4] 张中华,周华坤,赵新全,姚步青,马真,等. 青藏高原高寒草地生物多样性与生态系统功能的关系[J]. 生物多样性,2018,26(2):111−129. doi: 10.17520/biods.2017021 Zhang ZH,Zhou HK,Zhao XQ,Yao BQ,Ma Z,et al. Relationship between biodiversity and ecosystem functioning in alpine meadows of the Qinghai-Tibet Plateau[J]. Biodiversity Science,2018,26 (2):111−129. doi: 10.17520/biods.2017021
[5] 郝爱华,薛娴,彭飞,尤全刚,廖杰,等. 青藏高原典型草地植被退化与土壤退化研究[J]. 生态学报,2020,40(3):964−975. Hao AH,Xue X,Peng F,You QG,Liao J,et al. Different vegetation and soil degradation characteristics of a typical grassland in the Qinghai-Tibetan Plateau[J]. Acta Ecologica Sinica,2020,40 (3):964−975.
[6] 刘育红,魏卫东,杨元武,张英. 三江源区退化高寒草甸植物功能群特征[J]. 江苏农业科学,2019,47(1):286−291. Liu YH,Wei WD,Yang YW,Zhang Y. Characteristics of plant functional groups of degraded alpine meadow in the Source Region of Three Rivers,China[J]. Jiangsu Agricultural Sciences,2019,47 (1):286−291.
[7] 姜炎彬,张扬建. 西藏天然草地植物功能群分布的初步研究[J]. 植物科学学报,2016,34(2):220−229. Jiang YB,Zhang YJ. Distribution of plant functional groups in the natural grasslands of Xizang,China[J]. Plant Science Journal,2016,34 (2):220−229.
[8] Wu GL,Du GZ,Liu ZH,Thirgood S. Effect of fencing and grazing on a Kobresia-dominated meadow in the Qinghai-Tibetan Plateau[J]. Plant Soil,2009,319 (1-2):115−126. doi: 10.1007/s11104-008-9854-3
[9] Klein JA,Harte J,Zhao XQ. Decline in medicinal and forage species with warming is mediated by plant traits on the Tibetan Plateau[J]. Ecosystems,2008,11 (5):775−789. doi: 10.1007/s10021-008-9160-1
[10] 于海玲,樊江文,钟华平,李愈哲. 青藏高原区域不同功能群植物氮磷生态化学计量学特征[J]. 生态学报,2017,37(11):3755−3764. Yu HL,Fan JW,Zhong HP,Li YZ. Characteristics of N and P stoichiometry of plants in different functional groups in the Qinghai-Tibet Plateau regions[J]. Acta Ecologica Sinica,2017,37 (11):3755−3764.
[11] Wang J,Wang XT,Liu GB,Wang GL,Zhang C. Grazing-to-fencing conversion affects soil microbial composition,functional profiles by altering plant functional groups in a Tibetan alpine meadow[J]. Appl Soil Ecol,2021,166:104008. doi: 10.1016/j.apsoil.2021.104008
[12] 薛凯,张彪,周姝彤,冉沁蔚,唐立,等. 青藏高原高寒草地土壤微生物群落及影响因子[J]. 科学通报,2019,64(27):2915−2927. doi: 10.1360/TB-2019-0090 Xue K,Zhang B,Zhou ST,Ran QW,Tang L,et al. Soil microbial communities in alpine grasslands on the Tibet Plateau and their influencing factors[J]. Chinese Science Bulletin,2019,64 (27):2915−2927. doi: 10.1360/TB-2019-0090
[13] 肖颖,吉使阿微,赵文学,田莉华. 青藏高原东缘不同人工草地土壤养分、酶活性及微生物生物量特征[J]. 中国草地学报,2022,44(9):90−99. Xiao Y,Jishi AW,Zhao WX,Tian LH. Soil nutrients,enzyme activities and microbial biomass characteristics of different artificial grasslands in the eastern margin of the Qinghai-Tibetan Plateau[J]. Chinese Journal of Grassland,2022,44 (9):90−99.
[14] 姜鑫. 植物物种多样性对土壤微生物群落的影响: 以高寒草地为例[D]. 南京: 南京大学, 2021: 27-45. [15] 赵文,尹亚丽,李世雄,王玉琴,王彦龙. 三江源区退化高寒草甸土壤真菌群落特征[J]. 应用生态学报,2021,32(3):869−877. Zhao W,Yin YL,Li SX,Wang YQ,Wang YL. The characteristics of soil fungal community in degraded alpine meadow in the Three Rivers Source Region,China[J]. Chinese Journal of Applied Ecology,2021,32 (3):869−877.
[16] Orwin KH,Wardle DA. Plant species composition effects on belowground properties and the resistance and resilience of the soil microflora to a drying disturbance[J]. Plant Soil,2005,278 (1-2):205−221. doi: 10.1007/s11104-005-8424-1
[17] Connell RK,Zeglin LH,Blair JM. Plant legacies and soil microbial community dynamics control soil respiration[J]. Soil Biol Biochem,2021,160:108350. doi: 10.1016/j.soilbio.2021.108350
[18] Gui WY,Ren HY,Liu N,Zhang YJ,Cobb AB,et al. Plant functional group influences arbuscular mycorrhizal fungal abundance and hyphal contribution to soil CO2 efflux in temperate grasslands[J]. Plant Soil,2018,432 (1-2):157−170. doi: 10.1007/s11104-018-3789-0
[19] Chen DM,Pan QM,Bai YF,Hu SJ,Huang JH,et al. Effects of plant functional group loss on soil biota and net ecosystem exchange:a plant removal experiment in the Mongolian grassland[J]. J Ecol,2016,104 (3):734−743. doi: 10.1111/1365-2745.12541
[20] Jongen R,Hannula SE,de Long JR,Heinen R,Huberty M,et al. Plant community legacy effects on nutrient cycling,fungal decomposer communities and decomposition in a temperate grassland[J]. Soil Biol Biochem,2021,163:108450. doi: 10.1016/j.soilbio.2021.108450
[21] Francioli D,van Rijssel SQ,van Ruijven J,Termorshuizen AJ,Cotton TEA,et al. Plant functional group drives the community structure of saprophytic fungi in a grassland biodiversity experiment[J]. Plant Soil,2021,461 (1-2):91−105. doi: 10.1007/s11104-020-04454-y
[22] Chen WJ,Zhou HK,Wu Y,Wang J,Zhao ZW,et al. Loss of plant functional groups impacts soil carbon flow by changing multitrophic interactions within soil micro-food webs[J]. Appl Soil Ecol,2022,178:104566. doi: 10.1016/j.apsoil.2022.104566
[23] Strecker T,Macé OG,Scheu S,Eisenhauer N. Functional composition of plant communities determines the spatial and temporal stability of soil microbial properties in a long-term plant diversity experiment[J]. Oikos,2016,125 (12):1743−1754. doi: 10.1111/oik.03181
[24] 宛倩. 高寒草甸不同恢复方式对土壤微生物群落的影响[D]. 杨凌: 西北农林科技大学, 2022: 60-64. [25] 温杨雪,赵博,罗巧玉,贾云龙,冯涛,王强. 青藏高原高寒草地AM真菌分布及其对近自然恢复的生态作用[J]. 菌物学报,2021,40(10):2562−2578. Wen YX,Zhao B,Luo QY,Jia YL,Feng T,Wang Q. Distribution and ecological role in close-to-nature restoration of arbuscular mycorrhizal fungi in Tibetan Plateau alpine grassland[J]. Mycosystema,2021,40 (10):2562−2578.
[26] 王浩,吴爱姣,刘保兴,刘润进,陈应龙. 菌根真菌多样性与植物多样性的相互作用研究进展[J]. 微生物学通报,2020,47(11):3918−3932. Wang H,Wu AJ,Liu BX,Liu RJ,Chen YL. Interactions between mycorrhizal fungal diversity and plant diversity:a review[J]. Microbiology China,2020,47 (11):3918−3932.
[27] Wang P,Guo J,Xu XY,Yan XB,Zhang KC,et al. Soil acidification alters root morphology,increases root biomass but reduces root decomposition in an alpine grassland[J]. Environ Pollut,2020,265:115016. doi: 10.1016/j.envpol.2020.115016
[28] Luo YJ,Qin GL,Du GZ. Importance of assemblage-level thinning:a field experiment in an alpine meadow on the Tibet plateau[J]. J Veg Sci,2006,17 (4):417−424.
[29] 刘旻霞,朱柯嘉. 青藏高原东缘高寒草甸不同功能群植物氮磷化学计量特征研究[J]. 中国草地学报,2013,35(2):52−58. doi: 10.3969/j.issn.1673-5021.2013.02.010 Liu MX,Zhu KJ. Characteristics of nitrogen and phosphorus stoichiometry of plants in different functional groups on alpine meadow in the eastern edge of Tibetan plateau[J]. Chinese Journal of Grassland,2013,35 (2):52−58. doi: 10.3969/j.issn.1673-5021.2013.02.010
[30] 张国龙. 大针茅群落物种丰富度和功能多样性对混合凋落物分解特征的影响[D]. 呼和浩特: 内蒙古大学, 2019: 21-23. [31] 马百兵,孙建,朱军涛,罗广祥. 藏北高寒草地植物群落C、N化学计量特征及其影响因素[J]. 生态学杂志,2018,37(4):1026−1036. Ma BB,Sun J,Zhu JT,Luo GX. Carbon and nitrogen stoichiometry of plant community and its influencing factors in a northern Tibet alpine grassland[J]. Chinese Journal of Ecology,2018,37 (4):1026−1036.
[32] Li WJ,Zhang RL,Liu SS,Li WX,Li JH,et al. Effect of loss of plant functional group and simulated nitrogen deposition on subalpine ecosystem properties on the Tibetan Plateau[J]. Sci Total Environ,2018 (631-632):289−297. doi: 10.1016/j.scitotenv.2018.02.287
[33] Marshall CB,Mclaren JR,Turkington R. Soil microbial communities resistant to changes in plant functional group composition[J]. Soil Biol Biochem,2011,43 (1):78−85. doi: 10.1016/j.soilbio.2010.09.016
[34] Van der Wal A,van Veen JA,Smant W,Boschker HTS,Bloem J,et al. Fungal biomass development in a chronosequence of land abandonment[J]. Soil Biol Biochem,2006,38 (1):51−60. doi: 10.1016/j.soilbio.2005.04.017
[35] 于贵瑞,伏玉玲,孙晓敏,温学发,张雷明. 中国陆地生态系统通量观测研究网络(ChinaFLUX)的研究进展及其发展思路[J]. 中国科学D辑:地球科学,2006,36(S1):1−21. [36] 赵兴鸽,张世挺,牛克昌. 青藏高原高寒草甸土壤真菌多样性与植物群落功能性状和土壤理化特性的关系[J]. 应用与环境生物学报,2020,26(1):1−9. Zhao XG,Zhang ST,Niu KC. Relationships between soil fungal diversity,plant community functional traits,and soil attributes in Tibetan alpine meadows[J]. Chinese Journal of Applied and Environmental Biology,2020,26 (1):1−9.
[37] 李海云,姚拓,高亚敏,张建贵,马亚春,等. 退化高寒草地土壤真菌群落与土壤环境因子间相互关系[J]. 微生物学报,2019,59(4):678−688. Li HY,Yao T,Gao YM,Zhang JG,Ma YC,et al. Relationship between soil fungal community and soil environmental factors in degraded alpine grassland[J]. Acta Microbiologica Sinica,2019,59 (4):678−688.
[38] Liu YJ,Shi GX,Mao L,Cheng G,Jiang SJ,et al. Direct and indirect influences of 8 yr of nitrogen and phosphorus fertilization on Glomeromycota in an alpine meadow ecosystem[J]. New Phytol,2012,194 (2):523−535. doi: 10.1111/j.1469-8137.2012.04050.x
[39] 王幼珊,刘润进. 球囊菌门丛枝菌根真菌最新分类系统菌种名录[J]. 菌物学报,2017,36(7):820−850. Wang YS,Liu RJ. A checklist of arbuscular mycorrhizal fungi in the recent taxonomic system of Glomeromycota[J]. Mycosystema,2017,36 (7):820−850.
[40] Corsaro D,Köhsler M,Wylezich C,Venditti D,Walochnik J,Michel R. New insights from molecular phylogenetics of amoebophagous fungi (Zoopagomycota,Zoopagales)[J]. Parasitol Res,2018,117 (1):157−167. doi: 10.1007/s00436-017-5685-6
[41] Yang T,Adams JM,Shi Y,He JS,Jing X,et al. Soil fungal diversity in natural grasslands of the Tibetan Plateau:associations with plant diversity and productivity[J]. New Phytol,2017,215 (2):756−765. doi: 10.1111/nph.14606
[42] 刘安榕,杨腾,徐炜,上官子健,王金洲,等. 青藏高原高寒草地地下生物多样性:进展、问题与展望[J]. 生物多样性,2018,26(9):972−987. doi: 10.17520/biods.2018119 Liu AR,Yang T,Xu W,Shangguan ZJ,Wang JZ,et al. Status,issues and prospects of belowground biodiversity on the Tibetan alpine grassland[J]. Biodiversity Science,2018,26 (9):972−987. doi: 10.17520/biods.2018119
[43] 江奥,敬路淮,泽让东科,田黎明. 放牧影响草地凋落物分解研究进展[J]. 草业学报,2023,32(4):208−220. Jiang A,Jing LH,Mipam TD,Tian LM. Progress in research on the effects of grazing on grassland litter decomposition[J]. Acta Prataculturae Sinica,2023,32 (4):208−220.
[44] 王敏. 亚热带森林景观中可溶性有机碳的特征及土壤截存机制[D]. 北京: 中国科学院大学, 2019: 70-72. [45] Leff JW,Bardgett RD,Wilkinson A,Jackson BG,Pritchard WJ,et al. Predicting the structure of soil communities from plant community taxonomy,phylogeny,and traits[J]. ISME J,2018,12 (7):1794−1805. doi: 10.1038/s41396-018-0089-x
[46] Kang BT,Bowatte S,Hou FJ. Soil microbial communities and their relationships to soil properties at different depths in an alpine meadow and desert grassland in the Qilian mountain range of China[J]. J Arid Environ,2021,184:104316. doi: 10.1016/j.jaridenv.2020.104316
-
期刊类型引用(1)
1. 龙桂根,黄芝云,吴南生,冯胜,冯超,丁菲,金松松,何利人,王勇,陈玲. 南酸枣种质资源果实性状变异和综合评价. 热带亚热带植物学报. 2024(06): 781-790 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: