Analysis of fruit quality and sensory evaluation of 36 kiwifruit (Actinidia) germplasm accessions
-
摘要:
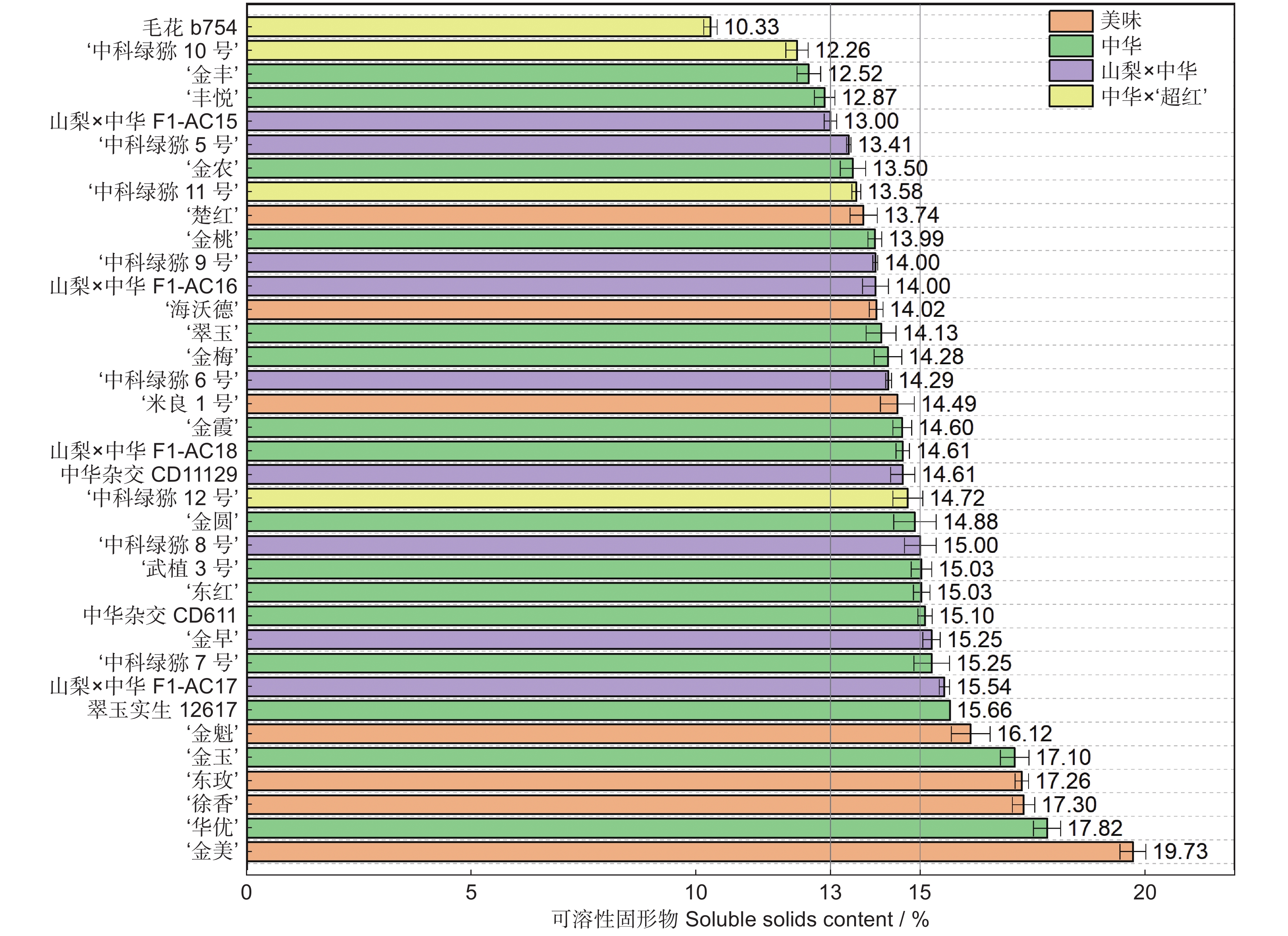
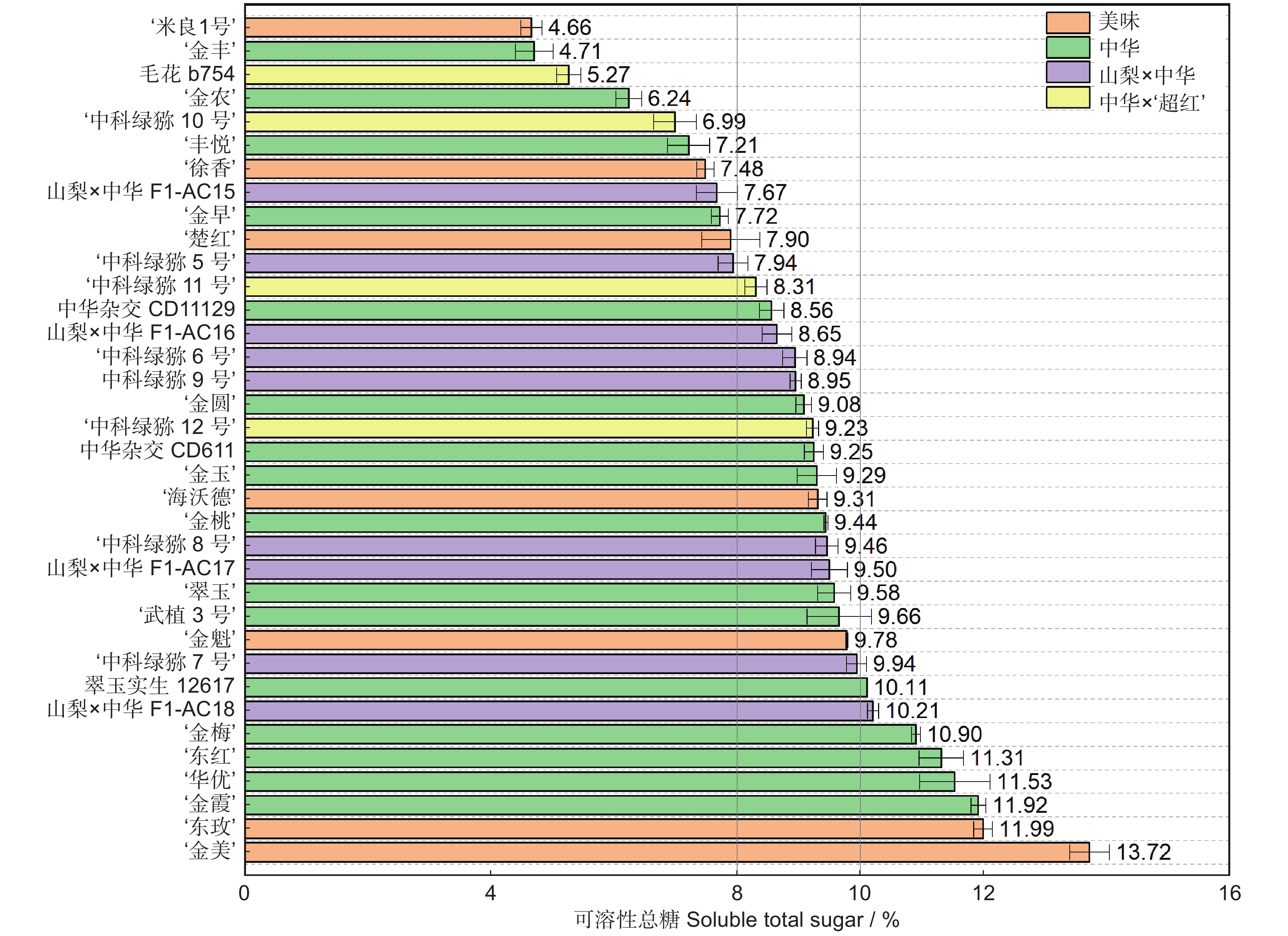
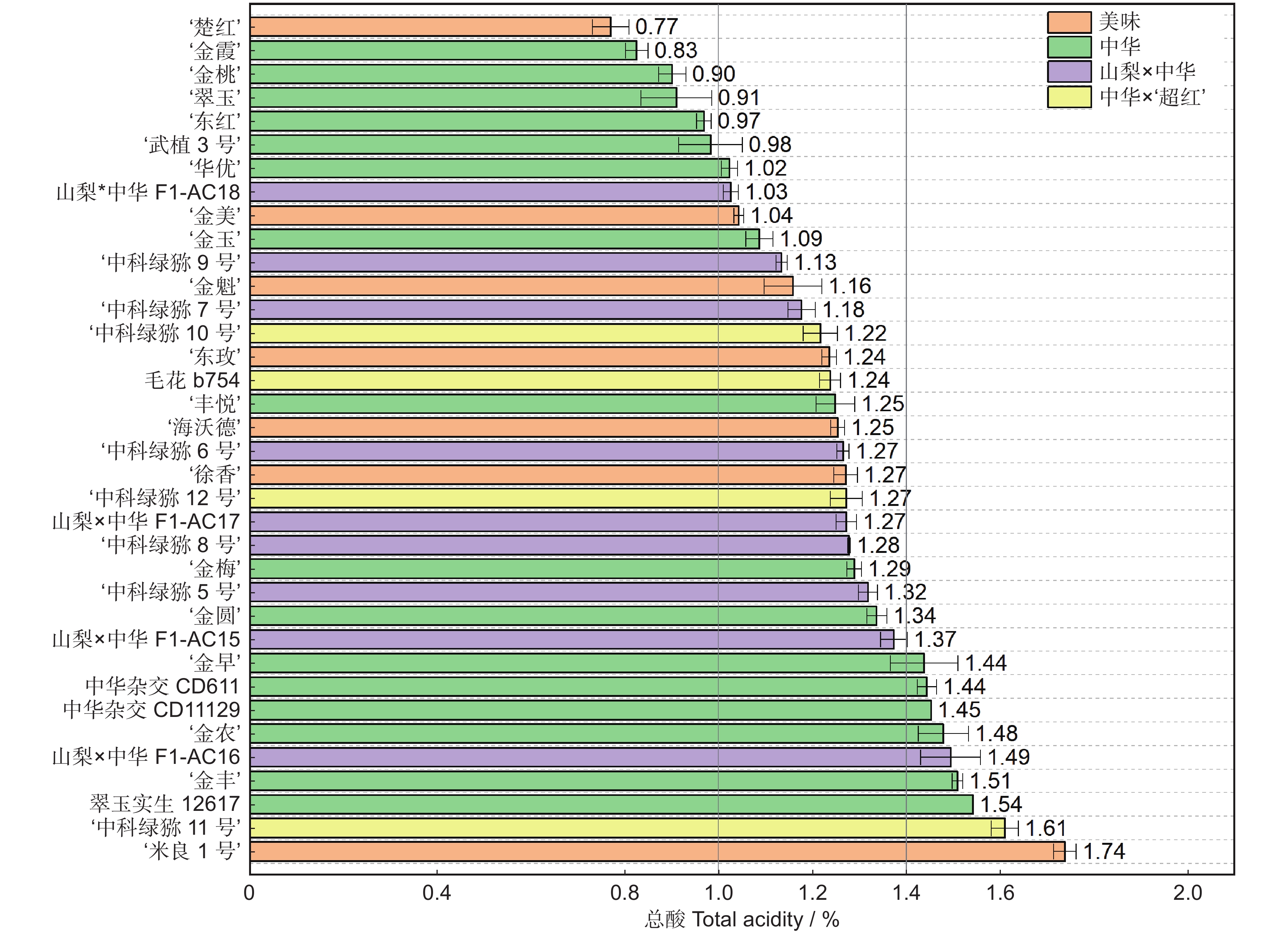
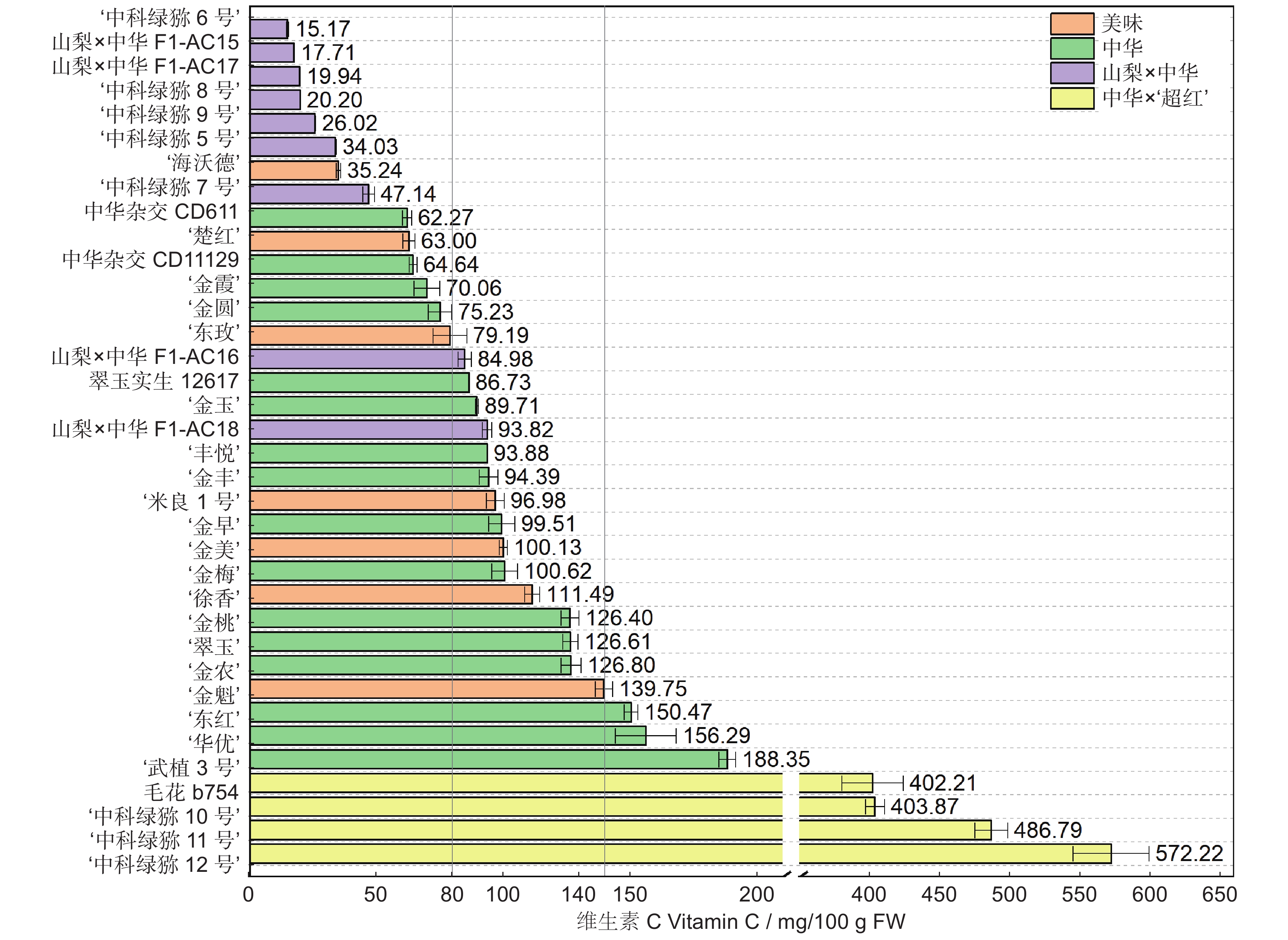
以湖北省丹江口市同一猕猴桃(Actinidia)资源圃内的36份不同种质,包括:7个美味猕猴桃(变种)(A. chinensis var. deliciosa (A. Chev.) A. Chev.)、16个中华猕猴桃(原变种)(A. chinensis var. chinensis Planch.)、9个山梨猕猴桃(A. rufa (Sieb. & Zucc.) Planch. ex Mi.) × 中华猕猴桃和4个中华猕猴桃 × ‘超红’猕猴桃(A. eriantha Benth. × A. chinensis var. chinensis Planch.)的果实为研究对象,在可溶性固形物 ≥ 7.0%时采收,测定果实采收成熟度和软熟内在品质指标,并分析果实感官评价及其与内在品质的相关性。结果显示,36份猕猴桃种质果实品质性状表现出明显的差异性,尤其是单果重和维生素C(Vc)含量,其变异系数分别为43.61%和103.16%。这与山梨 × 中华及中华 × ‘超红’种类有关,两个种类均为小果型(< 45 g);前者Vc含量最低(39.89 mg/100 g),后者最高(466.27 mg/100 g)。36份软熟果实样本中可溶性固形物、可溶性总糖和总酸的平均值分别为14.70%、8.96%和1.24%,其中可溶性固形物在美味种类中的平均值最高,最低为中华 × ‘超红’种类。果实感官评价在不同样本之间也表现出明显的差异性,就种类而言,山梨 × 中华的感官评价质量略高于其他种类。整体喜好度与风味喜好度、甜度紧密正相关(Pearson r ≥ 0.94),而与酸度有一定程度的负相关(r = −0.53)。可溶性固形物、可溶性总糖与整体喜好度的相关性明显高于总酸,但Vc与整体喜好度则无相关性。
Abstract:Thirty-six different accessions of kiwifruit (Actinidia), including seven Actinidia chinensis var. deliciosa (A. Chev.) A. Chev., 16 A. chinensis var chinensis Planch., nine A. rufa (Sieb. & Zucc.) Planch. ex Mi. × A. chinensis var. chinensis Planch., and four A. chinensis var. chinensis × ‘Chaohong’ (A. eriantha Benth. × A. chinensis var. chinensis Planch.) grown in a same kiwifruit germplasm garden in Danjiangkou City, Hubei Province, were used as study materials. The fruits were harvested once soluble solids content (SSC) reached 7.0%. Fruit maturity at harvest and internal quality of ripe fruit were measured, and sensory evaluation and correlation with internal qualities were also analyzed. Results indicated significant differences in fruit quality traits among the 36 accessions, particularly fruit fresh weight and vitamin C (Vc) content, which had the highest coefficients of variation (43.61% and 103.16%, respectively). The significant variations were associated with samples from the A. rufa × A. chinensis and A. chinensis × ‘Chaohong’ groups. These two groups had small fruit size (< 45 g of average fresh weight), with the former having the lowest level of Vc (39.89 mg/100 g) and the latter having the highest (466.27 mg/100 g). Average SSC, soluble sugar, and total acidity of the 36 kiwifruit accessions were 14.70%, 8.96%, and 1.24%, respectively, and average SSC was highest in the A. chinensis var. deliciosa group and lowest in the A. chinensis × ‘Chaohong’ group. The sensory evaluation scores also revealed significant differences among samples, with the A. rufa × A. chinensis group showing the best sensory qualities. Overall liking was highly positively correlated with flavor liking and sweetness (Pearson r ≥ 0.94), but negatively correlated with acidity (r = −0.53). Overall liking revealed a higher correlation with sweetness indices (SSC and soluble sugar) than the acidity index (total acidity), but no clear correlation with Vc.
-
Keywords:
- Actinidia /
- Fruit quality /
- Sensory evaluation /
- Correlation
-
土壤重金属污染是各方关注的严重环境问题之一。根据2014年《全国土壤重金属污染状况调查公报》,我国约有2 000万公顷耕地受到了重金属污染,其中330万公顷的污染程度达到了中度或重度污染。江西是我国矿产资源大省,铜资源在全国具有重要地位,长期的矿业开采、选矿、冶炼等产生的“三废”不断排放到周围环境,造成周边农田土壤铜污染严重,对农产品安全和人类身体健康都造成了极大的威胁[1]。以江西德兴铜矿区为例,周边土壤存在不同程度的铜污染,在919份调查样品中,铜含量位于50~400 mg/kg的有171个,含量大于400 mg/kg有18个,土壤最高铜含量可达1825 mg/kg,远大于中国土壤环境质量标准的三级标准(400 mg/kg)[2, 3],铜污染土壤的治理逐渐成为一个亟待解决的问题。植物修复(Phytoremediation)是一种新兴的土壤重金属净化技术[4],具有成本低廉、修复面积广、操作方便、二次污染易控制,美化植被环境等优点[5]。目前,关于修复植物的筛选多集中在草本植物,但草本生物量小、生长速度慢且很难进行机械收获作业,不适宜开展大面积污染土壤的修复[6],且农作物和草类等所吸收的重金属大多存在进入食物链或二次污染的风险,因此在实际修复应用中受到限制。当前,寻找生物量大、适应性强、观赏价值高且耐重金属的植物十分具有现实意义[7,8]。木本植物对重金属具有较强的耐性和一定的固定、吸收、累积能力,且其发达的深根系可使土壤中重金属移动性降低,降低其迁移和生物毒性,改善土壤质量等,引起研究人员的广泛关注[9]。
樟树(Cinnamomum camphora (L.) Presl)是重要的木本经济树种,樟脑、樟油等提取物是医药、化工、香料、防腐、农药的重要原料。樟树具有根系发达、生长迅速、生物量大、适应性强等优点,对重金属污染环境有较强的适应能力,15种常见乔木中,樟树对重金属的综合富集系数最高,对土壤中铜、锌和镉的富集能力均较强[10],在铜为主要污染源的土壤植物修复中有着较大的应用潜力。因此,樟树具有土壤修复收益型植物潜力。项目组前期将全国范围内收集的9个种源68个家系的樟树实生苗种植在以铜污染为主的江西德兴铜矿周边的水龙山实验修复基地,经过3年的跟踪调查,有12个家系适应性表现良好,成活率和保存率均较高,说明部分樟树具有较好的耐铜性,但樟树对铜离子的生理生化响应及富集转运特性还不清楚。本项目以前期筛选出的耐铜樟树为实验材料,通过盆栽实验研究不同浓度铜处理对樟树生长和生理指标的影响及铜的富集转运特性,探明耐铜樟树抵御铜毒性的生理生化机制,以期为樟树用于铜污染土壤修复提供科学依据。
1. 材料与方法
1.1 实验材料
实验于2021年7月在江西省科学院生物资源研究所人工气候室进行。实验地位于南昌市(28°41'N,115°59'E),实验材料为前期筛选出的耐铜樟树材料。收集同一单株的种子,将种子去果肉并反复搓洗干净,室内沙藏,于第2年春天播种,筛选长势一致的樟树幼苗统一移栽至事先准备好的基质中(红壤土∶细沙∶泥炭=1∶1∶1),栽培盆大小为上口径20 cm,底径14 cm,高14 cm,每盆基质重2.5 kg。经过3个月的缓苗,选取生长较好、高度一致的幼苗,采用随机区组设计,进行铜胁迫处理。
1.2 实验方法
以CuSO4·5H2O 为铜来源,配制铜浓度为100 g/kg的母液,处理前1周各栽培盆开始控水,至处理时各盆中基质均为干燥状态,处理时将各处理浓度所需母液用蒸馏水稀释至550 mL,缓缓浇灌至栽培盆中(经实验前反复验证,550 mL可以保证栽培盆内基质完全浸湿,且托盘里几乎没有多余水分流出),处理浓度分别为:0、50、150、300、600、900、1200 mg/kg(以基质重计算纯铜含量),每个处理4个重复。采样时间为处理60 d,每株选取3~4片嫩叶(枝条顶部开始倒数第 3~4 片叶)为待测材料,以锡箔纸包好,迅速投入液氮罐中,带回实验室放入−80 ℃冰箱保存,用于生理指标的测定;另准确称取0.1 g新鲜叶片,剪碎,放入事先准备好的装有95%乙醇的离心管中,黑暗处理,并放在摇床上震荡处理3 d,至叶片完全透明为止,用于色素含量的测定;最后将各处理单株分地上地下保存,放烘箱105 ℃杀青30 min,再70 ℃烘干至恒重测定干物质量,每株分别准确称取0.2 g根、茎、叶的研磨粉,微波消解,采用ICP-MS测定不同器官中铜含量。
1.3 生理指标测定
生理指标检测均参考施海涛[11]的方法。氯化硝基四氮唑蓝(NBT)光还原法测超氧化物歧化酶(SOD)活性;愈创木酚氧化法测过氧化物酶(POD)活性;高锰酸钾滴定法测过氧化氢酶(CAT)活性;烟酰胺腺嘌呤二核苷酸磷酸还原反应法测谷胱甘肽还原酶(GR)活性;硫代巴比妥酸比色法测丙二醛(MDA)含量;茚三酮比色法间接测定游离脯氨酸(Pro))含量;蒽酮比色法测定可溶性糖含量;考马斯亮蓝法测定可溶性蛋白含量。硫酸钛反应法测定过氧化氢(H2O2)含量,2-硝基苯甲酸反应法测谷胱甘肽(GSH)含量。所用试剂盒均由南京建成生物工程研究所提供,具体操作步骤按照相关说明书进行。
1.4 数据处理
所有指标的测定均进行4次生物学重复,最后结果采用平均值±标准差表示,采用SPSS 25软件作图并进行单因素方差分析(One-way ANOVA)。
2. 结果与分析
2.1 铜胁迫对樟树生长与生物量积累的影响
如图1所示,在铜胁迫浓度小于600 mg/kg时,樟树都可以很好地存活,根系和叶片均没有明显变化。其中150 mg/kg铜处理时,樟树长势最好,茎秆粗壮,叶片颜色墨绿。铜胁迫浓度为900 mg/kg时,叶片没有明显变化,部分根系开始出现褐化,根系的数量开始减少,但处理2个月后有新根萌出,可见900 mg/kg处理时,樟树依然可以存活。当处理浓度为1 200 mg/kg时,部分叶片开始萎蔫,根系褐化严重,且根系数量减少明显,也没有新根长出。因此在1 200 mg/kg铜处理下,樟树生长抑制及损害明显。
生物量干质量的结果与生长观察一致(表1),150 mg/kg处理时可以促进樟树的生长,其地上和根系干质量均高于其他处理,900 mg/kg处理时,地上干质量没有降低,反而高于对照组,但差异不显著(P>0.05);根系干质量稍有降低,差异也不显著(P>0.05)。1 200 mg/kg处理时,樟树的地上和根系干质量均低于其他各处理,且与150 mg/kg处理时差异显著(P<0.05),与其他处理差异不显著(P>0.05)。
表 1 不同浓度铜处理下樟树地上和根系生物量(干质量)的测定Table 1. Determination of aboveground and root biomass (dry mass) of Cinnamomum camphora treated with different concentrations of copper处理
Treatments / mg/kg地上质量
Dry mass of shoot / g根质量
Dry mass of root / g0 7.98±2.87bc 3.81±1.18ab 50 7.85±2.54bc 3.59±0.67ab 150 9.59±3.08a 4.53±1.35a 300 9.18±1.57ab 3.62±0.53ab 600 7.61±1.14bc 3.49±0.50ab 900 8.33±0.91bc 3.11±0.60b 1200 6.82±1.44c 2.97±0.90b 注:数据均为平均值±标准差,小写字母表示不同处理间在P<0.05水平上差异显著(n=4)。下同。 Notes: All data in the table are average values±standard deviation (SD). Lowercase letters after data in the same row indicate significant differences between different treatments at P<0.05 level (n=4). Same below. 2.2 铜胁迫对樟树光合色素含量的影响
研究结果显示,叶绿素a、b及类胡萝卜素的含量均随着铜浓度的升高而降低。处理浓度为1200 mg/kg时,叶绿素a、b的含量均降至最低,显著低于其他各处理(P<0.05,图2);900 mg/kg处理时,叶绿素a、b的含量与300、600 mg/kg处理的差异均不显著(P>0.05),但与CK、50、150 mg/kg 处理时差异显著(P<0.05)。50、150、300、600 mg/kg 4种处理间的叶绿素a与叶绿素b差异均不显著(P>0.05)。类胡萝卜素含量的变化趋势与叶绿素a、b的变化趋势大致相同,也表现出随处理浓度的升高而降低的趋势,1 200 mg/kg处理时,类胡萝卜素含量最低,但与50、600、900 mg/kg 3个处理的差异不显著(P>0.05),与CK、150、300 mg/kg处理的差异显著(P<0.05)。
![]() 图 2 不同浓度铜处理60 d叶片中叶绿素a、b及类胡萝卜素含量的测定不同小写字母表示处理间在 P<0.05水平差异显著。下同。Figure 2. Determination of chlorophyll a, chlorophyll b, and carotenoid in Cinnamomum camphora leaves treated with different concentrations of copper for 60 dDifferent lowercase letters indicate significant differences between different treatments at P<0.05 level. Same below.
图 2 不同浓度铜处理60 d叶片中叶绿素a、b及类胡萝卜素含量的测定不同小写字母表示处理间在 P<0.05水平差异显著。下同。Figure 2. Determination of chlorophyll a, chlorophyll b, and carotenoid in Cinnamomum camphora leaves treated with different concentrations of copper for 60 dDifferent lowercase letters indicate significant differences between different treatments at P<0.05 level. Same below.2.3 铜胁迫对樟树抗氧化酶系统的影响
不同铜浓度影响樟树抗氧化酶系统的分析结果表明(图3),CAT活性在150 mg/kg时最低,与CK、50、600、900、1 200 mg/kg处理的差异显著(P<0.05;图3:A), CK和1 200 mg/kg两个处理时CAT活性最高,但与50、600、900 mg/kg处理间的差异不显著(P>0.05)。POD活性在CK、150、900 mg/kg处理时最高,显著高于300和600 mg/kg两个处理,600 mg/kg处理时的POD活性最低(图3:B)。SOD活性最高的是CK和150 mg/kg两个处理,显著高于300、600 mg/kg处理,与其他处理间的差异不显著(图3:C)。谷胱甘肽还原酶(GR)活性有随着处理浓度的升高逐渐降低的趋势,CK和50 mg/kg处理的GR活性最高,1 200 mg/kg处理时,活性最低,与CK、50、150、300、600 mg/kg处理差异显著,但与900 mg/kg处理的差异不显著(图3:D)
2.4 铜胁迫对樟树渗透调节物质含量及抗逆性指标的影响
GSH作为植物体内重要的抗氧化剂和自由基清除剂,有随着处理浓度的升高而逐渐升高的趋势(图4:A)。渗透调节物质脯氨酸和可溶性糖含量均在1 200 mg/kg 处理时显著高于其他处理(P<0.05),其他处理间没有显著差异(P>0.05;图4:B、C)。可溶性蛋白在900和1 200 mg/kg 处理时显著高于其他处理,其他处理间差异不显著(图4:D)。随着铜浓度的升高,抗逆性指标MDA表现出逐渐升高的趋势(图4:E);H2O2浓度在CK和1 200 mg/kg两个处理时达到最高水平,显著高于50、150、300、600 mg/kg处理,与900 mg/kg处理的差异不显著(图4:F)。
2.5 铜胁迫对樟树不同组织铜浓度的影响
由表2可知,随着铜浓度的增加,根、茎、叶等不同组织的铜含量也逐渐升高,但与CK相比,处理浓度为50和150 mg/kg时,差异没有达到显著水平(P>0.05)。当处理浓度在300 mg/kg以上时,樟树叶、茎和根的铜含量均显著高于对照,但叶、茎的增幅显著低于根,与对照处理相比,300、600、900、1 200 mg/kg处理的叶片铜含量分别增加了1.73、1.80、1.74和2.12倍,茎部铜含量分别增加了1.42、1.45、1.35和2.02倍,而根部铜含量则分别增加了4.45、3.95、15.72和22.17倍。随着铜浓度的增加,铜离子由根系向叶片的转移率IF(Leaf/Root)由对照处理的0.078逐渐降至1 200 mg/kg处理时的0.007;铜离子由根系向茎的转移率IF(Stem/Root)由对照处理的0.06逐渐降至1 200 mg/kg处理时的0.005。樟树各器官铜含量的大小顺序为根>叶>茎,樟树主要将铜富集在根系,往地上茎和叶的转移率很低,且随着铜浓度的增大,往地上茎和叶的转移率也显著降低。
表 2 不同铜浓度处理下樟树不同部位铜含量及铜转移率的测定Table 2. Effects of different concentrations of copper on copper content and transfer rate in different parts of Cinnamomum camphora处理
Treatments /
mg/kg叶铜含量
Leaf Cu /
mg/kg茎铜含量
Stem Cu /
mg/kg根铜含量
Root Cu /
mg/kg铜转运
(叶/根)
IF (Leaf/Root)铜转运
(茎/根)
IF (Stem/Root)0 1.91±0.13c 1.46±0.29c 24.46±1.34d 0.078±0.005a 0.060±0.011a 50 1.72±0.01c 1.09±0.13c 25.20±1.28d 0.068±0.004b 0.044±0.007b 150 1.96±0.45c 1.40±0.23c 28.80±3.16d 0.067±0.009b 0.049±0.011ab 300 3.32±0.43b 2.08±0.24b 108.95±13.01c 0.031±0.002c 0.019±0.003c 600 3.44±0.37b 2.12±0.41b 96.67±11.71c 0.036±0.008c 0.022±0.006c 900 3.33±0.66b 1.97±0.36b 384.44±34.11b 0.009±0.002d 0.005±0.001d 1 200 4.06±0.53a 2.95±0.01a 542.27±51.01a 0.007±0.001d 0.005±0.001d 3. 讨论
3.1 铜胁迫对樟树生长的影响
樟树是重要的木本经济树种,茎叶是精油提取的主要器官,若能将樟树用于铜污染土壤修复中,不仅能改善生态环境,还可以实现收益,同时具有经济和生态效益。研究发现,樟树对铜污染有较好的适应能力[12, 13],在铜污染土壤的植物修复中应用潜力较大[14, 15]。本研究中,樟树对铜胁迫表现出“低促高抑”的变化趋势,一定浓度的铜(150 mg/kg)促进樟树的生长,其地上和根系生物量均高于其他处理,900 mg/kg处理时,樟树地上干质量没有降低,根系干重稍有降低,当处理浓度为1 200 mg/kg时,樟树的地上和根系干质量均降低。生长状况是反映植物对重金属耐受程度的直观指标[7],过量铜抑制植物生长曾多次被文献报道,例如,当Cu2+浓度高于20 μmol/L时,小白菜(Brassica campestris L. ssp. chinensis Makino)和芥菜(Brassica juncea L. Czern. et Coss.)的根、茎、叶生物量均随着铜浓度的升高而显著降低,铜胁迫抑制了小白菜和芥菜的生长[16, 17];玉米(Zea mays L.)幼苗的铜胁迫处理表明,Cu2+浓度为5 μmol/L时玉米幼苗的生长即受到抑制,随着胁迫浓度的升高,玉米幼苗地上和地下生物量均显著降低[18]。
光合作用是植物获取能量的重要途径,植物的能量含量与光合作用密切相关,叶绿素含量是反映植物耐受逆境胁迫的重要指标之一[19],本研究中叶绿素a、b及类胡萝卜素的含量均有随着铜处理浓度的升高而降低的趋势,与袁霞等[20]、李炎林等[21]的研究结果一致。当铜浓度为900 mg/kg时,叶绿素含量与其他低浓度处理差异均不显著;当铜浓度为1 200 mg/kg时,叶绿素含量则显著低于其他各处理。原因可能是重金属胁迫下,植物叶绿体膜结构受到一定程度的破坏,叶绿体开始降解,且叶绿体内的光合酶合成受抑制,叶片气孔关闭,光合作用强度降低[22],植物的生物量积累减少,生长受到抑制。
3.2 铜胁迫对樟树生理生化反应的影响
铜胁迫导致叶绿素含量降低及生长受抑制的主要原因是细胞内活性氧(ROS)含量不断增加并积累[23, 24]。低浓度的重金属可以激活植物的抗氧化应急系统,诱导 SOD、POD和CAT活性升高,以清除体内的活性氧[25],高浓度的 ROS则破坏细胞膜、核酸和叶绿素等关键成分,造成氧化损伤,影响植物的正常发育[26, 27]。MDA是细胞膜脂过氧化的产物,含量的高低反映了植物细胞膜脂过氧化的程度以及抗逆能力的强弱[25],MDA含量越高,植物细胞膜脂过氧化程度越高,ROS引起的细胞损伤越大[28]。本研究中MDA含量有随着铜处理浓度的升高而升高的趋势,900和1 200 mg/kg两个浓度处理时,MDA的含量显著高于其他各处理,说明高浓度铜胁迫对樟树细胞造成一定程度损伤。
可溶性蛋白、可溶性糖和游离脯氨酸作为植物体内重要的渗透调节物质,其含量的变化也是植物抗逆性强弱的重要反映。可溶性蛋白是植物细胞中含量最丰富的生物大分子之一,是植物结构和功能的重要物质基础,含量越高说明生理生化反应和代谢活动越强[29, 30]。本研究中,可溶性蛋白在铜浓度小于600 mg/kg时含量相对稳定,在900和1 200 mg/kg两个高浓度处理时,蛋白含量显著高于其他各处理,说明900和1 200 mg/kg两个浓度处理时,樟树的生理生化和代谢活动显著增强。游离脯氨酸既是渗透调节剂,又可作为自由基清除体内的重金属,其含量的增加可提高植物细胞液的浓度,维持细胞内外渗透压的平衡,保障细胞膜的结构稳定[31]。可溶性糖在维持细胞膜稳定、细胞扩张、酶活性和植株光合作用等方面起着重要作用[32],植物在逆境中可以通过增加可溶性糖等的含量来调节细胞的渗透压,提高对逆境的适应能力[33]。本研究中游离脯氨酸和可溶性糖的含量均在1 200 mg/kg处理时达到最高水平,显著高于其他各处理,900 mg/kg处理和其他低浓度处理的差异不显著,说明900 mg/kg处理时,细胞的内环境相对稳定。
植物抵抗重金属的能力与体内抗氧化酶系统的活性密切相关。POD、 CAT 与 SOD 协同作用,能够有效清除胁迫产生的活性氧,减少对植物细胞的危害,保证植物的正常生长[34]。过氧化氢是在铜胁迫下产生的活性氧物质,能直接或间接氧化细胞内的核酸、蛋白质等生物大分子,破坏细胞膜结构,从而加速细胞老化和解体,POD通过催化过氧化氢分解成无毒害的水和氧气,使植物体内的自由基保持在较低水平,从而避免对植物造成氧化伤害[35,36]。本研究中,不同铜处理后SOD、POD 和 CAT 酶的活性没有显著升高,过氧化氢的含量也相对稳定,在900 mg/kg处理时,其含量与对照差异不显著,说明该处理浓度没有超出樟树的自身调节能力,樟树可以有效抵抗铜的毒害作用。
3.3 铜胁迫对樟树不同器官铜含量的影响
植物对重金属的富集和转运能力是评价其耐受性的重要指标,与根系吸收及根系向地上部转运能力密切相关[9, 37]。本研究中,樟树主要将铜富集在根系,往地上茎和叶的转移率很低,且随着铜浓度的增加,往地上茎和叶的转移率逐渐降低,减轻了过量铜对樟树地上组织的毒害作用,与朱宇恩等[38]的研究结果一致。研究发现,植物主要通过两种途径抵抗铜的毒害作用:一是减少铜从根向地上部的转移,铜离子进入根系后,更多的集中在根系,从而降低铜对植物地上部的毒性;二是将铜离子集中在对铜毒性不太敏感的组织或部位固定起来,以减少铜在植物细胞中的转移,主要方式有将铜离子结合在细胞壁上或者转移到液泡中[39],或者利用植物体内的螯合剂与铜离子结合,形成对植物毒性较小或无毒的螯合物[40]。GSH为植物螯合剂(PCs)的合成提供合成前体,GR能够还原氧化型谷胱甘肽(GSSG)生成还原型谷胱甘肽(GSH),维持细胞内充足的GSH水平[41]。 本研究中,GSH含量有随着铜浓度的升高而升高的趋势,在900和1 200 mg/kg两个高浓度处理时,显著高于其他各处理;GR活性则在CK和50 mg/kg处理时活性最高,且随着处理浓度的升高逐渐降低,1 200 mg/kg处理时活性最低,推测GR被大量消耗,以合成更多的GSH参与植物螯合剂的合成并螯合过量铜离子。 但目前为止,樟树根系对铜离子的耐受策略及其分子调控机制还不清楚,深入探究樟树根系对铜离子的耐受和转运机制,是我们下一步要重点研究的内容。
1 1,2)如需查阅附图内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
表 1 36份猕猴桃种质果实采收时的成熟度
Table 1 Fruit maturity at harvest of 36 Actinidia accessions
种类名称
Class name种质名称
Accession name单果重
Fresh weight / g硬度
Firmness / N可溶性固形物
Soluble solids content / %干物质
Dry matter / %美味 ‘金美’ 63.13 ± 0.94 78.07 ± 1.54 7.52 ± 0.30 23.48 ± 0.22 美味 ‘东玫’ 52.79 ± 2.02 84.92 ± 3.52 7.55 ± 0.35 21.19 ± 0.44 美味 ‘金魁’ 99.98 ± 3.90 88.94 ± 3.56 7.52 ± 0.21 19.80 ± 0.38 美味 ‘米良1号’ 104.65 ± 0.83 65.98 ± 2.26 7.88 ± 0.32 19.02 ± 0.26 美味 ‘徐香’ 78.15 ± 3.54 89.93 ± 3.05 7.61 ± 0.22 18.97 ± 0.27 美味 ‘楚红’ 50.10 ± 1.43 49.67 ± 3.08 7.04 ± 0.36 18.77 ± 0.24 美味 ‘海沃德’ 115.03 ± 1.23 67.91 ± 1.75 7.18 ± 0.24 16.56 ± 0.23 美味平均值 80.55 ± 1.98 75.06 ± 2.68 7.47 ± 0.29 19.68 ± 0.29 中华 ‘华优’ 84.01 ± 1.98 53.34 ± 1.64 9.78 ± 0.55 20.95 ± 0.31 中华 翠玉实生12617 74.83 ± 1.91 59.03 ± 2.42 10.74 ± 0.42 20.46 ± 0.24 中华 中华杂交CD611 61.49 ± 1.21 61.39 ± 1.72 9.15 ± 0.29 19.09 ± 0.20 中华 ‘翠玉’ 69.32 ± 3.28 62.77 ± 2.21 9.91 ± 0.45 18.72 ± 0.43 中华 ‘武植3号’ 82.76 ± 3.61 56.65 ± 3.71 9.24 ± 0.62 18.44 ± 0.31 中华 ‘金早’ 79.51 ± 1.76 56.11 ± 1.94 7.80 ± 0.43 18.38 ± 0.35 中华 中华杂交CD11129 55.53 ± 1.82 62.19 ± 1.99 8.34 ± 0.26 18.34 ± 0.26 中华 ‘金玉’ 107.01 ± 2.67 54.14 ± 1.80 8.01 ± 0.33 18.11 ± 0.27 中华 ‘东红’ 112.28 ± 2.92 53.26 ± 1.66 8.79 ± 0.52 16.81 ± 0.37 中华 ‘金霞’ 103.08 ± 0.98 53.87 ± 1.79 8.55 ± 0.35 16.47 ± 0.18 中华 ‘金桃’ 148.26 ± 7.88 55.61 ± 1.65 9.12 ± 0.45 16.29 ± 0.27 中华 ‘金农’ 95.09 ± 3.84 45.50 ± 3.34 8.32 ± 0.37 15.22 ± 0.24 中华 ‘金丰’ 109.61 ± 2.77 60.97 ± 2.14 8.45 ± 0.15 15.06 ± 0.18 中华 ‘丰悦’ 111.04 ± 2.04 46.84 ± 2.96 7.53 ± 0.37 14.74 ± 0.25 ‘金艳’ × 中华 ‘金圆’ 116.14 ± 2.39 60.95 ± 1.34 9.36 ± 0.39 16.71 ± 0.19 ‘金艳’ × 中华 ‘金梅’ 102.27 ± 2.18 59.26 ± 1.63 8.27 ± 0.19 16.68 ± 0.24 中华平均值 94.51 ± 2.70 56.37 ± 2.12 8.84 ± 0.38 17.53 ± 0.27 山梨 × 中华 ‘中科绿猕7号’ 43.65 ± 0.51 66.98 ± 2.45 8.07 ± 0.22 17.86 ± 0.32 山梨 × 中华 山梨 × 中华F1-AC17 43.93 ± 0.53 47.00 ± 3.05 9.82 ± 0.26 17.73 ± 0.13 山梨 × 中华 ‘中科绿猕8号’ 41.97 ± 0.73 58.52 ± 1.66 9.00 ± 0.24 17.51 ± 0.15 山梨 × 中华 山梨 × 中华F1-AC18 38.31 ± 0.88 59.79 ± 3.10 11.50 ± 0.22 17.00 ± 0.15 山梨 × 中华 山梨 × 中华F1-AC16 45.45 ± 0.79 46.83 ± 1.47 9.38 ± 0.21 16.69 ± 0.22 山梨 × 中华 ‘中科绿猕9号’ 48.99 ± 0.91 33.80 ± 3.04 11.78 ± 0.21 16.41 ± 0.13 山梨 × 中华 山梨 × 中华F1-AC15 45.61 ± 0.94 57.16 ± 2.69 9.66 ± 0.16 16.23 ± 0.13 山梨 × 中华 ‘中科绿猕6号’ 44.66 ± 0.58 46.75 ± 1.57 10.25 ± 0.19 15.87 ± 0.20 山梨 × 中华 ‘中科绿猕5号’ 41.92 ± 1.11 47.73 ± 1.88 10.05 ± 0.15 15.35 ± 0.19 山梨 × 中华平均值 43.83 ± 0.78 51.62 ± 2.32 9.95 ± 0.21 16.74 ± 0.18 中华 × ‘超红’ ‘中科绿猕12号’ 36.46 ± 0.63 67.20 ± 1.55 8.31 ± 0.16 18.31 ± 0.17 中华 × ‘超红’ ‘中科绿猕10号’ 28.34 ± 0.86 56.06 ± 2.78 9.75 ± 0.30 17.31 ± 0.12 中华 × ‘超红’ ‘中科绿猕11号’ 33.44 ± 0.84 35.76 ± 2.01 10.03 ± 0.16 15.51 ± 0.15 中华 × ‘超红’ 毛花b754 32.70 ± 0.77 45.94 ± 2.78 7.99 ± 0.15 12.92 ± 0.21 中华 × ‘超红’平均值 32.74 ± 0.78 51.24 ± 2.28 9.02 ± 0.19 16.01 ± 0.16 总体 平均值 72.26 58.25 8.87 17.58 最小值 28.34 33.80 7.04 12.92 最大值 148.26 89.93 11.78 23.48 标准差 31.51 12.71 1.19 2.06 变异系数 / % 43.61 21.81 13.39 11.72 表 2 36份猕猴桃种质的软熟果实感官评价
Table 2 Sensory evaluation of ripe fruit of 36 Actinidia accessions
种类名称
Class name种质名称
Accession name整体喜好度
Overall liking风味喜好度
Flavor liking风味强烈程度
Flavor intensity甜度
Sweetness酸度
Acidity接受度
Acceptance美味 ‘徐香’ 6.05 ± 0.25 6.00 ± 0.21 5.75 ± 0.19 5.90 ± 0.22 4.55 ± 0.33 85 美味 ‘金美’ 5.95 ± 0.26 6.11 ± 0.25 6.00 ± 0.22 5.37 ± 0.21 4.42 ± 0.29 73.68 美味 ‘东玫’ 5.85 ± 0.26 5.95 ± 0.32 5.85 ± 0.22 5.70 ± 0.22 4.85 ± 0.3 60 美味 ‘金魁’ 5.32 ± 0.26 5.26 ± 0.28 6.00 ± 0.24 5.12 ± 0.33 5.65 ± 0.36 58.82 美味 ‘米良1号’ 5.06 ± 0.22 5.22 ± 0.24 5.22 ± 0.22 4.83 ± 0.17 5.17 ± 0.25 44.44 美味 ‘楚红’ 4.74 ± 0.38 4.88 ± 0.39 5.03 ± 0.38 4.76 ± 0.48 5.00 ± 0.33 35.29 美味 ‘海沃德’ 4.20 ± 0.40 4.63 ± 0.48 5.47 ± 0.43 4.40 ± 0.36 5.97 ± 0.47 13.33 美味平均值 5.31 ± 0.29 5.44 ± 0.31 5.62 ± 0.27 5.15 ± 0.28 5.09 ± 0.33 52.94 中华 ‘华优’ 7.19 ± 0.37 7.31 ± 0.28 6.69 ± 0.31 7.06 ± 0.3 3.50 ± 0.42 87.5 中华 ‘东红’ 6.90 ± 0.31 6.65 ± 0.33 5.90 ± 0.24 6.20 ± 0.3 3.55 ± 0.45 70 中华 翠玉实生12617 6.00 ± 0.21 5.50 ± 0.17 6.05 ± 0.28 5.63 ± 0.25 5.08 ± 0.32 68.42 中华 ‘金桃’ 5.63 ± 0.31 5.70 ± 0.31 4.60 ± 0.32 5.15 ± 0.22 4.80 ± 0.32 65 中华 ‘金早’ 5.56 ± 0.36 5.50 ± 0.48 4.81 ± 0.4 4.97 ± 0.36 4.19 ± 0.42 81.25 中华 ‘金霞’ 5.43 ± 0.26 5.53 ± 0.29 5.60 ± 0.35 4.78 ± 0.25 5.70 ± 0.28 70 中华 ‘翠玉’ 5.06 ± 0.26 4.82 ± 0.33 5.06 ± 0.3 4.65 ± 0.3 4.06 ± 0.37 29.41 中华 ‘金农’ 4.83 ± 0.44 4.60 ± 0.52 5.37 ± 0.44 4.77 ± 0.41 5.60 ± 0.36 46.67 中华 ‘金玉’ 4.75 ± 0.4 4.95 ± 0.34 5.40 ± 0.26 5.55 ± 0.26 4.50 ± 0.34 40 中华 中华杂交CD611 4.70 ± 0.18 4.75 ± 0.19 5.30 ± 0.15 4.20 ± 0.37 6.30 ± 0.4 20 中华 ‘武植3号’ 4.38 ± 0.33 3.92 ± 0.31 5.54 ± 0.31 3.38 ± 0.27 6.69 ± 0.35 7.69 中华 中华杂交CD11129 4.26 ± 0.3 4.47 ± 0.16 5.05 ± 0.28 3.58 ± 0.33 6.53 ± 0.34 5.26 中华 ‘丰悦’ 3.63 ± 0.31 3.69 ± 0.36 3.06 ± 0.35 3.31 ± 0.38 4.50 ± 0.29 12.5 中华 ‘金丰’ 1.80 ± 0.29 2.50 ± 0.27 5.10 ± 0.86 1.90 ± 0.31 6.80 ± 0.66 0 ‘金艳’ × 中华 ‘金圆’ 5.47 ± 0.39 5.21 ± 0.37 5.84 ± 0.36 5.11 ± 0.37 5.63 ± 0.35 47 ‘金艳’ × 中华 ‘金梅’ 5.17 ± 0.29 5.33 ± 0.26 5.56 ± 0.23 5.17 ± 0.22 5.56 ± 0.29 38.89 中华平均值 5.05 ± 0.31 5.03 ± 0.31 5.31 ± 0.34 4.71 ± 0.31 5.19 ± 0.37 43.1 山梨 × 中华 山梨 × 中华F1-AC16 6.65 ± 0.24 6.50 ± 0.29 5.15 ± 0.24 6.08 ± 0.3 4.25 ± 0.2 65 山梨 × 中华 ‘中科绿猕9号’ 6.55 ± 0.29 6.15 ± 0.32 5.55 ± 0.21 5.80 ± 0.27 4.25 ± 0.3 80 山梨 × 中华 ‘中科绿猕7号’ 6.52 ± 0.25 6.38 ± 0.28 5.95 ± 0.31 5.86 ± 0.28 4.76 ± 0.45 76.19 山梨 × 中华 山梨 × 中华F1-AC15 6.14 ± 0.27 6.19 ± 0.34 7.00 ± 0.32 5.90 ± 0.35 4.71 ± 0.4 61.91 山梨 × 中华 ‘中科绿猕6号’ 5.81 ± 0.31 5.62 ± 0.35 5.45 ± 0.32 5.48 ± 0.34 3.71 ± 0.35 61.91 山梨 × 中华 山梨 × 中华F1-AC17 5.80 ± 0.26 5.65 ± 0.33 4.95 ± 0.3 5.30 ± 0.38 4.55 ± 0.21 60 山梨 × 中华 山梨 × 中华F1-AC18 5.70 ± 0.35 5.60 ± 0.33 5.80 ± 0.32 5.60 ± 0.28 4.65 ± 0.29 65 山梨 × 中华 ‘中科绿猕8号’ 5.19 ± 0.27 4.62 ± 0.28 4.67 ± 0.28 4.57 ± 0.3 4.05 ± 0.37 38.1 山梨 × 中华 ‘中科绿猕5号’ 4.95 ± 0.36 4.89 ± 0.39 5.11 ± 0.37 4.58 ± 0.4 4.42 ± 0.38 42.11 山梨 × 中华平均值 5.92 ± 0.29 5.73 ± 0.32 5.51 ± 0.3 5.46 ± 0.32 4.37 ± 0.33 61.14 中华 × ‘超红’ ‘中科绿猕12号’ 5.88 ± 0.18 5.81 ± 0.28 5.06 ± 0.41 5.06 ± 0.41 4.00 ± 0.68 68.75 中华 × ‘超红’ ‘中科绿猕11号’ 5.40 ± 0.28 4.93 ± 0.29 4.20 ± 0.32 4.40 ± 0.3 3.40 ± 0.47 55 中华 × ‘超红’ ‘中科绿猕10号’ 4.60 ± 0.35 4.15 ± 0.39 3.40 ± 0.43 3.85 ± 0.32 4.10 ± 0.4 30 中华 × ‘超红’ 毛花b754 3.73 ± 0.38 3.53 ± 0.42 3.37 ± 0.49 3.57 ± 0.35 3.67 ± 0.43 13.33 中华 × ‘超红’平均值 4.90 ± 0.3 4.61 ± 0.35 4.01 ± 0.41 4.22 ± 0.35 3.79 ± 0.5 41.77 总体 平均值 5.30 5.24 5.28 4.93 4.81 49.37 最小值 1.80 2.50 3.06 1.90 3.40 0.00 最大值 7.19 7.31 7.00 7.06 6.80 87.50 标准差 1.03 0.96 0.82 0.99 0.92 24.67 变异系数 / % 19.48 18.35 15.59 20.07 19.06 49.96 -
[1] 黄宏文. 猕猴桃属分类资源驯化栽培[M]. 北京: 科学出版社, 2013: 2. [2] 钟彩虹,黄文俊,李大卫,张琼,李黎. 世界猕猴桃产业发展及鲜果贸易动态分析[J]. 中国果树,2021(7):101−108. Zhong CH,Huang WJ,Li DW,Zhang Q,Li L. Dynamic analysis of global kiwifruit industry development and fresh fruit trade[J]. China Fruits,2021 (7):101−108.
[3] 方金豹,钟彩虹. 新中国果树科学研究70年——猕猴桃[J]. 果树学报,2019,36(10):1352−1359. Fang JB,Zhong CH. Fruit scientific research in New China in the past 70 years:kiwifruit[J]. Journal of Fruit Science,2019,36 (10):1352−1359.
[4] Zhong HC,Huang WJ,Wang ZP,Li L,Li DW,et al. The breeding progress and development status of the kiwifruit industry in China[J]. Acta Hortic,2022,1332:445−454.
[5] Huang HW,Wang Y,Zhang ZH,Jiang ZW,Wang SM. Actinidia germplasm resources and kiwifruit industry in China[J]. HortScience,2004,39 (6):1165−1172. doi: 10.21273/HORTSCI.39.6.1165
[6] 黄宏文,龚俊杰,王圣梅,何子灿,张忠慧,李建强. 猕猴桃属(Actinidia)植物的遗传多样性[J]. 生物多样性,2000,8(1):1−12. Huang HW,Gong JJ,Wang SM,He ZC,Zhang ZH,Li JQ. Genetic diversity in the genus Actinidia[J]. Chinese Biodiversity,2000,8 (1):1−12.
[7] Zhang HX,Zhao QY,Lan T,Geng TH,Gao CX,et al. Comparative analysis of physicochemical characteristics,nutritional and functional components and antioxidant capacity of fifteen kiwifruit (Actinidia) cultivars-comparative analysis of fifteen kiwifruit (Actinidia) cultivars[J]. Foods,2020,9 (9):1267. doi: 10.3390/foods9091267
[8] Ma TT,Sun XY,Zhao JM,You YL,Lei YS,et al. Nutrient compositions and antioxidant capacity of kiwifruit (Actinidia) and their relationship with flesh color and commercial value[J]. Food Chem,2017,218:294−304. doi: 10.1016/j.foodchem.2016.09.081
[9] 黄文俊,江昌应,陈美艳,刘小莉,张琦,等. 三个产地猕猴桃品种‘金梅’在低温贮藏及货架期内的采后生理和品质变化[J]. 植物科学学报,2020,38(5):687−695. Huang WJ,Jiang CY,Chen MY,Liu XL,Zhang Q,et al. Changes in postharvest physiology and fruit quality of Actinidia chinensis Planch. ‘Jinmei’ from three different production regions during cool storage and shelf life[J]. Plant Science Journal,2020,38 (5):687−695.
[10] 刘璐,屈振江,张勇,李艳莉. 陕西猕猴桃果品气候品质认证模型构建[J]. 陕西气象,2017(4):21−25. [11] 肖涛,程均欢,刘涛,肖丽丽,王华玲,等. 不同授粉方式对猕猴桃果实性状的影响[J]. 中国南方果树,2022,51(3):122−125. [12] 易淑瑶,刘青,贾东峰,李亦淇,黄春辉,等. 不同结果母枝粗度对“东红”猕猴桃果实品质的影响[J]. 中国南方果树,2020,49(4):122−126. [13] Chai JX,Wang YT,Liu YF,Gu ZM,Liu ZD. High O2/N2 controlled atmosphere accelerates postharvest ripening of ‘Hayward’ kiwifruit[J]. Sci Hortic,2022,300:111073. doi: 10.1016/j.scienta.2022.111073
[14] 王依,雷靖,陈成,徐明,邴昊阳,雷玉山. 美味猕猴桃新品种‘瑞玉’果实品质综合评价[J]. 西北农林科技大学学报(自然科学版),2018,46(10):101−107. Wang Y,Lei J,Chen C,Xu M,Bing HY,Lei YS. Comprehensive evaluation of fruit quality of a new delicious kiwifruit variety ‘Ruiyu’[J]. Journal of Northwest A& F University (Natural Science Edition)
,2018,46 (10):101−107. [15] 陈美艳,赵婷婷,刘小莉,韩飞,张鹏,钟彩虹. 猕猴桃品种‘金艳’果实品质因子分析与综合评价[J]. 植物科学学报,2021,39(1):85−92. Chen MY,Zhao TT,Liu XL,Han F,Zhang P,Zhong CH. Factor analysis and comprehensive evaluation of fruit quality of ‘Jinyan’ kiwifruit (Actinidia eriantha × Actinidia chinensis)[J]. Plant Science Journal,2021,39 (1):85−92.
[16] 刘磊,李争艳,雷华,高本旺,赵佳,李薇. 30个猕猴桃品种(单株)主要果实品质特征的综合评价[J]. 果树学报,2021,38(4):530−537. Liu L,Li ZY,Lei H,Gao BW,Zhao J,Li W. Comprehensive evaluation of main fruit quality characteristics with 30 kiwifruit cultivars (strains)[J]. Journal of Fruit Science,2021,38 (4):530−537.
[17] 刘科鹏,黄春辉,冷建华,陈葵,严玉平,等. ‘金魁’猕猴桃果实品质的主成分分析与综合评价[J]. 果树学报,2012,29(5):867−871. Liu KP,Huang CH,Leng JH,Chen K,Yan YP,et al. Principal component analysis and comprehensive evaluation of the fruit quality of ‘Jinkui’ kiwifruit[J]. Journal of Fruit Science,2012,29 (5):867−871.
[18] 郭琳琳,庞荣丽,王瑞萍,乔成奎,田发军,等. 猕猴桃营养品质综合评价[J]. 果树学报,2022,39(10):1864−1872. Guo LL,Pang RL,Wang RP,Qiao CK,Tian FJ,et al. Comprehensive trait evaluation for kiwifruit nutritional quality[J]. Journal of Fruit Science,2022,39 (10):1864−1872.
[19] 李跃红,冉茂乾,徐孟怀,陈露,游元丁,等. 不同品种猕猴桃果实品质比较与综合评价[J]. 食品与发酵工业,2020,46(23):162−168. Li YH,Ran MQ,Xu MH,Chen L,You YD,et al. Comparison and comprehensive evaluation of fruit quality of different varieties of kiwifruit[J]. Food and Fermentation Industries,2020,46 (23):162−168.
[20] 赵金梅,高贵田,薛敏,耿鹏飞,孙翔宇,等. 不同品种猕猴桃果实的品质及抗氧化活性[J]. 食品科学,2014,35(9):118−122. Zhao JM,Gao GT,Xue M,Geng PF,Sun XY,et al. Fruit quality and antioxidant activity of different kiwifruit varieties[J]. Food Science,2014,35 (9):118−122.
[21] 陈永安,陈鑫,刘艳飞,杨宏. 基于模糊数学的猕猴桃感官评定分析[J]. 食品工业,2013,34(10):129−133. Chen YA,Chen X,Liu YF,Yang H. Analysis of an improved sensory comprehensive evaluation for kiwifruit based on fuzzy mathematics[J]. The Food Industry,2013,34 (10):129−133.
[22] 吕新刚,王智荣,杨琦,孟官丽. 不同处理对生鲜电商模式下“徐香”猕猴桃常温品质变化的影响[J]. 食品工业科技,2018,39(4):268−273,279. LÜ XG,Wang ZR,Yang Q,Meng GL. Effects of different treatment on quality changes of ‘Xu Xiang’ kiwifruit stored at room temperature under the supply pattern of e-commerce[J]. Science and Technology of Food Industry,2018,39 (4):268−273,279.
[23] 陈璐,廖光联,杨聪,黄春辉,钟敏,等. 基于主成分分析与聚类分析的黄肉猕猴桃品种(系)主要果实性状的综合评价[J]. 江西农业大学学报,2018,40(6):1231−1240. Chen Lu,Liao GL,Yang C,Hung CH,Zhong M,et al. Comprehensive evaluation of main fruit characters of yellow flesh kiwifruit cultivars (strains) based on principal component analysis and cluster analysis[J]. Acta Agriculturae Universitatis Jiangxiensis,2018,40 (6):1231−1240.
[24] 赵治兵,谢国芳,曹森,马立志. 基于主成分分析评价不同基地“贵长”猕猴桃品质特性[J]. 保鲜与加工,2019,19(5):144−148. Zhao ZB,Xie GF,Cao S,Ma LZ. Evaluation of quality characteristics of ‘Guichang’ kiwifruit from different producing regions based on principal component analysis[J]. Storage and Process,2019,19 (5):144−148.
[25] 韩飞,陈美艳,李昆同,黄文俊,闫春林,等. 不同产地‘金圆’猕猴桃低温贮藏下的生理指标及贮藏性变化[J]. 植物科学学报,2018,36(3):381−392. Han F,Chen MY,Li KT,Huang WJ,Yan CL,et al. Changes in physiological indices and storage properties of ‘Jinyuan’ kiwifruit from different orchards under low temperature storage[J]. Plant Science Journal,2018,36 (3):381−392.
[26] 陈双双,贺艳群,徐小彪,陶俊杰,贾东峰,等. 江西省不同产地“金艳”猕猴桃果实品质比较分析[J]. 中国南方果树,2022,51(2):113−116. [27] Burdon J,McLeod D,Lallu N,Gamble J,Petley M,Gunson A. Consumer evaluation of “Hayward” kiwifruit of different at-harvest dry matter contents[J]. Postharvest Biol Technol,2004,34 (3):245−255. doi: 10.1016/j.postharvbio.2004.04.009
[28] Rossiter KL,Young H,Walker SB,Miller M,Dawson DM. The effects of sugars and acids on consumer acceptability of kiwifruit[J]. J Sens Stud,2000,15 (3):241−250. doi: 10.1111/j.1745-459X.2000.tb00269.x
[29] Crisosto G,Hasey JK,Zegbe JA,Crisosto CH. New quality index based on dry matter and acidity proposed for Hayward kiwifruit[J]. Calif Agric,2012,66 (2):70−75. doi: 10.3733/ca.v066n02p70
-
期刊类型引用(1)
1. 龙桂根,黄芝云,吴南生,冯胜,冯超,丁菲,金松松,何利人,王勇,陈玲. 南酸枣种质资源果实性状变异和综合评价. 热带亚热带植物学报. 2024(06): 781-790 .  百度学术
百度学术
其他类型引用(3)
-
其他相关附件
-
PDF格式
申素云附图1-2 点击下载(373KB)
-




 下载:
下载: