Newly recorded species of Gomphonema from the Hengduan Mountains in China
-
摘要:
报道了横断山区异极藻属(Gomphonema)硅藻中国新记录18种,分别为:缠结异极藻头端变种(G. intricatum var. capitata Hustedt)、变窄异极藻(G. angustius Reichardt)、非洲异极藻(G. afrhombicum Reichardt)、假中间异极藻(G. pseudointermedium Reichardt)、尖顶型异极藻(G. auguriforme Levkov)、加利福尼亚异极藻(G. californicum Stancheva & Kociolek)、近拉蒂科尔异极藻(G. sublaticollum Reichardt)、球顶异极藻(G. sphenovertex Lange-Bertalot & Reichardt)、威尔斯科异极藻(G. wiltschkorum Lange-Bertalot)、瓦尔达异极藻(G. vardarense Reichardt)、微小异极藻(G. parvuliforme Lange-Bertalot)、细小异极藻(G. parvuloides Cholnoky)、维多利亚异极藻(G. lacus-victoriensis Reichardt)、尤卡塔尼异极藻(G. yucatanense Metzeltin & Lange-Bertalot)、窄头异极藻(G. angusticephalum Reichardt & Lange-Bertalot)、长贝尔塔异极藻(G. lange-bertalotii Reichardt)、中间异极藻(G. intermedium Hustedt)和中亚异极藻(G. medioasiae Metzeltin, Lange-Bertalot & Nergui)。本研究对新记录种的形态特征进行了详细描述,给出了每个种的地理分布、生境信息和理化指标,并对新记录种及其相似种的形态特征进行了讨论。
Abstract:This paper reports 18 new records of diatoms from the genus Gomphonema in the Hengduan Mountains of China, including G. intricatum var. capitata Hustedt, G. angustius Reichardt, G. afrhombicum Reichardt, G. pseudointermedium Reichardt, G. auguriforme Levkov, G. californicum Stancheva & Kociolek, G. sublaticollum Reichardt, G. sphenovertex Lange-Bertalot & Reichardt, G. wiltschkorum Lange-Bertalot, G. vardarense Reichardt, G. parvuliforme Lange-Bertalot, G. parvuloides Cholnoky, G. lacus-victoriensis Reichardt, G. yucatanense Metzeltin & Lange-Bertalot, G. angusticephalum Reichardt & Lange-Bertalot, G. lange-bertalotii Reichardt, G. intermedium Hustedt, and G. medioasiae Metzeltin, Lange-Bertalot & Nergui. Detailed descriptions of the morphological characteristics, geographical distribution, habitat preferences, and physicochemical indices for each species are provided. Furthermore, comparative analyses of the morphological characteristics of the newly recorded species and their closely related counterparts are discussed.
-
Keywords:
- Diatoms /
- Hengduan Mountains /
- Gomphonema /
- New records
-
正常的雌雄配子育性是植物保证后代繁殖的关键因素。对于农作物而言,雌雄配子育性还决定了作物的结实率和产量[1]。雄性不育既是植物最重要的质量性状之一,也是研究水稻(Oryza sativa L.)、小麦(Triticum aestivum L.)、玉米(Zea mays L.)等重要农作物杂种优势利用的基础。目前在水稻、玉米、小麦等作物中利用“三系杂交”的育种方法将雄性不育应用于育种中,极大提高了作物的产量[1-3]。植物雄性育性调控机制已成为近年来杂种优势利用的热门研究方向。
花药和花粉的正常发育是植物雄性繁殖成功的先决条件。从雄蕊原基的形成到花粉粒成熟,直至花药开裂散粉,花药发育受到一系列精细化生物学过程的调控[4]。雄蕊原基细胞经过数轮细胞地分裂和分化,由外至内形成由表皮层、内皮层、中间层和绒毡层4层体细胞包围着花粉母细胞的花药结构。花粉母细胞位于花药室中间,经过减数分裂形成小孢子。小孢子又经过两次不均等的有丝分裂形成成熟的花粉[5]。
1. 植物花药角质层和花粉壁的主要成分
花药和花粉表面分别被花药角质层和花粉壁覆盖,对环境和生物胁迫具有保护作用。花药角质层主要由角质和蜡质组成,角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质围绕在角质的表面,主要由C16 ~ C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。覆盖在成熟花粉粒表面的花粉壁可保护花粉粒不受外界生物或者非生物胁迫损伤,而且能帮助花粉与柱头识别,促进花粉传播[8]。成熟花粉粒的花粉壁由花粉外壁(Exine)、花粉内壁(Intine)和含油层(Tryphine)3层结构组成。花粉壁是一种成分非常复杂的胞外细胞壁基质。目前的研究表明,花粉外壁外层的主要成分是孢粉素,由饱和长链脂肪酸前体或饱和长脂肪链前体经过复杂的生物聚合组成[8, 9]。花粉内壁的成分与普通的细胞壁类似,主要由纤维素、半纤维素和果胶聚合物组成[10]。花粉包被(Pollen coat)或含油层,主要由复杂的脂质、蜡酯、类黄酮、羟肉桂酰基亚精胺代谢产物和蛋白质组成[10]。
角质、蜡质和孢粉素分别是形成花药角质层和花粉外壁的主要成分。研究表明,它们的脂质前体在花药绒毡层细胞中合成,然后被分别转运到花药表面和小孢子表面沉积。前期科学家们通过正向遗传学的手段,分析花药角质层和花粉壁发育缺陷的突变体,鉴定得到一系列蛋白,包括脂质合成酶基因、脂质转运蛋白、转录因子和ABCG转运蛋白等[8, 10, 11]。随着研究的不断深入,大量ABCG转运蛋白被报道参与植物雄性育性调控,本文将系统阐述ABCG转运蛋白参与植物雄性育性调控的功能与机制。
2. ABC转运蛋白的结构特点与分类
ABC转运蛋白又名ATP(Adenosine triphosphate)结合盒式转运蛋白,属于最大的转运蛋白家族。它们广泛存在于微生物到高等植物甚至人类中[12]。ABC转运蛋白属于多结构域的跨膜蛋白,它通过利用自身ATP结合结构域,在Mg2 + 参与下水解ATP获得能量来转运分子,如异生素、激素、糖、氨基酸和离子等[13, 14]。
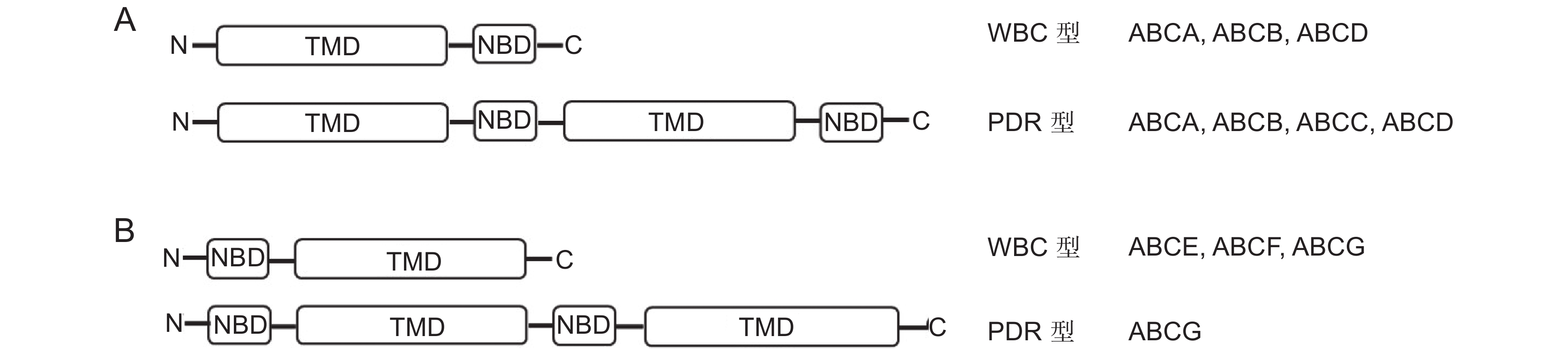
ABC转运蛋白由4个核心结构域组成:两个核苷酸结合结构域(Nucleotide-binding domain,NBD)和两个跨膜结构域(Transmembrane domain,TMD)(图1 :A、B)。根据NBD和TMD的组成可将ABC转运蛋白分为两类,一类是WBC (White/brown complex,WBC)型,其结构包含一个NBD和一个TMD,称为半分子(Half-size)转运蛋白,该类蛋白需要与自身或另外一个半分子转运蛋白结合,形成同源或异源二聚体蛋白发挥转运功能;另一类是PDR(Pleiotropic drug resistance,PDR)型,其结构包含两个NBD和两个TMD,称为全分子(Full-size)转运蛋白,可以单独发挥转运功能[12, 15]。值得一提的是,与其他真核生物ABC转运蛋白不同,植物半分子转运蛋白除了可形成同源二聚体外,还可以与另外的半分子转运蛋白形成异源二聚体[16]。
ABC转运蛋白的NBD和TMD结构域的排布可以是正向(TMD在前,NBD在后,图1:A),也可以是反向(TMD在后,NBD在前,图1:B)。在高等植物中,根据ABC转运蛋白遗传进化特征可分为8个亚族,分别是ABCA(ATP-binding cassette A transporter)至ABCI(ATP-binding cassette Ⅰ transporter),其中ABCH(ATP-binding cassette H transporter)转运蛋白在植物中不存在[17]。ABCA至ABCD(ATP-binding cassette D transporter)亚族蛋白由于TMD位于NBD之前,属于前向转运体[18]。ABCG亚族由于NBD位于TMD之前,属于反向转运体[18, 19]。
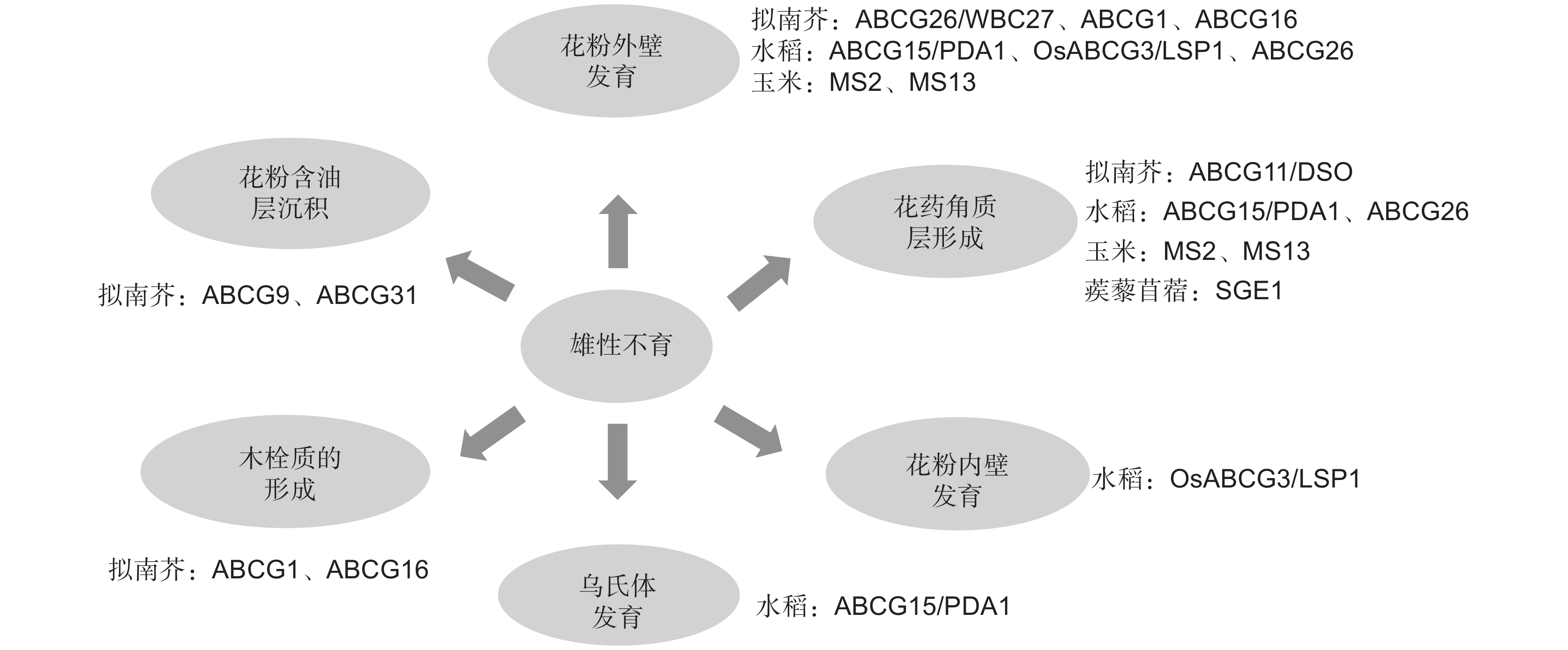
植物8个ABC转运蛋白亚族中,ABCG转运蛋白属于最大的一个亚族。在水稻、玉米和拟南芥(Arabidopsis thaliana (L.) Heynh.)中分别含有50、54和43个成员,其蛋白功能复杂多样[20]。其中拟南芥ABCG蛋白亚族包含28个半分子转运蛋白和15个全分子转运蛋白[17, 21]。随着研究的不断深入,ABCG转运蛋白被报道在植物生殖器官发育、激素运输、角质层形成、次生代谢产物分泌和生物或非生物胁迫响应等方面发挥重要作用[15, 22]。其中,ABCG转运蛋白主要是通过调控植物花粉壁的发育和花药角质层的形成来参与植物雄性育性发育过程[23]。
3. ABCG转运蛋白参与调控植物雄性不育的研究现状
3.1 参与调控花粉壁发育
近年来ABCG转运蛋白被多次研究报道参与转运由绒毡层产生的脂类、酚类、其他孢粉素前体物质以及含油层物质用于花粉壁形成[24]。早期研究发现,拟南芥AtABCG26基因与花粉外壁形成过程中多聚酮化合物的运输相关,该基因功能丧失后会导致植物育性显著降低[25-28]。水稻OsABCG15,又称为PDA1(Post-meitotic deficient anther 1),是AtABCG26的同源基因。pda1突变体由于乌氏体及花粉外壁缺失而导致小孢子败育[29, 30]。最近在玉米中首次报道ZmMS2(Zea mays male sterile2)参与调控花药发育,ZmMS2是OsABCG15和AtABCG26的同源基因,该基因突变后导致小孢子外壁发育不正常[31]。值得一提的是,水稻ABCG15基因突变后,突变体除了不能形成有功能的花粉外壁,其花药角质层发育也存在缺陷。但是拟南芥abcg26突变体的花药角质层发育正常。由此可推测水稻ABCG15可能与多个ABCG半分子转运蛋白相互作用,以运输不同的底物用于花粉外壁和花药角质层的形成。另外,Xu等[32]研究发现,拟南芥中一个bHLH转录因子AMS可以直接结合ABCG26基因启动子上的E-boxes,直接调控ABCG26基因的表达,从而影响花粉外壁的发育。但是目前尚未有研究报道水稻OsABCG15和玉米ZmMS2是否受到转录因子的调控。
早期研究报道拟南芥ABCG1和ABCG16基因参与木栓质和花粉壁细胞外屏障形成。abcg1 abcg16双突变体育性下降,花粉粒干瘪[33, 34]。水稻OsABCG3/LSP1(Less and shrunken pollen 1)是拟南芥ABCG1和ABCG16的同源基因,近期研究发现OsABCG3/LSP1可以转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失,最终导致植株完全雄性不育[35, 36]。以上研究成果提示,ABCG转运蛋白在不同物种中参与转运花粉壁发育前体物质的功能具有保守性。
此外,ABCG转运蛋白可同时转运多种底物用于植物生长和生殖发育。最新的研究发现,ABCG1和ABCG16除参与转运木栓质和孢粉素前体物质用于花粉发育外,还可影响拟南芥生殖器官中生长素的信号传导。abcg1abcg16双突变体雌蕊中花粉管生长受阻与生长素分布和生长素流动减少有关,此表型可以通过在雌蕊中添加外源生长素得到部分恢复[37]。值得一提的是,目前绝大部分参与植物雄性生殖器官发育的ABCG转运蛋白均属于半分子转运蛋白,关于ABCG全分子转运蛋白参与花药发育的研究报道极少。Choi等[38]研究发现,拟南芥ABCG半分子转运蛋白AtABCG9和ABCG全分子转运蛋白AtABCG31协同参与花粉壁合成。AtABCG9和AtABCG31在绒毡层中高表达,主要通过将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积,abcg9abcg31双突变体的花粉活力严重下降。
3.2 参与调控花药角质层发育
花药角质层可保护雄配子体免受外界环境影响[39]。角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质主要围绕在角质基质的表面,由C16~C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。
近年来,ABCG转运蛋白被报道参与转运植物角质和蜡质前体从而调控植物发育。Pighin等[40]的研究表明,拟南芥ABCG12/CER5(ECERIFERUM 5)主要从表皮细胞内转运蜡质前体至细胞表面。AtABCG12/CER5基因突变后,突变体茎秆表皮蜡质含量显著降低[40]。拟南芥ABCG11/DSO主要参与转运长链脂肪酸和超长链脂肪酸,该基因突变后,突变体不仅茎秆表面蜡质和角质含量显著性下降,而且突变体花器官脂质沉积和根软木质沉积均下降,突变体植株育性严重受到影响[41, 42]。进一步研究发现,ABCG11自身能形成同源二聚体,也能与ABCG12形成异源二聚体,但是ABCG12不能形成同源二聚体[16]。
与孢粉素前体或脂类物质从绒毡层细胞运输到花药室参与花粉壁的形成相比,绒毡层细胞产生的孢粉素前体或脂类物质如何被运输到花药表面用于花药角质层形成的研究报道较少。水稻ABCG半分子转运蛋白OsABCG26定位于花药表皮、内皮层和Stage 9期的绒毡层中,可将脂质分子从绒毡层转运到花药壁,供角质层发育需要。在osabcg26突变体中可以观察到大量电子致密的脂质颗粒包裹体沿着绒毡层细胞室壁连接至中间层,该现象提示OsABCG26可能主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。OsABCG26突变后会导致转运受阻,从而影响角质层形成,导致花粉败育[23, 43]。与OsABCG26蛋白不同,OsABCG15蛋白只定位于绒毡层内侧,并以极性方式面对花药室,因此被认为主要参与花粉外壁形成过程中脂质前体的分配[23]。由于osabcg26osabcg15双突变体的表型能减轻osabcg15单突变体表型,因此推测水稻OsABCG26和OsABCG15是协同调控雄性生殖发育的[23]。
ABCG转运蛋白作为植物大蛋白家族,通过介导脂质代谢,特别是脂质和酚类物质前体在花药层细胞两侧转运以形成花粉发育最重要的两个保护屏障——花粉壁和花药角质层。目前ABCG半分子转运蛋白参与花药发育的研究大部分只停留在表型上的观察,具体的分子机制尚未明确。Zhu等[44]首次研究报道蒺藜苜蓿(Medicago truncatula Gaertn.)ABCG转运蛋白SGE1(Stigma exsertion1)可通过影响花器官中蜡质和角质等长链脂肪酸的运输导致雌雄蕊隔离,形成柱头外露型雄性不育材料。SGE1蛋白可与另一个半分子转运蛋白MtABCG13相互作用,形成一个有功能的异源二聚体。对ABCG蛋白的功能进行深入研究,将有助于阐明其在植物雄性生殖器官发育中的分子机制。
近期,Fang等[45]首次报道玉米一个雄性不育新基因ZmMS13在花药和花粉发育的前期(Stage 5)、中期(Stage 8b)和后期(Stage 10)具有3个表达峰,分别受转录因子ZmbHLH122、ZmMYB84和ZmMYB33-1/-2调控,从而分别影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成。该研究首次发现ABCG基因多峰值表达受不同转录因子调控,并阐明其具体的分子机理,拓展了植物ABCG转运蛋白的生物学功能。
表1汇总了目前在玉米、拟南芥和水稻中报道的ABCG转运蛋白参与植物雄性育性调控的研究进展。
表 1 参与植物雄性育性调控的ABCG转运蛋白Table 1. ABCG transporters involved in regulation of plant male fertility物种
Species基因名称
Gene name转运蛋白类型
Transport protein type具体功能
Functions文献
References拟南芥
Arabidopsis thaliana (L.) Heynh.ABCG26/
WBC27半分子 参与花粉外壁形成过程中多聚酮化合物的运输,该基因突变后,花粉外壁发育异常,植株育性显著下降 [25-28] 水稻Oryza sativa L. ABCG15/
PDA1半分子 参与花药角质层、乌氏体及花粉外壁发育 [29, 30] 玉米Zea mays L. MS2 半分子 参与花粉外壁发育,GC-MS分析结果显示ms2突变体花药角质和蜡质单体显著下降 [31] 拟南芥 ABCG1 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 拟南芥 ABCG16 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 水稻 OsABCG3/
LSP1半分子 参与转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失 [35, 36] 拟南芥 ABCG9 半分子 与ABCG31协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG31 全分子 与ABCG9协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG12/
CER5半分子 参与从表皮细胞内转运蜡质前体至细胞表面 [40] 拟南芥 ABCG11/
DSO半分子 转运长链脂肪酸和超长链脂肪酸 [41, 42] 水稻 ABCG26 半分子 主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。该基因突变后,突变体花粉外壁及花药角质层发育存在缺陷,还可以影响花粉管伸长 [23, 43] 蒺藜苜蓿
Medicago truncatula Gaertn.SGE1 半分子 影响蒺藜苜蓿花器官中蜡质和角质等长链脂肪酸的运输 [44] 玉米 ZmMS13 半分子 影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成 [45] 拟南芥 ABCG28 半分子 将多胺和活性氧定位于正在生长的花粉管尖端 [46] 最新的研究发现,拟南芥AtABCG28在成熟花粉和生长的花粉管中特异表达,该蛋白定位于分泌囊泡膜上。当AtABCG28基因突变后,花粉管生长缺陷,无法将多胺和活性氧定位于正在生长的花粉管尖端,植株表现为完全雄性不育[46]。图2总结和归纳了目前研究中主要的ABCG转运蛋白参与植物雄性育性调控的具体功能。
4. 展望
ABCG作为ABC转运蛋白最大的一个亚族,参与植物发育中各种生理过程。本文首先概述了植物花药角质层和花粉壁的主要成分,其次总结了ABC转运蛋白的结构特点,最后重点阐述ABCG转运蛋白参与调控植物花药和花粉发育的具体功能。随着研究不断深入,ABCG转运蛋白参与植物雄性育性调控的功能不再局限于调控花药角质层和花粉外壁的发育。
虽然ABCG转运蛋白的研究报道较多,但是其具体转运的底物尚未研究清楚。目前对于ABCG转运蛋白功能的研究主要采用反向遗传学的方法,通过气相色谱-质谱联用仪(GC-MS)分析ABCG突变体和野生型的特定部位组织的代谢产物差异,对ABCG转运蛋白的底物或者底物类别做出合理的猜测。目前在拟南芥、水稻、玉米等植物中大部分的ABCG转运蛋白底物均是该方法预测的[23, 38, 45]。此外,根据ABCG转运蛋白的特点,目前最直接有效的ABCG转运底物鉴定方法是通过一个转运实验以严格的ATP依赖的方式证明其跨膜转运活性。该转运实验的先决条件是将ABCG转运蛋白在适当的系统中进行过表达,如烟草(Nicotiana tabacum L.)原生质体系统或者酵母菌株(YMM12和BY-2)细胞系[20]。目前拟南芥ABCG转运蛋白的底物可通过体内同位素标记实验进行检测。例如,通过烟草原生质体系统构建的转运实验鉴定拟南芥ABCG11和ABCG32可以转运10,16-二羟基、C16∶0-2甘油和W-OH C16∶0等角质前体用于植物角质层形成[22]。但是用同位素标记进行实验鉴定ABCG转运蛋白的底物非常耗时,且许多同位素化合物尚未商业化,因此阻碍了该技术的利用。除此之外,基于使用双光子显微镜的研究结果表明,聚酮化合物是拟南芥ABCG26的底物。当AtABCG26基因突变后,突变体在绒毡层细胞中积累了大的荧光液泡,小孢子中的荧光丧失。当AtABCG26基因和编码孢粉素聚酮化合物生物合成代谢基因构建双突变体(atabcg26 acos5(acyl coenzyme A synthetase5)、atabcg26 tkpr1)以及三突变体(atabcg26 pksa(polyketide synthase a) pksb),这些双突变体和三突变体花药绒毡层细胞并未观察到荧光液泡内含物[28]。因此,可以推测AtABCG26将聚酮化合物从绒毡层细胞转运到花粉壁形成孢粉素骨架。
目前ABCG家族蛋白参与植物花药发育的报道集中于对ABCG半分子转运蛋白的研究。ABCG半分子转运蛋白需要通过同源或者异源二聚体的方式形成一个有功能的ABCG转运蛋白。通过寻找与其他ABCG共表达的基因,或者通过酵母筛库,或者质谱等方式鉴定ABCG转运蛋白的潜在伴侣,并研究其分子生物学功能,可拓宽ABCG转运蛋白参与植物雄性育性调控的具体分子机制。由于ABCG转运蛋白在不同植物中具有保守性,因此其同源基因在其他作物中可能也发挥类似的作用,通过反向遗传学的方法,例如利用基因编辑,可加深我们对ABCG转运蛋白在多种植物中的功能机制的了解。而所获得的雄性不育等优良性状的突变系在杂交作物育种和种子生产中具有广泛的应用前景。
-
图版Ⅰ 缠结异极藻头端变种、变窄异极藻和非洲异极藻。
1~7、17:缠结异极藻头端变种(1~7:光镜照片。17:扫描电镜照片,外壳面观)。8~13、15~16:变窄异极藻(8~13:光镜照片。15~16:扫描电镜照片;15:中央区的外壳面观,A代表孤点;16:外壳面观)。14:非洲异极藻(光镜照片)。
图版Ⅰ. Gomphonema intricatum var. capitata, G. angustius and G. afrhombicum.
1-7, 17: G. intricatum var. capitata (1-7: Light microscopy images. 17: Scanning electron microscopy images, external valve view). 8-13, 15-16: G. angustius (8-13: Light microscopy images. 15-16: Scanning electron microscopy images; 15: Internal valve view of central area, A is stigma; 16: External valve view). 14: G. afrhombicum (Light microscopy images).
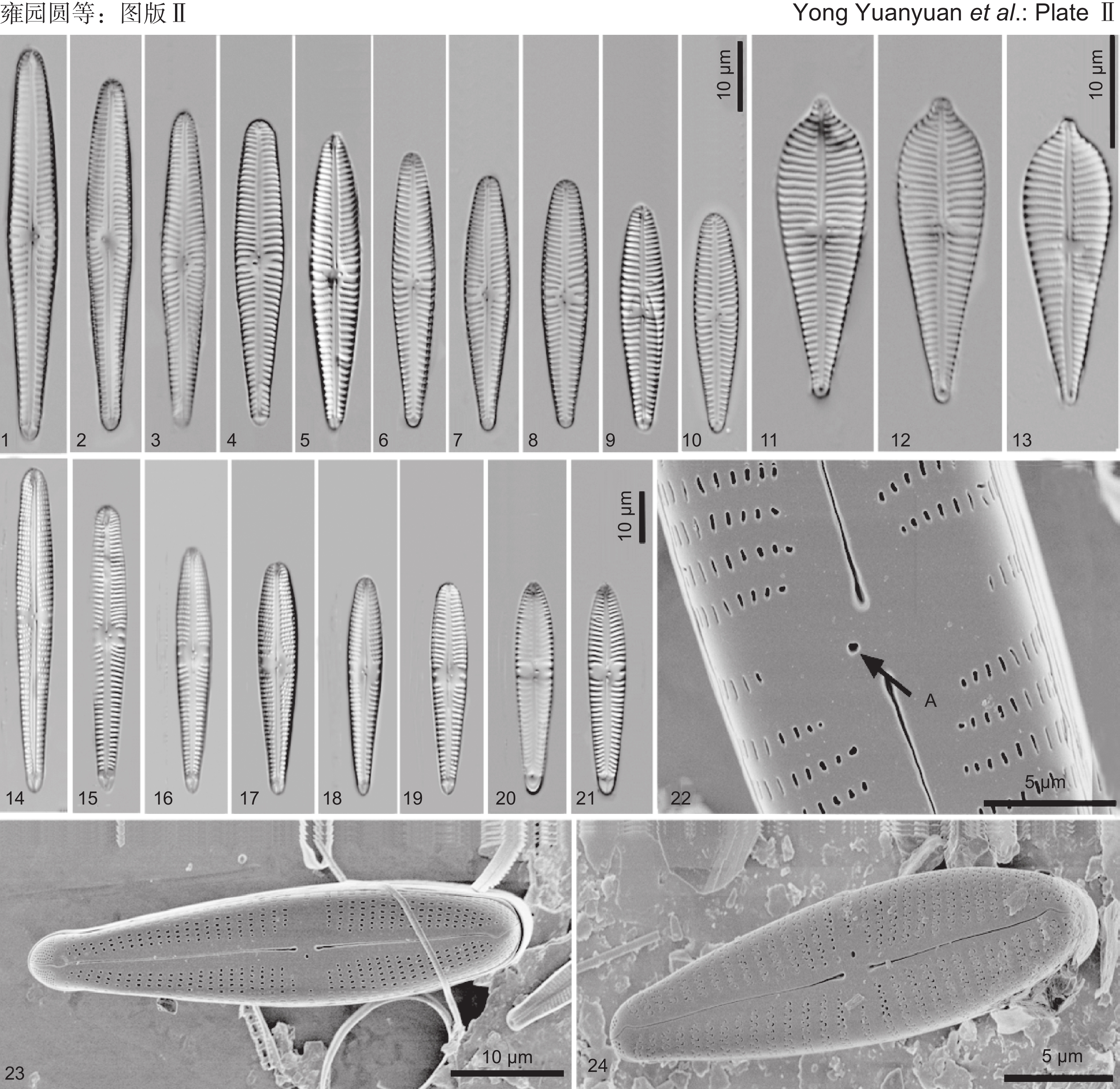
图版Ⅱ 假中间异极藻、尖顶型异极藻和加利福尼亚异极藻。
1~10、24:假中间异极藻(1~10:光镜照片。24:扫描电镜照片,外壳面观)。11~13:尖顶型异极藻(光镜照片)。14~23:加利福尼亚异极藻(14~21:光镜照片。22~23:扫描电镜照片;22:中央区的外壳面观,A代表孤点;23:外壳面观)。
图版Ⅱ. Gomphonema. pseudointermedium, G. auguriforme and G. californicum.
1-10, 24: G. pseudointermedium (1-10: Light microscopy images. 24: Scanning electron microscopy images, external valve view). 11-13: G. auguriforme (Light microscopy images). 14-23: G. californicum (14-21: Light microscopy images. 22-23: Scanning electron microscopy images; 22: Internal valve view of central area, A is stigma; 23: External valve view).
图版Ⅲ 近拉蒂科尔异极藻、球顶异极藻、威尔斯科异极藻和瓦尔达异极藻。
1~4:近拉蒂科尔异极藻(光镜照片)。5~9、24:球顶异极藻(5~9:光镜照片。24:外壳面观)。10~11:威尔斯科异极藻(光镜照片)。12~23:瓦尔达异极藻(12~21:光镜照片。22~23:扫描电镜照片;22:内壳面观;23:外壳面观,A代表孤点)。
图版Ⅲ. Gomphonema sublaticollum, G. sphenovertex, G. wiltschkorum, and G. vardarense.
1-4: G. sublaticollum (Light microscopy images). 5-9, 24: G. sphenovertex (5-9: Light microscopy images. 24: External valve view). 10-11: G. wiltschkorum (Light microscopy images). 12-23: G. vardarense (12-21: Light microscopy images. 22-23: Scanning electron microscopy images; 22: Internal valve view; 23: External valve view, A is stigma).
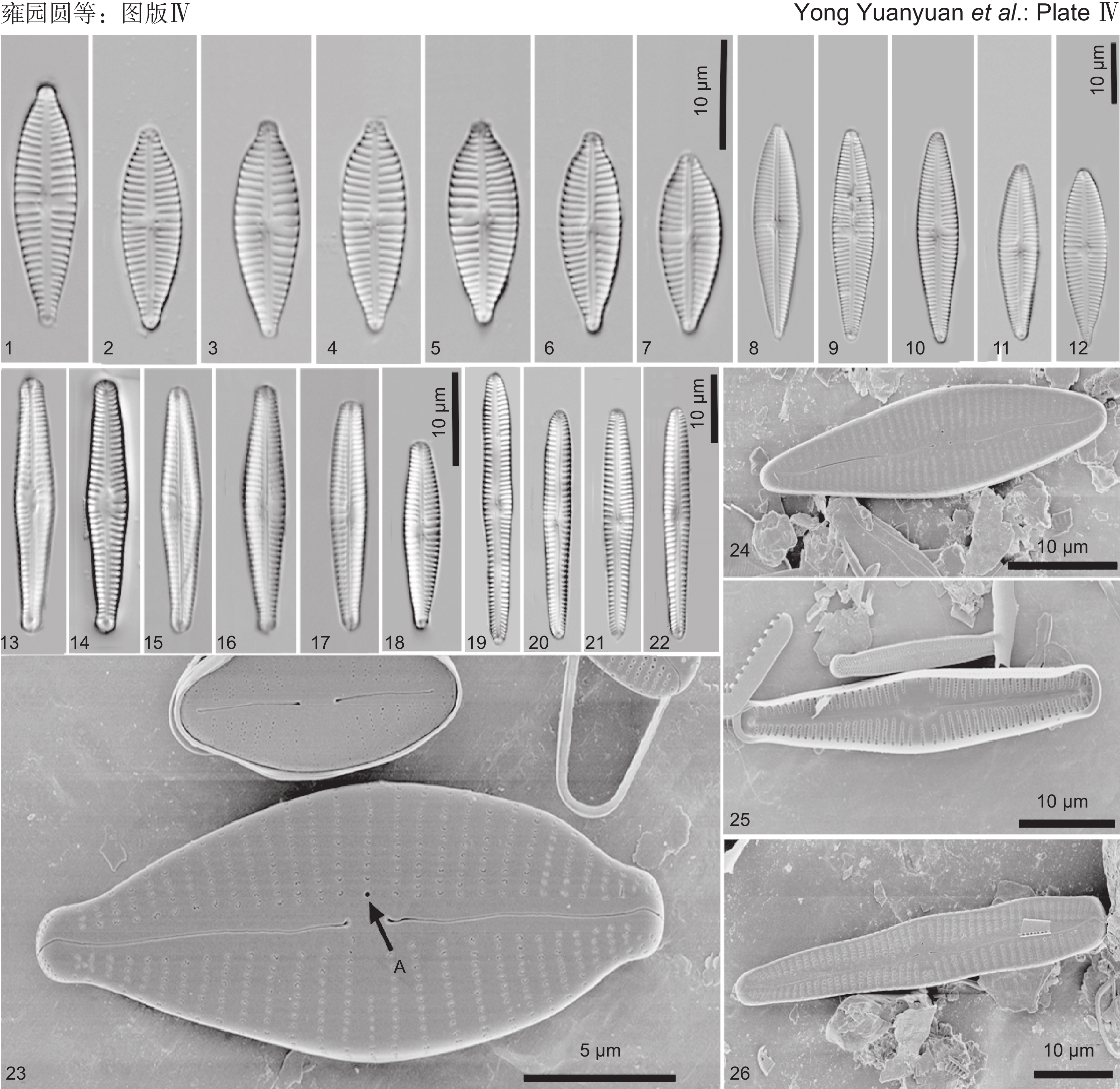
图版Ⅳ 微小异极藻、细小异极藻、维多利亚异极藻和尤卡塔尼异极藻。
1~7、23:微小异极藻(1~7:光镜照片。23:扫描电镜照片,外壳面观,A代表孤点)。8~12、24:细小异极藻:(8~12:光镜照片。24:扫描电镜照片,外壳面观)。13~18、25:维多利亚异极藻(13~18:光镜照片。25:扫描电镜照片,内壳面观)。19~22、26:尤卡塔尼异极藻(19~22:光镜照片。26:扫描电镜照片,外壳面观)。
图版Ⅳ. Gomphonema parvuliforme, G. parvuloides, G. lacus-victoriensis, and G. yucatanense.
1-7, 23: G. parvuliforme (1-7: Light microscopy images. 23: Scanning electron microscopy images, external valve view, A is stigma). 8-12, 24: G. parvuloides: (8-12: Light microscopy images. 24: Scanning electron microscopy images, external valve view). 13-18, 25: G. lacus-victoriensis Victoria (13-18: Light microscopy images. 25: Scanning electron microscopy images, internal valve view). 19-22, 26: G. yucatanense (19-22: Light microscopy images. 26: Scanning electron microscopy images, external valve view).
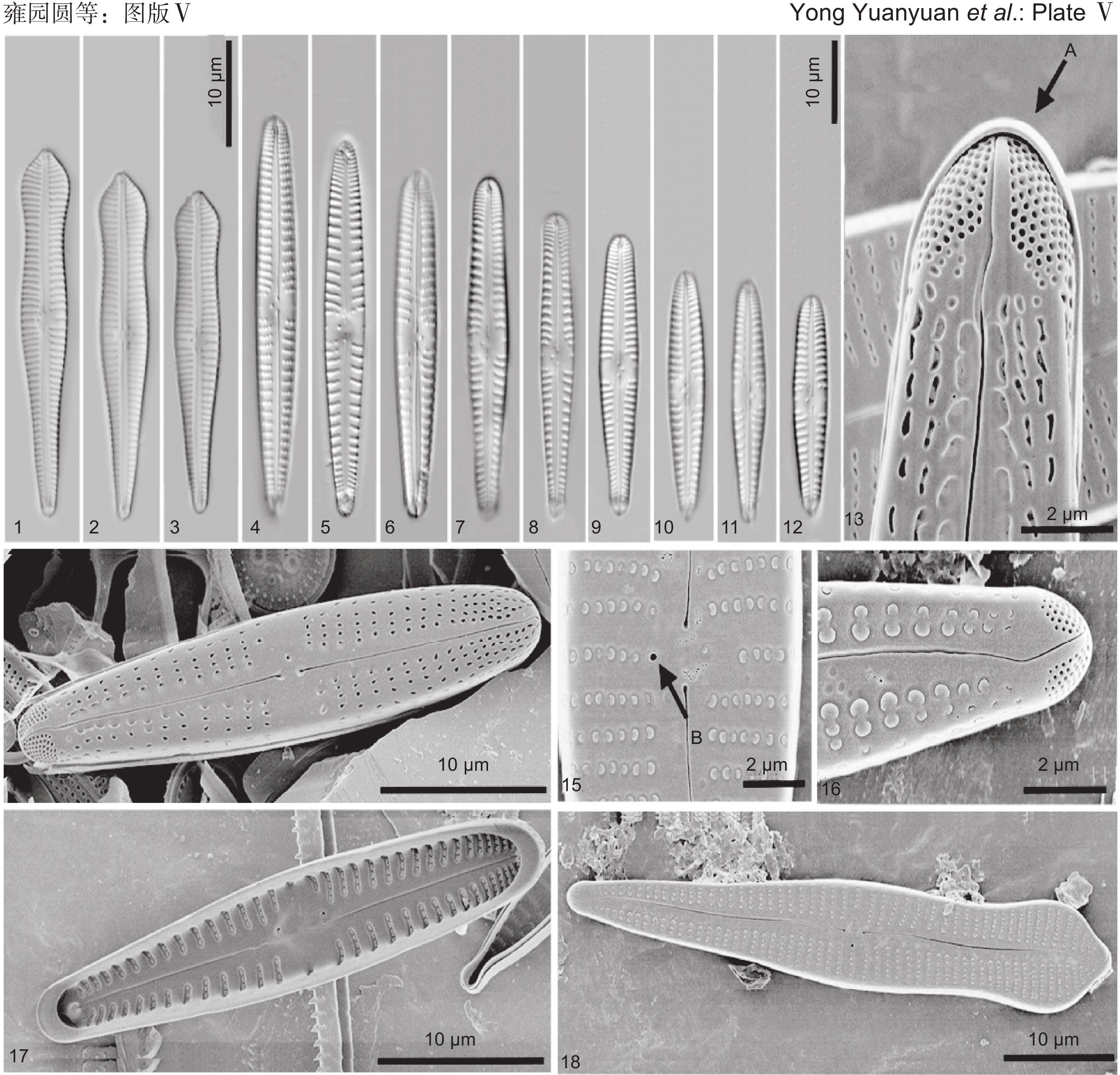
图版Ⅴ 窄头异极藻和长贝尔塔异极藻。
1~3、15、16、18:窄头异极藻(1~3:光镜照片。15、16、18:扫描电镜照片;15:中央区的外壳面观,B代表孤点;16:远缝端和顶孔区的外壳面观;18:外壳面观)。4~14、17:长贝尔塔异极藻(4~12:光镜照片。13、14、17:扫描电镜照片;13:远缝端,A代表顶孔区;14:外壳面观;17:内壳面观)。
图版Ⅴ. Gomphonema angusticephalum and G. lange-bertalotii.
1-3, 15, 16, 18: G. angusticephalum (1-3: Light microscopy images. 15, 16, 18: Scanning electron microscopy images; 15: Internal valve view of central area, B is stigma; 16: External valve view of distant raphe end and apical pore field; 18: External valve view). 4-14, 17: G. lange-bertalotii (4-12: Light microscopy images. 13, 14, 17: Scanning electron microscopy images; 13: Distant raphe end, A is apical pore field; 14: External valve view; 17: Internal valve view).
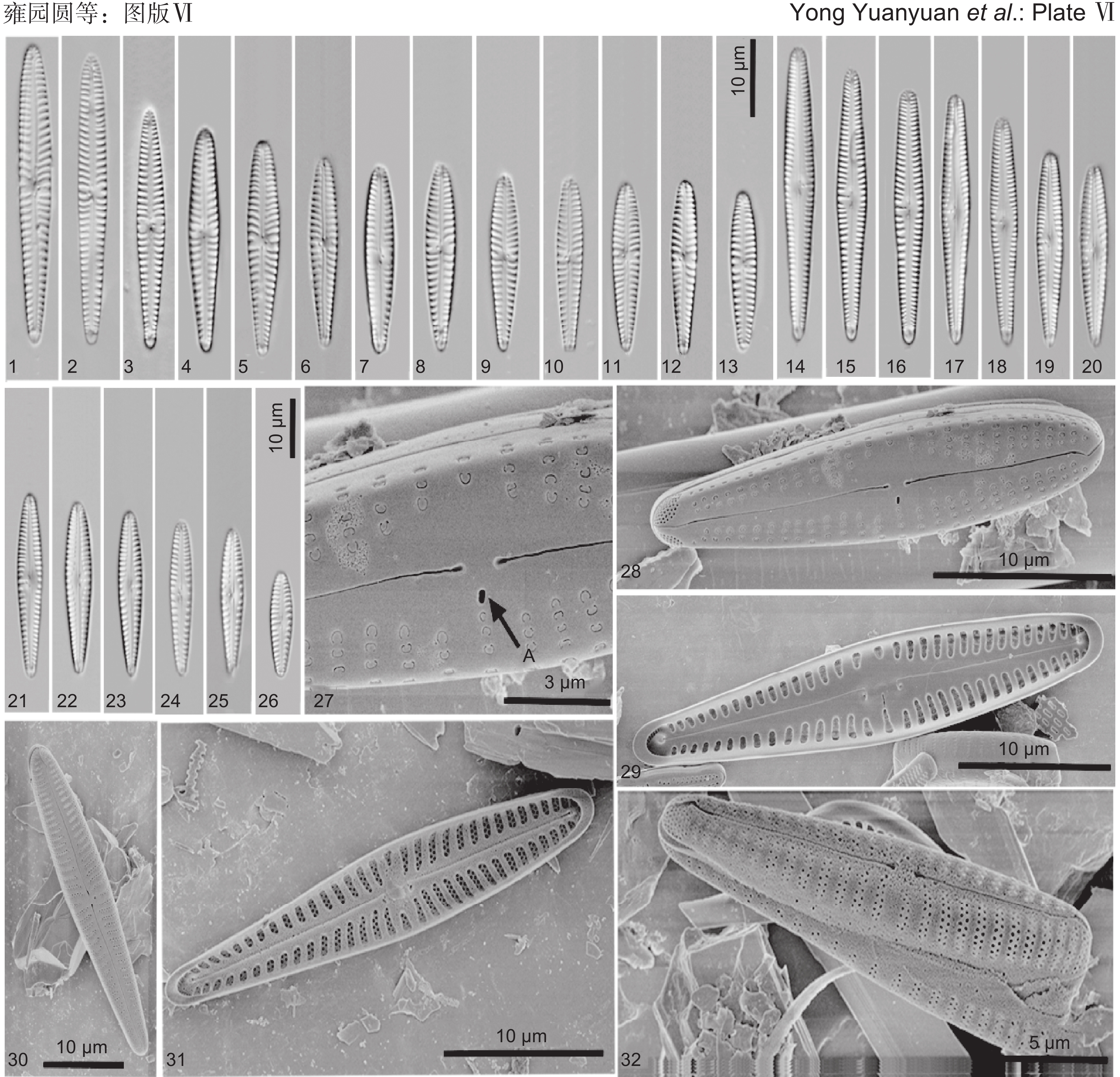
图版Ⅵ 中间异极藻和中亚异极藻。
1~13、30~32:中间异极藻(1~13:光镜照片。29~32:扫描电镜照片;30:外壳面观;31:内壳面观;32:带面观)。14~29:中亚异极藻(14~26:光镜照片。27~29:扫描电镜照片;27:中央区的外壳面观,A代表孤点;28:外壳面观;29:内壳面观)。
图版Ⅵ. Gomphonema intermedium and G. medioasiae.
1-13, 30-32: G. intermedium (1-13: Light microscopy images. 30-32: Scanning electron microscopy images; 30: External valve view; 31: External valve view; 32: Girdle view). 14-29: G. medioasiae (14-26: Light microscopy images. 27-29: Scanning electron microscopy images; 27: Internal valve view of central area, A is stigma; 28: External valve view; 29: Internal valve view).
-
[1] Schnetzer A,Steinberg D. Natural diets of vertically migrating zooplankton in the Sargasso Sea[J]. Mar Biol,2002,141(1):89−99.
[2] Falciatore A,Bowler C. Revealing the molecular secrets of marine diatoms[J]. Annu Rev Plant Biol,2002,53:109−130.
[3] obo EA,Heinrich CG,Schuch M,Wetzel CE,Ector L. Diatoms as bioindicators in rivers[M]//Necchi Jr O,ed. River Algae. Chambridge:Springer,2016:245−271.
[4] 谢淑琦,蔡石勋. 山西、河北、内蒙古及河南内陆水体中心硅藻的研究[J]. 山西大学学报,1981(3):14−32. Xie SQ,Cai SX. Study on diatoms in inland water centers in Shanxi,Hebei,Inner Mongolia and Henan[J]. Journal of Shanxi University,1981(3):14−32.
[5] Patrick R,Reimer CW. The Diatoms of the United States:Exclusive of Alaska and Hawaii:Vol. 2,Part 1[M]. Philadelphia:Academy of Natural Sciences of Philadelphia,1975:213.
[6] 刘玥彤,刘妍,刘琪琛,范亚文. 异极藻属(硅藻门)5种中国新记录[J]. 西北植物学报,2016,36(1):190−193. Liu YT,Liu Y,Liu QC,Fan YW. Five newly recorded species of Gomphonema (Bacillariophyta) from China[J]. Acta Botanica Boreali-Occidentalia Sinica,2016,36(1):190−193.
[7] Guiry MD,Guiry GM. AlgaeBase. World-wide electronic publication,National University of Ireland,Galway. 2024[EB/OL]. (2024-03-20). https://www.algaebase.org.
[8] Skvortzow BW. Alpine diatoms from Fukien province,South China[J]. Philipp J Sci,1929,41(1):39−49.
[9] 饶钦止. 西藏南部地区的藻类[J]. 海洋与湖沼,1964,6(2):169−189. Rao QZ. Some fresh-water algae from southern Tibet[J]. Oceanologia et Limnologia Sinica,1964,6(2):169−189.
[10] 饶钦止,朱蕙忠,李尧英. 我国西藏南部珠穆朗玛峰地区藻类概要[J]. 科学通报,1973,18(1):30−32. Rao QZ,Zhu HZ,Li YY. Overview of algae in Mount Everest in southern Tibet,China[J]. Chinese Science Bulletin,1973,18(1):30−32.
[11] 朱蕙忠,陈嘉佑. 索溪峪的硅藻研究[M]//施之新. 湖南武陵源自然保护区水生生物. 北京:科学出版社,1983:1−80. [12] 朱蕙忠. 陈嘉佑. 中国西藏硅藻[M]. 北京:科学出版社,2000:1−353. [13] 包文美,王全喜,Reimer CW. 长白山地区硅藻的研究[J]. 植物研究,1992,12(2):125−143. Bao WM,Wang QX,Reimer CW. Diatoms from the Changbaishan Monutain area[J]. Bulletin of Botanical Research,1992,12(2):125−143.
[14] 范亚文,包文美,王全喜. 中国黑龙江省异极藻科植物研究[J]. 植物研究,1998,18(2):243−251. Fan YW,Bao WM,Wang QX. Investigation on gomphonemaceae from Heilongjiang province in China[J]. Bulletin of Botanical Research,1998,18(2):243−251.
[15] Li YL,Xie P,Gong ZJ,Shi ZX. Cymbellaceae and Gomphonemataceae (Bacillariophyta) from the Hengduan Mountains region (southwestern China)[J]. Nova Hedwigia,2003,76(3-4):507−536.
[16] 施之新. 中国淡水藻志(第十二卷):硅藻门-异极藻科[M]. 北京:科学出版社,2004:1−147. [17] 刘琪. 四川若尔盖湿地及其附近水域硅藻的分类及生态研究[D]. 杭州:浙江大学,2015:1−364. [18] 王艳璐,尤庆敏,于潘,王全喜. 四川亚丁自然保护区硅藻植物分类研究[J]. 上海师范大学学报(自然科学版),2018,47(5):585−591. Wang YL,You QM,Yu P,Wang QX. A taxonomic study of diatom plants in Yading Nature Reserve of Sichuan[J]. Journal of Shanghai Normal University (Natural Sciences),2018,47(5):585−591.
[19] Reichardt E. Zur Revision der Gattung Gomphonema:die Arten um G. affine/insigne,G. angustatum/micropus,G. acuminatum sowie Gomphonemoide Diatomeen aus dem Oberoligozän in Böhmen[M]//Lange-Bertalot H,ed. Iconographia Diatomologica. Königstein:Koeltz Scientific Books,1999:1−203.
[20] Stancheva R,Sheath RG,Kociolek JP. New freshwater gomphonemoid diatoms from streams in the Sierra Nevada Mountains,California,USA[J]. Phytotaxa,2016,289(2):118−134.
[21] Jahn R,Kusber WH,Skibbe O,Zimmermann J,Van AT, et al. Gomphonella olivacea (Bacillariophyceae) - a new phylogenetic position for a well-known taxon,its typification,new species and combinations[J]. Plant Ecol Evol,2019,152(2):219−247.
[22] Reichardt E. Silikatauswüchse an den inneren Stigmenöffnungen bei Gomphonema-Arten[J]. Diatom Res,2009,24(1):159−173.
[23] Reichardt E. Neue und wenig bekannte Gomphonema-Arten (Bacillariophyceae) mit Areolen in Doppelreihen[J]. Nova Hedwigia,2007,85(1-2):103−137.
[24] Reichardt E. Gomphonema intermedium Hustedt sowie drei neue,ähnliche Arten[J]. Diatom Res,2008,23(1):105−115.
[25] Levkov Z,Mitic-Kopanja D,Reichardt E. The diatom genus gomphonema in the republic of Macedonia[M]//Lange-Bertalot H,ed. Diatoms of Europe. Diatoms of the European Inland Waters and Comparable Habitats. Oberreifenberg:Koeltz Botanical Books,2016:1−552.
[26] Lange-Bertalot H,Metzeltin D. Indicators of oligotrophy-800 taxa representative of three ecologically distinct lake types,carbonate buffered-Oligodystrophic-weakly buffered soft water[M]//Lange-Bertalot H,ed. Iconographia Diatomologica. Königstein:Koeltz Scientific Books,1996:1−390.
[27] Metzeltin D,Lange-Bertalot H. Tropical diatoms of South America Ⅰ:about 700 predominantly rarely known or new taxa representative of the neotropical flora[M]//Lange-Bertalot H,ed. Iconographia Diatomologica. Königstein:Koeltz Scientific Books,1998:3−695.
[28] Metzeltin D,Lange-Bertalot H,Soninkhishig N. Diatoms in mongolia[M]//Lange-Bertalot H,ed. Iconographia Diatomologica. Königstein:Koeltz Scientific Books,2009:3−686.



 下载:
下载: