Temporal and spatial variation of sexual reproduction in a remnant population of the endangered species Myricaria laxiflora (Franch.) P. Y. Zhang et Y. J. Zhang
-
摘要:
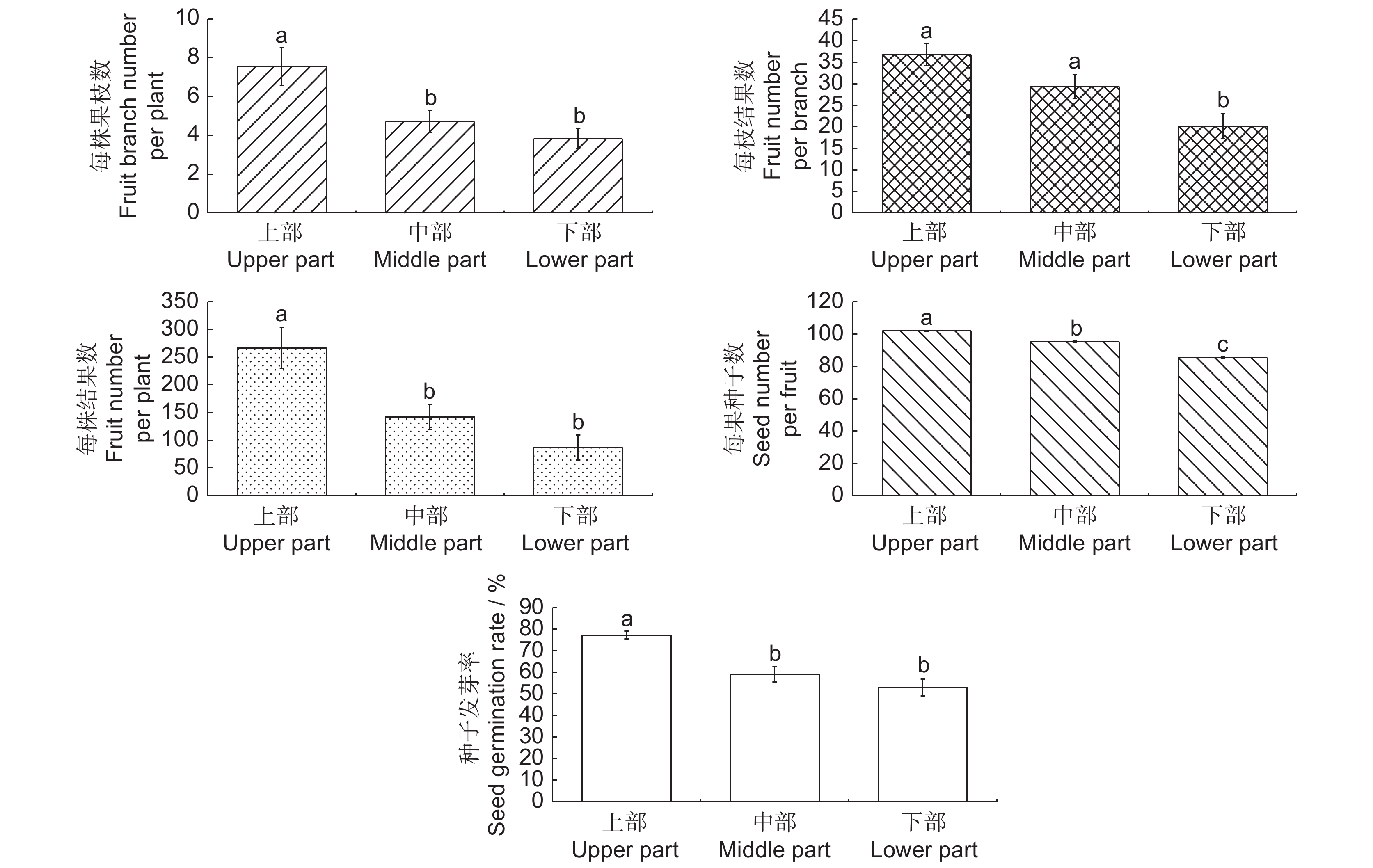
本文以分布于枝江关洲岛的濒危物种疏花水柏枝(Myricaria laxiflora (Franch.) P. Y. Zhang et Y. J. Zhang)为研究对象,调查其种群开花和结果性状沿高程的变化,分析该残存种群有性繁殖的时空变化规律;同时结合三峡大坝-葛洲坝水利水电工程修建所引起生境地水位消涨节律的变化,分析其对残存种群有性繁殖的影响。结果显示,残存疏花水柏枝种群的有性繁殖在不同高程之间存在显著差异。消涨带上部植株的每株花枝数、每枝花朵数、每株花朵数分别比消涨带中部植株高66.09%、50.14%和98.63%,比消涨带下部植株高79.50%、283.33%和461.05%。消涨带上部植株的每株果枝数、每枝结果数、每株结果数、每果种子数和种子发芽率分别比消涨带中部高60.17%、25.26%、88.05%、6.96%和30.69%,比消涨带下部高97.39%、82.45%、208.31%、19.12%和45.91%。相关性分析结果表明,植株的开花结果特性与高程、出露时期、土壤含水量以及温度变化极显著相关。环境因子对有性繁殖的影响强度依次为出露时间>高程>日均温度>土壤含水量。上游水利水电工程对疏花水柏枝残存种群的有性繁殖具有一定的影响。
Abstract:Temporal and spatial variations of sexual reproduction in a remnant population of the endangered species Myricaria laxiflora (Franch.) P. Y. Zhang et Y. J. Zhang were investigated based on changes in flowering and fruiting traits with elevation on Guanzhou Island, Zhijiang, China. The impact of cascade water conservancy and hydropower construction projects on the sexual reproduction of remnant populations was analyzed based on the characteristics of water-level fluctuations in the habitat of M. laxiflora. Results showed significant differences in the sexual reproduction of the remnant population at different elevations. Flower branch number per plant, flower number per branch, and flower number per plant of plants at the upper part of the fluctuation zone were 66.09%, 50.14%, and 98.63% higher than those at the middle part, and 79.50%, 283.33%, and 461.05% higher than those at the lower part, respectively. Fruit branch number per plant, fruit number per branch, fruit number per plant, seed number per fruit, and seed germination percentage of plants at the upper part of the fluctuation zone were 60.17%, 25.26%, 88.05%, 6.96%, and 30.69% higher than those at the middle part, and 97.39%, 82.45%, 208.31%, 19.12%, and 45.91% higher than those at the lower part. Correlation analysis showed significant correlations between the flowering and fruiting characteristics and elevation, plant exposure period, soil water content, and temperature. The influence of environmental factors on sexual reproduction was in the order of exposure time, elevation, daily average temperature, and soil moisture content.
-
正常的雌雄配子育性是植物保证后代繁殖的关键因素。对于农作物而言,雌雄配子育性还决定了作物的结实率和产量[1]。雄性不育既是植物最重要的质量性状之一,也是研究水稻(Oryza sativa L.)、小麦(Triticum aestivum L.)、玉米(Zea mays L.)等重要农作物杂种优势利用的基础。目前在水稻、玉米、小麦等作物中利用“三系杂交”的育种方法将雄性不育应用于育种中,极大提高了作物的产量[1-3]。植物雄性育性调控机制已成为近年来杂种优势利用的热门研究方向。
花药和花粉的正常发育是植物雄性繁殖成功的先决条件。从雄蕊原基的形成到花粉粒成熟,直至花药开裂散粉,花药发育受到一系列精细化生物学过程的调控[4]。雄蕊原基细胞经过数轮细胞地分裂和分化,由外至内形成由表皮层、内皮层、中间层和绒毡层4层体细胞包围着花粉母细胞的花药结构。花粉母细胞位于花药室中间,经过减数分裂形成小孢子。小孢子又经过两次不均等的有丝分裂形成成熟的花粉[5]。
1. 植物花药角质层和花粉壁的主要成分
花药和花粉表面分别被花药角质层和花粉壁覆盖,对环境和生物胁迫具有保护作用。花药角质层主要由角质和蜡质组成,角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质围绕在角质的表面,主要由C16 ~ C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。覆盖在成熟花粉粒表面的花粉壁可保护花粉粒不受外界生物或者非生物胁迫损伤,而且能帮助花粉与柱头识别,促进花粉传播[8]。成熟花粉粒的花粉壁由花粉外壁(Exine)、花粉内壁(Intine)和含油层(Tryphine)3层结构组成。花粉壁是一种成分非常复杂的胞外细胞壁基质。目前的研究表明,花粉外壁外层的主要成分是孢粉素,由饱和长链脂肪酸前体或饱和长脂肪链前体经过复杂的生物聚合组成[8, 9]。花粉内壁的成分与普通的细胞壁类似,主要由纤维素、半纤维素和果胶聚合物组成[10]。花粉包被(Pollen coat)或含油层,主要由复杂的脂质、蜡酯、类黄酮、羟肉桂酰基亚精胺代谢产物和蛋白质组成[10]。
角质、蜡质和孢粉素分别是形成花药角质层和花粉外壁的主要成分。研究表明,它们的脂质前体在花药绒毡层细胞中合成,然后被分别转运到花药表面和小孢子表面沉积。前期科学家们通过正向遗传学的手段,分析花药角质层和花粉壁发育缺陷的突变体,鉴定得到一系列蛋白,包括脂质合成酶基因、脂质转运蛋白、转录因子和ABCG转运蛋白等[8, 10, 11]。随着研究的不断深入,大量ABCG转运蛋白被报道参与植物雄性育性调控,本文将系统阐述ABCG转运蛋白参与植物雄性育性调控的功能与机制。
2. ABC转运蛋白的结构特点与分类
ABC转运蛋白又名ATP(Adenosine triphosphate)结合盒式转运蛋白,属于最大的转运蛋白家族。它们广泛存在于微生物到高等植物甚至人类中[12]。ABC转运蛋白属于多结构域的跨膜蛋白,它通过利用自身ATP结合结构域,在Mg2 + 参与下水解ATP获得能量来转运分子,如异生素、激素、糖、氨基酸和离子等[13, 14]。
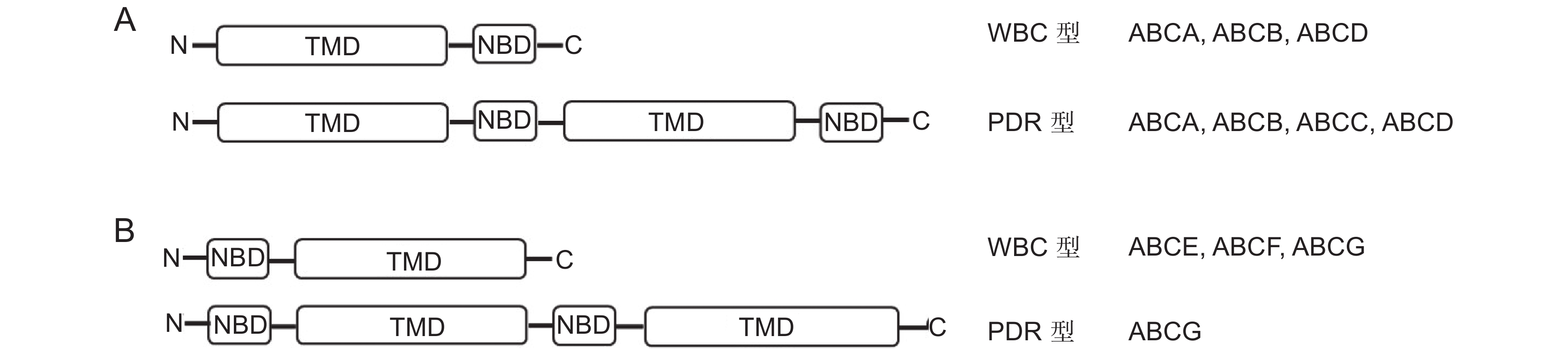
ABC转运蛋白由4个核心结构域组成:两个核苷酸结合结构域(Nucleotide-binding domain,NBD)和两个跨膜结构域(Transmembrane domain,TMD)(图1 :A、B)。根据NBD和TMD的组成可将ABC转运蛋白分为两类,一类是WBC (White/brown complex,WBC)型,其结构包含一个NBD和一个TMD,称为半分子(Half-size)转运蛋白,该类蛋白需要与自身或另外一个半分子转运蛋白结合,形成同源或异源二聚体蛋白发挥转运功能;另一类是PDR(Pleiotropic drug resistance,PDR)型,其结构包含两个NBD和两个TMD,称为全分子(Full-size)转运蛋白,可以单独发挥转运功能[12, 15]。值得一提的是,与其他真核生物ABC转运蛋白不同,植物半分子转运蛋白除了可形成同源二聚体外,还可以与另外的半分子转运蛋白形成异源二聚体[16]。
ABC转运蛋白的NBD和TMD结构域的排布可以是正向(TMD在前,NBD在后,图1:A),也可以是反向(TMD在后,NBD在前,图1:B)。在高等植物中,根据ABC转运蛋白遗传进化特征可分为8个亚族,分别是ABCA(ATP-binding cassette A transporter)至ABCI(ATP-binding cassette Ⅰ transporter),其中ABCH(ATP-binding cassette H transporter)转运蛋白在植物中不存在[17]。ABCA至ABCD(ATP-binding cassette D transporter)亚族蛋白由于TMD位于NBD之前,属于前向转运体[18]。ABCG亚族由于NBD位于TMD之前,属于反向转运体[18, 19]。
植物8个ABC转运蛋白亚族中,ABCG转运蛋白属于最大的一个亚族。在水稻、玉米和拟南芥(Arabidopsis thaliana (L.) Heynh.)中分别含有50、54和43个成员,其蛋白功能复杂多样[20]。其中拟南芥ABCG蛋白亚族包含28个半分子转运蛋白和15个全分子转运蛋白[17, 21]。随着研究的不断深入,ABCG转运蛋白被报道在植物生殖器官发育、激素运输、角质层形成、次生代谢产物分泌和生物或非生物胁迫响应等方面发挥重要作用[15, 22]。其中,ABCG转运蛋白主要是通过调控植物花粉壁的发育和花药角质层的形成来参与植物雄性育性发育过程[23]。
3. ABCG转运蛋白参与调控植物雄性不育的研究现状
3.1 参与调控花粉壁发育
近年来ABCG转运蛋白被多次研究报道参与转运由绒毡层产生的脂类、酚类、其他孢粉素前体物质以及含油层物质用于花粉壁形成[24]。早期研究发现,拟南芥AtABCG26基因与花粉外壁形成过程中多聚酮化合物的运输相关,该基因功能丧失后会导致植物育性显著降低[25-28]。水稻OsABCG15,又称为PDA1(Post-meitotic deficient anther 1),是AtABCG26的同源基因。pda1突变体由于乌氏体及花粉外壁缺失而导致小孢子败育[29, 30]。最近在玉米中首次报道ZmMS2(Zea mays male sterile2)参与调控花药发育,ZmMS2是OsABCG15和AtABCG26的同源基因,该基因突变后导致小孢子外壁发育不正常[31]。值得一提的是,水稻ABCG15基因突变后,突变体除了不能形成有功能的花粉外壁,其花药角质层发育也存在缺陷。但是拟南芥abcg26突变体的花药角质层发育正常。由此可推测水稻ABCG15可能与多个ABCG半分子转运蛋白相互作用,以运输不同的底物用于花粉外壁和花药角质层的形成。另外,Xu等[32]研究发现,拟南芥中一个bHLH转录因子AMS可以直接结合ABCG26基因启动子上的E-boxes,直接调控ABCG26基因的表达,从而影响花粉外壁的发育。但是目前尚未有研究报道水稻OsABCG15和玉米ZmMS2是否受到转录因子的调控。
早期研究报道拟南芥ABCG1和ABCG16基因参与木栓质和花粉壁细胞外屏障形成。abcg1 abcg16双突变体育性下降,花粉粒干瘪[33, 34]。水稻OsABCG3/LSP1(Less and shrunken pollen 1)是拟南芥ABCG1和ABCG16的同源基因,近期研究发现OsABCG3/LSP1可以转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失,最终导致植株完全雄性不育[35, 36]。以上研究成果提示,ABCG转运蛋白在不同物种中参与转运花粉壁发育前体物质的功能具有保守性。
此外,ABCG转运蛋白可同时转运多种底物用于植物生长和生殖发育。最新的研究发现,ABCG1和ABCG16除参与转运木栓质和孢粉素前体物质用于花粉发育外,还可影响拟南芥生殖器官中生长素的信号传导。abcg1abcg16双突变体雌蕊中花粉管生长受阻与生长素分布和生长素流动减少有关,此表型可以通过在雌蕊中添加外源生长素得到部分恢复[37]。值得一提的是,目前绝大部分参与植物雄性生殖器官发育的ABCG转运蛋白均属于半分子转运蛋白,关于ABCG全分子转运蛋白参与花药发育的研究报道极少。Choi等[38]研究发现,拟南芥ABCG半分子转运蛋白AtABCG9和ABCG全分子转运蛋白AtABCG31协同参与花粉壁合成。AtABCG9和AtABCG31在绒毡层中高表达,主要通过将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积,abcg9abcg31双突变体的花粉活力严重下降。
3.2 参与调控花药角质层发育
花药角质层可保护雄配子体免受外界环境影响[39]。角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质主要围绕在角质基质的表面,由C16~C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。
近年来,ABCG转运蛋白被报道参与转运植物角质和蜡质前体从而调控植物发育。Pighin等[40]的研究表明,拟南芥ABCG12/CER5(ECERIFERUM 5)主要从表皮细胞内转运蜡质前体至细胞表面。AtABCG12/CER5基因突变后,突变体茎秆表皮蜡质含量显著降低[40]。拟南芥ABCG11/DSO主要参与转运长链脂肪酸和超长链脂肪酸,该基因突变后,突变体不仅茎秆表面蜡质和角质含量显著性下降,而且突变体花器官脂质沉积和根软木质沉积均下降,突变体植株育性严重受到影响[41, 42]。进一步研究发现,ABCG11自身能形成同源二聚体,也能与ABCG12形成异源二聚体,但是ABCG12不能形成同源二聚体[16]。
与孢粉素前体或脂类物质从绒毡层细胞运输到花药室参与花粉壁的形成相比,绒毡层细胞产生的孢粉素前体或脂类物质如何被运输到花药表面用于花药角质层形成的研究报道较少。水稻ABCG半分子转运蛋白OsABCG26定位于花药表皮、内皮层和Stage 9期的绒毡层中,可将脂质分子从绒毡层转运到花药壁,供角质层发育需要。在osabcg26突变体中可以观察到大量电子致密的脂质颗粒包裹体沿着绒毡层细胞室壁连接至中间层,该现象提示OsABCG26可能主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。OsABCG26突变后会导致转运受阻,从而影响角质层形成,导致花粉败育[23, 43]。与OsABCG26蛋白不同,OsABCG15蛋白只定位于绒毡层内侧,并以极性方式面对花药室,因此被认为主要参与花粉外壁形成过程中脂质前体的分配[23]。由于osabcg26osabcg15双突变体的表型能减轻osabcg15单突变体表型,因此推测水稻OsABCG26和OsABCG15是协同调控雄性生殖发育的[23]。
ABCG转运蛋白作为植物大蛋白家族,通过介导脂质代谢,特别是脂质和酚类物质前体在花药层细胞两侧转运以形成花粉发育最重要的两个保护屏障——花粉壁和花药角质层。目前ABCG半分子转运蛋白参与花药发育的研究大部分只停留在表型上的观察,具体的分子机制尚未明确。Zhu等[44]首次研究报道蒺藜苜蓿(Medicago truncatula Gaertn.)ABCG转运蛋白SGE1(Stigma exsertion1)可通过影响花器官中蜡质和角质等长链脂肪酸的运输导致雌雄蕊隔离,形成柱头外露型雄性不育材料。SGE1蛋白可与另一个半分子转运蛋白MtABCG13相互作用,形成一个有功能的异源二聚体。对ABCG蛋白的功能进行深入研究,将有助于阐明其在植物雄性生殖器官发育中的分子机制。
近期,Fang等[45]首次报道玉米一个雄性不育新基因ZmMS13在花药和花粉发育的前期(Stage 5)、中期(Stage 8b)和后期(Stage 10)具有3个表达峰,分别受转录因子ZmbHLH122、ZmMYB84和ZmMYB33-1/-2调控,从而分别影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成。该研究首次发现ABCG基因多峰值表达受不同转录因子调控,并阐明其具体的分子机理,拓展了植物ABCG转运蛋白的生物学功能。
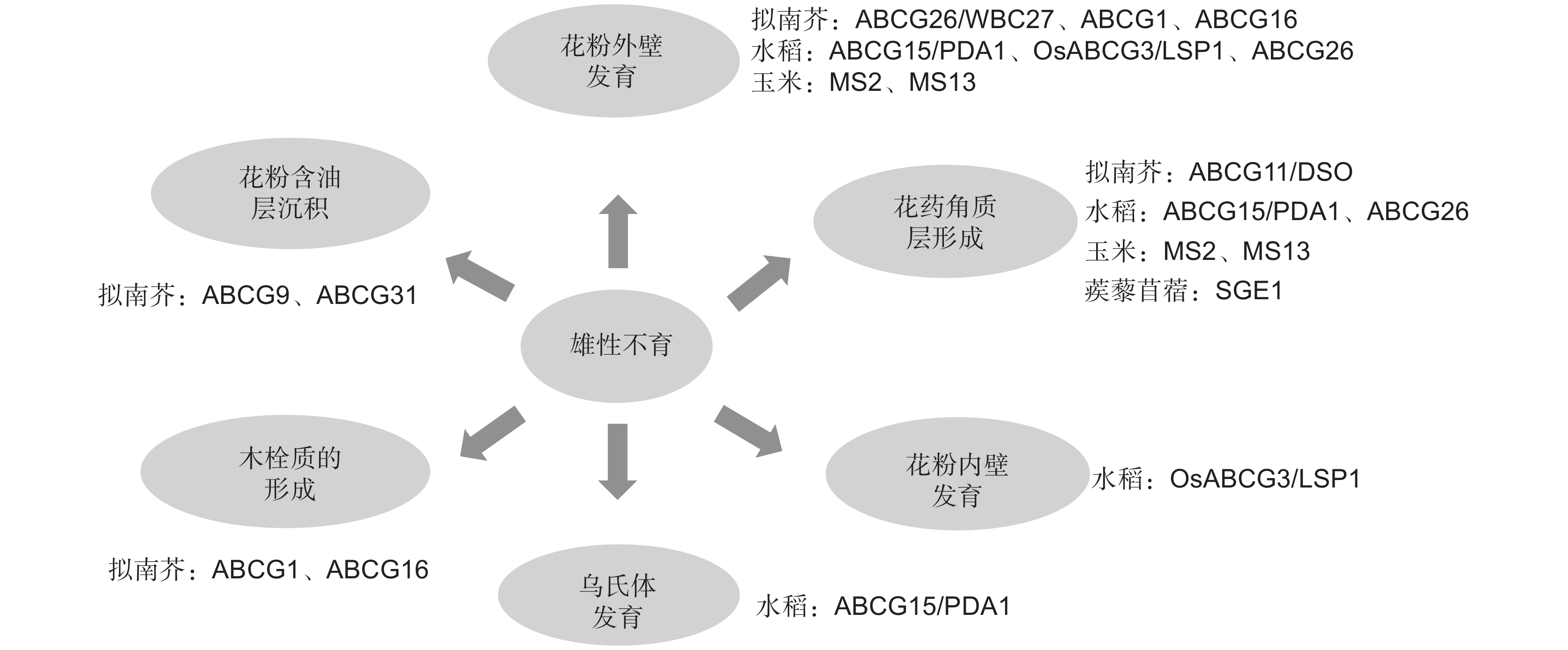
表1汇总了目前在玉米、拟南芥和水稻中报道的ABCG转运蛋白参与植物雄性育性调控的研究进展。
表 1 参与植物雄性育性调控的ABCG转运蛋白Table 1. ABCG transporters involved in regulation of plant male fertility物种
Species基因名称
Gene name转运蛋白类型
Transport protein type具体功能
Functions文献
References拟南芥
Arabidopsis thaliana (L.) Heynh.ABCG26/
WBC27半分子 参与花粉外壁形成过程中多聚酮化合物的运输,该基因突变后,花粉外壁发育异常,植株育性显著下降 [25-28] 水稻Oryza sativa L. ABCG15/
PDA1半分子 参与花药角质层、乌氏体及花粉外壁发育 [29, 30] 玉米Zea mays L. MS2 半分子 参与花粉外壁发育,GC-MS分析结果显示ms2突变体花药角质和蜡质单体显著下降 [31] 拟南芥 ABCG1 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 拟南芥 ABCG16 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 水稻 OsABCG3/
LSP1半分子 参与转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失 [35, 36] 拟南芥 ABCG9 半分子 与ABCG31协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG31 全分子 与ABCG9协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG12/
CER5半分子 参与从表皮细胞内转运蜡质前体至细胞表面 [40] 拟南芥 ABCG11/
DSO半分子 转运长链脂肪酸和超长链脂肪酸 [41, 42] 水稻 ABCG26 半分子 主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。该基因突变后,突变体花粉外壁及花药角质层发育存在缺陷,还可以影响花粉管伸长 [23, 43] 蒺藜苜蓿
Medicago truncatula Gaertn.SGE1 半分子 影响蒺藜苜蓿花器官中蜡质和角质等长链脂肪酸的运输 [44] 玉米 ZmMS13 半分子 影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成 [45] 拟南芥 ABCG28 半分子 将多胺和活性氧定位于正在生长的花粉管尖端 [46] 最新的研究发现,拟南芥AtABCG28在成熟花粉和生长的花粉管中特异表达,该蛋白定位于分泌囊泡膜上。当AtABCG28基因突变后,花粉管生长缺陷,无法将多胺和活性氧定位于正在生长的花粉管尖端,植株表现为完全雄性不育[46]。图2总结和归纳了目前研究中主要的ABCG转运蛋白参与植物雄性育性调控的具体功能。
4. 展望
ABCG作为ABC转运蛋白最大的一个亚族,参与植物发育中各种生理过程。本文首先概述了植物花药角质层和花粉壁的主要成分,其次总结了ABC转运蛋白的结构特点,最后重点阐述ABCG转运蛋白参与调控植物花药和花粉发育的具体功能。随着研究不断深入,ABCG转运蛋白参与植物雄性育性调控的功能不再局限于调控花药角质层和花粉外壁的发育。
虽然ABCG转运蛋白的研究报道较多,但是其具体转运的底物尚未研究清楚。目前对于ABCG转运蛋白功能的研究主要采用反向遗传学的方法,通过气相色谱-质谱联用仪(GC-MS)分析ABCG突变体和野生型的特定部位组织的代谢产物差异,对ABCG转运蛋白的底物或者底物类别做出合理的猜测。目前在拟南芥、水稻、玉米等植物中大部分的ABCG转运蛋白底物均是该方法预测的[23, 38, 45]。此外,根据ABCG转运蛋白的特点,目前最直接有效的ABCG转运底物鉴定方法是通过一个转运实验以严格的ATP依赖的方式证明其跨膜转运活性。该转运实验的先决条件是将ABCG转运蛋白在适当的系统中进行过表达,如烟草(Nicotiana tabacum L.)原生质体系统或者酵母菌株(YMM12和BY-2)细胞系[20]。目前拟南芥ABCG转运蛋白的底物可通过体内同位素标记实验进行检测。例如,通过烟草原生质体系统构建的转运实验鉴定拟南芥ABCG11和ABCG32可以转运10,16-二羟基、C16∶0-2甘油和W-OH C16∶0等角质前体用于植物角质层形成[22]。但是用同位素标记进行实验鉴定ABCG转运蛋白的底物非常耗时,且许多同位素化合物尚未商业化,因此阻碍了该技术的利用。除此之外,基于使用双光子显微镜的研究结果表明,聚酮化合物是拟南芥ABCG26的底物。当AtABCG26基因突变后,突变体在绒毡层细胞中积累了大的荧光液泡,小孢子中的荧光丧失。当AtABCG26基因和编码孢粉素聚酮化合物生物合成代谢基因构建双突变体(atabcg26 acos5(acyl coenzyme A synthetase5)、atabcg26 tkpr1)以及三突变体(atabcg26 pksa(polyketide synthase a) pksb),这些双突变体和三突变体花药绒毡层细胞并未观察到荧光液泡内含物[28]。因此,可以推测AtABCG26将聚酮化合物从绒毡层细胞转运到花粉壁形成孢粉素骨架。
目前ABCG家族蛋白参与植物花药发育的报道集中于对ABCG半分子转运蛋白的研究。ABCG半分子转运蛋白需要通过同源或者异源二聚体的方式形成一个有功能的ABCG转运蛋白。通过寻找与其他ABCG共表达的基因,或者通过酵母筛库,或者质谱等方式鉴定ABCG转运蛋白的潜在伴侣,并研究其分子生物学功能,可拓宽ABCG转运蛋白参与植物雄性育性调控的具体分子机制。由于ABCG转运蛋白在不同植物中具有保守性,因此其同源基因在其他作物中可能也发挥类似的作用,通过反向遗传学的方法,例如利用基因编辑,可加深我们对ABCG转运蛋白在多种植物中的功能机制的了解。而所获得的雄性不育等优良性状的突变系在杂交作物育种和种子生产中具有广泛的应用前景。
-
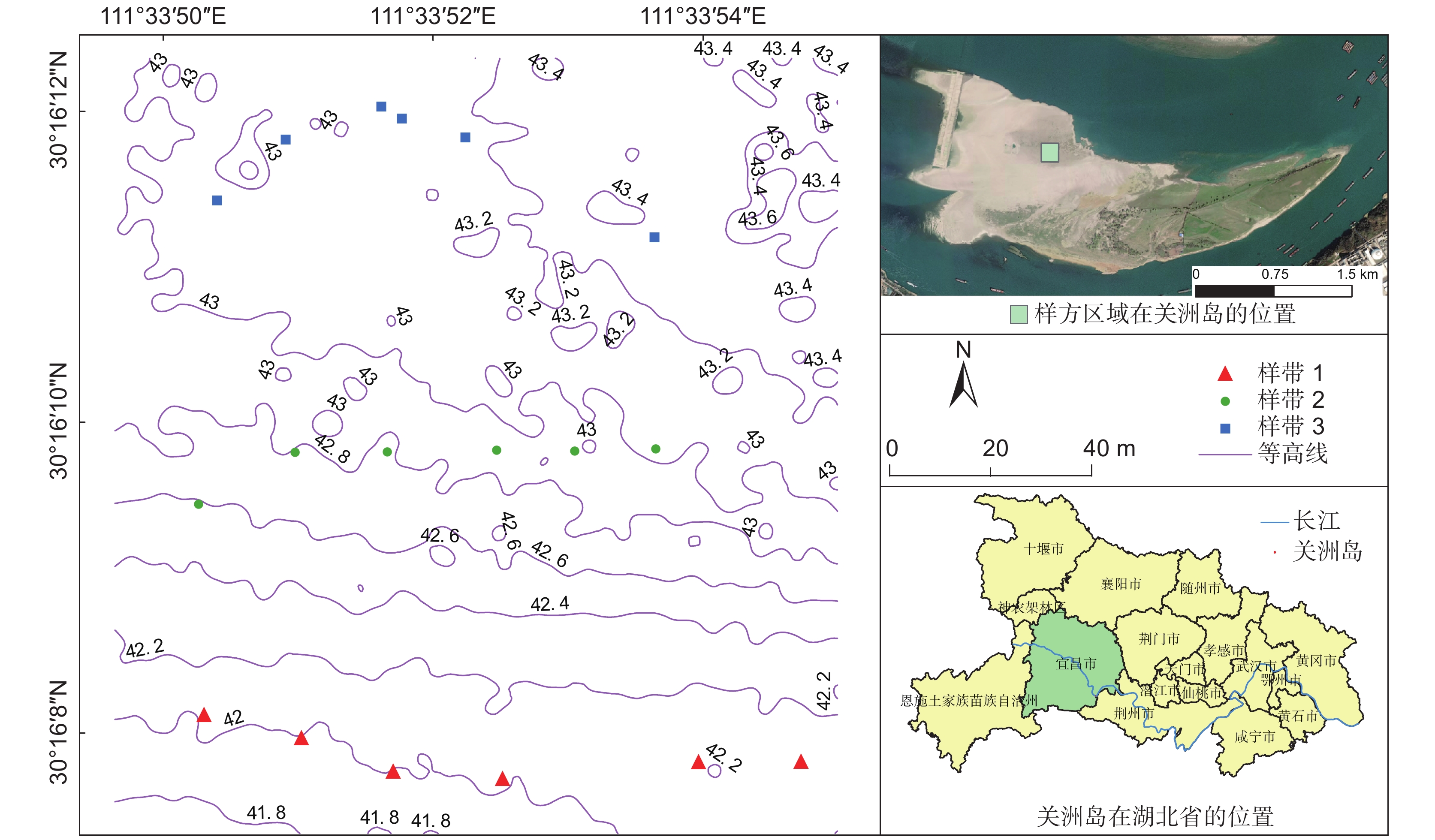
图 1 研究区的地理位置与样带分布
主图为样地高程图,来自于2022年3月27日的无人机遥感影像(其数据为相对于水平面DEM加上水位线高度,DEM数据源自无人机,当天水位线高度源自宜昌市水利和湖泊局官方网站的枝城河道站的监测数据);右上角为生境地鸟瞰图,截取自谷歌地图;右下角为湖北省行政区划图,源自地理空间数据云网站。
Figure 1. Location of study site and distribution of transects
Main elevation data: UAV remote sensing image data from 27 March 2022 (relative to horizontal plane DEM plus height of water mark on the day. DEM data were obtained from a drone, and height of water level on the day was obtained from the Zhicheng River Station monitoring data from the Yichang Water Conservancy and Lake Bureau website). Picture on upper right was taken from Google Maps, and administrative division map of Hubei Province and vector map of the Yangtze River on the lower right were downloaded from the geospatial data cloud website.
图 5 疏花水柏枝残存种群开花结果与环境因子的RDA 排序
FLP:每株开花数;FNP:每株结果数;FNF:每果种子数;SGP:种子萌发率;E:高程;SW:土壤含水量;ET:出露时间;ADT:日均温度。
Figure 5. RDA ordination of flowering and fruiting traits of the Myricaria laxiflora remnant population and environmental factors
FLP: Flower number per plant; FNP: Fruit number per plant; FNF: Seed number per fruit; SGP: Seed germination percentage; E: Elevation; SW: Soil water content; ET: Exposure time; ADT: Average daily temperature.
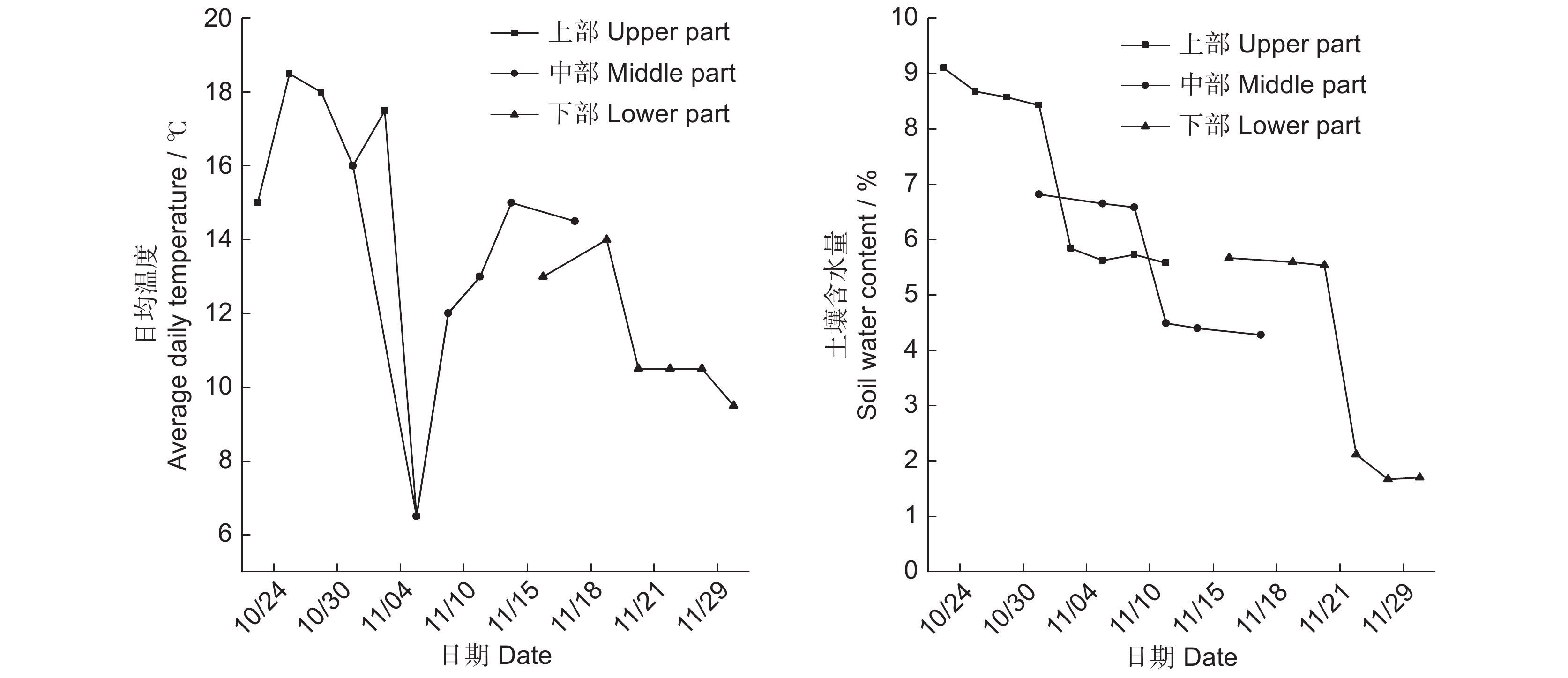
表 1 不同消涨梯度与高程疏花水柏枝植株出露与开花结果时间
Table 1 Exposure, flowering, and fruiting time of Myricaria laxiflora plants at different fluctuation gradients and elevations
消涨梯度
Fluctuation gradient高程
Elevation / m出露日期
Exposure date盛花期
Peak flowering time盛果期
Full fruiting time上部 43.20~43.40 2021-09-10 2021-10-24 2021-11-04 中部 42.40~43.00 2021-09-25 2021-11-03 2021-11-12 下部 41.80~42.20 2021-10-15 2021-11-17 2021-11-28 表 2 疏花水柏枝植株开花结果性状与环境因子的Pearson相关性分析
Table 2 Pearson correlation analysis between flowering and fruiting traits of Myricaria laxiflora and environmental factors
性状
Traits每株开花数
Flower number per plant每株结果数
Fruit number per plant每果种子数
Seed number per fruit种子发芽率
Seed germination percentage高程
Elevation土壤含水量
Soil water content出露时间
Exposure time日均温度
Average daily temperature每株开花数 1 每株结果数 0.564** 1 每果种子数 0.626** 0.535** 1 种子发芽率 0.463** 0.497** 0.547** 1 高程 0.637** 0.540** 0.962** 0.598** 1 土壤含水量 0.607** 0.500** 0.970** 0.551** 0.675** 1 出露时间 0.637** 0.547** 0.910** 0.613** 0.656** 0.981** 1 日均温度 0.358** 0.546** 0.939** 0.609** 0.797** 0.699** 0.656** 1 注:** 表示在0.01 水平(双侧)上显著相关。 Note: ** indicates significant correlation at 0.01 level (bilateral). 表 3 环境因子对疏花水柏枝残存种群开花结果影响的冗余分析
Table 3 RDA of effects of environmental factors on flowering and fruiting traits of the Myricaria laxiflora remnant population
因子
Factor解释率
Explanation贡献率
ContributionF值
Pseudo-FP值
P-value出露时间 44.5% 58.3% 85.1 0.002 高程 27.1% 35.5% 100.0 0.002 日均温度 3.7% 4.9% 15.8 0.002 土壤含水量 1.0% 1.4% 4.5 0.008 -
[1] Nathan R,Muller-Landau HC. Spatial patterns of seed dispersal,their determinants and consequences for recruitment[J]. Trends Ecol Evol,2000,15(7):278−285. doi: 10.1016/S0169-5347(00)01874-7
[2] Luo T,Zhang J,Khan MN,Liu JH,Xu ZH,Hu LY. Temperature variation caused by sowing dates significantly affects floral initiation and floral bud differentiation processes in rapeseed (Brassica napus L.)[J]. Plant Sci,2018,271:40−51. doi: 10.1016/j.plantsci.2018.03.004
[3] Braun P,Winkelmann T. Effect of photoperiod and temperature on flower induction in three Aizoaceae genera[J]. Eur J Hortic Sci,2016,81(4):204−211. doi: 10.17660/eJHS.2016/81.4.3
[4] 龚月桦,高俊凤. 高等植物光合同化物的运输与分配[J]. 西北植物学报,1999,19(3):564−570 Gong YH,Gao JF. Transport and partitioning of photoassimilate in higher plant[J]. Acta Botanica Boreali- Occidentalia Sinica,1999,19(3):564−570.
[5] Steiner BL,Armbruster GFJ,Scheepens JF,Stöcklin J. Distribution of bulbil-and seed-producing plants of Poa alpina (Poaceae) and their growth and reproduction in common gardens suggest adaptation to different elevations[J]. Am J Bot,2012,99(12):2035−2044. doi: 10.3732/ajb.1200213
[6] Park H,Kim JG. Temporal and spatial variations of vegetation in a riparian zone of South Korea[J]. J Ecol Environ,2020,44(1):9. doi: 10.1186/s41610-020-00152-z
[7] 周志琼,包维楷,吴福忠,何晓,吴宁. 岷江干旱河谷黄蔷薇(Rosa hugonis)生长与繁殖特征及其空间差异[J]. 生态学报,2008,28(4):1820−1828 doi: 10.3321/j.issn:1000-0933.2008.04.053 Zhou ZQ,Bao WK,Wu FZ,He X,Wu N. Differences in growth and reproductive characters of Rosa hugonis in the dry valley of the upper Minjiang River,Sichuan[J]. Acta Ecologica Sinica,2008,28(4):1820−1828. doi: 10.3321/j.issn:1000-0933.2008.04.053
[8] Warwick NWM,Brock MA. Plant reproduction in temporary wetlands:the effects of seasonal timing,depth,and duration of flooding[J]. Aquat Bot,2003,77(2):153−167. doi: 10.1016/S0304-3770(03)00102-5
[9] 黄桂云,张海玲,邱利文,李薇,李豪,等. 濒危植物疏花水柏枝残存种群数量及群落特征[J]. 植物科学学报,2023,41(1):26−36 doi: 10.11913/PSJ.2095-0837.22085 Huang GY,Zhang HL,Qiu LW,Li W,Li H,et al. Population and community characteristics of remnant populations of endangered Myricaria laxiflora (Franch. ) P. Y. Zhang et Y. J. Zhang[J]. Plant Science Journal,2023,41(1):26−36. doi: 10.11913/PSJ.2095-0837.22085
[10] 吴金清,赵子恩,金义兴,沈泽昊. 三峡库区特有植物疏花水柏枝的调查研究[J]. 武汉植物学研究,1998,16(2):111−116 Wu JQ,Zhao ZE,Jin YX,Shen ZH. Investigation and study on the endemic plant Myricaria laxiflora in the Three-Gorge Reservoir Area[J]. Journal of Wuhan Botanical Research,1998,16(2):111−116.
[11] 陈芳清,谢宗强,熊高明,刘彦明,杨会英. 三峡濒危植物疏花水柏枝的回归引种和种群重建[J]. 生态学报,2005,25(7):1811−1817 doi: 10.3321/j.issn:1000-0933.2005.07.039 Chen FQ,Xie ZQ,Xiong GM,Liu YM,Yang HY. Reintroduction and population reconstruction of an endangered plant Myricaria laxiflora in the Three Gorges Reservoir Area,China[J]. Acta Ecologica Sinica,2005,25(7):1811−1817. doi: 10.3321/j.issn:1000-0933.2005.07.039
[12] Li LB,Wu D,Zhen QL,Zhang J,Qiu LW,et al. Morphological structures and histochemistry of roots and shoots in Myricaria laxiflora (Tamaricaceae)[J]. Open Life Sci,2021,16(1):455−463. doi: 10.1515/biol-2021-0049
[13] 陈芳清,谢宗强. 三峡库区濒危植物疏花水柏枝的生理生化特性研究[J]. 广西植物,2008,28(3):367−372 doi: 10.3969/j.issn.1000-3142.2008.03.021 Chen FQ,Xie ZQ. Physiological and biochemical characteristics of Myricaria laxiflora,an endangered species in the Three Gorges Reservoir Area[J]. Guihaia,2008,28(3):367−372. doi: 10.3969/j.issn.1000-3142.2008.03.021
[14] Chen FQ,Wang N,Zhou JM,Zhao ZX,Lv K,et al. Summer dormancy of Myricaria laxiflora to escape flooding stress:changes in phytohormones and enzymes induced by environmental factors[J]. Plant Physiol Biochem,2022,193:61−69. doi: 10.1016/j.plaphy.2022.10.020
[15] Zhou JM,Chen FQ,Lv K,Guan SP,Huang YW. Endodormancy induction and photosynthetic physiology of Myricaria laxiflora remnant populations under chronic summer submersion[J]. Flora,2020,271:151682. doi: 10.1016/j.flora.2020.151682
[16] Guo SH,Xiong LH,Zha XN,Zeng L,Cheng L. Impacts of the Three Gorges Dam on the streamflow fluctuations in the downstream region[J]. J Hydrol,2021,598:126480. doi: 10.1016/j.jhydrol.2021.126480
[17] Guan SP,Chen FQ,Zhou JM,Xie ZQ,Huang YW. Spatiotemporal photosynthetic physiology responses of remnant Myricaria laxiflora populations to regulated water level fluctuations[J]. Conserv Physiol,2020,8(1):coaa020. doi: 10.1093/conphys/coaa020
[18] Guan SP,Chen FQ,Zhou JM,Lv K,Huang YW. Temporal and spatial responses of the branch and leaf growth relationship to human water flow regulation:a case study on remnant Myricaria laxiflora populations[J]. J Freshwater Ecol,2020,35(1):255−270. doi: 10.1080/02705060.2020.1781701
[19] 江明喜. 疏花水柏枝保护分析与研究[J]. 中国三峡,2012(9):35−39. [20] Nishizawa M,Ohara M. The role of sexual and vegetative reproduction in the population maintenance of a monocarpic perennial herb,Cardiocrinum cordatum var. glehnii[J]. Plant Spec Biol,2018,33(4):289−304. doi: 10.1111/1442-1984.12223
[21] Lestari DA,Fiqa AP. Environmental factors influence on flowering and fruiting period of selected essential oil plants from Annonaceae[J]. Biodiversitas,2020,21(3):910−921.
[22] Mathieu AS,Périlleux C,Jacquemin G,Renard ME,Lutts S,Quinet M. Impact of vernalization and heat on flowering induction,development and fertility in root chicory (Cichorium intybus L. var. sativum)[J]. J Plant Physiol,2020,254:153272. doi: 10.1016/j.jplph.2020.153272
[23] 宋远丽,栾维江. 水稻开花的光温调控分子机理[J]. 中国水稻科学,2012,26(4):383−392 doi: 10.3969/j.issn.1001-7216.2012.04.001 Song YL,Luan WJ. Regulatory pathways of rice flowering in different light and temperature conditions[J]. Chinese Journal of Rice Science,2012,26(4):383−392. doi: 10.3969/j.issn.1001-7216.2012.04.001
[24] 种康,雍伟东,谭克辉. 高等植物春化作用研究进展[J]. 植物学通报,1999,16(5):481−487 Chong K,Yong WD,Tan KH. Advances on research of vernalization in higher plants[J]. Chinese Bulletin of Botany,1999,16(5):481−487.
[25] 刘浪涛,祖超,鱼欢,邬华松,王灿,等. 光照强度对作物库源关系及成花影响的研究进展[J]. 热带农业科学,2018,38(11):1−6,15 Liu LT,Zu C,Yu H,Wu HS,Wang C,et al. Effect of light intensity on the source-sink adjustment and flower formation of crops[J]. Chinese Journal of Tropical Agriculture,2018,38(11):1−6,15.
[26] 孙敏,谢利娟,康美丽,田自华,李永红. 毛棉杜鹃成花与土壤因子和某些生理特性的相关研究[J]. 安徽农业科学,2009,37(16):7392−7395 doi: 10.3969/j.issn.0517-6611.2009.16.052 Sun M,Xie LJ,Kang ML,Tian ZH,Li YH. Studies on the correlation between flower formation of Rhododendron moulmainense Hook. f. and Soil factors and some physiological charactors[J]. Journal of Anhui Agricultural Sciences,2009,37(16):7392−7395. doi: 10.3969/j.issn.0517-6611.2009.16.052
[27] 陈芳清,谢宗强. 濒危植物疏花水柏枝对模拟夏季水淹的生理生化响应[J]. 热带亚热带植物学报,2009,17(3):249−253 doi: 10.3969/j.issn.1005-3395.2009.03.007 Chen FQ,Xie ZQ. The physiological and biochemical responses of endangered Myricaria laxiflora to simulated summer flooding[J]. Journal of Tropical and Subtropical Botany,2009,17(3):249−253. doi: 10.3969/j.issn.1005-3395.2009.03.007
[28] 陈禹含,罗亦夫,孙鑫晟,魏冠文,黄文军,等. 根部水淹和土壤养分提升对三峡库区消落带水蓼生长和繁殖特性的影响[J]. 植物生态学报,2020,44(11):1184−1194 doi: 10.17521/cjpe.2020.0159 Chen YH,Luo YF,Sun XS,Wei GW,Huang WJ,et al. Effects of waterlogging and increased soil nutrients on growth and reproduction of Polygonum hydropiper in the hydro-fluctuation belt of the Three Gorges Reservoir Region[J]. Chinese Journal of Plant Ecology,2020,44(11):1184−1194. doi: 10.17521/cjpe.2020.0159
[29] Luo FL,Matsubara S,Chen Y,Wei GW,Dong BC,et al. Consecutive submergence and de-submergence both impede growth of a riparian plant during water level fluctuations with different frequencies[J]. Environ Exp Bot,2018,155:641−649. doi: 10.1016/j.envexpbot.2018.08.015
[30] 官守鹏. 疏花水柏枝残存种群更新与植株生长受限机制的生态学研究[D]. 宜昌:三峡大学,2020:1−64. [31] Jian ZJ,Ma FQ,Guo QS,Qin AL,Xiao WF. Long-term responses of riparian plants’ composition to water level fluctuation in China's Three Gorges Reservoir[J]. PLoS One,2018,13(11):e0207689. doi: 10.1371/journal.pone.0207689
[32] 陈芳清,李永,郄光武,许文年. 水蓼对水淹胁迫的耐受能力和形态学响应[J]. 武汉植物学研究,2008,26(2):142−146 Chen FQ,Li Y,Qie GW,Xu WN. The morphological responses and endurance of Polygonum hydropiper to flooding stress[J]. Journal of Wuhan Botanical Research,2008,26(2):142−146.
[33] 类淑桐,曾波,徐少君,任秋芳. 水淹对三峡库区秋华柳抗性生理的影响[J]. 重庆师范大学学报(自然科学版),2009,26(3):30−33 Lei ST,Zeng B,Xu SJ,Ren QF. Effects of submergence on resistance physiology of Salix varegata Franch in Three Gorges Reservoir Region[J]. Journal of Chongqing Normal University (Natural Science),2009,26(3):30−33.
[34] Zhou JM,Chen FQ,Lv K,Wu Y,Huang YW. Summer dormancy in an endangered riparian shrub Myricaria laxiflora:changes in branches,leaves,and nonstructural carbohydrates[J]. Glob Ecol Conserv,2021,31:e01809.
[35] Zhu ZH,Chen ZL,Li L,Shao Y. Response of dominant plant species to periodic flooding in the riparian zone of the Three Gorges Reservoir (TGR),China[J]. Sci Total Envi ron,2020,747:141101. doi: 10.1016/j.scitotenv.2020.141101
[36] Fischer S,Greet J,Walsh CJ,Catford JA. Flood disturbance affects morphology and reproduction of woody riparian plants[J]. Sci Rep,2021,11(1):16477. doi: 10.1038/s41598-021-95543-0
[37] 官守鹏,陈芳清,吕坤,周菊梅,夏萍娟. 疏花水柏枝幼苗生物量与构件对模拟土壤地下水位变化的响应[J]. 植物科学学报,2019,37(4):485−494 doi: 10.11913/PSJ.2095-0837.2019.40485 Guan SP,Chen FQ,Lü K,Zhou JM,Xia PJ. Responses of biomass and components of Myricaria laxiflora seedlings to simulated soil water level changes[J]. Plant Science Journal,2019,37(4):485−494. doi: 10.11913/PSJ.2095-0837.2019.40485
[38] 鲍大川,卢志军,江明喜,徐绍东,姚清,等. 三峡大坝下游残存疏花水柏枝种群结构和动态[J]. 植物科学学报,2010,28(6):711−717 Bao DC,Lu ZJ,Jiang MX,Xu SD,Yao Q,et al. Population structure and dynamics of remanent Myricaria laxiflora downstream from the Three Gorges Dam[J]. Plant Science Journal,2010,28(6):711−717.
[39] 郭怡,孙昭华,罗方冰. 三峡水库蓄水后宜昌枯水位的时变特征及成因[J]. 水利水运工程学报,2017(4):35−42 Guo Y,Sun ZH,Luo FB. Time-variation characteristics and causes of Yichang low-water level since impoundment of Three Gorges Reservoir[J]. Hydro-Science and Enginee ring,2017(4):35−42.



 下载:
下载: