Genetic identification of ‘Changshanhuyou’ (Citrus × aurantium L.) of different ages and propagation types
-
摘要:
本研究以20~100年实生和嫁接的常山柚橙(Citrus × aurantium L. ‘Changshanhuyou’)为材料,进行全基因组背景分析、体细胞变异检测和果实品质评价。结果显示,常山柚橙与药用枳壳基原品种黄皮酸橙(C. aurantium L. ‘Huangpi’)、代代花(C. aurantium L. ‘Daidai’)、朱栾(C. aurantium L. ‘Chuluan’)和塘橙(C. aurantium L. ‘Tangcheng’)聚类在一起,两者与酸橙(C. aurantium L.)的遗传相似度在76.99%~91.06%。随着常山柚橙树龄的增加,其果实品质发生变化,且体细胞变异总数增加。枳(Poncirus trifoliata (L.) Raf.)砧不会改变常山柚橙的果实品质,但其接穗中体细胞变异总数增加,其中变异基因涉及衰老修复和逆境防御过程。综上所述,常山柚橙是酸橙变种,且在常规生产年限内,其果实品质稳定,遗传物质保持不变,但体细胞变异数量逐渐积累。
Abstract:Whole-genome genetic analysis, somatic variation detection, and fruit quality evaluation were performed on different ‘Changshanhuyou’ (Citrus × aurantium L.). specimens. Results showed that Changshanhuyou clustered with the original sour orange cultivars used in Aurantii Fructus production, such as Huangpi (C. aurantium L. ‘Huangpi’), Daidai (C. aurantium L. ‘Daidai’), Chuluan (C. aurantium L. ‘Chuluan’), and Tangcheng (C. aurantium L. ‘Tangcheng’), exhibiting 76.99%–91.06% genetic similarity with sour orange (C. aurantium L.). Fruit quality fluctuated and somatic mutations increased with age of the Changshanhuyou trees. Fruit quality was not influenced by the use of trifoliate orange (Poncirus trifoliata (L.) Raf.) as the rootstock, but higher somatic mutations were detected in the grafted trees. The mutated genes were mainly involved in senescence repair and stress defense. In conclusion, this study confirmed that Changshanhuyou is a domesticated form of sour orange, demonstrating stable fruit quality and genetic material within its optimal production period. This work provides a theoretical basis for the promotion of Changshanhuyou and grafting.
-
Keywords:
- Changshanhuyou /
- Medicinal Citrus /
- Graft /
- Genetic variation /
- Somatic mutation
-
土壤重金属污染是各方关注的严重环境问题之一。根据2014年《全国土壤重金属污染状况调查公报》,我国约有2 000万公顷耕地受到了重金属污染,其中330万公顷的污染程度达到了中度或重度污染。江西是我国矿产资源大省,铜资源在全国具有重要地位,长期的矿业开采、选矿、冶炼等产生的“三废”不断排放到周围环境,造成周边农田土壤铜污染严重,对农产品安全和人类身体健康都造成了极大的威胁[1]。以江西德兴铜矿区为例,周边土壤存在不同程度的铜污染,在919份调查样品中,铜含量位于50~400 mg/kg的有171个,含量大于400 mg/kg有18个,土壤最高铜含量可达1825 mg/kg,远大于中国土壤环境质量标准的三级标准(400 mg/kg)[2, 3],铜污染土壤的治理逐渐成为一个亟待解决的问题。植物修复(Phytoremediation)是一种新兴的土壤重金属净化技术[4],具有成本低廉、修复面积广、操作方便、二次污染易控制,美化植被环境等优点[5]。目前,关于修复植物的筛选多集中在草本植物,但草本生物量小、生长速度慢且很难进行机械收获作业,不适宜开展大面积污染土壤的修复[6],且农作物和草类等所吸收的重金属大多存在进入食物链或二次污染的风险,因此在实际修复应用中受到限制。当前,寻找生物量大、适应性强、观赏价值高且耐重金属的植物十分具有现实意义[7,8]。木本植物对重金属具有较强的耐性和一定的固定、吸收、累积能力,且其发达的深根系可使土壤中重金属移动性降低,降低其迁移和生物毒性,改善土壤质量等,引起研究人员的广泛关注[9]。
樟树(Cinnamomum camphora (L.) Presl)是重要的木本经济树种,樟脑、樟油等提取物是医药、化工、香料、防腐、农药的重要原料。樟树具有根系发达、生长迅速、生物量大、适应性强等优点,对重金属污染环境有较强的适应能力,15种常见乔木中,樟树对重金属的综合富集系数最高,对土壤中铜、锌和镉的富集能力均较强[10],在铜为主要污染源的土壤植物修复中有着较大的应用潜力。因此,樟树具有土壤修复收益型植物潜力。项目组前期将全国范围内收集的9个种源68个家系的樟树实生苗种植在以铜污染为主的江西德兴铜矿周边的水龙山实验修复基地,经过3年的跟踪调查,有12个家系适应性表现良好,成活率和保存率均较高,说明部分樟树具有较好的耐铜性,但樟树对铜离子的生理生化响应及富集转运特性还不清楚。本项目以前期筛选出的耐铜樟树为实验材料,通过盆栽实验研究不同浓度铜处理对樟树生长和生理指标的影响及铜的富集转运特性,探明耐铜樟树抵御铜毒性的生理生化机制,以期为樟树用于铜污染土壤修复提供科学依据。
1. 材料与方法
1.1 实验材料
实验于2021年7月在江西省科学院生物资源研究所人工气候室进行。实验地位于南昌市(28°41'N,115°59'E),实验材料为前期筛选出的耐铜樟树材料。收集同一单株的种子,将种子去果肉并反复搓洗干净,室内沙藏,于第2年春天播种,筛选长势一致的樟树幼苗统一移栽至事先准备好的基质中(红壤土∶细沙∶泥炭=1∶1∶1),栽培盆大小为上口径20 cm,底径14 cm,高14 cm,每盆基质重2.5 kg。经过3个月的缓苗,选取生长较好、高度一致的幼苗,采用随机区组设计,进行铜胁迫处理。
1.2 实验方法
以CuSO4·5H2O 为铜来源,配制铜浓度为100 g/kg的母液,处理前1周各栽培盆开始控水,至处理时各盆中基质均为干燥状态,处理时将各处理浓度所需母液用蒸馏水稀释至550 mL,缓缓浇灌至栽培盆中(经实验前反复验证,550 mL可以保证栽培盆内基质完全浸湿,且托盘里几乎没有多余水分流出),处理浓度分别为:0、50、150、300、600、900、1200 mg/kg(以基质重计算纯铜含量),每个处理4个重复。采样时间为处理60 d,每株选取3~4片嫩叶(枝条顶部开始倒数第 3~4 片叶)为待测材料,以锡箔纸包好,迅速投入液氮罐中,带回实验室放入−80 ℃冰箱保存,用于生理指标的测定;另准确称取0.1 g新鲜叶片,剪碎,放入事先准备好的装有95%乙醇的离心管中,黑暗处理,并放在摇床上震荡处理3 d,至叶片完全透明为止,用于色素含量的测定;最后将各处理单株分地上地下保存,放烘箱105 ℃杀青30 min,再70 ℃烘干至恒重测定干物质量,每株分别准确称取0.2 g根、茎、叶的研磨粉,微波消解,采用ICP-MS测定不同器官中铜含量。
1.3 生理指标测定
生理指标检测均参考施海涛[11]的方法。氯化硝基四氮唑蓝(NBT)光还原法测超氧化物歧化酶(SOD)活性;愈创木酚氧化法测过氧化物酶(POD)活性;高锰酸钾滴定法测过氧化氢酶(CAT)活性;烟酰胺腺嘌呤二核苷酸磷酸还原反应法测谷胱甘肽还原酶(GR)活性;硫代巴比妥酸比色法测丙二醛(MDA)含量;茚三酮比色法间接测定游离脯氨酸(Pro))含量;蒽酮比色法测定可溶性糖含量;考马斯亮蓝法测定可溶性蛋白含量。硫酸钛反应法测定过氧化氢(H2O2)含量,2-硝基苯甲酸反应法测谷胱甘肽(GSH)含量。所用试剂盒均由南京建成生物工程研究所提供,具体操作步骤按照相关说明书进行。
1.4 数据处理
所有指标的测定均进行4次生物学重复,最后结果采用平均值±标准差表示,采用SPSS 25软件作图并进行单因素方差分析(One-way ANOVA)。
2. 结果与分析
2.1 铜胁迫对樟树生长与生物量积累的影响
如图1所示,在铜胁迫浓度小于600 mg/kg时,樟树都可以很好地存活,根系和叶片均没有明显变化。其中150 mg/kg铜处理时,樟树长势最好,茎秆粗壮,叶片颜色墨绿。铜胁迫浓度为900 mg/kg时,叶片没有明显变化,部分根系开始出现褐化,根系的数量开始减少,但处理2个月后有新根萌出,可见900 mg/kg处理时,樟树依然可以存活。当处理浓度为1 200 mg/kg时,部分叶片开始萎蔫,根系褐化严重,且根系数量减少明显,也没有新根长出。因此在1 200 mg/kg铜处理下,樟树生长抑制及损害明显。
生物量干质量的结果与生长观察一致(表1),150 mg/kg处理时可以促进樟树的生长,其地上和根系干质量均高于其他处理,900 mg/kg处理时,地上干质量没有降低,反而高于对照组,但差异不显著(P>0.05);根系干质量稍有降低,差异也不显著(P>0.05)。1 200 mg/kg处理时,樟树的地上和根系干质量均低于其他各处理,且与150 mg/kg处理时差异显著(P<0.05),与其他处理差异不显著(P>0.05)。
表 1 不同浓度铜处理下樟树地上和根系生物量(干质量)的测定Table 1. Determination of aboveground and root biomass (dry mass) of Cinnamomum camphora treated with different concentrations of copper处理
Treatments / mg/kg地上质量
Dry mass of shoot / g根质量
Dry mass of root / g0 7.98±2.87bc 3.81±1.18ab 50 7.85±2.54bc 3.59±0.67ab 150 9.59±3.08a 4.53±1.35a 300 9.18±1.57ab 3.62±0.53ab 600 7.61±1.14bc 3.49±0.50ab 900 8.33±0.91bc 3.11±0.60b 1200 6.82±1.44c 2.97±0.90b 注:数据均为平均值±标准差,小写字母表示不同处理间在P<0.05水平上差异显著(n=4)。下同。 Notes: All data in the table are average values±standard deviation (SD). Lowercase letters after data in the same row indicate significant differences between different treatments at P<0.05 level (n=4). Same below. 2.2 铜胁迫对樟树光合色素含量的影响
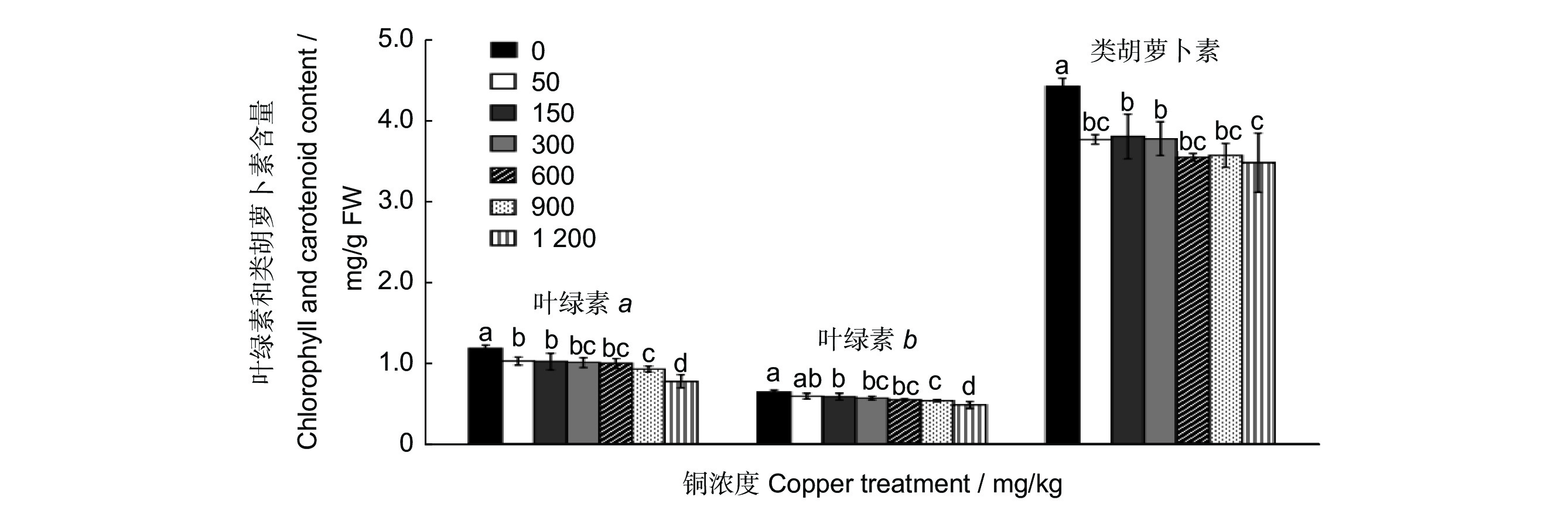
研究结果显示,叶绿素a、b及类胡萝卜素的含量均随着铜浓度的升高而降低。处理浓度为1200 mg/kg时,叶绿素a、b的含量均降至最低,显著低于其他各处理(P<0.05,图2);900 mg/kg处理时,叶绿素a、b的含量与300、600 mg/kg处理的差异均不显著(P>0.05),但与CK、50、150 mg/kg 处理时差异显著(P<0.05)。50、150、300、600 mg/kg 4种处理间的叶绿素a与叶绿素b差异均不显著(P>0.05)。类胡萝卜素含量的变化趋势与叶绿素a、b的变化趋势大致相同,也表现出随处理浓度的升高而降低的趋势,1 200 mg/kg处理时,类胡萝卜素含量最低,但与50、600、900 mg/kg 3个处理的差异不显著(P>0.05),与CK、150、300 mg/kg处理的差异显著(P<0.05)。
![]() 图 2 不同浓度铜处理60 d叶片中叶绿素a、b及类胡萝卜素含量的测定不同小写字母表示处理间在 P<0.05水平差异显著。下同。Figure 2. Determination of chlorophyll a, chlorophyll b, and carotenoid in Cinnamomum camphora leaves treated with different concentrations of copper for 60 dDifferent lowercase letters indicate significant differences between different treatments at P<0.05 level. Same below.
图 2 不同浓度铜处理60 d叶片中叶绿素a、b及类胡萝卜素含量的测定不同小写字母表示处理间在 P<0.05水平差异显著。下同。Figure 2. Determination of chlorophyll a, chlorophyll b, and carotenoid in Cinnamomum camphora leaves treated with different concentrations of copper for 60 dDifferent lowercase letters indicate significant differences between different treatments at P<0.05 level. Same below.2.3 铜胁迫对樟树抗氧化酶系统的影响
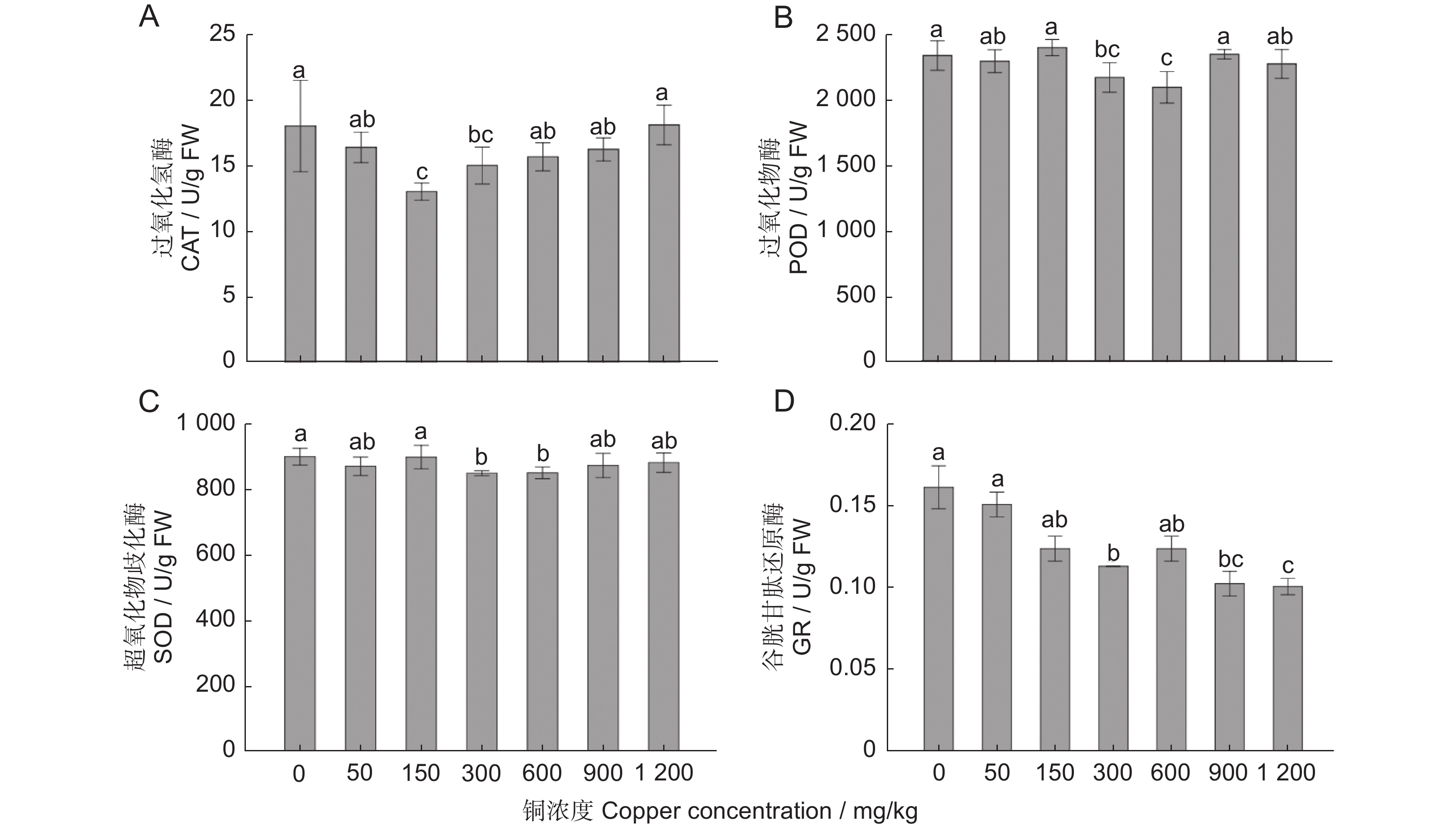
不同铜浓度影响樟树抗氧化酶系统的分析结果表明(图3),CAT活性在150 mg/kg时最低,与CK、50、600、900、1 200 mg/kg处理的差异显著(P<0.05;图3:A), CK和1 200 mg/kg两个处理时CAT活性最高,但与50、600、900 mg/kg处理间的差异不显著(P>0.05)。POD活性在CK、150、900 mg/kg处理时最高,显著高于300和600 mg/kg两个处理,600 mg/kg处理时的POD活性最低(图3:B)。SOD活性最高的是CK和150 mg/kg两个处理,显著高于300、600 mg/kg处理,与其他处理间的差异不显著(图3:C)。谷胱甘肽还原酶(GR)活性有随着处理浓度的升高逐渐降低的趋势,CK和50 mg/kg处理的GR活性最高,1 200 mg/kg处理时,活性最低,与CK、50、150、300、600 mg/kg处理差异显著,但与900 mg/kg处理的差异不显著(图3:D)
2.4 铜胁迫对樟树渗透调节物质含量及抗逆性指标的影响
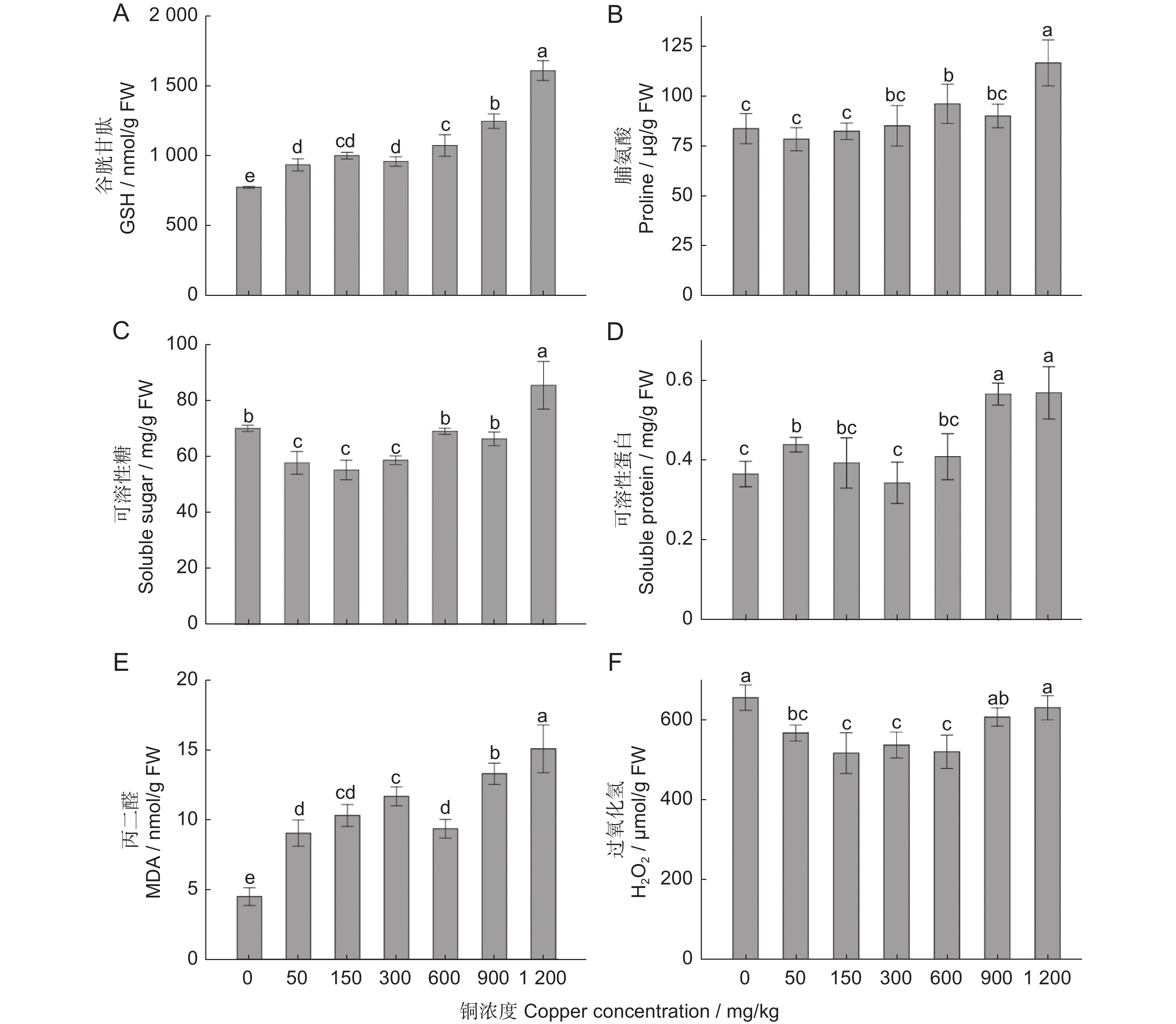
GSH作为植物体内重要的抗氧化剂和自由基清除剂,有随着处理浓度的升高而逐渐升高的趋势(图4:A)。渗透调节物质脯氨酸和可溶性糖含量均在1 200 mg/kg 处理时显著高于其他处理(P<0.05),其他处理间没有显著差异(P>0.05;图4:B、C)。可溶性蛋白在900和1 200 mg/kg 处理时显著高于其他处理,其他处理间差异不显著(图4:D)。随着铜浓度的升高,抗逆性指标MDA表现出逐渐升高的趋势(图4:E);H2O2浓度在CK和1 200 mg/kg两个处理时达到最高水平,显著高于50、150、300、600 mg/kg处理,与900 mg/kg处理的差异不显著(图4:F)。
2.5 铜胁迫对樟树不同组织铜浓度的影响
由表2可知,随着铜浓度的增加,根、茎、叶等不同组织的铜含量也逐渐升高,但与CK相比,处理浓度为50和150 mg/kg时,差异没有达到显著水平(P>0.05)。当处理浓度在300 mg/kg以上时,樟树叶、茎和根的铜含量均显著高于对照,但叶、茎的增幅显著低于根,与对照处理相比,300、600、900、1 200 mg/kg处理的叶片铜含量分别增加了1.73、1.80、1.74和2.12倍,茎部铜含量分别增加了1.42、1.45、1.35和2.02倍,而根部铜含量则分别增加了4.45、3.95、15.72和22.17倍。随着铜浓度的增加,铜离子由根系向叶片的转移率IF(Leaf/Root)由对照处理的0.078逐渐降至1 200 mg/kg处理时的0.007;铜离子由根系向茎的转移率IF(Stem/Root)由对照处理的0.06逐渐降至1 200 mg/kg处理时的0.005。樟树各器官铜含量的大小顺序为根>叶>茎,樟树主要将铜富集在根系,往地上茎和叶的转移率很低,且随着铜浓度的增大,往地上茎和叶的转移率也显著降低。
表 2 不同铜浓度处理下樟树不同部位铜含量及铜转移率的测定Table 2. Effects of different concentrations of copper on copper content and transfer rate in different parts of Cinnamomum camphora处理
Treatments /
mg/kg叶铜含量
Leaf Cu /
mg/kg茎铜含量
Stem Cu /
mg/kg根铜含量
Root Cu /
mg/kg铜转运
(叶/根)
IF (Leaf/Root)铜转运
(茎/根)
IF (Stem/Root)0 1.91±0.13c 1.46±0.29c 24.46±1.34d 0.078±0.005a 0.060±0.011a 50 1.72±0.01c 1.09±0.13c 25.20±1.28d 0.068±0.004b 0.044±0.007b 150 1.96±0.45c 1.40±0.23c 28.80±3.16d 0.067±0.009b 0.049±0.011ab 300 3.32±0.43b 2.08±0.24b 108.95±13.01c 0.031±0.002c 0.019±0.003c 600 3.44±0.37b 2.12±0.41b 96.67±11.71c 0.036±0.008c 0.022±0.006c 900 3.33±0.66b 1.97±0.36b 384.44±34.11b 0.009±0.002d 0.005±0.001d 1 200 4.06±0.53a 2.95±0.01a 542.27±51.01a 0.007±0.001d 0.005±0.001d 3. 讨论
3.1 铜胁迫对樟树生长的影响
樟树是重要的木本经济树种,茎叶是精油提取的主要器官,若能将樟树用于铜污染土壤修复中,不仅能改善生态环境,还可以实现收益,同时具有经济和生态效益。研究发现,樟树对铜污染有较好的适应能力[12, 13],在铜污染土壤的植物修复中应用潜力较大[14, 15]。本研究中,樟树对铜胁迫表现出“低促高抑”的变化趋势,一定浓度的铜(150 mg/kg)促进樟树的生长,其地上和根系生物量均高于其他处理,900 mg/kg处理时,樟树地上干质量没有降低,根系干重稍有降低,当处理浓度为1 200 mg/kg时,樟树的地上和根系干质量均降低。生长状况是反映植物对重金属耐受程度的直观指标[7],过量铜抑制植物生长曾多次被文献报道,例如,当Cu2+浓度高于20 μmol/L时,小白菜(Brassica campestris L. ssp. chinensis Makino)和芥菜(Brassica juncea L. Czern. et Coss.)的根、茎、叶生物量均随着铜浓度的升高而显著降低,铜胁迫抑制了小白菜和芥菜的生长[16, 17];玉米(Zea mays L.)幼苗的铜胁迫处理表明,Cu2+浓度为5 μmol/L时玉米幼苗的生长即受到抑制,随着胁迫浓度的升高,玉米幼苗地上和地下生物量均显著降低[18]。
光合作用是植物获取能量的重要途径,植物的能量含量与光合作用密切相关,叶绿素含量是反映植物耐受逆境胁迫的重要指标之一[19],本研究中叶绿素a、b及类胡萝卜素的含量均有随着铜处理浓度的升高而降低的趋势,与袁霞等[20]、李炎林等[21]的研究结果一致。当铜浓度为900 mg/kg时,叶绿素含量与其他低浓度处理差异均不显著;当铜浓度为1 200 mg/kg时,叶绿素含量则显著低于其他各处理。原因可能是重金属胁迫下,植物叶绿体膜结构受到一定程度的破坏,叶绿体开始降解,且叶绿体内的光合酶合成受抑制,叶片气孔关闭,光合作用强度降低[22],植物的生物量积累减少,生长受到抑制。
3.2 铜胁迫对樟树生理生化反应的影响
铜胁迫导致叶绿素含量降低及生长受抑制的主要原因是细胞内活性氧(ROS)含量不断增加并积累[23, 24]。低浓度的重金属可以激活植物的抗氧化应急系统,诱导 SOD、POD和CAT活性升高,以清除体内的活性氧[25],高浓度的 ROS则破坏细胞膜、核酸和叶绿素等关键成分,造成氧化损伤,影响植物的正常发育[26, 27]。MDA是细胞膜脂过氧化的产物,含量的高低反映了植物细胞膜脂过氧化的程度以及抗逆能力的强弱[25],MDA含量越高,植物细胞膜脂过氧化程度越高,ROS引起的细胞损伤越大[28]。本研究中MDA含量有随着铜处理浓度的升高而升高的趋势,900和1 200 mg/kg两个浓度处理时,MDA的含量显著高于其他各处理,说明高浓度铜胁迫对樟树细胞造成一定程度损伤。
可溶性蛋白、可溶性糖和游离脯氨酸作为植物体内重要的渗透调节物质,其含量的变化也是植物抗逆性强弱的重要反映。可溶性蛋白是植物细胞中含量最丰富的生物大分子之一,是植物结构和功能的重要物质基础,含量越高说明生理生化反应和代谢活动越强[29, 30]。本研究中,可溶性蛋白在铜浓度小于600 mg/kg时含量相对稳定,在900和1 200 mg/kg两个高浓度处理时,蛋白含量显著高于其他各处理,说明900和1 200 mg/kg两个浓度处理时,樟树的生理生化和代谢活动显著增强。游离脯氨酸既是渗透调节剂,又可作为自由基清除体内的重金属,其含量的增加可提高植物细胞液的浓度,维持细胞内外渗透压的平衡,保障细胞膜的结构稳定[31]。可溶性糖在维持细胞膜稳定、细胞扩张、酶活性和植株光合作用等方面起着重要作用[32],植物在逆境中可以通过增加可溶性糖等的含量来调节细胞的渗透压,提高对逆境的适应能力[33]。本研究中游离脯氨酸和可溶性糖的含量均在1 200 mg/kg处理时达到最高水平,显著高于其他各处理,900 mg/kg处理和其他低浓度处理的差异不显著,说明900 mg/kg处理时,细胞的内环境相对稳定。
植物抵抗重金属的能力与体内抗氧化酶系统的活性密切相关。POD、 CAT 与 SOD 协同作用,能够有效清除胁迫产生的活性氧,减少对植物细胞的危害,保证植物的正常生长[34]。过氧化氢是在铜胁迫下产生的活性氧物质,能直接或间接氧化细胞内的核酸、蛋白质等生物大分子,破坏细胞膜结构,从而加速细胞老化和解体,POD通过催化过氧化氢分解成无毒害的水和氧气,使植物体内的自由基保持在较低水平,从而避免对植物造成氧化伤害[35,36]。本研究中,不同铜处理后SOD、POD 和 CAT 酶的活性没有显著升高,过氧化氢的含量也相对稳定,在900 mg/kg处理时,其含量与对照差异不显著,说明该处理浓度没有超出樟树的自身调节能力,樟树可以有效抵抗铜的毒害作用。
3.3 铜胁迫对樟树不同器官铜含量的影响
植物对重金属的富集和转运能力是评价其耐受性的重要指标,与根系吸收及根系向地上部转运能力密切相关[9, 37]。本研究中,樟树主要将铜富集在根系,往地上茎和叶的转移率很低,且随着铜浓度的增加,往地上茎和叶的转移率逐渐降低,减轻了过量铜对樟树地上组织的毒害作用,与朱宇恩等[38]的研究结果一致。研究发现,植物主要通过两种途径抵抗铜的毒害作用:一是减少铜从根向地上部的转移,铜离子进入根系后,更多的集中在根系,从而降低铜对植物地上部的毒性;二是将铜离子集中在对铜毒性不太敏感的组织或部位固定起来,以减少铜在植物细胞中的转移,主要方式有将铜离子结合在细胞壁上或者转移到液泡中[39],或者利用植物体内的螯合剂与铜离子结合,形成对植物毒性较小或无毒的螯合物[40]。GSH为植物螯合剂(PCs)的合成提供合成前体,GR能够还原氧化型谷胱甘肽(GSSG)生成还原型谷胱甘肽(GSH),维持细胞内充足的GSH水平[41]。 本研究中,GSH含量有随着铜浓度的升高而升高的趋势,在900和1 200 mg/kg两个高浓度处理时,显著高于其他各处理;GR活性则在CK和50 mg/kg处理时活性最高,且随着处理浓度的升高逐渐降低,1 200 mg/kg处理时活性最低,推测GR被大量消耗,以合成更多的GSH参与植物螯合剂的合成并螯合过量铜离子。 但目前为止,樟树根系对铜离子的耐受策略及其分子调控机制还不清楚,深入探究樟树根系对铜离子的耐受和转运机制,是我们下一步要重点研究的内容。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。3 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。2 1~3)如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
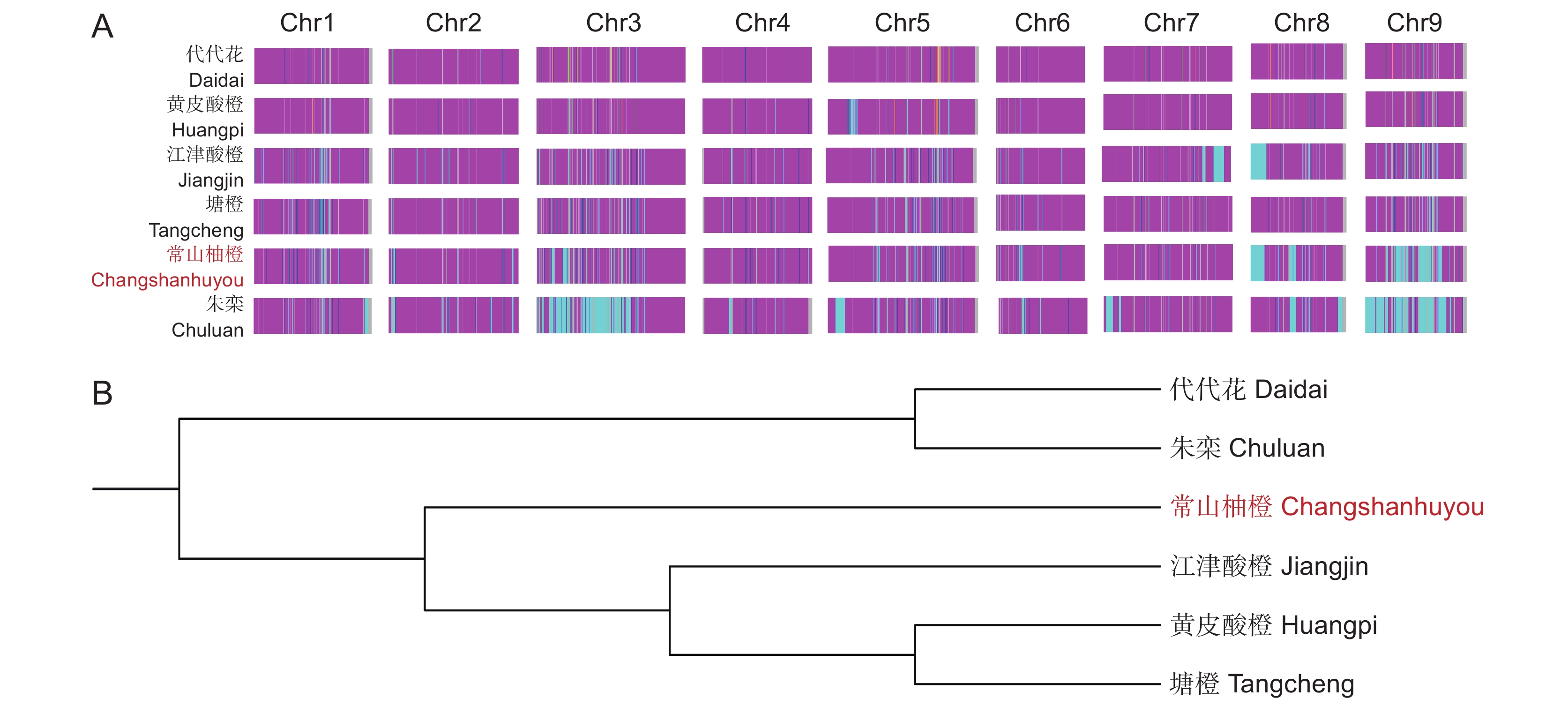
图 2 常山柚橙与枳壳基原品种材料遗传分析
A:常山柚橙与枳壳基原品种全基因组特征比较分析。紫色mp区域为酸橙;青色pp区域为柚;蓝色mm区域为橘。B:常山柚橙与枳壳基原品种的聚类分析。
Figure 2. Genetic analysis between Changshanhuyou and original plant species of Aurantii Fructus
A: Comparative analysis of whole-genome characteristics between Changshanhuyou and original plant species of Aurantii Fructus. Purple mp area represents sour orange. Cyan pp area represents pummelo. Blue mm area represents mandarin. B: Cluster analysis among Changshanhuyou and original plant species of Aurantii Fructus.
图 3 不同树龄不同来源常山柚橙遗传分析
A:不同资源常山柚橙材料的全基因组特征比较分析。紫色mp区域为酸橙;青色pp区域为柚;蓝色mm区域为橘。B:常山柚橙与枳壳基原品种的主成分分析。
Figure 3. Genetic analysis among Changshanhuyou of different ages and sources
A: Comparative analysis of whole genome characteristics of different resources. Purple mp area represents sour orange. Cyan pp area represents pummelo. Blue mm area represents mandarin. B: Principal component analysis of Changshanhuyou and the original plant species of Aurantii Fructus.
图 4 不同树龄不同繁殖方式常山柚橙体细胞变异鉴定
A:实生与嫁接常山柚橙间变异数量比较;B:体细胞变异中单核苷酸突变的类型;C:染色体间体细胞变异的分布。ns:无显著差异。
Figure 4. Identification of somatic mutations in Changshanhuyou with different age and reproduction
A: Comparison of number of mutations between seedlings and graftings; B: Types of single nucleotide variants in somatic mutations; C: Distribution of spontaneous mutations among chromosomes. ns: No significant difference.
表 1 供试柑橘基本信息
Table 1 Information on tested citrus resources
编号
Code柑橘资源
Citrus resource来源地
SourceCS20 常山柚橙实生20年 浙江省衢州市常山县招贤镇招贤村 CS50 常山柚橙实生50年 浙江省衢州市常山县青石镇大塘后村 CS100 常山柚橙实生100年 浙江省衢州市常山县青石镇澄潭村 CJ20-1 常山柚橙嫁接20年 浙江省衢州市常山县东案乡白马村 CJ20-2 常山柚橙嫁接20年 浙江省衢州市常山县球川镇沙安村 CJ32-1 常山柚橙嫁接32年 浙江省衢州市常山县金川街道新都天子公司 CJ32-2 常山柚橙嫁接32年 浙江省衢州市常山县同弓乡金川源村 CJ32-3 常山柚橙嫁接32年 浙江省衢州市常山县球川镇红旗岗 CJ32-4 常山柚橙嫁接32年 浙江省衢州市常山县同弓乡中和村 Tangcheng 塘橙 浙江省金华市兰溪市水亭畲族乡朱带式村 表 2 测序数据质量分析
Table 2 Quality analysis of sequencing data
样品
SampleReads数
Read number碱基总数
Total bases / bpGC含量
GC content / %质量值≥20的碱基
百分比Q20 / %CS20 115 985 378 17 513 792 078 40.02 96.48 CS50 137 623 196 20 781 102 596 39.79 96.75 CS100 144 505 274 21 820 296 374 39.70 96.69 CJ20-1 136 216 168 20 568 641 368 39.65 96.74 CJ20-2 144 962 820 21 889 385 820 39.73 96.49 CJ32-1 136 405 016 20 597 157 416 39.67 96.50 CJ32-2 122 836 900 18 548 371 900 39.48 96.63 CJ32-3 126 206 300 19 057 151 300 39.67 96.79 CJ32-4 120 260 128 18 159 279 328 39.75 96.51 Tangcheng 133 286 964 20 126 331 564 39.37 96.75 注:样品编号同表1。下同。 Note: Sample code is the same as Table 1. Same below. 表 3 不同资源常山柚橙的果实品质
Table 3 Fruit quality of Changshanhuyou from different resources
品质指标
Quality indexCS20 CS50 CS100 CJ20-1 CJ20-2 单果重/ g 325.96±17.68cd 394.04±18.93abc 239.90±11.38e 334.82±24.76cd 285.2±10.66de 果形指数 0.84±0.02a 0.85±0.01a 0.92±0.06a 0.85±0.02a 0.81±0.01a 果皮厚度 / cm 0.52±0.07b 0.60±0.03ab 0.48±0.02b 0.58±0.04b 0.50±0.05b 囊瓣数 10.20±0.37a 10.00±0.32a 10.40±0.24a 10.60±0.51a 10.60±0.51a 种子重 / g 0.00b 0.18±0.18b 0.00b 0.00b 0.00b 果皮重 / g 86.78±6.22bc 110.62±6.40ab 66.24±1.37c 97.64±8.57b 66.64±5.63c 可溶性固形物 / % 11.09±0.19d 11.52±0.17d 13.63±0.25bc 11.46±0.30d 13.94±0.18b 可滴定酸 / % 0.86±0.13c 1.23±0.04ab 1.17±0.06b 1.06±0.07bc 1.51±0.07a 固酸比 14.71±3.19a 9.43±0.33b 11.76±0.62ab 10.98±0.64ab 9.31±0.38b 可食率 / % 62.78±2.34ab 62.33±2.24ab 58.46±1.65b 60.90±2.40ab 68.23±1.60a 品质指标
Quality indexCJ32-1 CJ32-2 CJ32-3 CJ32-4 单果重/ g 356.82±16.27bcd 453.3±41.42a 322.3±19.07cd 432.94±28.16ab 果形指数 0.92±0.06a 0.91±0.03a 0.95±0.06a 0.88±0.02a 果皮厚度 / cm 0.66±0.05ab 0.64±0.05ab 0.62±0.02ab 0.78±0.11a 囊瓣数 9.80±0.20a 10.60±0.40a 10.80±0.37a 11.40±0.75a 种子重 / g 0.70±0.47b 0.96±0.96ab 2.08±1.04ab 3.62±1.76a 果皮重 / g 109.26±10.27ab 136.46±14.23a 100.00±4.09b 136.22±9.72a 可溶性固形物 / % 12.89±0.17c 15.37±0.38a 13.17±0.17bc 12.93±0.22c 可滴定酸 / % 1.48±0.06a 1.51±0.15a 1.20±0.08ab 1.10±0.06bc 固酸比 8.77±0.40b 10.56±0.94ab 11.10±0.61ab 11.89±0.71ab 可食率 / % 61.25±1.07ab 61.10±2.10ab 58.15±1.90b 59.16±2.51b 注:同行不同小写字母表示差异显著(P<0.05)。 Note: Different lowercase letters in the same row indicate significant difference at P<0.05. -
[1] 赵维良,黄琴伟,张文婷,岳超,宋剑锋. 中药材衢枳壳的基源植物研究[J]. 中国现代应用药学,2019,36(13):1652−1655. Zhao WL,Huang QW,Zhang WT,Yue C,Song JF. Research for the original plant of Chinese medicinal materials Qu Aurantii Fructus[J]. Chinese Journal of Modern Applied Pharmacy,2019,36(13):1652−1655.
[2] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2020: 258. [3] Fang CF,He J,Xiao Q,Chen BL,Zhang WT. Development of the volatile fingerprint of Qu Aurantii Fructus by HS-GC-IMS[J]. Molecules,2022,27(14):4537. doi: 10.3390/molecules27144537
[4] 郑成,赵维良,宋剑锋,汪丽霞,张文婷. 衢枳壳作为枳壳药用的论证和研究[J]. 中国现代应用药学,2022,39(16):2096−2102. Zheng C,Zhao WL,Song JF,Wang LX,Zhang WT. Demonstration and study of Qu Aurantii Fructus medicinally used as Aurantii Fructus[J]. Chinese Journal of Modern Applied Pharmacy,2022,39(16):2096−2102.
[5] 毛桑隐,汪丽霞,宋剑锋,刘胜军,王沦,徐强. 基于全基因组信息的常山胡柚遗传鉴定[J]. 果树学报,2023,40(1):25−34. Mao SY,Wang LX,Song JF,Liu SJ,Wang L,Xu Q. Genetic identification of Changshan Huyou based on whole genome information[J]. Journal of Fruit Science,2023,40(1):25−34.
[6] 林大盛,吴少华,陈志红,夏维君,陈子敏,余良富. 温州蜜柑树龄、着果状态与果实品质的关系[J]. 中国柑桔,1989,18(1):30−31. [7] 官雪芳,林碧芬,徐庆贤,钱蕾,林斌. 种植年限对土壤性状、微生物群落及脐橙果实品质的影响[J]. 浙江农业学报,2012,24(1):105−113. Guan XF,Lin BF,Xu QX,Qian L,Lin B. Effect of different planting years on soil nutrient status,microbial community and fruit quality in navel orange orchards[J]. Acta Agriculturae Zhejiangensis,2012,24(1):105−113.
[8] 赖九江,马小焕,钟莉华,彭良志. 赣南纽荷尔脐橙果实品质比较研究[J]. 中国南方果树,2012,41(5):5−7. Lai JJ,Ma XH,Zhong LH,Peng LZ. Comparative study on fruit quality of Newhall navel orange in southern Jiangxi province[J]. South China Fruits,2012,41(5):5−7.
[9] Bassal MA. Growth,yield and fruit quality of ‘Marisol’ clementine grown on four rootstocks in Egypt[J]. Sci Hortic,2009,119(2):132−137. doi: 10.1016/j.scienta.2008.07.020
[10] Georgiou A. Evaluation of rootstocks for ‘Clementine’ mandarin in Cyprus[J]. Sci Hortic,2002,93:29−38. doi: 10.1016/S0304-4238(01)00311-9
[11] Syvertsen JP,Graham JH. Hydraulic conductivity of roots,mineral nutrition,and leaf gas exchange of citrus rootstocks[J]. J Am Soc Hortic Sci,1985,110(6):865−869. doi: 10.21273/JASHS.110.6.865
[12] Castle WS,Krezdorn AH. Soil water use and apparent root efficiencies of citrus trees on four rootstocks[J]. J Am Soc Hortic Sci,1977,102(4):403−406. doi: 10.21273/JASHS.102.4.403
[13] 王蓉,张露瑶,谭丰全,李超超,解凯东,等. 5种砧木对“华农本地早”桔“国庆1号”温州蜜柑营养生长及果实品质的影响[J]. 中国南方果树,2019,48(6):12−16. Wang R,Zhang LY,Tan FQ,Li CC,Xie KD,et al. Effects of five rootstocks on plant growth and fruit quality of ‘Guoqing No. 1’ satsuma and ‘Huanong Bendizao’ tangerine[J]. South China Fruits,2019,48(6):12−16.
[14] 刘要鑫,陈东奎,李果果,仇惠君,欧智涛,等. 不同砧木对沃柑树体及果实品质的影响[J]. 南方农业学报,2019,50(2):338−343. Liu YX,Chen DK,Li GG,Qiu HJ,Ou ZT,et al. Effect of different rootstocks on Orah’s tree body and fruit quality[J]. Journal of Southern Agriculture,2019,50(2):338−343.
[15] Mendel K. Bud mutations in Citrus and their potential commercial value[J]. Proc Int Soc Citriculture,1981,1:86−89.
[16] Wang L,Huang Y,Liu ZA,He JX,Jiang XL,et al. Somatic variations led to the selection of acidic and acidless orange cultivars[J]. Nat Plants,2021,7(7):954−965. doi: 10.1038/s41477-021-00941-x
[17] Stegemann S,Bock R. Exchange of genetic material between cells in plant tissue grafts[J]. Science,2009,324(5927):649−651. doi: 10.1126/science.1170397
[18] Stegemann S,Keuthe M,Greiner S,Bock R. Horizontal transfer of chloroplast genomes between plant species[J]. Proc Natl Acad Sci USA,2012,109(7):2434−2438. doi: 10.1073/pnas.1114076109
[19] Kim M,Canio W,Kessler S,Sinha N. Developmental changes due to long-distance movement of a homeobox fusion transcript in tomato[J]. Science,2001,293(5528):287−289. doi: 10.1126/science.1059805
[20] Banerjee AK,Chatterjee M,Yu YY,Suh SG,Miller WA,Hannapel DJ. Dynamics of a mobile RNA of potato involved in a long-distance signaling pathway[J]. Plant Cell,2006,18(12):3443−3457.
[21] Molnar A,Melnyk CW,Bassett A,Hardcastle TJ,Dunn R,Baulcombe DC. Small silencing RNAs in plants are mobile and direct epigenetic modification in recipient cells[J]. Science,2010,328(5980):872−875. doi: 10.1126/science.1187959
[22] Cao LW,Yu NN,Li JX,Qi ZY,Wang D,Chen LP. Heritability and reversibility of DNA methylation induced by in vitro grafting between Brassica juncea and B. oleracea[J]. Sci Rep,2016,6:27233. doi: 10.1038/srep27233
[23] Li H,Durbin R. Fast and accurate short read alignment with Burrows-Wheeler transform[J]. Bioinformatics,2009,25(14):1754−1760. doi: 10.1093/bioinformatics/btp324
[24] Xu Q,Chen LL,Ruan XA,Chen DJ,Zhu AD,et al. The draft genome of sweet orange (Citrus sinensis)[J]. Nat Genet,2013,45(1):59−66. doi: 10.1038/ng.2472
[25] Mckenna A,Hanna M,Banks E,Sivachenko A,Cibulskis K,et al. The genome analysis toolkit:a MapReduce framework for analyzing next-generation DNA sequencing data[J]. Genome Res,2010,20(9):1297−1303. doi: 10.1101/gr.107524.110
[26] Wang L,He F,Huang Y,He JX,Yang SZ,et al. Genome of wild mandarin and domestication history of mandarin[J]. Mol Plant,2018,11(8):1024−1037. doi: 10.1016/j.molp.2018.06.001
[27] 姜小倩. 群体进化速率的影响因素及有性生殖的保持机制[D]. 杨凌: 西北农林科技大学, 2013: 15. [28] Watson JM,Platzer A,Kazda A,Akimcheva S,Valuchova S,et al. Germline replications and somatic mutation accumulation are independent of vegetative life span in Arabidopsis[J]. Proc Natl Acad Sci USA,2016,113(43):12226−12231. doi: 10.1073/pnas.1609686113
[29] Moore GA. Oranges and lemons:clues to the taxonomy of Citrus from molecular markers[J]. Trends Genet,2001,17(9):536−540. doi: 10.1016/S0168-9525(01)02442-8
[30] Pelsy F,Hocquigny S,Moncada X,Barbeau G,Forget D,et al. An extensive study of the genetic diversity within seven French wine grape variety collections[J]. Theor Appl Genet,2010,120(6):1219−1231. doi: 10.1007/s00122-009-1250-8
[31] Gaut B,Yang L,Takuno S,Eguiarte LE. The patterns and causes of variation in plant nucleotide substitution rates[J]. Annu Rev Ecol Evol Syst,2011,42:245−266. doi: 10.1146/annurev-ecolsys-102710-145119
[32] Ossowski S,Schneeberger K,Lucas-Lledó JI,Warthmann N,Clark RM,et al. The rate and molecular spectrum of spontaneous mutations in Arabidopsis thaliana[J]. Science,2010,327(5961):92−94. doi: 10.1126/science.1180677
[33] Schmid-Siegert E,Sarkar N,Iseli C,Calderon S,Gouhier-Darimont C,et al. Low number of fixed somatic mutations in a long-lived oak tree[J]. Nat Plants,2017,3(12):926−929. doi: 10.1038/s41477-017-0066-9
[34] Fulcher N,Sablowski R. Hypersensitivity to DNA damage in plant stem cell niches[J]. Proc Natl Acad Sci USA,2009,106(49):20984−20988. doi: 10.1073/pnas.0909218106
[35] Guo YF,Ren GD,Zhang KW,Li ZH,Miao Y,Guo HW. Leaf senescence:progression,regulation,and application[J]. Mol Hortic,2021,1:5. doi: 10.1186/s43897-021-00006-9
-
期刊类型引用(1)
1. 龙桂根,黄芝云,吴南生,冯胜,冯超,丁菲,金松松,何利人,王勇,陈玲. 南酸枣种质资源果实性状变异和综合评价. 热带亚热带植物学报. 2024(06): 781-790 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: