Above-ground removal of plant functional groups on soil nematode communities in alpine meadows on the Qinghai-Tibet Plateau
-
摘要:
土壤线虫对高寒草甸生态系统功能有重要的指示作用,植物功能群丧失对土壤线虫群落的影响尚不清楚。本研究在青藏高原东部的高寒草甸生态系统中设置对照、保留豆科、保留禾状草、保留非豆科杂类草和去除所有植物功能群5个处理的地上部植物功能群去除实验,以探究植物功能群损失对土壤线虫群落的影响。结果显示:(1)去除植物功能群地上部对植物根系生物量和土壤线虫总密度影响不显著。(2)去除植物功能群地上部对线虫不同营养类群相对丰度影响显著。保留豆科处理下,食细菌线虫相对丰度整体最高,而植物寄生线虫相对丰度最低;保留杂类草处理下,植物寄生线虫相对丰度整体最高,而食细菌线虫相对丰度最低。(3)非度量多维尺度分析(NMDS)结果表明,去除不同植物功能群会导致土壤线虫类群产生差异,对土壤线虫群落结构产生显著影响。
Abstract:Soil nematodes play an important role in indicating the structure and function of alpine meadow ecosystems, yet the impact of plant functional group loss on soil nematode communities remains unclear. In this study, five treatments involving the removal of above-ground plant functional groups were established in an alpine meadow ecosystem of the eastern Qinghai-Tibet Plateau, including a control (CK), graminoids, legumes, forbs, and remove all. The aim was to explore the impact of plant functional group loss on soil nematode communities. Results showed that: (1) Above-ground removal of plant functional groups had no significant effect on plant root biomass and soil nematode total density. (2) Above-ground removal of plant functional groups had a significant effect on the relative abundance of nematode trophic taxa. Under legume treatment, the relative abundance of bacterial feeder nematodes was the highest, while that of plant parasite nematodes was the lowest; under forbs treatment, the relative abundance of plant parasite nematodes was the highest, while that of bacterial feeder nematodes was the lowest. (3) Nonmetric multidimensional-scaling analysis (NMDS) showed that the removal of different plant functional groups led to differences in soil nematode taxa, with significant impact on soil nematode community structure.
-
当今世界煤炭、石油、天然气等不可再生资源的过度消耗,使我们面临着能源短缺问题,另一方面,石油、天然气等资源消耗过程中产生的CO2等气体,又造成了环境污染和温室效应等问题[1]。人类社会的可持续性发展,必须寻求可再生的清洁能源,开发能源作物是解决能源问题和环境问题的有效途径之一。第一代能源作物是以玉米(Zea mays L.)、高粱(Sorghum bicolor (L.) Moench)、甘蔗(Saccharum officinarum L.)、大豆(Glycine max (L.) Merr.)、油菜(Brassica campestris L.)等为代表的粮食作物或经济作物,目前成熟的工业化利用主要是生产生物燃料。然而,这些作物大多为一年生,需要年年耕种,投入成本高且挤占了本已有限的耕地,带来了与人争粮,与粮食争地的负面效应。因此,第一代能源作物用于工业化生产受到极大限制。鉴于此,以芒属(Miscanthus)、柳枝稷(Panicum virgatum L.)、杨(Populus)、柳(Salix babylonica L.)等为代表的第二代能源作物应运而生[2, 3]。其中,芒属植物(俗称芒草)具有生物量高,生态适应性强,多年生等优点,可用于与煤混合燃烧发电、发酵制造乙醇和环境修复等,在生物能源领域受到广泛关注[4-6]。自20世纪70年代起,芒属资源开始作为能源作物出现在人们视野,其中芒(M. sinensis Anderss.)与荻(M. sacchariflorus (Maxim.) Hack.)的不育杂种奇岗(M. × giganteus)成为欧美国家主推的能源作物[6, 7]。
芒属作为能源植物具有以下一些优良的特性。首先,芒草是C4植物,生物量大,具有很强的光捕获能力和转化效率[8]。据报道,奇岗的高度可达7 m,在欧洲干物质年产量可达44 t/hm2[9]。在我国,芒和南荻(M. lutarioriparius L. Liou ex S. L. Chen & Renvoize)的干物质年产量也可分别达到15.1 t/hm2和22.8 t/hm2 [10]。其次,芒草为多年生草本,一次种植可持续收获至少20年,大大减少了播种所带来的人力物力消耗。与其他能源植物相比,在土地使用、种植、灌溉、施肥以及杂草和病虫害管理上成本较低[6, 7]。再者,芒草有耐寒、耐旱、耐贫瘠、耐盐碱和耐污染的优良品质。例如,奇岗在低温下光合效率比玉米高80%[11],对铝、铬和锌等重金属有极强的耐受力[12, 13]。此外,芒草比一般的植物能更多地吸收CO2放出O2,具有降低温室效应的作用[14],其发达的根系能够截流雨水、涵养水源、防止表土流失和滑坡,具有很高的水土保持价值[15]。简言之,芒草既可用于生物能源、造纸等产业,也是园林观赏、生态恢复的优质原材料,具有重要的开发利用前景[6, 14, 16]。
中国是芒属植物的多样性中心,该属约14个种,其中7个分布在中国,包括生物量最高的中国特有种—南荻,为我们研究开发芒属植物提供了丰富的天然种质资源[17]。考虑到中国有约1亿hm2的边际土地,大约769.37 × 104 hm2适合芒属植物生长,如果在这些边际土地上种植芒草,以干物质产量18.1 ~ 44.2 t/hm2计算,总产量为每年13 521.7 × 104 t,其发电量为每年183.9 TW,减少CO2排放量为21 242.4 × 104 t[14,18]。因此,中国具有开发利用芒属植物资源的有利条件和广阔前景。
尽管如此,迄今对芒属植物资源的利用仍十分不充分,欧美广泛耕种的奇岗为不育杂种,基因型单一、抗逆性差,大规模推广存在一定风险;其两个亲本(芒和荻)丰富的野生资源并未得到充分开发利用;而芒属其他野生种资源更未得到有效的发掘和利用[19]。虽然其基本生物学特性、野生资源调查和收集以及人工栽培和管理等已开展了不少研究,取得了一定的成绩[10, 11, 16, 17, 20],但迄今人们对芒草基本的生物学特性、物种分类及种间关系、群体遗传学特点和适应性机制仍缺乏清楚的认识,这些无疑阻碍了芒草资源的充分利用和为打造能源作物而开展的分子辅助育种工作。本文介绍了芒草的分类学现状、遗传多样性和群体遗传结构特点、资源研究和开发等方面的基本情况,总结了前人取得的研究成果以及存在的问题,以期对未来芒属植物的研究及资源的开发利用有所裨益。
1. 芒属植物的分类和地理分布
芒属隶属于禾本科黍亚科须芒草族甘蔗亚族,由Andersson[21]于1855年建立,含5种,主要区别特征是花序上小花两性,小穗成对着生,且具小穗柄。随着类群研究的不断深入,芒属类群的数目也不断增加,但同时不同的分类学观点也导致芒属的界定及其范围以及物种数目出现争议、甚至混乱。Pilger[22]将芒属非洲分布的4个种处理为属下的一个组sect. Miscanthidium,而Clayton[23]和Hartley[24]则分别支持它们应独立成属Miscanthidium或属下的组。孙必兴和王松[25]描述了红山茅属(Rubimons),认为该属花序紧缩呈圆锥花序,无基盘毛,同芒属植物有别。但是Chen和Renvoize[26]以及Sun等[27]却将该属放在芒属中,包括2种。刘亮[28]将喜马拉雅和我国西南山区分布、仅具2个花药的10个种独立为双药芒属(Diandranthus(Keng)L. Liu)。但随后的细胞和分子系统学研究表明双药芒属染色体基数为10,和黄金茅属(Eulalia)与高粱属(Sorghum)的关系更近,如Hodkinson等[29]认为,喜马拉雅南部地区的特有种M. fuscus(Roxb.)Benth.(=Sclerostachya fusca(Roxb.)A. Camus)与非洲分布的芒属物种和甘蔗属(Saccharum)的部分物种有较近的亲缘关系。由此可见,早期定义的芒属是禾本科中一个类群间性状多有交叉、比较庞杂的属,即广义芒属(Miscanthus s.l.),依不同学者的观点包含约13 ~ 24个种,分布于亚洲、太平洋群岛及热带非洲[23, 30]。芒属主要的分类系统见表1。
表 1 芒属主要分类系统Table 1. Main classifications proposed for the genus Miscanthus刘亮[28]
Liu[28]Chen 和 Renvoize[26]
Chen and Renvoize[26]Sun等[27]
Sun et al.[27]荻属
Triarrhena2种8变种8变型 荻组
Sect. Triarrhena2种 芒亚属
Subgenus
Miscanthus荻组
Sect. Triarrhena1种 2亚种 芒属
Miscanthus6种 芒组
Sect. Miscanthus2种 芒组
Sect. Miscanthus2种 2变种 双药芒属
Diandranthus10种 朝日芒组
Sect. Kariyasua3种 平截颖亚属
Subgenus Diandranthus3种2变种 双药芒组
Sect. Diandra5种 Hodkinson等[29]利用2个叶绿体片段与核基因ITS对芒属、甘蔗属及近缘属进行系统发生分析,认为东亚和东南亚分布的芒属类群形成一单系分支,染色体基数均为x=19,是相对自然的类群,并将其定义为狭义芒属(Miscanthus s.s.)。随着分类学研究的不断深入,尤其是分子证据的广泛应用,大量证据表明广义芒属并未构成单系群,而是包括了Hodkinson等[29]定义的狭义芒属、双药芒属、红山茅属、Sclerostachya、Miscanthidium等不同属的物种,而且这些属的界定和关系也存在很多争议[7, 31]。
根据Hodkinson等[7]的总结,狭义芒属大致包括11 ~ 12个种,主要分布在亚洲和部分太平洋岛国。尽管狭义芒属的范畴基本清楚,但也存在物种界定不明确的问题。例如,刘亮[28]曾发表了金县芒 M. jinxianensis L. Liu,而Sun等[27]不承认该种。Andersson[21]从芒中分出紫芒M. purpurascens Andersson,并得到刘亮[28]的认可,但Nakai[32]和Flora of China [26]分别将其处理为芒的变型和异名。Honda[33]发表M. flavidus Honda,但在Flora of China中该种被处理为芒的异名[26]。尽管Sun等[27]将南荻处理为荻的亚种,但刘亮[28]却在南荻种下建立了8变种8变型。
造成芒属分类上有如此诸多争议的主要原因在于:(1)形态分类划分标准的不统一;(2)对自然杂交和多倍体类群研究不足;(3)缺乏利用可靠分子标记进行的系统发生研究;(4)缺乏基于群体水平变异式样的深入研究,存在较多的同物异名(Synonymy)。因此,针对表型性状群体变异式样的研究有助于清楚地界定芒草类群,而在全面取样的基础上,利用更高分辨率的分子标记重建芒属植物的系统发生关系是解决上述问题的关键。为此,马洪峥[31]选取广义芒属及近缘类群16个物种,利用14个叶绿体片段重建了该类植物的系统发育关系,认为广义芒属可以划分为3大支系,建议将双药芒支系和红山茅支系移出芒属,分别恢复为独立的属,其余东亚和东南亚分布为主的类群构成狭义芒属的成员。随后,Li等[17]选用24个SSR标记,对采自覆盖中国全境100个居群的芒属植物开展了较为全面的群体遗传学和进化历史研究。这些最新的研究进展表明以东亚和东南亚分布为主的芒属植物构成一个单系,包括中国有分布的4个种:芒、五节芒(M. floridulus (Labil.) Warb. ex K. Schum. & Lauterb.)、荻和南荻;另3种为特有种,仅分布于日本(少序芒M. oligostachyus Stapf.、短毛荻M. tinctorius (Steud.) Hack.)和韩国(M. longiberbis Nakai)。这些结果与Hodkinson等[29]对狭义芒属的界定一致。因此,笔者支持Hodkinson等[29]的界定,中国含2组4种:芒组(Sect. Miscanthus)含芒和五节芒,荻组(Sect. Trarrihena)含荻和南荻。下文涉及芒属的相关论述均按狭义芒属的范畴展开。
芒属物种分布于亚洲的东部、东南亚地区和太平洋群岛,其中芒、五节芒和荻分布较为广泛。芒主要分布于中国除青藏地区、西北地区西部以外的所有地区、朝鲜半岛和日本、印度尼西亚和太平洋群岛等东南亚地区,在海拔2 500 m以下的山地、丘陵和荒坡原野常形成优势群落;五节芒分布于中国南部和东南部以及东南亚,主要生长在海拔2 400 m以下的山坡上;荻分布在长江流域以北地区以及朝鲜半岛、日本和俄罗斯远东,主要生长于海拔4 100 m以下的山坡和路边、草地、平原和河岸湿地[27]。南荻是中国的特有种,常见于洞庭湖为中心的湖南、湖北一带,多生长在海拔50 m以下的岸边湿地[34]。其他几个物种是否成立以及种间关系还不是很清楚或存在争议,包括少序芒、短毛荻和中间型芒(M. intermedius (Honda)),均为日本特有种;M. changii是朝鲜半岛特有种[7, 31]。
2. 开花物候和交配系统
芒属植物花期变异较大,同一物种的开花时间也会由于纬度和气候条件而存在差异[35-38]。例如,在日本本州岛北纬32° ~ 40°分布的芒其抽穗期差异有3个月之多[35]。荻在江汉平原9月中旬至10月中旬已经开花结实[36],但在山东微山9月才开始抽穗[37]。安徽合肥地区五节芒抽穗期为每年的5-6月,开花时间为6月下旬[38]。自然条件下芒属植物的花期差异在同质园中仍旧能够体现。Jenson等[39]将在中国东北部、韩国和日本采集的芒、荻和M. × giganteus在英国阿伯里斯特威斯附近进行同地栽培试验,连续3年的统计结果显示芒的开花时间从6月中旬一直延续到11月下旬,荻的开花时间比芒晚1个月左右。将整个中国范围内采集的芒、荻和南荻群体分别种植在湖北江夏和甘肃庆阳,结果表明纬度更低的湖北江夏种植区内芒的花期为6-11月,荻比芒开花时间晚半月,南荻花期较短,为9月中旬到10月中旬;而纬度更高的甘肃庆阳种植区内,芒、荻和南荻的花期比湖北江夏晚1~2个月[40]。由于以上各项研究实验地点的气候土壤条件不同,且开花时间的判定标准不统一,所以很难得出具体统一的结果。但是现有观测和大田试验结果表明,五节芒的花期最早,一般在5-6月;芒由于地理分布范围最广,因此花期跨度最大,为6-11月;荻比芒晚了半月到1个月;南荻花期很短,大约在8月中旬-10月(表2)。自然条件和同质园实验中芒属植物表现出相似的花期差异,说明这种花期差异具有一定的遗传基础。由于花期隔离会限制物种间的基因交流,推测花期隔离有可能是芒属种间生殖隔离的重要方式。
表 2 芒属物种的开花时间Table 2. Flowering time of Miscanthus species物种
Species野外观测点或取样点
Observation or sampling
station in the wild同质园观测点
Observation station in
common garden花期
Flowering time荻 M. sacchariflorus 中国江汉平原 9月中旬-10月中旬花果期[36] 荻 山东微山县 9月抽穗[37] 五节芒 M. floridulus 安徽合肥 5-6月抽穗,6月下旬开花[38] 芒 M. sinensis 中国东北部、韩国、日本 英国阿伯里斯特威斯 6月中旬-11月下旬抽穗[39] 荻 中国东北部、韩国、日本 英国阿伯里斯特威斯 7月中旬-11月下旬抽穗[39] 芒 中国 湖北江夏 6月初-9月初抽穗[40] 荻 中国 湖北江夏 6月下旬-9月初抽穗[40] 南荻 M. lutarioriparius 中国 湖北江夏 8月中旬-9月初抽穗[40] 芒 中国 甘肃庆阳 7月中旬-10月下旬抽穗[40] 荻 中国 甘肃庆阳 7月中旬-10月下旬抽穗[40] 南荻 中国 甘肃庆阳 9月下旬-10月上旬抽穗[40] 芒属植物自交率极低,自交不亲和。Hirayoshi等[41]最早对日本的芒M. sinensis var. condensatus 和M. tinctorius进行了自交实验,发现自交的植株结实率很低(0 ~ 6.2%),而异交的植株结实率较高(18.25% ~ 61.82%)。对欧洲地区芒13个个体、荻1个个体、M. × giganteus 2个个体进行套袋自交实验,3个种的自交结实率分别为0、0.01和0,而异交结实率为42.2% ~ 57.5%,该研究同时对10个芒个体进行自交和杂交实验,套袋的自交植株中,花期早的植株结实率为0.07%,花期处在中间的植株结实率为0.03%,花期晚的植株结实率为0.08%;配对的异交植株中,3种时期的植株结实率分别为42.2%、45.1%和45.8%;而自由交配的植株中分别为57.5%、50.0%和52.1%[42]。可见芒属植物的自交不亲和不是绝对的,一些基因型在特殊的条件下自交可以产生极少的种子,自由交配比配对杂交的植株结实率高。Jiang等[43]再次证实芒的自交不亲和性,并发现大多数自花花粉的花粉管较短,只能到达雌蕊的柱头表面,仅有少部分能进入花粉管通道。而雌蕊的发育阶段会影响花粉和雌蕊的相互作用,雌蕊越不成熟,花粉管越能接近胚珠。
3. 细胞学、多倍化和杂交
芒属植物细胞学研究开展较早,五节芒、奇岗、中间型芒、少序芒、荻、芒和短毛荻的染色体基数为19[7]。有研究推测,芒属x=19的染色体基数起源于x=10和x=9的亲本,近年来图谱的研究发现芒属基因组与高粱属的基因组高度相似,且经历过基因组重复事件[44, 45]。Tang等[46]利用PI和DAPI组合(CPD)染色和45S rDNA探针荧光原位杂交对芒、五节芒、荻和南荻的中期染色体进行了分析,结果显示4个种核型皆为2n= 2x=38=34m(2SAT) + 4sm。流式细胞仪被广泛用于基因组大小的测定,不同研究中芒属类群DNA的含量略有差异,但基本趋势是芒DNA含量最大,为(5.27 ± 0.2) pg/2C,其次是五节芒(5.17 ± 0.3) pg/2C、南荻(4.26 ± 0.6) pg/2C、荻(3.96 ± 0.2) pg/2C[47, 48]。
芒属中多倍化现象很普遍,存在二倍体至六倍体等多种倍性(表3)。目前荻和芒中都有多个同源多倍体和异源多倍体被鉴定。例如,同源三倍体M. sinensis ‘Goliath’、M. sinensis var. condensatus、M. sinensis ‘Autumn Light’;同源四倍体M. sacchariflorus;异源三倍体中最具代表性的是M. × giganteus;此外还有M. sacchariflorus var. brevibarbis、M. sacchariflorus var. glaber等[7]。Adati和Shiotani[49]用核型分析显示四倍体的荻是异源多倍体起源,由两套不同染色体组成,一套是具随体的染色体,而另外一套是不具随体的染色体,两套和芒同源,另两套部分同源。五倍体M. sacchariflorus var. latifolius是由荻和芒构成的异源多倍体,而中间型芒M. intermedius是由少序芒M. oligostachyus和短毛荻M. tinctorius构成的异源多倍体[49]。整个芒属染色体倍性很复杂,非整倍体现象也常被报道[7, 42]。我们可以通过选择父母本倍性、育性恢复和打破自交不亲和体系等方法,人工对芒属物种进行多倍化,从而选育出优良性状[50-52]。另外,可以通过构建不育基因型来降低芒草广泛种植后产生的入侵风险[53]。
表 3 芒属物种的倍性和染色体数目Table 3. Ploidy and chromosome number of Miscanthus species物种
Species倍性和染色体数目
Ploidy and chromosome number荻
M. sacchariflorus2n=2x=38[7]
2n =3x =57
2n =4x =76
2n =5x=95[35]南荻
M. lutarioriparius2n=4x=76 [7] 芒
M. sinensis2n =2x=38、36、50、42
2n =3x=57[42]五节芒
M. floridulus2n =2x=38[7]
2n =3x=57[42]少序芒
M. oligostachyus2n =2x=38[7] 中间型芒
M. intermedius2n =4x=76[42]
2n =6x=114[7]短毛荻
M. tinctorius2n=2x=38
2n=4x=76
2n=6x=114[7]芒属植物天然杂交现象很普遍,目前广泛推广的M. × giganteus本身就是一个天然的三倍体杂交种,多项研究鉴定出芒和荻的天然杂交株系[54, 55],以及芒和五节芒种间自然杂交株系[56]。利用芒属植物花期调控技术和远缘杂交技术,现已成功在五节芒和荻[57, 58]、南荻与芒[59]、荻与南荻[60]之间完成人工杂交,并在子一代杂交群体中鉴定出了大量明显的分离性状和超亲现象。
4. 群体遗传变异和适应性分化
早期针对芒属开展的一些群体遗传学研究,多偏重于资源利用和开发,且多局限在某个国家或局部地区,所用分子标记都是传统的Isoenzyme、AFLP、SSR及其叶绿体片段序列等[61-64]。近年来群体遗传学研究的取样范围逐渐扩大,涵盖整个中国、日本和韩国等地区,随着测序技术和基因组学的飞速发展,简化基因组(RAD-seq)等组学手段被广泛采用(表4)[64-84],人们对芒属植物种间关系、遗传多样性和群体遗传结构以及谱系地理等方面的认识逐步加深[17, 65, 66]。Clark等[65]用RAD-seq和SSR标记对中国、韩国和日本的773份芒样品进行了研究,所有样品被分为6个组,其中4组分布于亚洲大陆(中国北部、东南部、中部的秦岭-长江一带和四川盆地以及韩国),另外两组分布在日本北部和南部。该研究还显示中国东南部是温带亚洲芒的起源中心,分几条路径迁移到北方和亚洲东部[65]。基于采自中国100个芒属物种居群的SSR检测,Li等[17]发现4个芒属物种(芒、五节芒、荻和南荻)均具有高水平的遗传多样性,既体现在物种水平上(He =0.559 ~ 0.708),也体现在种内群体水平上(He=0.468 ~ 0.599),意味着这些天然芒草群体蕴含着丰富的、可被利用的遗传资源。该研究进一步推断从末次冰期到现在,中国的芒和五节芒经历了群体扩张,相比之下荻和南荻则经历了一定的群体收缩;而且,五节芒很可能起源于中国东南地区的芒,并经历了生态物种形成过程。Zhang等[67]通过PacBio测序和Hi-C图谱对五节芒基因组进行测序和组装,与甘蔗亚族基因组之间的比较分析发现,芒属和甘蔗属在4.6-4.3 Ma分化开来,之后芒属的祖先经历同源多倍化事件,并在此过程中发生染色体融合和基因丢失。该研究对分布在中国的芒、五节芒、荻、南荻的74份材料进行了重测序,分析结果表明荻和南荻关系密切,而五节芒与这两个物种的距离较远。五节芒与其他物种相比遗传多样性更高,而荻和南荻相对较低。
表 4 芒属物种群体遗传学研究概况Table 4. Summary of studies on population genetics of Miscanthus species编号No. 类群
Species分子标记
Marker取样范围
Sampling area群体和个体数目
Amount of populations and accessions1 芒[64] cpDNA 日本全境 30群体,636个体 2 芒[76] SSR 中国西南地区 26群体,389个体 3 芒[61] SSR 中国全境 459个体 4 芒[77] ISSR 中国浙江省、广东省 12群体,93个体 5 芒[78] SRAP 中国西南地区 26群体,260个体 6 芒[65] RAD-seq,SSR 中、日、韩 737个体 7 荻、芒[79] SSR 韩国全境 69个体 8 芒[80] cpDNA 中国西南地区 14群体,75个体 9 荻和芒[81] RAD-seq,SSR 日本全境 745个体 10 南荻[82] SSR 中国长江中下游地区 25群体,644个体 11 芒[83] SSR 美国东部 228个体 12 荻[66] RAD-seq 中、日、韩、俄 764个体 13 芒、五节芒、荻、南荻[17] SSR 中国全境 100群体,1 960个体 14 南荻[84] SCoT 中国长江中下游地区 9群体,153个体 迄今,很多田间试验和实验室控制实验研究了芒属植物不同基因型之间农艺性状的差异,并取得了明显的进展,涉及产量、耐旱、耐寒、开花时间、化学成分和种子萌发等[7, 68, 69]。通过多个地点的同质园实验来探讨不同基因型之间的适应性差异也逐步开展起来。例如,Clifton-Brown 和 Lewandowski[70]将M. × giganteus、荻、芒的不同基因型分别种植在位于不同温度梯度上的瑞典、丹麦、英国和德国的试验田中,发现不同基因型在过冬能力上存在明显区别。Yan等[40]将在中国广泛收集的芒属93个基因型种植于3种自然环境中(冬季寒冷的温带草地、半干旱的黄土高原、温暖湿润的中国中部地区),检测到高水平的生长性状差异,以及呈显著水平的Site × Population交互作用。Dong等[71]在3个不同地点对M. × giganteus基因型进行了3年的田间试验,观测过冬率、产量、抽穗期、株高等表型,分析不同地点试验田中植株的过冬率和产量差异,找到了比“1993-1780”(现在大规模推广的基因型)具有更高过冬率和产量的基因型。这些研究表明,芒属植物中存在大量的表型差异,这些表型差异为后续利用关联分析、QTL定位等技术进行分子标记辅助育种提供了群体的表型数据[72-75]。
在群体遗传学研究中应用转录组数据不但可以得到该物种遗传和表达上的差异,而且可以了解物种遗传和表达对环境条件响应的信息。Xu等[85, 86]和Zhu等[87]对湖北江夏(原生境)和甘肃庆阳(胁迫生境)两个试验地的南荻进行转录组分析,发现低表达基因对环境变化相对更敏感,遗传多样性低的基因在胁迫环境下更易发生变异,而且lncRNA比蛋白质编码mRNA对环境变化更敏感,揭示了lncRNA对环境变化的响应特征。60%的基因在庆阳比在江夏核苷酸多样性降低,说明大多数基因在胁迫环境下受到了选择作用,一些非生物胁迫反应基因和光合作用相关基因响应胁迫环境。Song等[88]将南荻的天然群体种在山东东营的高盐性实验样地上,对比盐胁迫条件下和原生境条件下群体的转录组数据,找到59个响应高盐环境的基因,功能主要涉及植物防御、光合作用、细胞新陈代谢、信号转导和解毒作用,不同基因的表达趋势体现了典型的表达调和性,即与生长相关的基因表达量下调,伴随与抗性相关基因的表达量上升。Xing等[89]探讨南荻在驯化过程中基因的表达差异,分别找到共变异表达模式(Co-variation expression pattern,CE)基因和高表达变异(Top rank of expression fold change,TE)基因,CE基因多与水的利用效率有关,而TE基因多与生物或非生物胁迫相关,CE和TE基因的表达差异反映了南荻驯化过程中适应新环境的能力。Yan等[90]对南荻群体进行转录组测序,发现南荻群体间不同基因表达水平的差异较高,例如光合作用相关基因和对温度和活性氧刺激相关基因的表达水平在某些群体中显著高于其他群体,群体内部核苷酸多样性与表达多样性呈显著负相关,群体间则呈正相关,说明遗传和表达差异在物种适应性和种群持续性上扮演不同角色。Hu等[91]对南荻5个组织(叶、茎、根、侧芽和根茎芽)进行de novo转录组测序,寻找到很多和根茎发育相关的候选基因。目前,转录组相关研究多集中于南荻中,而其他几个重要的近缘物种,如芒、五节芒、荻的相关研究较少,另外,目前研究多停留在差异表达基因分析和功能注释上,我们可以通过寻找表达差异基因与QTL关联基因相一致的基因,从而进一步缩小候选基因的范围,提高候选基因的可靠性。
5. 资源利用和遗传改良
芒属植物既是重要的能源植物,又可用于园林观赏、造纸、生态恢复以及建筑材料[4, 16, 92, 93]。芒属植物对太阳能的转化效率以及对水分的利用效率均远远高于一般农作物[94, 95]。目前,欧美国家对芒草的开发已进入产业化应用阶段,如丹麦已经利用芒草与煤混合发电,英国的Elean公司是世界上最大的生物质发电厂,其燃料来自Anglian Straw公司大规模种植的芒草,美国农业部曾启动“能源植物援助计划”(Biomass Crop Assistance Program,BCAP),大力发展芒草等能源植物的种植,并开展了一系列纤维素乙醇商业化项目[96]。初步估计,若将美国9.7%的耕地用于种植芒草,则可生产133 × 109 L乙醇,相当于美国1/5的汽油消耗[94];而将欧盟35%的闲置土地种植芒草,将解决欧盟12%的能源需求[97]。
现在欧美国家广泛推广的三倍体杂种M. × giganteus平均干物质年产量为30 t/hm2 [11]。由于M. × giganteus基因型单一,在抗逆性等方面存在局限性,其亲本芒、荻以及另外两个近缘种五节芒和南荻也已作为能源作物被开发并利用。其中南荻和五节芒在生物质产量方面表现出优良特性,可以与M. × giganteus相媲美。五节芒在我国华东地区的干物质年产量可达31.9 t/hm2,我国的特有种南荻年产量约22.8 t/hm2 [14]。研究表明,芒和五节芒表现出较强的耐热性和耐旱性[38, 98-100];荻抗寒能力优于芒、五节芒和南荻[40, 101];而芒、五节芒、荻和南荻均能耐受中度盐碱环境,尤其是南荻的耐盐能力高于其他3个物种[10, 102]。芒属植物还表现出对多种重金属的耐性,可用于矿山废弃地植被恢复[103]。
要实现芒属植物大规模栽培生产,离不开对芒属资源的研究和利用。欧美国家虽然不是芒属植物的天然分布区,但十分重视扩大其种质资源的遗传基础,多个欧洲国家联合启动了“欧洲芒改良计划”,构建芒属核心种质和育种体系,利用生物技术手段开展新品种培育[104]。美国伊利诺伊州大学专注于产量、稳定性、开花时间、越冬能力、低温光合作用、叶片延展、耐寒性等性状[7]。
中国早在20世纪50年代就开始了对芒属植物的遗传改良,但早期的研究主要集中在将南荻作为造纸原料或将五节芒作为牧草的利用上[96],用系统选育法培育出了‘突节荻’和‘胖节荻’新品种,其产量和纤维含量明显优于以往的栽培品种,提高了造纸经济效益[105]。湖南农业大学在芒属植物的育种工作中取得突出成果,曾先后建立了芒属植物人工快繁和远缘杂交技术体系,并培育出‘湘杂芒1号’、‘2号’和‘3号’等第一批芒属能源植物新品种[96],分别培育出适合发酵产沼气型、适合直燃型和适合发酵产乙醇型的杂交株系[59]。利用植物细胞工程技术选育出了同源四倍体新品种‘芙蓉南荻’,利用转基因技术培育出南荻的抗虫品种,这是国际上第一例转基因芒属植物。此外,荻与南荻杂交F1代也表现出明显的杂种优势[60]。
为了实现芒草资源的高效利用,需要对其产量、抗逆性、化学组成成分等性状进行优化,精确的遗传图谱和准确的QTL定位是了解性状遗传机制的前提,有助于制定切实可行的遗传改良方案。由于芒属物种的基因组大而且杂合度高,其遗传图谱的研究进展比较缓慢。早期研究主要利用RAPD、SSR等分子标记构建遗传图谱,随着二代测序技术的发展,芒属物种高分辨率的遗传图谱陆续产生,其标记间距可以达到0.3 cM,已经有涉及生物量、开花时间、叶片条纹、抗逆性等性状的大量QTL被定位(表5)。
表 5 芒属植物遗传图谱和QTL研究汇总Table 5. Summary of studies on genetic map and QTLs of Miscanthus species编号
No.物种
Species标记
Marker图谱长度
Length / cM分辨率
Average interval / cMQTL 相关性状
Characters1 芒[106-110] RAPD 1075 4.2 45 花期、产量、株高、茎秆直径、矿物组成等 2 芒[44, 111] RNA-seq SSR 1782 2.7 72 株高、分蘖直径、分蘖数目等 3 芒[112] GBS 2396 0.6 4 荻、芒[113] SSR 1999 9.0 2238 8.0 5 芒[114] RAD-seq 1599 0.8 6 叶片斑马状条纹的有无和密度 1612 0.9 6 五节芒、荻[115] SSR 2053 3.3 66 株高、抽穗时间、开花时间等 1685 3.5 7 荻和芒[45, 72] RAD-seq 2223 0.3 112 腋芽数、茎秆密度、茎秆节数等 8 芒[116] GBS 2396 0.6 5 开花时间 近年来,全基因组关联分析(Genome-wide association studies,GWAS)技术被广泛应用于芒草属资源的研究和发掘,大量与抽穗期、植株高度、茎叶长度、木质素含量、产量、抗性等性状相关的位点被定位和解析[61, 73]。Nie等[117]用SRAP、ISAP和SSR标记对中国西南地区的芒进行关联分析,发现一个与产量相关的标记,以及11个与其他性状关联的标记。Clark等[75]发现了27个与产量相关的SNP,并在不同种植点和不同年份间找到298个与其他性状相关的SNP,在单个种植点和多个种植点得到的基因组预测的准确性相似。Dong等[74]针对芒的耐寒性进行关联分析,共发现73个关联位点,该作者前期另一项研究对芒的耐寒性进行QTL分析,有一个QTL区段包含了此研究中的5个关联位点和一个响应寒冷的基因,其他的QTL区段中包含2个关联位点和3个响应寒冷的基因。目前芒草的基因定位仍存在定位区间大、区间内包含基因多的问题。将不同基因定位技术相结合,发掘区间的重叠区域,例如可以将BSA(Bulked segregation analysis)与遗传图谱相结合,或者将GWAS分析与遗传图谱分析相结合,将有助于缩小区间,筛选出更加可靠的候选基因。另外,目前的研究得到了众多的候选基因,但缺乏后续的基因验证,未来可以通过Southern blot、Northern bolt、qRT-PCR、RNA干扰、基因敲除等技术来对候选基因进行功能验证。
6. 展望
迄今,在芒属野生资源的调查评估、分类学、分子系统学、群体遗传学以及遗传改良等方面已取得了很大进展,但其中很多问题仍未解决或存在争议,有待进一步的深入研究。首先,科学的分类和明确的种间关系对人们认识、保护和合理利用生物多样性资源至关重要,而芒属的界定、芒属与近缘属的系统发生关系以及属下各个类群的分类仍存在诸多问题。造成这些问题的原因不仅和类群本身复杂的生物学特性有关(如大多自交不亲和,个别情况下存在种间天然杂交现象以及多倍化现象),同时也和研究策略不合理、研究不够深入有关(取样范围不全面,缺乏足够的群体水平研究以及对重要性状研究不够深入),对这些问题的进一步探讨是下一步工作的重点之一。
其次,针对芒属植物群体遗传结构和进化历史的研究仍然十分薄弱,有很多基本的群体遗传学和进化历史问题亟待解决,包括:(1)芒属野生种质资源调查和搜集还不全面,有些物种(如分布在中国和东亚地区的荻和南荻)研究比较全面,而对于分布在东南亚国家的芒属植物几乎没有研究报道。(2)群体遗传结构研究不够深入导致物种及种下等级的划分存在很大矛盾,包括属下组的划分和类群间的关系。其原因既有来自以往研究所用分子标记的分辨率不高,也和研究材料没有按照群体策略进行取样有很大关系。因此,选用分辨率更高的分子标记和群体取样策略进行深入研究是亟待开展的工作。(3)芒属很多物种的起源和进化历史尚不清楚,物种形成方式和机制更缺乏研究。例如中国、日本和韩国的特有种是如何起源的,广域分布的芒、五节芒、荻中谁是祖先种,起源中心在哪里,何时起源,经历了怎样的进化路线等问题都尚无定论。了解物种形成方式和机制既是探讨性状进化、生态适应、物种分化等进化生物学重要问题的基础,也是资源利用和遗传改良的基础,应加大研究的力度。
再者,随着测序技术的快速提高以及测序成本的急速下降,组学技术得到了飞速发展,对植物科学研究带来了前所未有的机遇[118, 119]。例如,Mitros等[120]完成了芒的染色体水平基因组组装,Zhang等[67]发布五节芒基因组数据,Miao等[121]构建第一个染色体水平的南荻基因组。荻基因组(https://www.ncbi.nlm.nih.gov/genome/?term=Miscanthus + sacchariflorus) 也在NCBI发布。芒属基因组数据的发表将大力推动芒属及近缘类群基因组数据库的构建和发展(例如CSGRqtl database、Gramene等)以及相关生物学理论研究,有助于通过GWAS、GS、比较基因组学等方法和技术寻找与驯化相关的基因或QTL,为交叉利用甘蔗乃至整个禾本科植物的图谱数据提供便利,加快芒草资源的开发和改良。
我国有着丰富的芒属植物资源优势,但是资源的有效利用、产业化技术研发和科研成果转化方面却相对滞后,是未来重点关注和加大研究力度的领域。我国有大面积的边际土地,包括黄河滩地和滨海盐土、南方低山丘陵的红壤、西北地区的黄绵土等,要有效利用这些边际土地进行大规模种植,并开发配套的产业化技术,实现科学技术到生产力的转化,需要各级政府部门、科研院所和企业单位联合起来,结合各方的资源、技术和人才优势,这将有利于我国芒属资源的发掘、整合和开发利用。
-
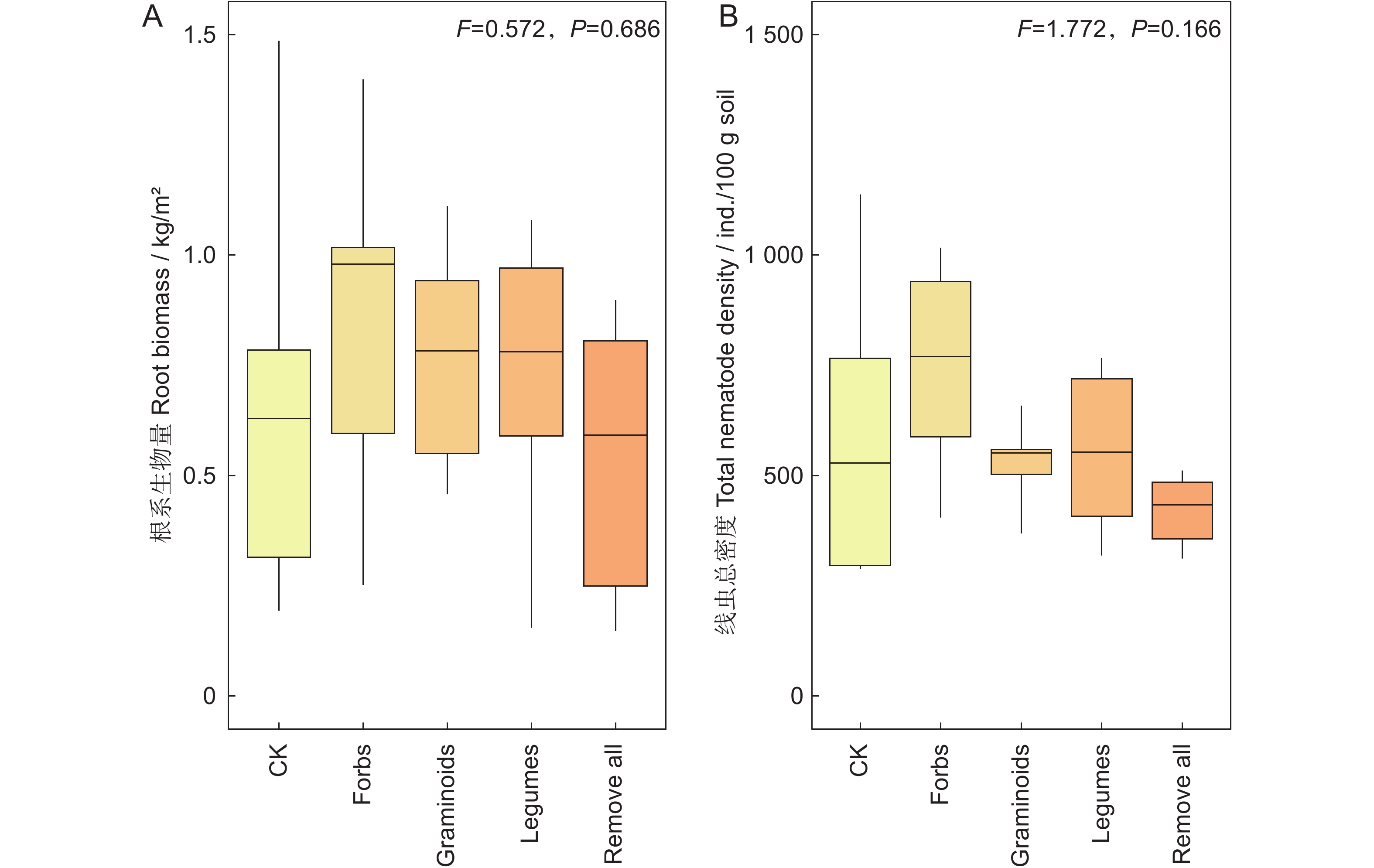
图 1 不同处理下根系生物量(A)和线虫总密度(B)
CK表示对照,Forbs表示保留非豆科杂类草,Graminoids表示保留禾状草,Legumes表示保留豆科,Remove all表示去除所有植物功能群。下同。
Figure 1. Root biomass (A) and total density of nematodes (B) under different treatments
CK, control; Forbs, only non-legume forbs; Graminoids, only graminoids; Legumes, only legumes; Remove all, all plant functional groups removed. Same below.
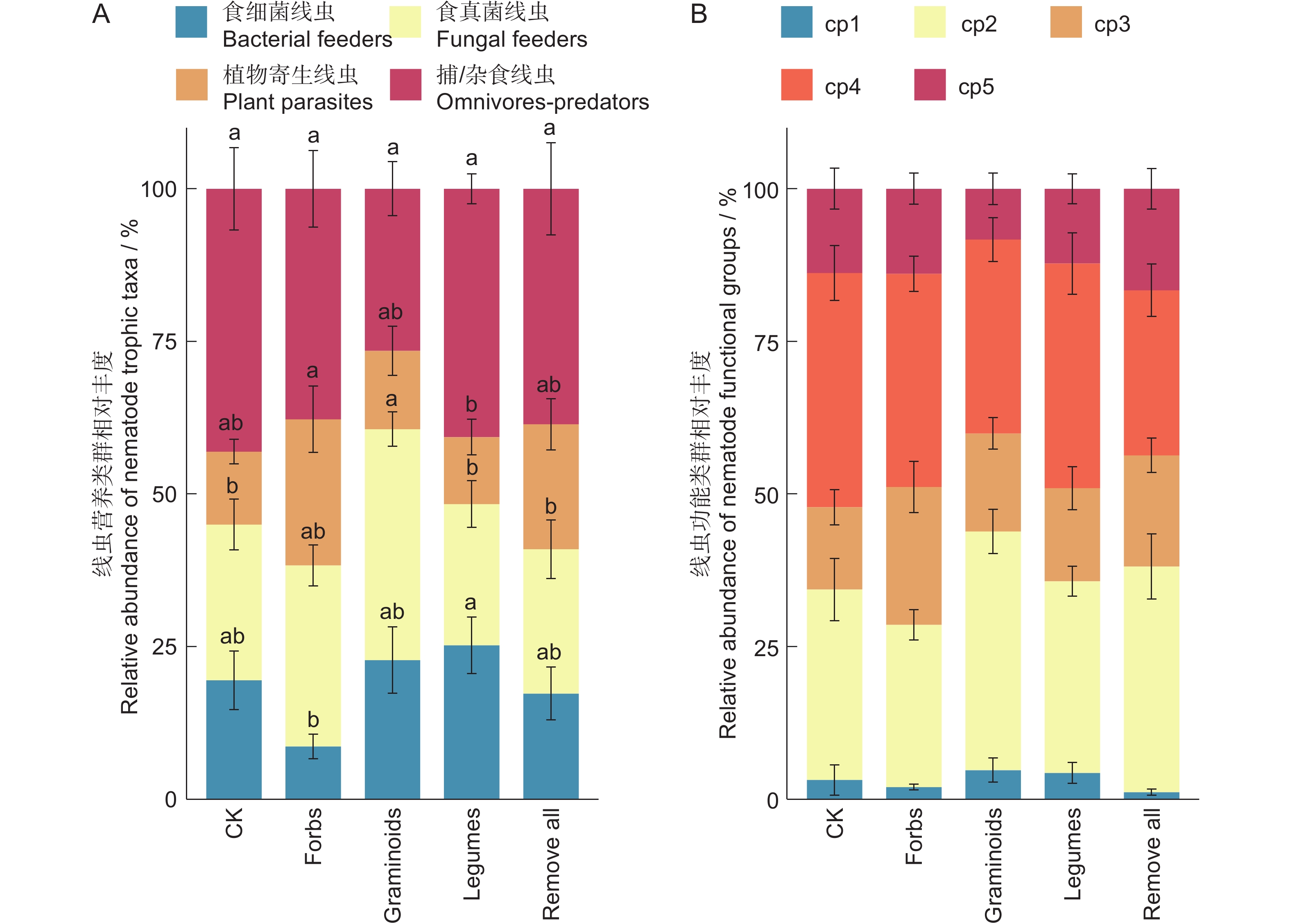
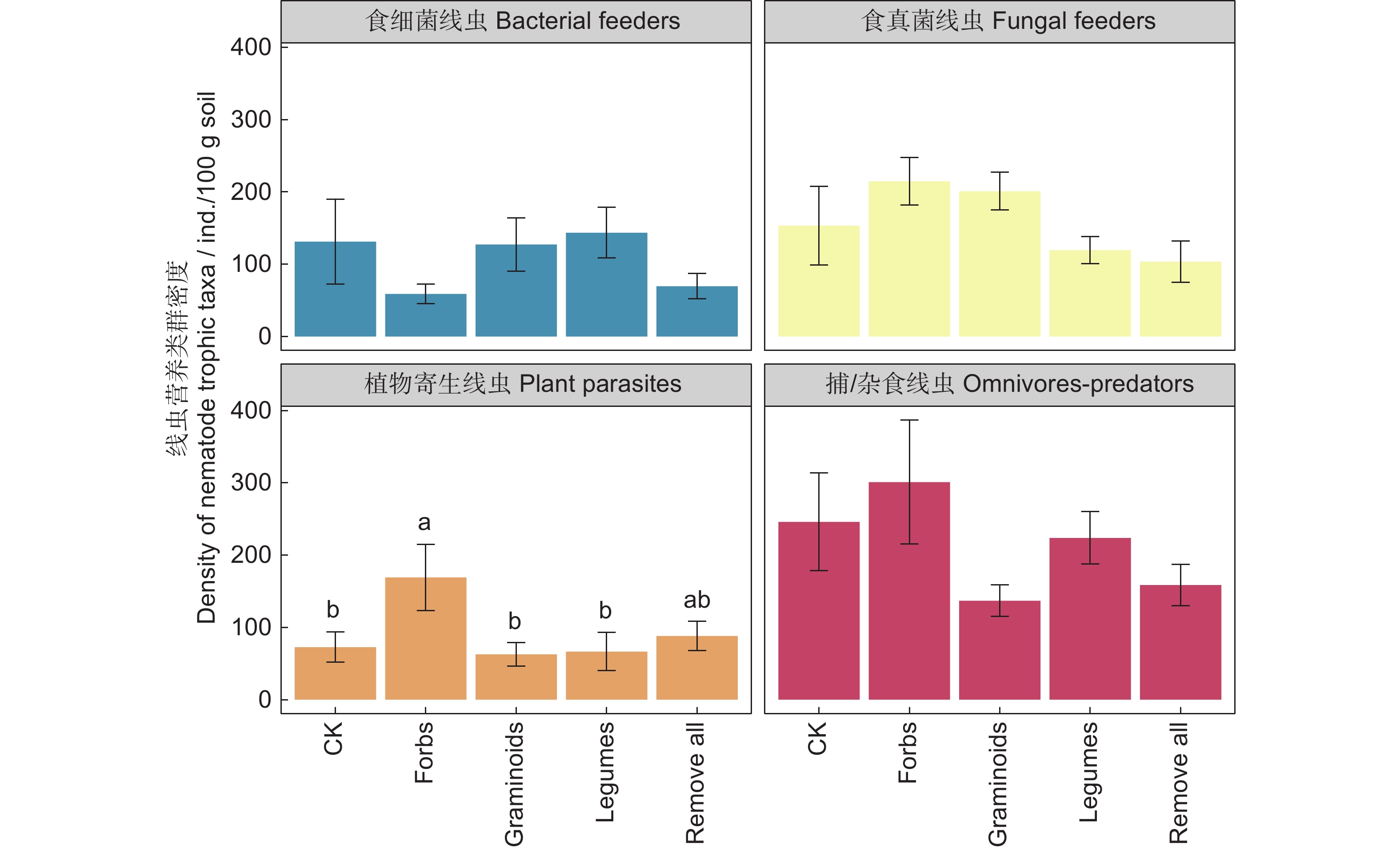
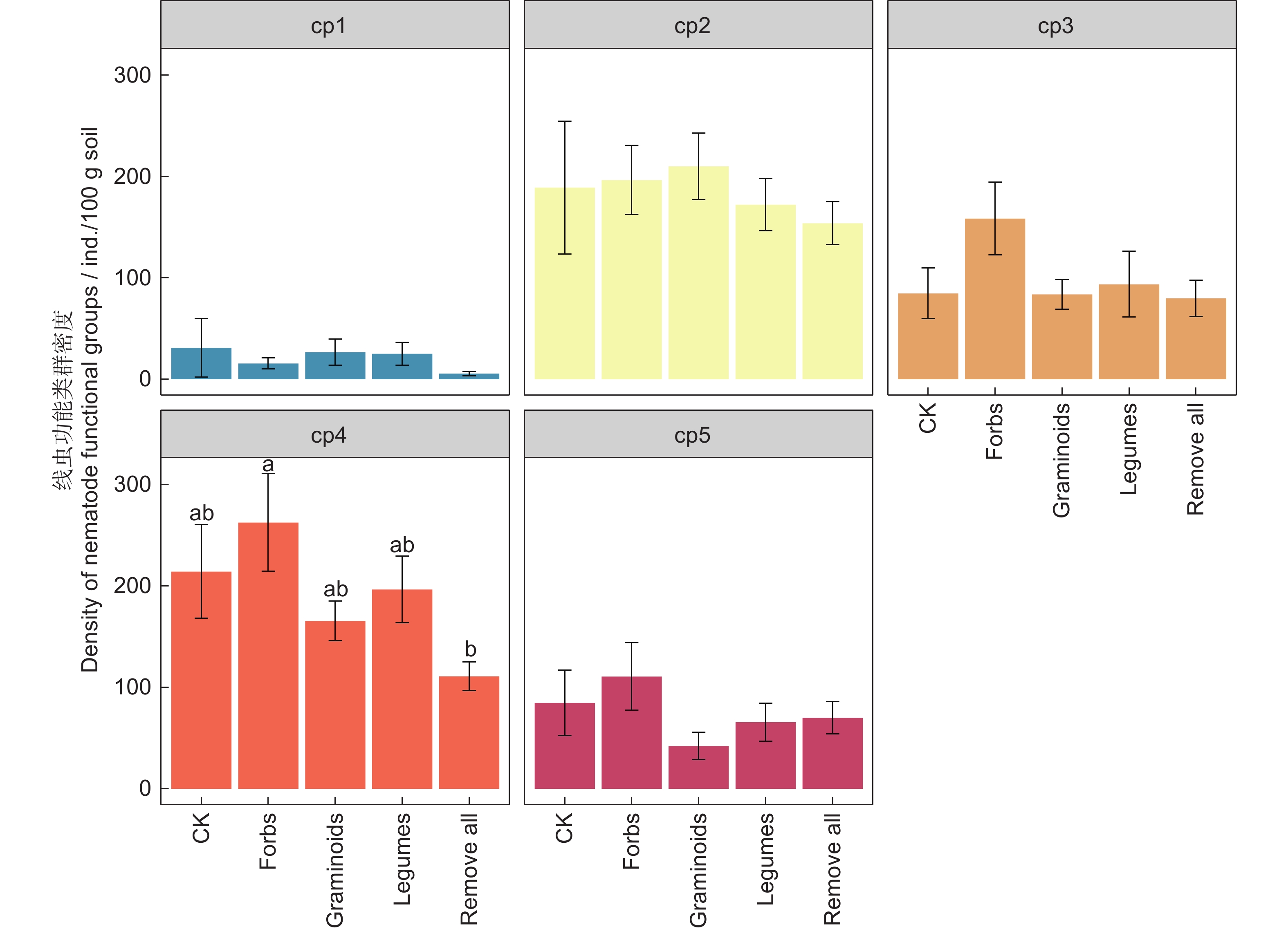
图 2 不同处理下线虫营养类群(A)和功能类群(B)的相对丰度
不同小写字母表示不同处理间相同线虫营养类群的差异显著(P<0.05)。下同。
Figure 2. Relative abundance of nematode trophic taxa (A) and functional groups (B) under different treatments
Different lowercase letters indicate differences in same nematode trophic taxa among treatments at the 0.05 level. Same below.
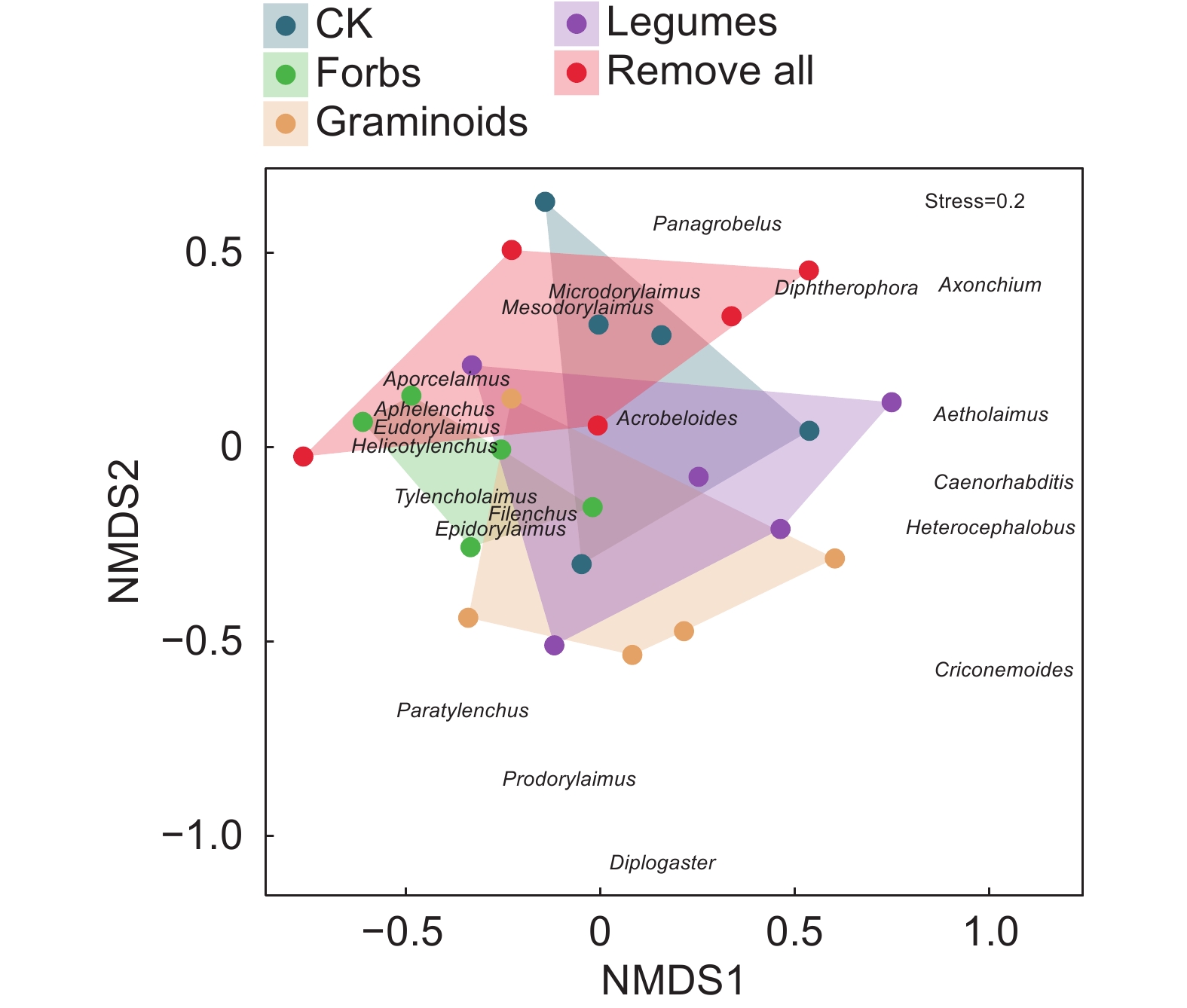
图 5 土壤线虫群落非度量多维尺度分析(NMDS)
Helicotylenchus螺旋属,Filenchus丝尾垫刃属,Aporcelaimus孔咽属,Eudorylaimus真矛线属,Acrobeloides拟丽突属,Aphelenchus真滑刃属,Tylencholaimus垫咽属,Microdorylaimus微矛线属,Mesodorylaimus中矛线属,Epidorylaimus表矛线属,Diphtherophora膜皮属,Prodorylaimus前矛线属,Heterocephalobus异头叶属,Axonchium缢咽属,Paratylenchus针属,Caenorhabditis广杆属,Diplogaster双胃属,Aetholaimus (尚无中文名),Criconemoides轮属,Panagrobelus瓣唇属。
Figure 5. Nonmetric multidimensional-scaling analysis (NMDS) of soil nematode communities
表 1 不同处理下去除的植物功能群生物量
Table 1 Plant functional group biomass removed under different treatments
处理
Treatment杂类草
Forbs禾状草
Graminoids豆科植物
Legumes对照 − − − 保留杂类草 − 250.526±24.045a 4.482±1.010b 保留禾状草 130.184±18.125a − 3.276±1.259b 保留豆科植物 292.600±23.032a 334.168±24.688a − 去除所有 318.982±49.623a 455.814±39.827a 5.684±2.320b 注:表中数据均为平均值±标准误。每处理5个重复。同行不同小写字母表示不同功能群生物量在同一处理下差异显著(P<0.05)。 Notes: All data are average values±SD. Each treatment has five replicates. Different lowercase letters in the same row indicate significant differences in biomass of different functional groups under the same treatment at the 0.05 level. 表 2 不同处理下线虫各类指数
Table 2 Various indices of nematodes under different treatments
指数
Index对照
CK保留杂类草
Forbs保留禾状草
Graminoids保留豆科
Legumes去除所有
Remove allF P H' 2.69±0.11a 2.32±0.09b 2.68±0.12a 2.65±0.10a 2.42±0.14ab 2.94 0.040 2* J' 0.88±0.01a 0.82±0.01c 0.85±0.01b 0.88±0.01a 0.86±0.01ab 8.43 <0.001 0*** λ 0.08±0.01c 0.14±0.01a 0.10±0.01bc 0.09±0.01bc 0.12±0.01ab 5.06 <0.010 0** SR 4.52±0.40a 3.61±0.37a 5.06±0.58a 4.34±0.48a 3.66±0.48a 2.13 0.106 4 NCR 0.42±0.06a 0.22±0.04a 0.35±0.06a 0.51±0.08a 0.43±0.10a 2.69 0.054 6 EI 47.39±5.61a 52.22±2.22a 52.87±4.10a 50.27±3.39a 41.68±4.12a 1.59 0.207 9 SI 85.11±3.65a 86.39±2.91a 74.28±4.72a 85.83±1.30a 82.25±4.31a 2.50 0.075 0 CI 77.89±14.16a 73.08±3.91a 67.17±10.82a 61.44±13.39a 83.22±7.61a 0.81 0.531 3 注:表中数据均为平均值±标准误。H '、J '、λ、SR、NCR、EI、SI、CI分别表示香农-维纳多样性指数、均匀度指数、优势度指数、丰富度指数、线虫通路比值、富集指数、结构指数和通道指数。同行不同小写字母表示同一指标在不同处理间差异显著(P<0.05)。*: P<0.05; **: P<0.01; ***: P<0.001。下同。 Notes: All data are average values±SD. H ', J ', λ, SR, NCR, EI, SI, and CI indicate Shannon-Wiener index, Pielou evenness index, Simpson dominance index, Margalef richness index, Nematode channel ratio, Enrichment index, Structure index, and Channel index, respectively. Different lowercase letters for the same parameter in the same row indicate significant differences among different treatments at the 0.05 level. Same below. 表 3 不同处理下NMDS多重比较结果
Table 3 Multiple comparison results of NMDS under different treatments
处理 Treatment F P 对照-保留杂类草 1.91 0.041* 对照-保留禾状草 2.19 0.046* 对照-保留豆科 0.59 0.858 对照-去除所有 0.99 0.426 保留杂类草-保留禾状草 2.80 0.022* 保留杂类草-保留豆科 1.95 0.081 保留杂类草-去除所有 1.51 0.189 保留禾状草-保留豆科 1.53 0.107 保留禾状草-去除所有 2.62 0.006** 保留豆科-去除所有 1.30 0.208 -
[1] Chen H,Zhu QA,Peng CH,Wu N,Wang YF,et al. The impacts of climate change and human activities on biogeochemical cycles on the Qinghai-Tibetan Plateau[J]. Glob Change Biol,2013,19(10):2940−2955. doi: 10.1111/gcb.12277
[2] 董世魁,汤琳,张相锋,刘世梁,刘全儒,等. 高寒草地植物物种多样性与功能多样性的关系[J]. 生态学报,2017,37(5):1472−1483 Dong SK,Tang L,Zhang XF,Liu SL,Liu QR,et al. Relationship between plant species diversity and functional diversity in alpine grasslands[J]. Acta Ecologica Sinica,2017,37(5):1472−1483.
[3] 王一博,王根绪,沈永平,王彦莉. 青藏高原高寒区草地生态环境系统退化研究[J]. 冰川冻土,2005,27(5):633−640 Wang YB,Wang GX,Shen YP,Wang YL. Degradation of the eco-environmental system in alpine meadow on the Tibetan Plateau[J]. Journal of Glaciology and Geocryology,2005,27(5):633−640.
[4] Shao QQ,Cao W,Fan JW,Huang L,Xu XL. Effects of an ecological conservation and restoration project in the Three-River Source Region,China[J]. J Geogr Sci,2017,27(2):183−204. doi: 10.1007/s11442-017-1371-y
[5] Loreau M,Naeem S,Inchausti P,Bengtsson J,Grime JP,et al. Biodiversity and ecosystem functioning:current knowledge and future challenges[J]. Science,2001,294(5543):804−808. doi: 10.1126/science.1064088
[6] Wang P,Guo J,Xu XY,Yan XB,Zhang KC,et al. Soil acidification alters root morphology,increases root biomass but reduces root decomposition in an alpine grassland[J]. Environ Pollut,2020,265:115016. doi: 10.1016/j.envpol.2020.115016
[7] 侯扶江,杨中艺. 放牧对草地的作用[J]. 生态学报,2006,26(1):244−264 Hou FJ,Yang ZY. Effects of grazing of livestock on grassland[J]. Acta Ecologica Sinica,2006,26(1):244−264.
[8] Li W,Wen SJ,Hu WX,Du GZ. Root-shoot competition interactions cause diversity loss after fertilization:a field experiment in an alpine meadow on the Tibetan Plateau[J]. J Plant Ecol,2011,4(3):138−146. doi: 10.1093/jpe/rtq031
[9] Wu GL,Du GZ,Liu ZH,Thirgood S. Effect of fencing and grazing on a Kobresia-dominated meadow in the Qinghai-Tibetan Plateau[J]. Plant Soil,2009,319(1-2):115−126. doi: 10.1007/s11104-008-9854-3
[10] Gou XM,Reich PB,Qiu LP,Shao MA,Wei GH,et al. Leguminous plants significantly increase soil nitrogen cycling across global climates and ecosystem types[J]. Glob Change Biol,2023,29(14):4028−4043. doi: 10.1111/gcb.16742
[11] Chen WJ,Zhou HK,Wu Y,Wang J,Zhao ZW,et al. Loss of plant functional groups impacts soil carbon flow by changing multitrophic interactions within soil micro-food webs[J]. Appl Soil Ecol,2022,178:104566. doi: 10.1016/j.apsoil.2022.104566
[12] Yeates GW,Bongers T,de Goede RGM,Freckman DW,Georgieva SS. Feeding habits in soil nematode families and genera-an outline for soil ecologists[J]. J Nematol,1993,25(3):315−331.
[13] 吴雨薇,罗珊,拉琼,吴纪华. 青藏高原三江源区不同恢复期高寒草甸土壤线虫群落演变[J]. 土壤,2022,54(3):532−538 Wu YW,Luo S,La Q,Wu JH. Response of soil nematode communities to restoration of alpine meadow grassland in three-river headwater region on Qinghai-Tibet Plateau in different restoration periods[J]. Soils,2022,54(3):532−538.
[14] Jiang YJ,Qian HY,Wang XY,Chen LJ,Liu MQ,et al. Nematodes and microbial community affect the sizes and turnover rates of organic carbon pools in soil aggregates[J]. Soil Biol Biochem,2018,119:22−31. doi: 10.1016/j.soilbio.2018.01.001
[15] 马金豪,栾军伟,王晖,叶晓丹,王一,等. 乔木根系和凋落物对南亚热带3种人工林土壤线虫群落的差异化影响[J]. 生态学报,2023,43(18):7367−7380 Ma JH,Luan JW,Wang H,Ye XD,Wang Y,et al. Differential impacts of tree root and litter on soil nematode communities in three artificial stands in subtropical South China[J]. Acta Ecologica Sinica,2023,43(18):7367−7380.
[16] Altieri MA. The ecological role of biodiversity in agroecosystems[J]. Agric Ecosyst Environ,1999,74(1-3):19−31. doi: 10.1016/S0167-8809(99)00028-6
[17] 刘艳方,王文颖,索南吉,周华坤,毛旭锋,等. 青海海北植物群落类型与土壤线虫群落相互关系[J]. 植物生态学报,2022,46(1):27−39 doi: 10.17521/cjpe.2020.0406 Liu YF,Wang WY,Suo NJ,Zhou HK,Mao XF,et al. Relationship between plant community types and soil nematode communities in Haibei,Qinghai,China[J]. Chinese Journal of Plant Ecology,2022,46(1):27−39. doi: 10.17521/cjpe.2020.0406
[18] Viketoft M. Effects of six grassland plant species on soil nematodes:a glasshouse experiment[J]. Soil Biol Biochem,2008,40(4):906−915. doi: 10.1016/j.soilbio.2007.11.006
[19] Ye YY,Rui YC,Zeng ZX,He XY,Wang KL,Zhao J. Responses of soil nematode community to monoculture or mixed culture of a grass and a legume forage species in China[J]. Pedosphere,2020,30(6):791−800. doi: 10.1016/S1002-0160(20)60039-X
[20] 姬阳光. 降水改变、施氮和增温对青藏高原高寒草甸植物群落结构的影响[D]. 南京:南京农业大学,2017:9. [21] Li WJ,Luo S,Wang JF,Zheng XY,Zhou X,et al. Nitrogen deposition magnifies destabilizing effects of plant functional group loss[J]. Sci Total Environ,2022,835:155419. doi: 10.1016/j.scitotenv.2022.155419
[22] Wang SP,Duan JC,Xu GP,Wang YF,Zhang ZH,et al. Effects of warming and grazing on soil N availability,species composition,and ANPP in an alpine meadow[J]. Ecology,2012,93(11):2365−2376. doi: 10.1890/11-1408.1
[23] Liu MQ,Chen XY,Qin JT,Wang D,Griffiths B,Hu F. A sequential extraction procedure reveals that water management affects soil nematode communities in paddy fields[J]. Appl Soil Ecol,2008,40(2):250−259. doi: 10.1016/j.apsoil.2008.05.001
[24] Bongers T. The maturity index:an ecological measure of environmental disturbance based on nematode species composition[J]. Oecologia,1990,83(1):14−19. doi: 10.1007/BF00324627
[25] Bongers T. De Nematoden Van Nederland:Een Identificatietabel Voor de in Nederland Aangetroffen Zoetwater-En Bodembewonende Nematoden[M]. The Netherlands:Stichting Uitgeverij Koninklijke Nederlandse Natuurhistorische Vereniging,1988:52−408.
[26] Yeates GW,Bongers T. Nematode diversity in agroecosystems[J]. Agric Ecosyst Environ,1999,74(1-3):113−135. doi: 10.1016/S0167-8809(99)00033-X
[27] Yeates GW. Nematodes as soil indicators:functional and biodiversity aspects[J]. Biol Fertil Soils,2003,37(4):199−210. doi: 10.1007/s00374-003-0586-5
[28] Ferris H,Bongers T,de Goede RGM. A framework for soil food web diagnostics:extension of the nematode faunal analysis concept[J]. Appl Soil Ecol,2001,18(1):13−29. doi: 10.1016/S0929-1393(01)00152-4
[29] Kuznetsova A,Brockhoff PB,Christensen RHB. lmerTest package:tests in linear mixed effects models[J]. J Stat Softw,2017,82(13):1−26.
[30] R Core Team. The R project for statistical computing[EB/OL]. Vienna,Austria. 2022. https://www.R-project.org/.
[31] Hothorn T,Bretz F,Westfall P. Simultaneous inference in general parametric models[J]. Biom J,2008,50(3):346−363. doi: 10.1002/bimj.200810425
[32] Dixon P. Vegan,a package of R functions for community ecology[J]. J Veg Sci,2003,14(6):927−930. doi: 10.1111/j.1654-1103.2003.tb02228.x
[33] Ginestet C. ggplot2:Elegant graphics for data analysis[J]. J Roy Stat Soc Ser A Stat Soc,2011,174(1):245−246. doi: 10.1111/j.1467-985X.2010.00676_9.x
[34] Gastine A,Scherer-Lorenzen M,Leadley PW. No consistent effects of plant diversity on root biomass,soil biota and soil abiotic conditions in temperate grassland communities[J]. Appl Soil Ecol,2003,24(1):101−111. doi: 10.1016/S0929-1393(02)00137-3
[35] Viketoft M,Palmborg C,Sohlenius B,Huss-Danell K,Bengtsson J. Plant species effects on soil nematode communities in experimental grasslands[J]. Appl Soil Ecol,2005,30(2):90−103. doi: 10.1016/j.apsoil.2005.02.007
[36] Viketoft M,Bengtsson J,Sohlenius B,Berg MP,Petchey O,et al. Long-term effects of plant diversity and composition on soil nematode communities in model grasslands[J]. Ecology,2009,90(1):90−99. doi: 10.1890/08-0382.1
[37] Stephan A,Meyer AH,Schmid B. Plant diversity affects culturable soil bacteria in experimental grassland communities[J]. J Ecol,2000,88(6):988−998. doi: 10.1046/j.1365-2745.2000.00510.x
[38] Zhao J,Zeng ZX,He XY,Chen HS,Wang KL. Effects of monoculture and mixed culture of grass and legume forage species on soil microbial community structure under different levels of nitrogen fertilization[J]. Eur J Soil Biol,2015,68:61−68. doi: 10.1016/j.ejsobi.2015.03.008
[39] Scherer-Lorenzen M,Palmborg C,Prinz A,Schulze ED. The role of plant diversity and composition for nitrate leaching in grasslands[J]. Ecology,2003,84(6):1539−1552. doi: 10.1890/0012-9658(2003)084[1539:TROPDA]2.0.CO;2
[40] 杨晓理. 高寒草甸不同优势植物对土壤线虫群落的直接和间接作用及其机制[D]. 兰州:兰州大学,2019:19−21. [41] Kaiser C,Kilburn MR,Clode PL,Fuchslueger L,Koranda M,et al. Exploring the transfer of recent plant photosynthates to soil microbes:mycorrhizal pathway vs direct root exudation[J]. New Phytol,2015,205(4):1537−1551. doi: 10.1111/nph.13138
[42] Wang YT,Niu KC. Effect of soil environment on functional diversity of soil nematodes in Tibetan alpine meadows[J]. Biodiv Sci,2020,28(6):707−717. doi: 10.17520/biods.2020042
[43] Andriuzzi WS,Wall DH. Grazing and resource availability control soil nematode body size and abundance-mass relationship in semi-arid grassland[J]. J Anim Ecol,2018,87(5):1407−1417. doi: 10.1111/1365-2656.12858
[44] Liu T,Guo R,Ran W,Whalen JK,Li HX. Body size is a sensitive trait-based indicator of soil nematode community response to fertilization in rice and wheat agroecosystems[J]. Soil Biol Biochem,2015,88:275−281. doi: 10.1016/j.soilbio.2015.05.027
[45] Van den Hoogen J,Geisen S,Routh D,Ferris H,Traunspurger W,et al. Soil nematode abundance and functional group composition at a global scale[J]. Nature,2019,572(7768):194−198. doi: 10.1038/s41586-019-1418-6
[46] Fanin N,Kardol P,Farrell M,Kempel A,Ciobanu M,et al. Effects of plant functional group removal on structure and function of soil communities across contrasting ecosystems[J]. Ecol Lett,2019,22(7):1095−1103. doi: 10.1111/ele.13266
[47] Sun JJ,Wang PB,Wang HB,Yu XJ. Changes in plant communities,soil characteristics,and microbial communities in alpine meadows degraded to different degrees by pika on the Qinghai-Tibetan Plateau[J]. Glob Ecol and Conserv,2021,27:e01621.
[48] 杨锐,吴鹏飞,魏雪. 天然高寒草地转变为燕麦人工草地对土壤线虫群落的影响[J]. 生态学报,2020,40(14):4903−4920 Yang R,Wu PF,Wei X. Effects of the transformation from natural alpine grassland to artificial oat grassland on the soil nematode communities[J]. Acta Ecologica Sinica,2020,40(14):4903−4920.
[49] De Deyn GB,Raaijmakers CE,van Ruijven J,Berendse F,van der Putten WH. Plant species identity and diversity effects on different trophic levels of nematodes in the soil food web[J]. Oikos,2004,106(3):576−586. doi: 10.1111/j.0030-1299.2004.13265.x
[50] Zhang CZ,Wang JJ,Ren ZH,Hu ZK,Tian SY,et al. Root traits mediate functional guilds of soil nematodes in an ex-arable field[J]. Soil Biol Biochem,2020,151:108038. doi: 10.1016/j.soilbio.2020.108038
[51] Gupta D,Bhandari S,Bhusal DR. Variation of nematode indices under contrasting pest management practices in a tomato growing agro-ecosystem[J]. Heliyon,2019,5(10):e02621. doi: 10.1016/j.heliyon.2019.e02621
-
期刊类型引用(1)
1. 何拓,曾岩,殷亚方,张坤,袁良琛,董晖,周志华. 为野生植物保护和可持续贸易奠定科学基础——CITES植物委员会第27次会议评述. 生物多样性. 2024(09): 171-175 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: