Genome size determination of ornamental crabapple cultivars based on flow cytometry
-
摘要:
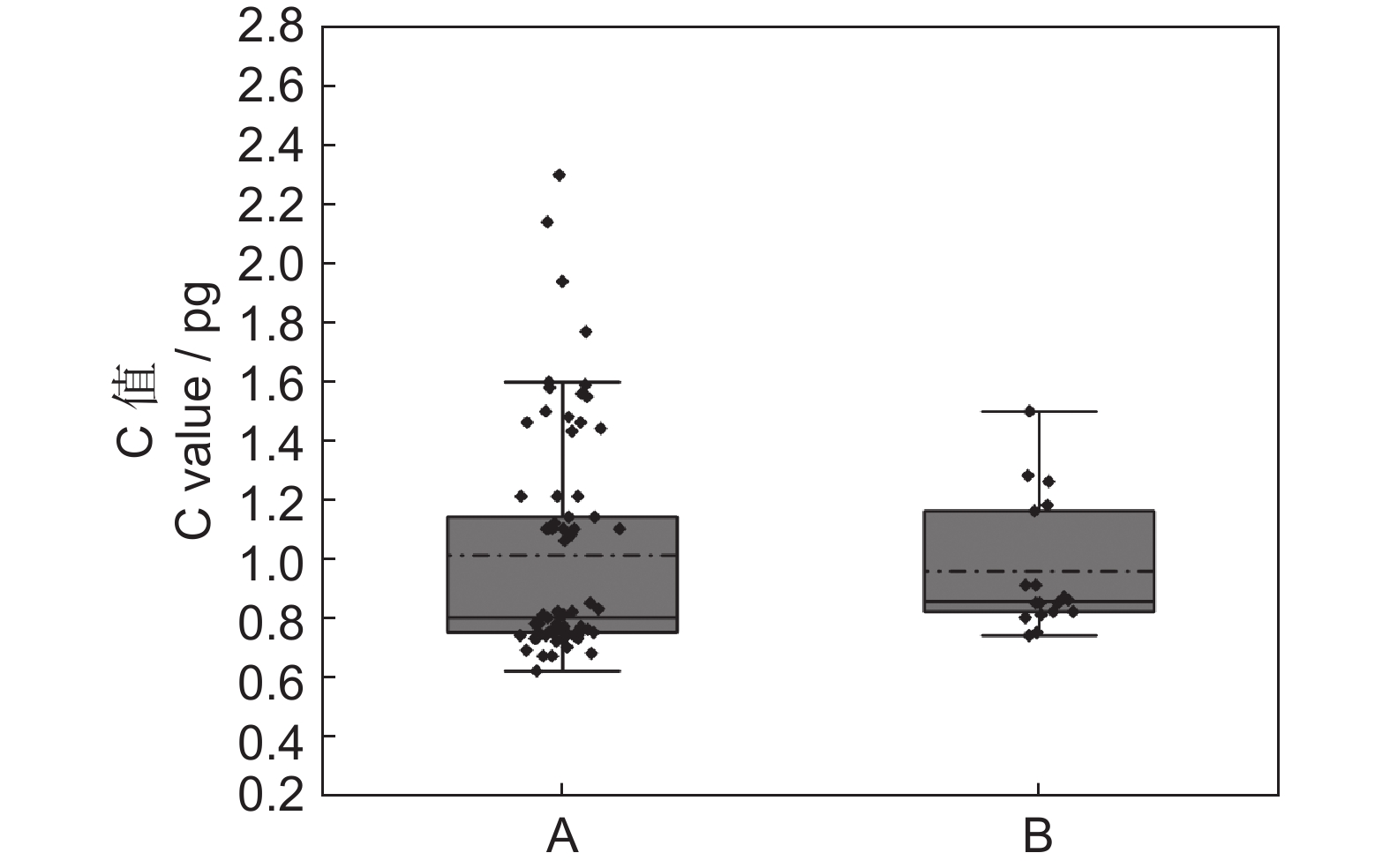
核DNA C值和基因组大小是重要的生物多样性特征,本研究以18个观赏海棠(Malus spp.)品种的嫩叶为材料,并以玉米(Zea mays L.)品种‘B73’为内参样本,利用流式细胞术对观赏海棠基因组大小进行了测定。结果显示:18份观赏海棠C值大小范围为0.74~1.50 pg,平均为0.96 pg;其中,‘玛丽波特’(‘Mary Potter’)C值最大,达到1.50 pg,而‘红珠宝’(‘Red Jewel’)C值最小,为0.74 pg。方差分析结果表明观赏海棠品种间C值大小存在显著差异。观赏海棠不同品种间DNA C值和基因组大小存在显著的多样性。
Abstract:Nuclear DNA C value and genome size are important characteristics of biodiversity. In this study, young leaves of 18 cultivars of ornamental crabapple (Malus spp.) were used as test material, and Zea mays L. cv. ‘B73’ was used as an internal reference sample. The genome size of ornamental crabapple was measured by flow cytometry. It provides a theoretical basis for germplasm resource identification, genomics research and new variety breeding of ornamental crabapple. The results showed that the C value of 18 samples of ornamental crabapple ranged from 0.74 to 1.50 pg, and the average size was 0.96 pg. Among them, ‘Mary Potter’ had the highest C value (1.50 pg), while ‘Red Jewel’ had the lowest C value (0.74 pg). ANOVA showed that there were significant differences in the C value between ornamental begonia cultivars. The research results indicate significant diversity in DNA C values and genome sizes among different ornamental crabapple cultivars.
-
Keywords:
- Malus spp. /
- Flow cytometry /
- Genome size /
- DNA content
-
正常的雌雄配子育性是植物保证后代繁殖的关键因素。对于农作物而言,雌雄配子育性还决定了作物的结实率和产量[1]。雄性不育既是植物最重要的质量性状之一,也是研究水稻(Oryza sativa L.)、小麦(Triticum aestivum L.)、玉米(Zea mays L.)等重要农作物杂种优势利用的基础。目前在水稻、玉米、小麦等作物中利用“三系杂交”的育种方法将雄性不育应用于育种中,极大提高了作物的产量[1-3]。植物雄性育性调控机制已成为近年来杂种优势利用的热门研究方向。
花药和花粉的正常发育是植物雄性繁殖成功的先决条件。从雄蕊原基的形成到花粉粒成熟,直至花药开裂散粉,花药发育受到一系列精细化生物学过程的调控[4]。雄蕊原基细胞经过数轮细胞地分裂和分化,由外至内形成由表皮层、内皮层、中间层和绒毡层4层体细胞包围着花粉母细胞的花药结构。花粉母细胞位于花药室中间,经过减数分裂形成小孢子。小孢子又经过两次不均等的有丝分裂形成成熟的花粉[5]。
1. 植物花药角质层和花粉壁的主要成分
花药和花粉表面分别被花药角质层和花粉壁覆盖,对环境和生物胁迫具有保护作用。花药角质层主要由角质和蜡质组成,角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质围绕在角质的表面,主要由C16 ~ C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。覆盖在成熟花粉粒表面的花粉壁可保护花粉粒不受外界生物或者非生物胁迫损伤,而且能帮助花粉与柱头识别,促进花粉传播[8]。成熟花粉粒的花粉壁由花粉外壁(Exine)、花粉内壁(Intine)和含油层(Tryphine)3层结构组成。花粉壁是一种成分非常复杂的胞外细胞壁基质。目前的研究表明,花粉外壁外层的主要成分是孢粉素,由饱和长链脂肪酸前体或饱和长脂肪链前体经过复杂的生物聚合组成[8, 9]。花粉内壁的成分与普通的细胞壁类似,主要由纤维素、半纤维素和果胶聚合物组成[10]。花粉包被(Pollen coat)或含油层,主要由复杂的脂质、蜡酯、类黄酮、羟肉桂酰基亚精胺代谢产物和蛋白质组成[10]。
角质、蜡质和孢粉素分别是形成花药角质层和花粉外壁的主要成分。研究表明,它们的脂质前体在花药绒毡层细胞中合成,然后被分别转运到花药表面和小孢子表面沉积。前期科学家们通过正向遗传学的手段,分析花药角质层和花粉壁发育缺陷的突变体,鉴定得到一系列蛋白,包括脂质合成酶基因、脂质转运蛋白、转录因子和ABCG转运蛋白等[8, 10, 11]。随着研究的不断深入,大量ABCG转运蛋白被报道参与植物雄性育性调控,本文将系统阐述ABCG转运蛋白参与植物雄性育性调控的功能与机制。
2. ABC转运蛋白的结构特点与分类
ABC转运蛋白又名ATP(Adenosine triphosphate)结合盒式转运蛋白,属于最大的转运蛋白家族。它们广泛存在于微生物到高等植物甚至人类中[12]。ABC转运蛋白属于多结构域的跨膜蛋白,它通过利用自身ATP结合结构域,在Mg2 + 参与下水解ATP获得能量来转运分子,如异生素、激素、糖、氨基酸和离子等[13, 14]。
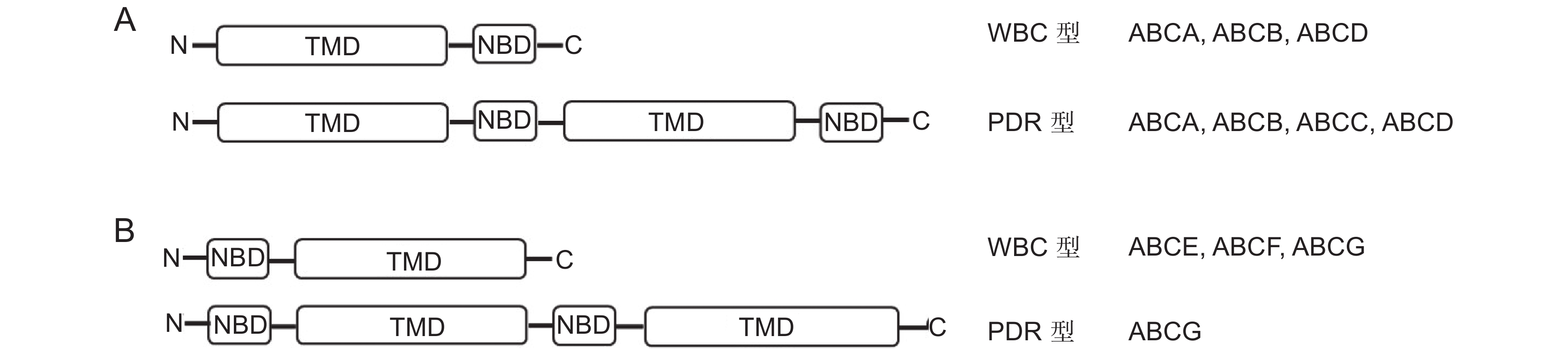
ABC转运蛋白由4个核心结构域组成:两个核苷酸结合结构域(Nucleotide-binding domain,NBD)和两个跨膜结构域(Transmembrane domain,TMD)(图1 :A、B)。根据NBD和TMD的组成可将ABC转运蛋白分为两类,一类是WBC (White/brown complex,WBC)型,其结构包含一个NBD和一个TMD,称为半分子(Half-size)转运蛋白,该类蛋白需要与自身或另外一个半分子转运蛋白结合,形成同源或异源二聚体蛋白发挥转运功能;另一类是PDR(Pleiotropic drug resistance,PDR)型,其结构包含两个NBD和两个TMD,称为全分子(Full-size)转运蛋白,可以单独发挥转运功能[12, 15]。值得一提的是,与其他真核生物ABC转运蛋白不同,植物半分子转运蛋白除了可形成同源二聚体外,还可以与另外的半分子转运蛋白形成异源二聚体[16]。
ABC转运蛋白的NBD和TMD结构域的排布可以是正向(TMD在前,NBD在后,图1:A),也可以是反向(TMD在后,NBD在前,图1:B)。在高等植物中,根据ABC转运蛋白遗传进化特征可分为8个亚族,分别是ABCA(ATP-binding cassette A transporter)至ABCI(ATP-binding cassette Ⅰ transporter),其中ABCH(ATP-binding cassette H transporter)转运蛋白在植物中不存在[17]。ABCA至ABCD(ATP-binding cassette D transporter)亚族蛋白由于TMD位于NBD之前,属于前向转运体[18]。ABCG亚族由于NBD位于TMD之前,属于反向转运体[18, 19]。
植物8个ABC转运蛋白亚族中,ABCG转运蛋白属于最大的一个亚族。在水稻、玉米和拟南芥(Arabidopsis thaliana (L.) Heynh.)中分别含有50、54和43个成员,其蛋白功能复杂多样[20]。其中拟南芥ABCG蛋白亚族包含28个半分子转运蛋白和15个全分子转运蛋白[17, 21]。随着研究的不断深入,ABCG转运蛋白被报道在植物生殖器官发育、激素运输、角质层形成、次生代谢产物分泌和生物或非生物胁迫响应等方面发挥重要作用[15, 22]。其中,ABCG转运蛋白主要是通过调控植物花粉壁的发育和花药角质层的形成来参与植物雄性育性发育过程[23]。
3. ABCG转运蛋白参与调控植物雄性不育的研究现状
3.1 参与调控花粉壁发育
近年来ABCG转运蛋白被多次研究报道参与转运由绒毡层产生的脂类、酚类、其他孢粉素前体物质以及含油层物质用于花粉壁形成[24]。早期研究发现,拟南芥AtABCG26基因与花粉外壁形成过程中多聚酮化合物的运输相关,该基因功能丧失后会导致植物育性显著降低[25-28]。水稻OsABCG15,又称为PDA1(Post-meitotic deficient anther 1),是AtABCG26的同源基因。pda1突变体由于乌氏体及花粉外壁缺失而导致小孢子败育[29, 30]。最近在玉米中首次报道ZmMS2(Zea mays male sterile2)参与调控花药发育,ZmMS2是OsABCG15和AtABCG26的同源基因,该基因突变后导致小孢子外壁发育不正常[31]。值得一提的是,水稻ABCG15基因突变后,突变体除了不能形成有功能的花粉外壁,其花药角质层发育也存在缺陷。但是拟南芥abcg26突变体的花药角质层发育正常。由此可推测水稻ABCG15可能与多个ABCG半分子转运蛋白相互作用,以运输不同的底物用于花粉外壁和花药角质层的形成。另外,Xu等[32]研究发现,拟南芥中一个bHLH转录因子AMS可以直接结合ABCG26基因启动子上的E-boxes,直接调控ABCG26基因的表达,从而影响花粉外壁的发育。但是目前尚未有研究报道水稻OsABCG15和玉米ZmMS2是否受到转录因子的调控。
早期研究报道拟南芥ABCG1和ABCG16基因参与木栓质和花粉壁细胞外屏障形成。abcg1 abcg16双突变体育性下降,花粉粒干瘪[33, 34]。水稻OsABCG3/LSP1(Less and shrunken pollen 1)是拟南芥ABCG1和ABCG16的同源基因,近期研究发现OsABCG3/LSP1可以转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失,最终导致植株完全雄性不育[35, 36]。以上研究成果提示,ABCG转运蛋白在不同物种中参与转运花粉壁发育前体物质的功能具有保守性。
此外,ABCG转运蛋白可同时转运多种底物用于植物生长和生殖发育。最新的研究发现,ABCG1和ABCG16除参与转运木栓质和孢粉素前体物质用于花粉发育外,还可影响拟南芥生殖器官中生长素的信号传导。abcg1abcg16双突变体雌蕊中花粉管生长受阻与生长素分布和生长素流动减少有关,此表型可以通过在雌蕊中添加外源生长素得到部分恢复[37]。值得一提的是,目前绝大部分参与植物雄性生殖器官发育的ABCG转运蛋白均属于半分子转运蛋白,关于ABCG全分子转运蛋白参与花药发育的研究报道极少。Choi等[38]研究发现,拟南芥ABCG半分子转运蛋白AtABCG9和ABCG全分子转运蛋白AtABCG31协同参与花粉壁合成。AtABCG9和AtABCG31在绒毡层中高表达,主要通过将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积,abcg9abcg31双突变体的花粉活力严重下降。
3.2 参与调控花药角质层发育
花药角质层可保护雄配子体免受外界环境影响[39]。角质作为角质层的结构骨架,主要由脂肪酸及其衍生物组成。蜡质主要围绕在角质基质的表面,由C16~C34脂肪酸及其衍生物组成,包括酯、醛、醇、酮和烷烃[6, 7]。
近年来,ABCG转运蛋白被报道参与转运植物角质和蜡质前体从而调控植物发育。Pighin等[40]的研究表明,拟南芥ABCG12/CER5(ECERIFERUM 5)主要从表皮细胞内转运蜡质前体至细胞表面。AtABCG12/CER5基因突变后,突变体茎秆表皮蜡质含量显著降低[40]。拟南芥ABCG11/DSO主要参与转运长链脂肪酸和超长链脂肪酸,该基因突变后,突变体不仅茎秆表面蜡质和角质含量显著性下降,而且突变体花器官脂质沉积和根软木质沉积均下降,突变体植株育性严重受到影响[41, 42]。进一步研究发现,ABCG11自身能形成同源二聚体,也能与ABCG12形成异源二聚体,但是ABCG12不能形成同源二聚体[16]。
与孢粉素前体或脂类物质从绒毡层细胞运输到花药室参与花粉壁的形成相比,绒毡层细胞产生的孢粉素前体或脂类物质如何被运输到花药表面用于花药角质层形成的研究报道较少。水稻ABCG半分子转运蛋白OsABCG26定位于花药表皮、内皮层和Stage 9期的绒毡层中,可将脂质分子从绒毡层转运到花药壁,供角质层发育需要。在osabcg26突变体中可以观察到大量电子致密的脂质颗粒包裹体沿着绒毡层细胞室壁连接至中间层,该现象提示OsABCG26可能主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。OsABCG26突变后会导致转运受阻,从而影响角质层形成,导致花粉败育[23, 43]。与OsABCG26蛋白不同,OsABCG15蛋白只定位于绒毡层内侧,并以极性方式面对花药室,因此被认为主要参与花粉外壁形成过程中脂质前体的分配[23]。由于osabcg26osabcg15双突变体的表型能减轻osabcg15单突变体表型,因此推测水稻OsABCG26和OsABCG15是协同调控雄性生殖发育的[23]。
ABCG转运蛋白作为植物大蛋白家族,通过介导脂质代谢,特别是脂质和酚类物质前体在花药层细胞两侧转运以形成花粉发育最重要的两个保护屏障——花粉壁和花药角质层。目前ABCG半分子转运蛋白参与花药发育的研究大部分只停留在表型上的观察,具体的分子机制尚未明确。Zhu等[44]首次研究报道蒺藜苜蓿(Medicago truncatula Gaertn.)ABCG转运蛋白SGE1(Stigma exsertion1)可通过影响花器官中蜡质和角质等长链脂肪酸的运输导致雌雄蕊隔离,形成柱头外露型雄性不育材料。SGE1蛋白可与另一个半分子转运蛋白MtABCG13相互作用,形成一个有功能的异源二聚体。对ABCG蛋白的功能进行深入研究,将有助于阐明其在植物雄性生殖器官发育中的分子机制。
近期,Fang等[45]首次报道玉米一个雄性不育新基因ZmMS13在花药和花粉发育的前期(Stage 5)、中期(Stage 8b)和后期(Stage 10)具有3个表达峰,分别受转录因子ZmbHLH122、ZmMYB84和ZmMYB33-1/-2调控,从而分别影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成。该研究首次发现ABCG基因多峰值表达受不同转录因子调控,并阐明其具体的分子机理,拓展了植物ABCG转运蛋白的生物学功能。
表1汇总了目前在玉米、拟南芥和水稻中报道的ABCG转运蛋白参与植物雄性育性调控的研究进展。
表 1 参与植物雄性育性调控的ABCG转运蛋白Table 1. ABCG transporters involved in regulation of plant male fertility物种
Species基因名称
Gene name转运蛋白类型
Transport protein type具体功能
Functions文献
References拟南芥
Arabidopsis thaliana (L.) Heynh.ABCG26/
WBC27半分子 参与花粉外壁形成过程中多聚酮化合物的运输,该基因突变后,花粉外壁发育异常,植株育性显著下降 [25-28] 水稻Oryza sativa L. ABCG15/
PDA1半分子 参与花药角质层、乌氏体及花粉外壁发育 [29, 30] 玉米Zea mays L. MS2 半分子 参与花粉外壁发育,GC-MS分析结果显示ms2突变体花药角质和蜡质单体显著下降 [31] 拟南芥 ABCG1 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 拟南芥 ABCG16 半分子 参与木栓质和花粉壁细胞外屏障形成,还可影响拟南芥生殖器官中生长素的信号传导 [33, 34, 37] 水稻 OsABCG3/
LSP1半分子 参与转运绒毡层和花粉壁合成的前体物质用于植物生殖发育,该基因功能缺失后会引起花药绒毡层异常降解、花粉外壁内层及花粉内壁层缺失 [35, 36] 拟南芥 ABCG9 半分子 与ABCG31协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG31 全分子 与ABCG9协同将特定甾醇糖苷转运到花粉表面用于花粉含油层的沉积 [38] 拟南芥 ABCG12/
CER5半分子 参与从表皮细胞内转运蜡质前体至细胞表面 [40] 拟南芥 ABCG11/
DSO半分子 转运长链脂肪酸和超长链脂肪酸 [41, 42] 水稻 ABCG26 半分子 主要负责将脂质物质从绒毡层转运到花药壁表面供角质层形成。该基因突变后,突变体花粉外壁及花药角质层发育存在缺陷,还可以影响花粉管伸长 [23, 43] 蒺藜苜蓿
Medicago truncatula Gaertn.SGE1 半分子 影响蒺藜苜蓿花器官中蜡质和角质等长链脂肪酸的运输 [44] 玉米 ZmMS13 半分子 影响胼胝质降解、绒毡层程序性死亡和花粉外壁以及花药角质层的形成 [45] 拟南芥 ABCG28 半分子 将多胺和活性氧定位于正在生长的花粉管尖端 [46] 最新的研究发现,拟南芥AtABCG28在成熟花粉和生长的花粉管中特异表达,该蛋白定位于分泌囊泡膜上。当AtABCG28基因突变后,花粉管生长缺陷,无法将多胺和活性氧定位于正在生长的花粉管尖端,植株表现为完全雄性不育[46]。图2总结和归纳了目前研究中主要的ABCG转运蛋白参与植物雄性育性调控的具体功能。
4. 展望
ABCG作为ABC转运蛋白最大的一个亚族,参与植物发育中各种生理过程。本文首先概述了植物花药角质层和花粉壁的主要成分,其次总结了ABC转运蛋白的结构特点,最后重点阐述ABCG转运蛋白参与调控植物花药和花粉发育的具体功能。随着研究不断深入,ABCG转运蛋白参与植物雄性育性调控的功能不再局限于调控花药角质层和花粉外壁的发育。
虽然ABCG转运蛋白的研究报道较多,但是其具体转运的底物尚未研究清楚。目前对于ABCG转运蛋白功能的研究主要采用反向遗传学的方法,通过气相色谱-质谱联用仪(GC-MS)分析ABCG突变体和野生型的特定部位组织的代谢产物差异,对ABCG转运蛋白的底物或者底物类别做出合理的猜测。目前在拟南芥、水稻、玉米等植物中大部分的ABCG转运蛋白底物均是该方法预测的[23, 38, 45]。此外,根据ABCG转运蛋白的特点,目前最直接有效的ABCG转运底物鉴定方法是通过一个转运实验以严格的ATP依赖的方式证明其跨膜转运活性。该转运实验的先决条件是将ABCG转运蛋白在适当的系统中进行过表达,如烟草(Nicotiana tabacum L.)原生质体系统或者酵母菌株(YMM12和BY-2)细胞系[20]。目前拟南芥ABCG转运蛋白的底物可通过体内同位素标记实验进行检测。例如,通过烟草原生质体系统构建的转运实验鉴定拟南芥ABCG11和ABCG32可以转运10,16-二羟基、C16∶0-2甘油和W-OH C16∶0等角质前体用于植物角质层形成[22]。但是用同位素标记进行实验鉴定ABCG转运蛋白的底物非常耗时,且许多同位素化合物尚未商业化,因此阻碍了该技术的利用。除此之外,基于使用双光子显微镜的研究结果表明,聚酮化合物是拟南芥ABCG26的底物。当AtABCG26基因突变后,突变体在绒毡层细胞中积累了大的荧光液泡,小孢子中的荧光丧失。当AtABCG26基因和编码孢粉素聚酮化合物生物合成代谢基因构建双突变体(atabcg26 acos5(acyl coenzyme A synthetase5)、atabcg26 tkpr1)以及三突变体(atabcg26 pksa(polyketide synthase a) pksb),这些双突变体和三突变体花药绒毡层细胞并未观察到荧光液泡内含物[28]。因此,可以推测AtABCG26将聚酮化合物从绒毡层细胞转运到花粉壁形成孢粉素骨架。
目前ABCG家族蛋白参与植物花药发育的报道集中于对ABCG半分子转运蛋白的研究。ABCG半分子转运蛋白需要通过同源或者异源二聚体的方式形成一个有功能的ABCG转运蛋白。通过寻找与其他ABCG共表达的基因,或者通过酵母筛库,或者质谱等方式鉴定ABCG转运蛋白的潜在伴侣,并研究其分子生物学功能,可拓宽ABCG转运蛋白参与植物雄性育性调控的具体分子机制。由于ABCG转运蛋白在不同植物中具有保守性,因此其同源基因在其他作物中可能也发挥类似的作用,通过反向遗传学的方法,例如利用基因编辑,可加深我们对ABCG转运蛋白在多种植物中的功能机制的了解。而所获得的雄性不育等优良性状的突变系在杂交作物育种和种子生产中具有广泛的应用前景。
-
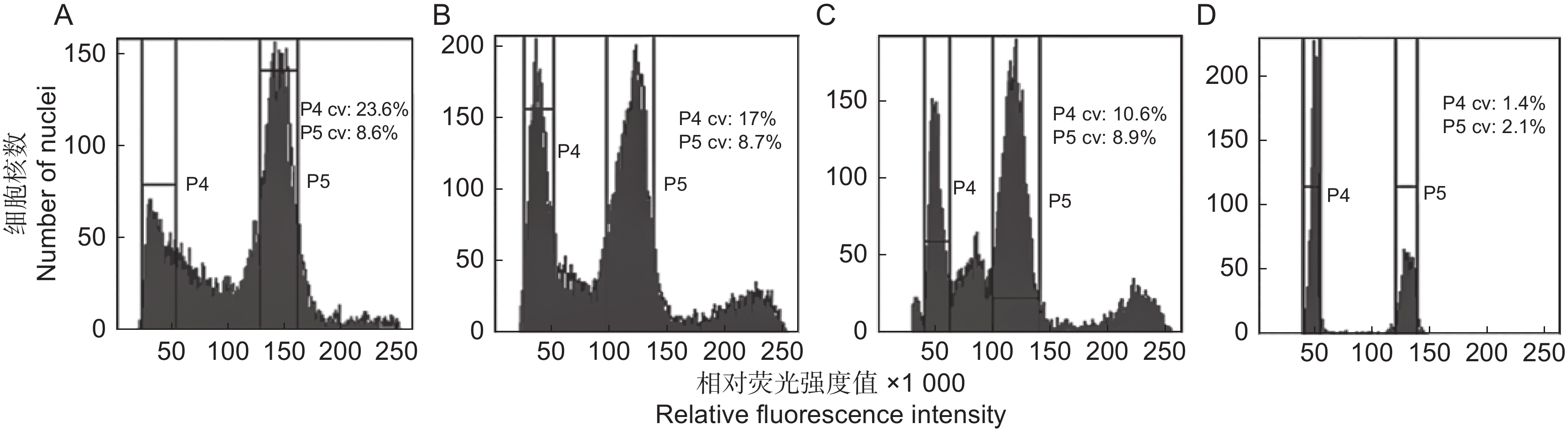
图 1 不同内标与观赏海棠‘皇家雨点’的流式直方图
A:大豆和‘皇家雨点’;B:水稻和‘皇家雨点’;C:楸子和‘皇家雨点’;D:玉米和‘皇家雨点’。P4:‘皇家雨点’峰位;P5:内标峰位;CV表示变异系数。
Figure 1. Flow histograms of different internal indexes and Malus ‘Royal Raindrop’
A: Glycine max and ‘Royal Raindrop’; B: Oryza sativa and ‘Royal Raindrop’; C: M. Prunifolia and ‘Royal Raindrop’; D: Zea mays and ‘Royal Raindrop’. P4: ‘Royal Raindrop’ peak; P5: Internal standard peak; CV represents coefficient of variation.
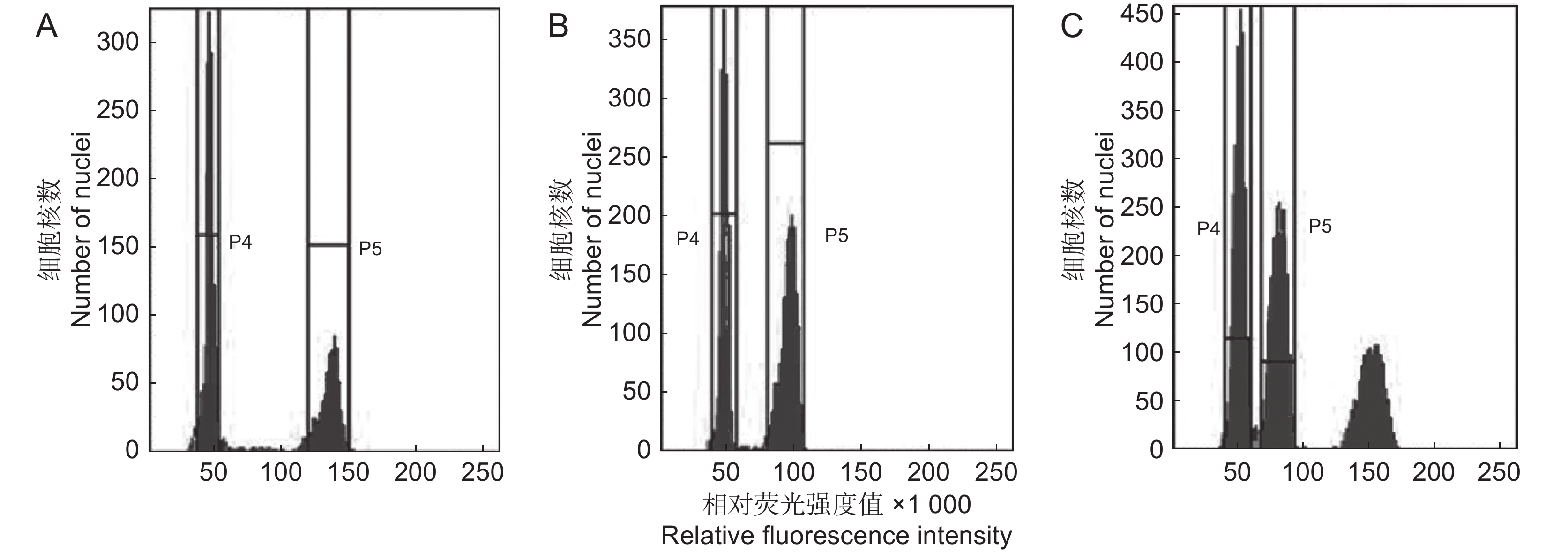
图 2 部分观赏海棠与标样混合样本的流式直方图
A:‘黄金甲’和玉米; B:‘火鸟’和玉米;C:‘玛丽波特’和玉米。P4:观赏海棠峰位;P5:玉米峰位。
Figure 2. Flow cytometry results of mixed samples of some Malus spp. and standard sample
A: ‘Fairytail Gold’ and Zea mays; B: ‘Firebird’ and Zea mays; C: ‘Mary Potter’ and Zea mays. P4: Peak position of ornamental crabapple; P5: Zea mays peak.
表 1 供试海棠品种名称
Table 1 Malus spp. cultivar list applied in the test
序号 Code 品种 Cultivars 序号 Code 品种 Cultivars 1 ‘春之韵’ ‘Spring Sensation’ 10 ‘灰姑娘’ ‘Cinderella’ 2 ‘蒂娜’ ‘Tina’ 11 ‘火鸟’ ‘Firebird’ 3 ‘范艾斯汀’ ‘Van Eseltine’ 12 ‘金丰收’ ‘Harvest Gold’ 4 ‘高原红’ ‘Prairifire’ 13 ‘金雨滴’ ‘Golden Raindrop’ 5 ‘红哨兵’ ‘Red Sentinel’ 14 ‘玛丽波特’ ‘Mary Potter’ 6 ‘红衣主教’ ‘Cardinal’ 15 ‘美果海棠’ ‘Calocarpa’ 7 ‘红珠宝’ ‘Red Jewel’ 16 ‘时光秀’ ‘Show Time’ 8 ‘皇家雨点’ ‘Royal Raindrop’ 17 ‘斯普伦格’ ‘Professor Sprenger’ 9 ‘黄金甲’ ‘Fairytail Gold’ 18 ‘紫王子’ ‘Purple Prince’ 表 2 几种常用解离液对样品的处理效果对比
Table 2 Comparison in using different isolation buffers to deal with samples
物种
SpeciesmGb解离液
mGb bufferTris-Mgcl2解离液
Tris-Mgcl2 bufferLB01解离液
LB01 bufferGalbraith’s解离液
Galbraith’s buffer玉米Zea mays L. cv.‘B73’ CV<4% CV<5% CV<5% CV<5% 大豆Glycine max (L.)Merr. CV<6% CV<5% CV<5% CV<6% 楸子Malus prunifolia (Willd.) Borkh. CV<5% CV<6% CV<6% CV<8% 水稻Oryza sativa subsp. japonica
cv.‘Nipponbare’CV<5% CV<8% CV<5% CV<5% 观赏海棠‘皇家雨点’Malus ‘Royal Raindrop’ CV<3% CV<6% CV<6% CV<8% 注:CV表示变异系数。 Note: CV represents coefficient of variation. 表 3 观赏海棠样品流式细胞术测定结果
Table 3 Results of flow cytometry of ornamental Malus spp. samples
序号
Code品种名
Cultivars内参平均荧光强度
Average internal reference
fluorescence intensity待测样品平均荧光强度
Average samples to be tested
fluorescence intensity平均DNA指数
Mean DNA index1C值
1C value / pg基因组大小
Genome size / Mbp1 ‘春之韵’ 89 268 46 030 0.52 1.26±0.01b 1 232.28 2 ‘蒂娜’ 105 605 55 412 0.52 1.28±0.02b 1 251.84 3 ‘范艾斯汀’ 129 051 45 702 0.35 0.87±0.01e 850.28 4 ‘高原红’ 127 654 45 673 0.36 0.85±0.02ef 831.30 5 ‘红哨兵’ 136 645 50 094 0.37 0.91±0.01d 889.98 6 ‘红衣主教’ 100 646 49 065 0.49 1.18±0.01c 1 154.04 7 ‘红珠宝’ 139 821 42 288 0.30 0.74±0.01i 723.72 8 ‘皇家雨点’ 127 846 45 916 0.36 0.85±0.02efg 831.30 9 ‘黄金甲’ 132 992 42 776 0.32 0.75±0.02i 733.50 10 ‘灰姑娘’ 121 731 40 875 0.34 0.82±0.01gh 806.21 11 ‘火鸟’ 92 371 44 177 0.48 1.16±0.01c 1 134.48 12 ‘金丰收’ 136 737 47 981 0.35 0.86±0.01ef 842.51 13 ‘金雨滴’ 138 446 47 158 0.34 0.85±0.01fg 831.30 14 ‘玛丽波特’ 77 819 47 948 0.62 1.50±0.01a 1 467.00 15 ‘美果海棠’ 160 637 53 281 0.33 0.82±0.01gh 801.96 16 ‘时光秀’ 137 232 44 652 0.33 0.81±0.01h 792.18 17 ‘斯普伦格’ 152 962 50 215 0.33 0.80±0.01h 782.40 18 ‘紫王子’ 123 844 45 587 0.37 0.91±0.02d 889.98 注:每个样品设3次重复;表中数据为平均值±标准误;1C值栏中数据后的不同小写字母表示差异显著(P<0.05)。
Notes: Three replicates for each sample; data in table are average values±SD; Different lowercase letters after the data in the 1C value column indicate significant difference(P<0.05). -
[1] 徐曼. 红果肉海棠资源亲缘关系的AFLP分析[D]. 杨凌:西北农林科技大学,2014:1−10. [2] 唐菲,丁增成,任杰,史丹,刘祚军,等. 我国观赏海棠种类及品种概述[J]. 安徽农业科学,2015,43(16):190−195. [3] 钱关泽,汤庚国. 苹果属植物分类学研究进展[J]. 南京林业大学学报(自然科学版),2005,29(3):94−98. Qian GZ,Tang GG. A review on the plant taxonomic study on the genus Malus Miller[J]. Journal of Nanjing Forestry University(Natural Sciences Edition),2005,29(3):94−98.
[4] 楚爱香,汤庚国. 观赏海棠品种分类研究进展[J]. 生物学通报,2008,43(7):15−17. doi: 10.3969/j.issn.0006-3193.2008.07.005 Chu AX,Tang GG. Advances in research on classification of ornamental crabapple[J]. Bulletin of Biology,2008,43(7):15−17. doi: 10.3969/j.issn.0006-3193.2008.07.005
[5] 张往祥,张龙,江皓,范俊俊,周婷,曹福亮. 观赏海棠新品种‘洛可可女士’[J]. 南京林业大学学报(自然科学版),2019,43(4):203−204. Zhang WX,Zhang L,Jiang H,Fan JJ,Zhou T,Cao FL. A new ornamental crabapple cultivar ‘Luokeke Nüshi’[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2019,43(4):203−204.
[6] 胡丁猛,许景伟,王立辉,囤兴建,朱升祥,杨健. ‘蕊沁’等7个海棠新品种[J]. 南京林业大学学报(自然科学版),2021,45(4):238−242. doi: 10.12302/j.issn.1000-2006.202002022 Hu DM,Xu JW,Wang LH,Dun XJ,Zhu SX,Yang J. Seven new crabapple cultivars such as ‘Rui Qin’[J]. Journal of Nanjing Forestry University(Natural Sciences Edition)2021,45(4):238−242. doi: 10.12302/j.issn.1000-2006.202002022
[7] 张俊环,杨丽,姜凤超,张美玲,孙浩元,王玉柱. 基于流式细胞仪对杏属植物基因组大小的测定[J]. 华北农学报,2020,35(5):32−38. doi: 10.7668/hbnxb.20191226 Zhang JH,Yang L,Jiang FC,Zhang ML,Sun HY,Wang YZ. Estimation of genome size of apricots based on flow cytometry[J]. Acta Agriculturae Boreali-Sinica,2020,35(5):32−38. doi: 10.7668/hbnxb.20191226
[8] Doležel J,Bartoš J,Voglmayr H,Greilhuber J. Nuclear DNA content and genome size of trout and human[J]. Cytometry A,2003,51A(2):127−128. doi: 10.1002/cyto.a.10013
[9] Arumuganathan K,Earle ED. Nuclear DNA content of some important plant species[J]. Plant Mol Biol Rep,1991,9(3):208−218. doi: 10.1007/BF02672069
[10] 严东莹,李艳,孙文礼,陈进明,李治中. 基于流式细胞术的海菜花属植物基因组大小测定[J]. 植物科学学报,2020,38(2):173−180. doi: 10.11913/PSJ.2095-0837.2020.20173 Yan DY,Li Y,Sun WL,Chen JM,Li ZZ. Estimation of genome sizes of plants from Ottelia Pers. Based on flow cytometry[J]. Plant Science Journal,2020,38(2):173−180. doi: 10.11913/PSJ.2095-0837.2020.20173
[11] 李雯雯,刘立强,帕米尔·艾尼,王亚楠,程功,廖康. 利用流式细胞术鉴定新疆野杏染色体倍性和DNA含量[J]. 农业生物技术学报,2019,27(3):542−550. Li WW,Liu LQ,Pamier·Aini,Wang YN,Cheng G,Liao K. Identification of chromosomal ploidy and DNA content in Xinjiang Armeniaca vulgaris by flow cytometry[J]. Journal of Agricultural Biotechnology,2019,27(3):542−550.
[12] 潘根,董志雪,唐蜻,程超华,臧巩固,等. 流式细胞术测定玫瑰茄及红麻的基因组大小[J]. 中国麻业科学,2021,43(5):217−221. doi: 10.3969/j.issn.1671-3532.2021.05.001 Pan G,Dong ZX,Tang Q,Cheng CH,Zang GG,et al. Estimation of genome size of two species from Hibiscus and kenaf by flow cytometry[J]. Plant Fiber Sciences in China,2021,43(5):217−221. doi: 10.3969/j.issn.1671-3532.2021.05.001
[13] Kang M,Tao JJ,Wang J,Ren C,Qi QW,et al. Adaptive and nonadaptive genome size evolution in Karst endemic flora of China[J]. New Phytol,2014,202(4):1371−1381. doi: 10.1111/nph.12726
[14] 陈林,宋丽. 流式细胞术的发展及在植物研究中的应用[J]. 生物工程学报,2023,39(2):472−487. Chen L,Song L. Development of flow cytometry and its application in plant research[J]. Chinese Journal of Biotechnology,2023,39(2):472−487.
[15] 邹璇,孙李勇,万小霞,陈瑶,林峰,尹增芳. 玉兰亚属多倍体植物DNA C-值流式细胞术测定体系的建立[J]. 植物科学学报,2020,38(3):369−377. Zou X,Sun LY,Wan XX,Chen Y,Lin F,Yin ZF. Establishment of flow cytometry system for DNA C-value determination of polyploid species in subgenus Yulania[J]. Plant Science Journal,2020,38(3):369−377.
[16] 汪艳,肖媛,刘伟,李婷婷,胡锐,乔志仙. 流式细胞仪检测高等植物细胞核DNA含量的方法[J]. 植物科学学报,2015,33(1):126−131. Wang Y,Xiao Y,Liu W,Li TT,Hu R,Qiao ZX. Operation skills of flow cytometer for detecting nuclear DNA contents in higher plant cells[J]. Plant Science Journal,2015,33(1):126−131.
[17] Galbraith DW. Simultaneous flow cytometric quantification of plant nuclear DNA contents over the full range of described angiosperm 2C values[J]. Cytometry A,2009,75A(8):692−698. doi: 10.1002/cyto.a.20760
[18] 林峰,周翔宇,徐莉,孙海军,宣艳. 几种鼠尾草属植物基因组C值测定[J]. 农业生物技术学报,2017,25(10):1622−1628. Lin F,Zhou XY,Xu L,Sun HJ,Xuan Y. Estimation of genomic C value in several species of Salvia[J]. Journal of Agricultural Biotechnology,2017,25(10):1622−1628.
[19] 李彩琴,王泽槐,徐咏珊,张劲霭,李建国. 流式细胞术细胞核分离缓冲液的改良及大、小果型荔枝幼果和果皮细胞分裂活性比较[J]. 园艺学报,2011,38(9):1781−1790. Li CQ,Wang ZH,Xu YS,Zhang JA,Li JG. Improvement of the cell nuclei suspensions for flow cytometry and comparison on the cell division activity of litchi fruitlet and pericarp which having different final fruit size[J]. Acta Horticulturae Sinica,2011,38(9):1781−1790.
[20] 田新民,周香艳,弓娜. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报,2011,27(9):21−27. Tian XM,Zhou XY,Gong N. Applications of flow cytometry in plant research:analysis of nuclear DNA content and ploidy level in plant cells[J]. Chinese Agricultural Science Bulletin,2011,27(9):21−27.
[21] 杨转英,吴传龙,丰锋,吕庆芳,王俊宁,叶春海. 不同株系菠萝蜜染色体倍性及基因组大小分析[J]. 果树学报,2015,32(4):567−571. Yang ZY,Wu CL,Feng F,Lü QF,Wang JN,Ye CH. Determination and analysis of ploidy and genome size of different jackfruit lines[J]. Journal of Fruit Science,2015,32(4):567−571.
[22] 杨慧娴,饶培瑜,胡晶晶,欧晓昆,李志敏. 应用流式细胞术测定绢毛苣属4种8居群基因组大小[J]. 植物科学学报,2019,37(6):775−780. doi: 10.11913/PSJ.2095-0837.2019.60775 Yang HX,Rao PY,Hu JJ,Ou XK,Li ZM. Estimation of genome size from eight populations of four species of Soroseris Stebbins by flow cytometry[J]. Plant Science Journal,2019,37(6):775−780. doi: 10.11913/PSJ.2095-0837.2019.60775
[23] 黄阿晶,周佳熠,李天泽,邢怡德,高飞,周宜君. 基于流式细胞术和K-me分析的苦豆子基因组大小估测[J]. 中草药,2019,50(24):6098−6102. doi: 10.7501/j.issn.0253-2670.2019.24.026 Huang AJ,Zhou JY,Li TZ,Xing YD,Gao F,Zhou YJ. Flow cytometry and K-mer analysis estimates of genome size of Sophora alopecuroides[J]. Chinese Traditional and Herbal Drugs,2019,50(24):6098−6102. doi: 10.7501/j.issn.0253-2670.2019.24.026
[24] 黄茂根,沈凝,刘雪羽,吴兴盛,陈爱平,等. 利用流式细胞术鉴定桦木染色体倍性和DNA含量[J]. 西南林业大学学报,2023,43(1):49−57. doi: 10.11929/j.swfu.202105029 Huang MG,Shen N,Liu XY,Wu XS,Chen AP,et al. Identification of chromosomal ploidy and DNA content in Betula by flow cytometry[J]. Journal of Southwest Forestry University,2023,43(1):49−57. doi: 10.11929/j.swfu.202105029
[25] Mank JE,Avise JC. Cladogenetic correlates of genomic expansions in the recent evolution of actinopterygiian fishes[J]. Proc R Soc B Biol Sci,2006,273(1582):33−38. doi: 10.1098/rspb.2005.3295



 下载:
下载: