Characterization of leaf phenotypic traits in natural populations of three Polyspora species
-
摘要:
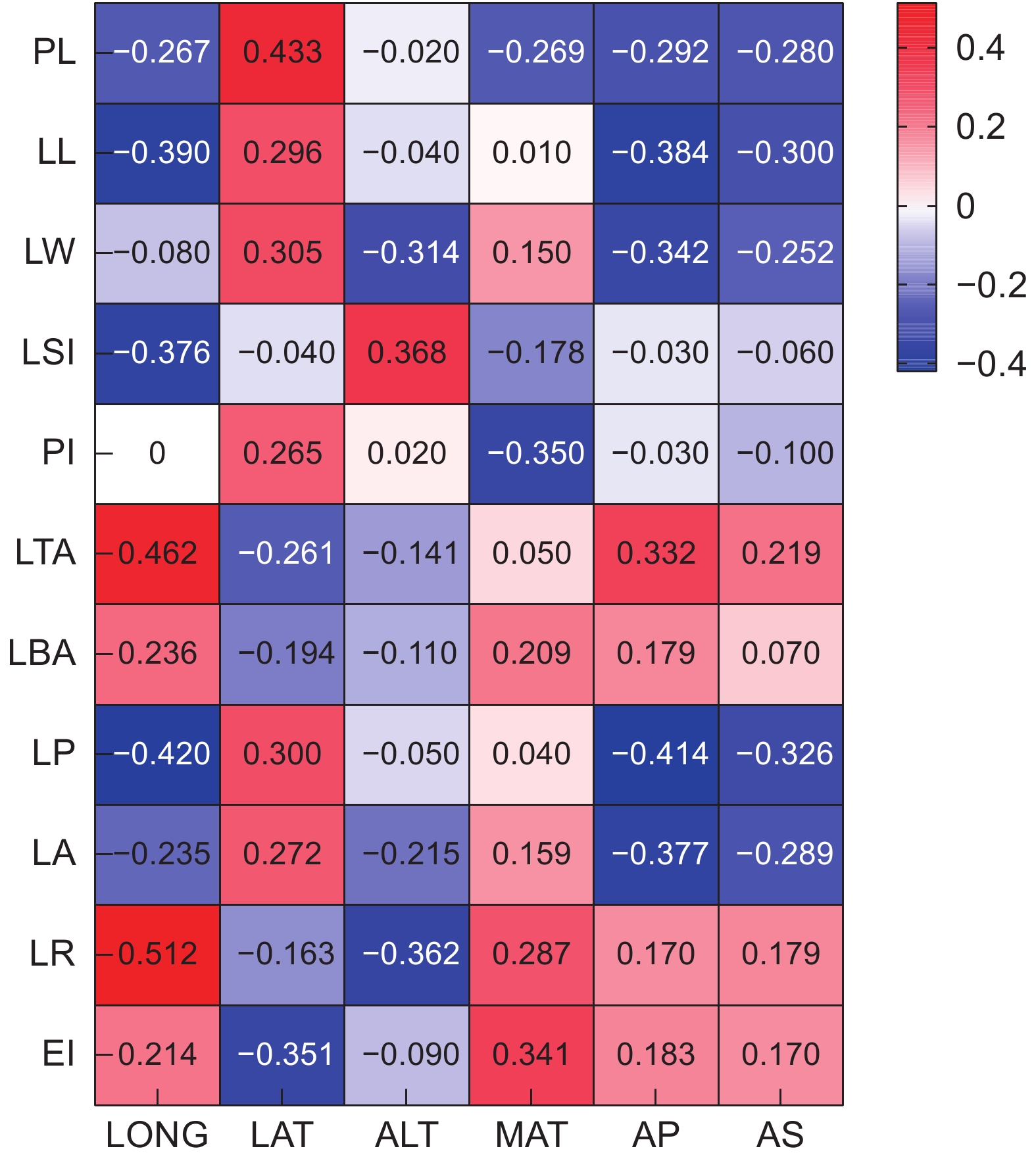
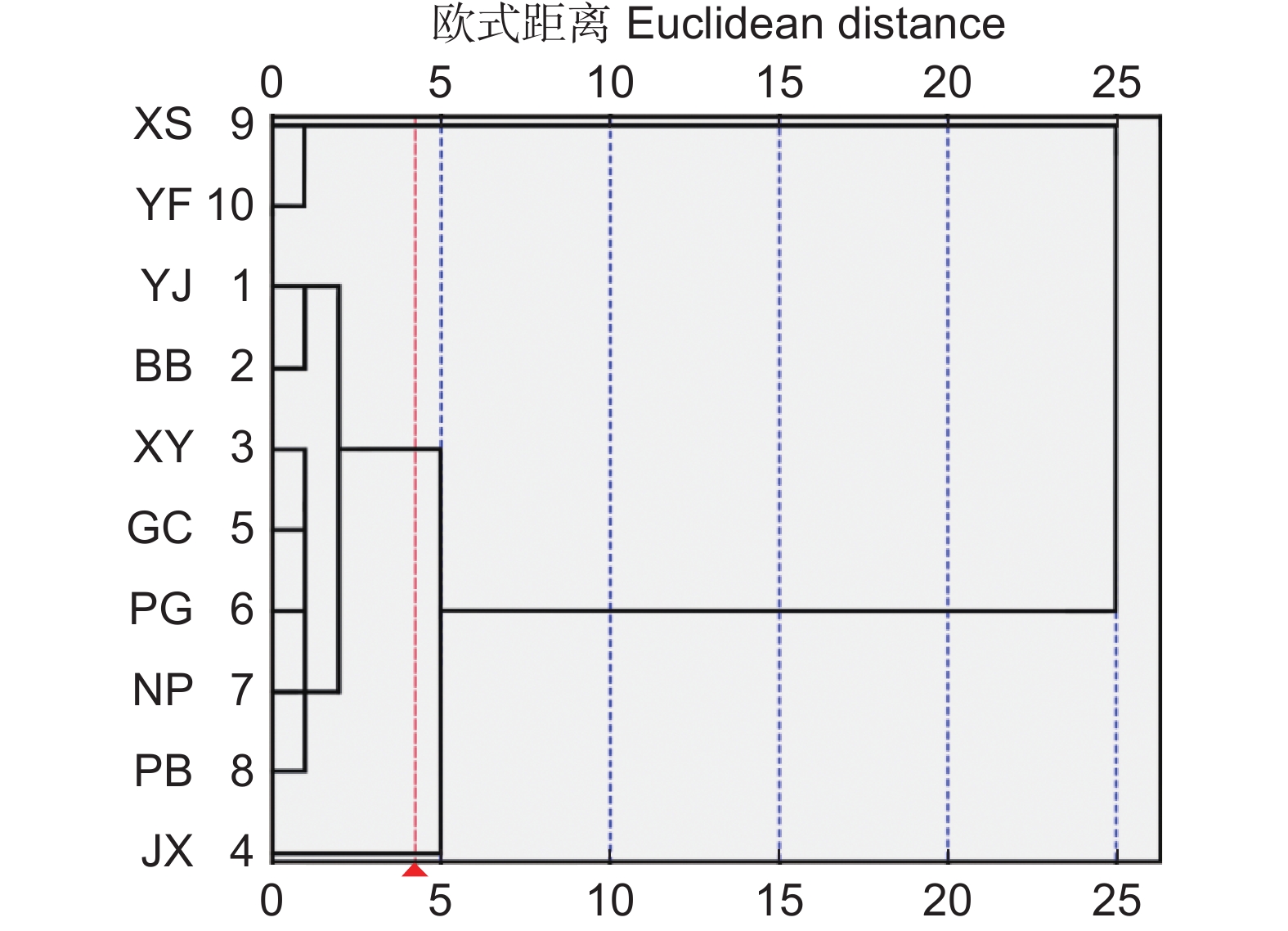
以大头茶属(Polyspora)3种植物的10个天然居群为研究对象,通过多重比较、巢式方差分析、相关性分析、主成分分析和聚类分析等方法,对11个叶表型性状的变异规律进行研究。结果显示:(1)叶表型性状在居群内和居群间均存在极显著差异(P<0.01),平均变异系数为17.03%,不同性状的变异幅度为0.05%~31.37%。叶表型性状在居群内和居群间的方差分量均值分别为180.79和82.63,表明叶表型性状分化程度为居群内高于居群间。(2)叶宽、叶柄长、叶面积、叶基角、叶圆度和叶柄指数为叶表型变异的主导因素;各表型性状之间存在明显的相关性,环境因子对大头茶属植物叶表型性状变异的影响很大;基于叶表型性状可将10个居群分为3类。研究结果可为大头茶属植物的适应性进化和开发利用提供理论依据。
Abstract:Leaf phenotypic variation among 10 populations of three Polyspora species was analyzed using multiple comparisons, nested variance analysis, correlation analysis, principal component analysis (PCA), and cluster analysis. Results revealed: (1) Significant differences in leaf phenotypic traits both within and among Polyspora populations (P<0.01). The average coefficient of variation was 17.03%, with trait-specific variation ranging from 0.05% to 31.37%. Mean variance components for leaf traits were higher within populations (180.79) than among populations (82.63), indicating greater differentiation within populations. (2) Dominant contributors to phenotypic variation included leaf width, petiole length, leaf area, leaf base angle, leaf roundness, and petiole index. Significant correlations among leaf traits were identified, highlighting the strong influence of environmental factors on leaf phenotypic variation. Cluster analysis grouped the 10 populations into three distinct groups based on leaf phenotypic traits. The results provide valuable insights into the adaptive evolution and exploitation of Polyspora species.
-
Keywords:
- Leaf traits /
- Natural population /
- Phenotypic variation /
- Environmental factors /
- Polyspora
-
高寒草地是青藏高原最主要的生态系统,是维护国家生态安全和改善青藏高原地区农牧民生活质量的重要保障[1]。在过去几十年里,受人类活动和自然因素的影响,高寒草地的生产和生态功能急剧下降,造成大面积土地裸露和草畜不平衡等诸多问题[2]。最近,经过相关领域学者们的不断探索实践,我国高寒草地退化的趋势明显改善,植被覆盖度大幅提升,水土流失和荒漠化基本遏制[3]。然而,青藏高原地区气候寒冷,有机质分解较慢,土壤微生物活性较低[4],导致退化草地治理周期较长,草畜矛盾仍未能有效解决。因此,在退化草地恢复的同时,建植多年生人工草地便成为满足生产和生态功能需求的重要手段。在实践中发现,多年生高寒栽培草地在建植2~3年后地上生物量达到峰值,第4年开始其地上生物量逐年下降,且饲草品质普遍较低[5]。究其原因,与青藏高原地区土壤氮限制密切相关[6]。青藏高原地区土壤氮限制极其严重,加之气温较低,严重抑制了与氮有关的功能微生物的活性,导致生产力较低[6]。此外,多年生牧草常年吸收土壤中的营养物质,导致土壤养分贫瘠,进而造成草地减产[7]。综合两方面的原因,氮添加成为提升多年生栽培草地生产功能的直接手段。
氮素形态和施氮水平是草地氮肥管理的两项重要内容,对植物生长发育起着关键调节作用。根据化合物形态可将氮肥分为铵态氮肥(A)、酰胺态氮肥(U)和硝态氮肥(N)等多种类型,不同形态氮肥均能促进植物的生长,但在土壤中的转化机制不同,导致植物的干物质分配和营养积累存在差异[8]。植物可以吸收利用的土壤氮素主要为硝态氮和铵态氮,氮素形态对不同植物生长发育的影响存在差异,氮肥形态是影响肥效的主要因素之一[9]。施用不同形态氮素会影响作物的根系发育及碳氮代谢等生理进程,进而影响植株生物量的积累。同时,氮素形态还会影响糖、激素、维生素和生物碱等各种化学物质的合成,进而影响植物的品质[10]。向雪梅等[11]在高寒区的施氮研究表明,酰胺态氮能保证植物较高的氮素利用率和较低的氮损失率,是提高植物生产力最佳的氮素形态,而Guo等[12]研究发现,硝态氮能促进野牛草(Buchloe dactyloides (Nutt.) Engelm.)的营养繁殖和品质积累。两种结果不一致的主要原因是不同植物对氮素形态的需求存在差异,故应根据植物类型和生存环境设置合理的氮源。对于青藏高原地区多年生高寒栽培草地而言,哪种氮素形态更有利于生产力和营养品质的积累不得而知。此外,研究施氮水平对植物生产性能的影响并确定合理的氮添加量也是科学添加氮肥的关键[13]。以往研究证实,合理的氮添加量是保证植物生产力和营养品质的关键[14],但关于具体氮添加量始终没有形成统一的结论,这是因为施氮水平应符合环境状况,不同区域氮素水平的阈值存在显著差异,氮限制比较严重的土壤环境可能需要施加更多的氮肥来满足植物的生长需求[15]。但过量的氮添加不仅造成氮肥利用率下降,也会对生态环境构成威胁。因此,确定最佳施氮量也是维持多年生高寒栽培草地生产力和营养品质的核心目标。
鉴于此,本研究以4年龄人工草地为研究对象,设置3个氮素形态和4个施氮水平,通过比较不同处理植物的地上生物量和饲草营养品质等参数,探究不同氮素形态和施氮水平对饲草生产性能和营养品质的影响,通过灰色关联度综合分析,进一步筛选出最佳的氮素形态和施氮水平,以期为高寒地区优质饲草的生产提供科学依据。
1. 材料与方法
1.1 试验区概况
试验区位于青海省海南藏族自治州共和县巴卡台农牧场(36°17'N,100°55'E),平均海拔3 300 m,年均降水量为300 mm,年蒸发量在2 000~2 400 mm,年平均气温为4.1 ℃。试验区冬季寒冷漫长,夏季温和短暂,年内干旱少雨且温度偏低,气温垂直分布明显,太阳辐射强,属高原大陆性气候特征。降水季节性分布不均,主要集中在7-10月。试验地土壤为高山草甸土和黄绵土[16]。
1.2 试验设计
于2022年6月,以2019年建植的青海草地早熟禾(Poa pratensis L. cv. Qinghai)+青海中华羊茅(Festuca sinensis L. cv. Qinghai)混播草地为研究对象,两个物种的混播比例为1∶1,建植面积为15 m×150 m。设置小区时,为避免边际效应,选取整块地中间较均匀的地段,采用随机区组设计,设置3个氮素形态,分别为尿素(酰胺态氮,U)、硫酸铵(铵态氮,A)和硝酸钙(硝态氮,N);参照中国氮沉降分布格局(青海地区干湿沉降率7.55 kg·hm−2·yr−1)确定氮素添加剂量,设4个施氮梯度,分别为青海省干湿氮沉降的0、3、6、9倍,浓度依次为0(T0,CK)、22.5(T1)、45(T2)、67.5 kg·hm−2·a−1(T3),各处理见表1。每个处理3个重复,共30个小区,小区面积为4 m×4 m,小区之间间隔5 m。将称好的肥料分为两等份,分别于6月上旬和下旬加到2 L水中溶解,摇匀后装入喷壶,均匀喷洒在相应的小区内,CK处理喷洒相同体积的水。
表 1 氮素形态和施氮水平设置Table 1. Nitrogen forms and nitrogen level settings施肥处理
Fertilization treatment氮素形态
Nitrogen form施氮水平
Nitrogen level / kg·hm−2·a−1T0(CK) − 0.0 UT1 酰胺态氮 22.5 UT2 45.0 UT3 67.5 AT1 铵态氮 22.5 AT2 45.0 AT3 67.5 NT1 硝态氮 22.5 NT2 45.0 NT3 67.5 1.3 样品采集与分析
1.3.1 样品采集与处理
于2022年8月上旬(植物生长旺期)对各试验小区进行调查与样品采集。采用样方法,设置50 cm×50 cm的样方,齐地面刈割后带回实验室称取鲜重,后转移至105 ℃烘箱中杀青30 min,然后在75 ℃烘干至恒重,称取地上生物量。之后将烘干草样用粉碎机粉碎,过1 mm筛备用。
1.3.2 牧草品质测定方法
利用元素分析仪测定植物粗蛋白含量[17],利用索氏抽提法测定粗脂肪含量[18],使用马弗炉灼烧法测定粗灰分含量[18],中性洗涤纤维含量和酸性洗涤纤维含量采用范式纤维洗涤法进行测定[19],并根据童永尚等[19]的方法计算相对饲喂价值。
1.3.3 数据处理与分析
采用Excel 2010软件进行原始数据整理和灰色关联度分析,具体参见童永尚等[19]的方法。运用SPSS 27.0软件进行双因素方差分析和聚类分析。在Origin 2022软件中绘图。
2. 结果与分析
2.1 氮素形态和施氮水平对饲草生产性能的影响
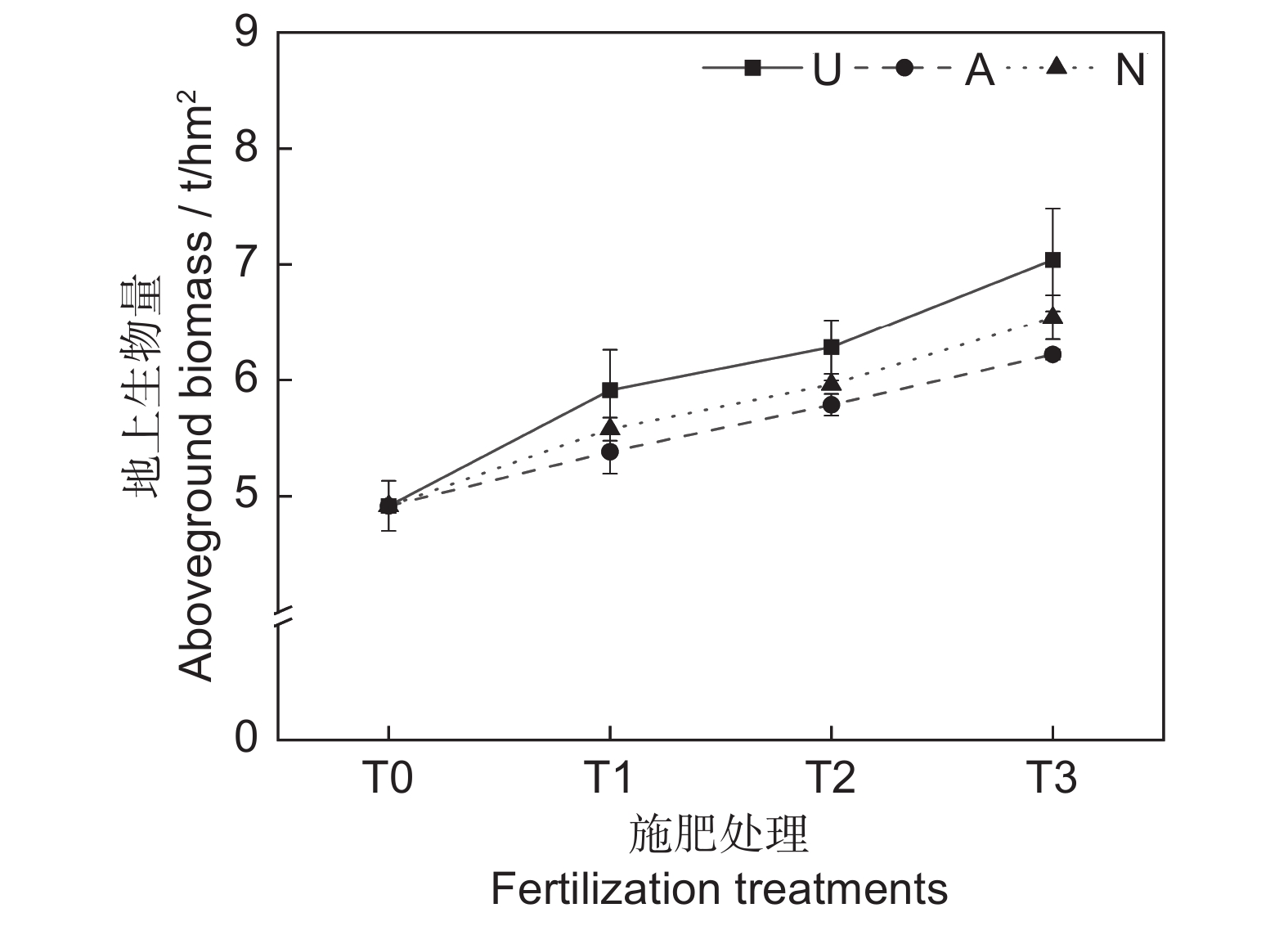
由表2可知,氮素形态对多年生高寒栽培草地的地上生物量影响显著(P<0.05),施氮水平对地上生物量的影响极显著(P<0.001),氮素形态和施氮水平交互作用对地上生物量影响不显著。氮添加整体上提高了群落地上生物量,且随着施氮水平的提高呈递增趋势,UT3、AT3和NT3处理分别较CK处理提高43.22%、26.54%和33.11%。同等氮水平相比较,对地上生物量的促进作用表现为U>N>A(图1)。
表 2 氮素形态和施氮水平的双因素方差分析Table 2. Two factor analysis of variance for nitrogen forms and nitrogen application levels影响因素
Influence factor氮素形态
Nitrogen form (F)施氮水平
Nitrogen level (L)氮素形态×施氮水平
F×LF P F P F P 地上生物量 5.622 <0.05 14.056 <0.001 0.153 0.959 粗蛋白 18.073 <0.001 38.120 <0.001 1.748 0.184 粗脂肪 39.829 <0.001 5.377 <0.05 1.183 0.351 粗灰分 0.020 0.980 0.576 0.572 1.714 0.191 中性洗涤纤维 1.979 0.167 1.423 0.267 1.422 0.267 酸性洗涤纤维 1.153 0.338 0.718 0.501 1.555 0.229 相对饲喂价值 1.275 0.304 1.284 0.301 1.909 0.153 2.2 氮素形态和施氮水平对饲草营养品质的影响
2.2.1 对饲草粗蛋白含量的影响
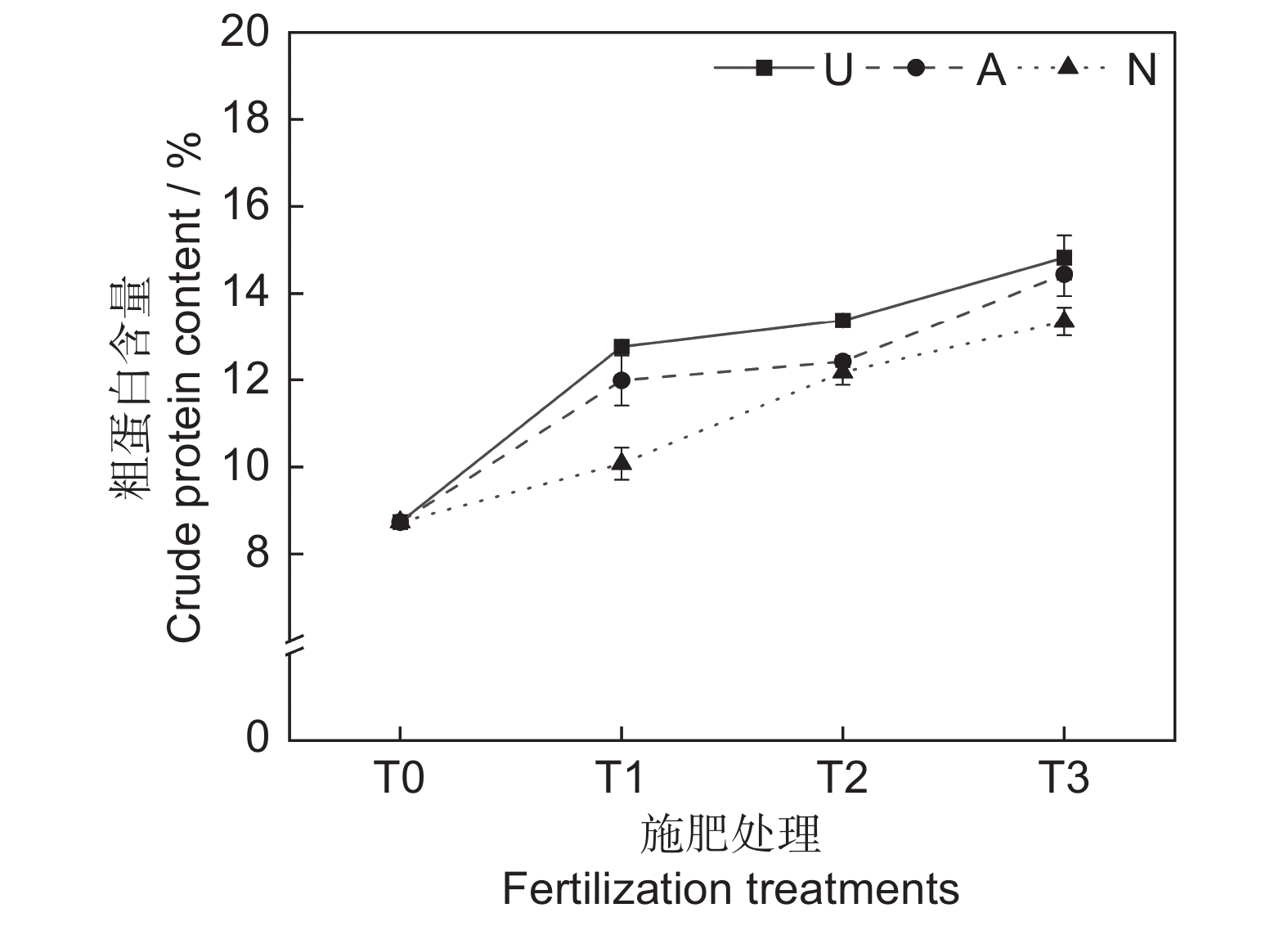
由表2和图2可知,氮素形态和施氮水平对饲草粗蛋白含量均具有极显著影响(P<0.001),氮素形态和施氮水平交互作用对饲草粗蛋白含量影响不显著。氮添加整体上提高了植物的粗蛋白含量,且随着施氮水平的提高呈递增趋势,UT3、AT3和NT3处理分别较CK处理提高了69.76%、65.41%和52.86%。同等氮水平相比较,对饲草粗蛋白含量的促进作用表现为U>A>N。
2.2.2 对饲草粗脂肪含量的影响
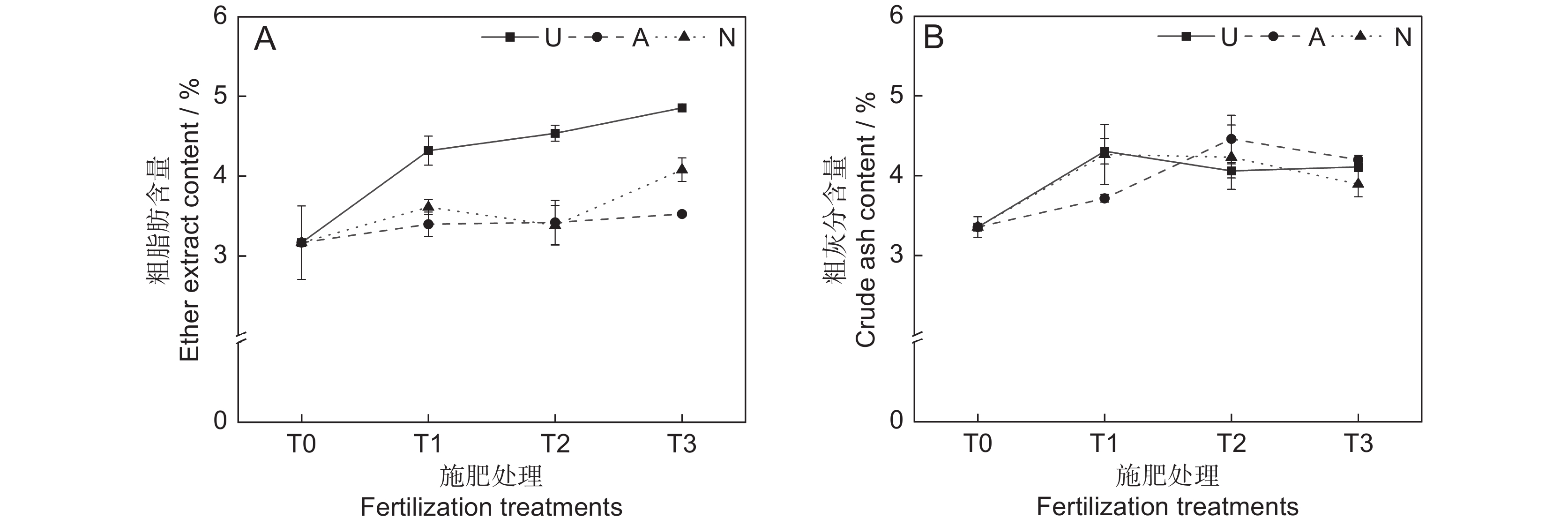
氮素形态对饲草粗脂肪含量具有极显著影响(P<0.001),施氮水平对饲草粗脂肪含量具有显著影响(P<0.05),氮素形态和施氮水平对饲草粗脂肪含量没有明显的交互作用(表2)。氮添加整体上提高了植物的粗脂肪含量,不同施氮水平对饲草粗脂肪含量的促进作用因氮素形态不同而有所差异。饲草粗脂肪含量随着酰胺态氮施肥水平的提高而增加,铵态氮施肥水平的增加对植物粗脂肪含量的影响较小。3种氮素形态下,饲草的粗脂肪含量均在T3水平时达到峰值,UT3、AT3和NT3处理分别较CK提高了53.30%、11.34%和28.86%。同等氮水平相比较,对地上生物量的促进作用表现为U>N>A(图3:A)。
2.2.3 对饲草粗灰分含量的影响
由表2可知,氮素形态、施氮水平及二者交互作用对饲草粗灰分含量的影响均不显著。氮添加整体上提高了植物的粗灰分含量(P<0.05),AT2处理下植物的粗灰分含量最高,为4.46%。同一氮素形态下不同施氮水平相比较,A和N处理均在T1水平时达到最大粗灰分含量,分别为4.31%和4.26%(图3:B)。
2.2.4 对饲草中性洗涤纤维含量的影响
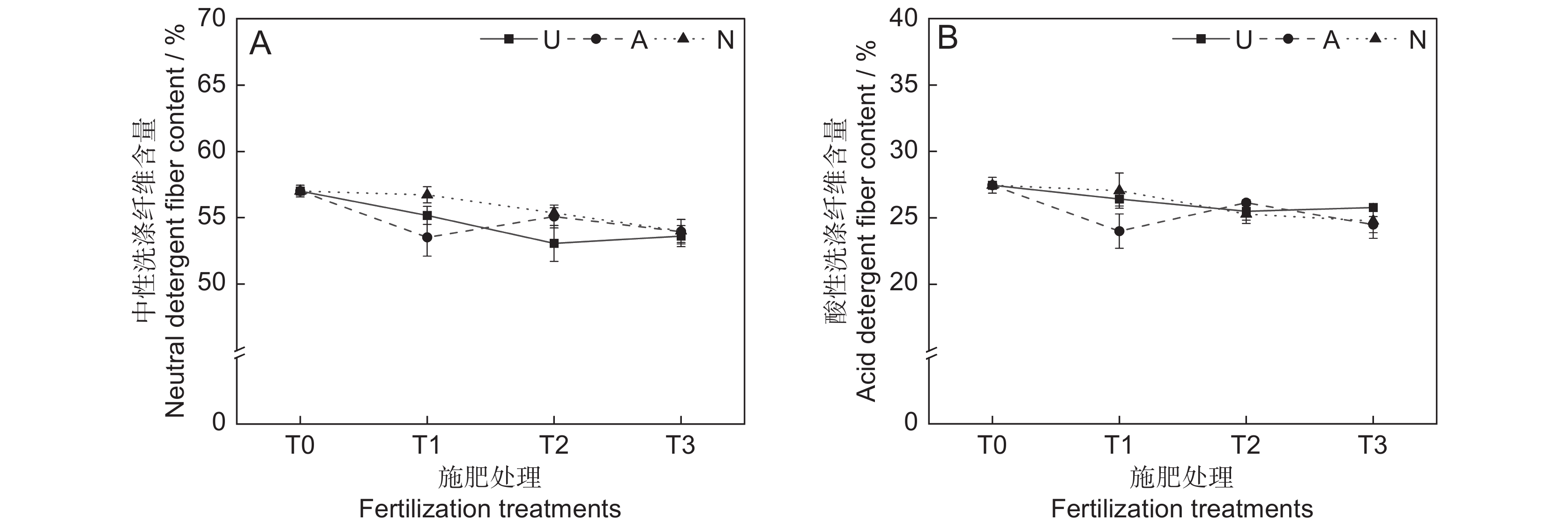
本研究发现,氮素形态、施氮水平及二者交互作用对饲草中性洗涤纤维含量均未产生显著影响(表2)。氮添加整体上降低了植物的中性洗涤纤维含量(P<0.05)。随着硝态氮施肥水平的提高,植物中性洗涤纤维含量逐渐降低(图4:A)。3种氮肥在T3水平时的中性洗涤纤维含量趋于一致,介于63.6%~64.0%。
2.2.5 对饲草酸性洗涤纤维含量的影响
由表2可知,氮素形态、施氮水平、氮素形态和施氮水平交互作用对饲草酸性洗涤纤维含量的影响均不显著。氮添加整体上降低了植物的酸性洗涤纤维含量(图4:B)。T2水平时,3种氮肥对植物酸性洗涤纤维含量的影响不明显。总体来看,T1水平时,施用铵态氮肥对植物酸性洗涤纤维含量的降低效果最为明显。
2.2.6 对饲草相对饲喂价值的影响
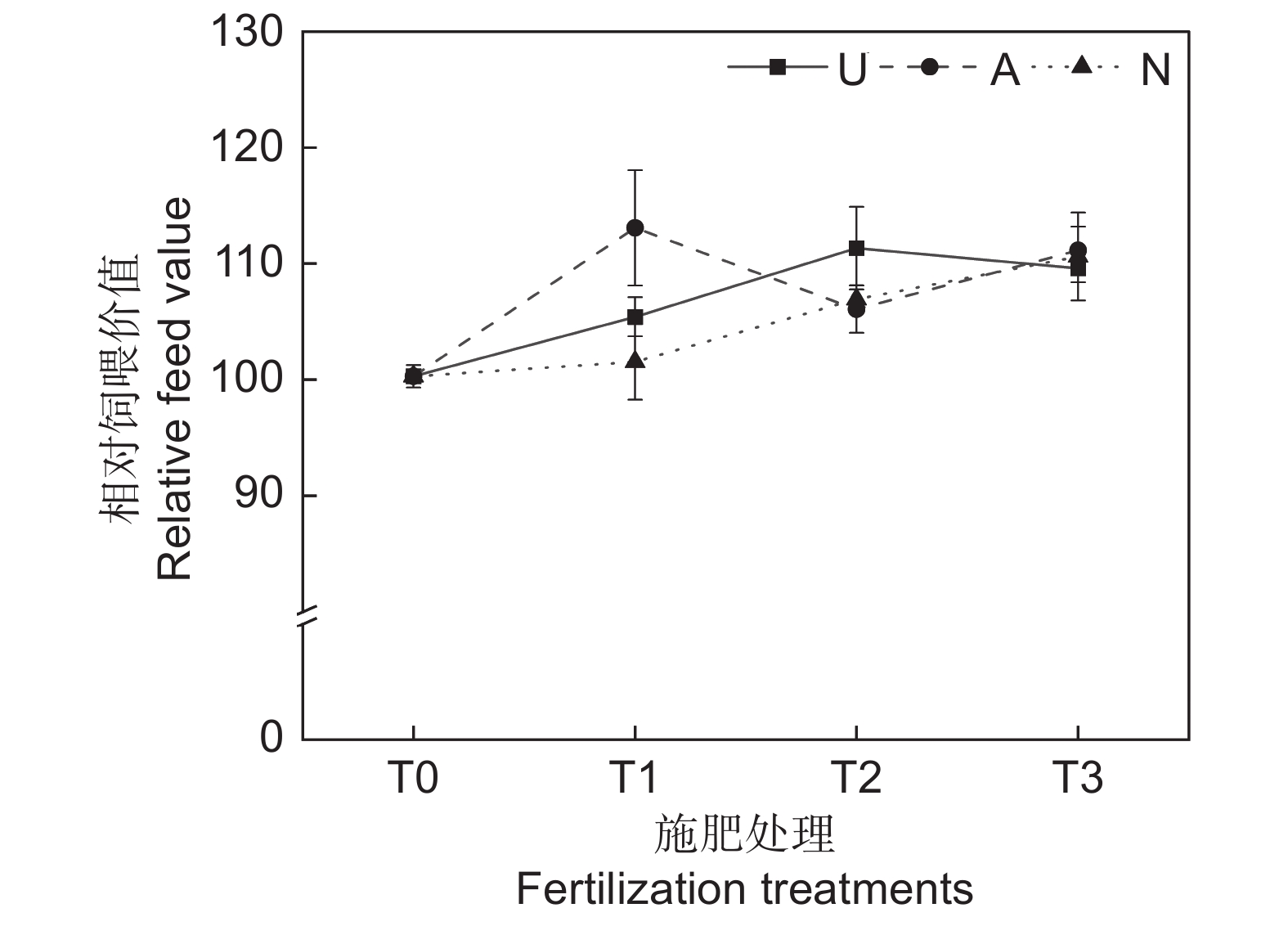
由表2可知,氮素形态、施氮水平及二者交互作用对饲草相对饲喂价值均未产生显著影响。如图5所示,氮添加整体上提高了饲草的相对饲喂价值,不同氮素形态和施氮水平对饲草相对饲喂价值的影响较大。随着硝态氮肥施氮水平的提高,饲草的相对饲喂价值逐渐提高。T3水平时,3种氮肥对饲草相对饲喂价值的提升效果接近。不同氮肥形态相比较,T1水平时,施用铵态氮肥的饲草其相对饲喂价值最高,为113.08;T2水平时,施用酰胺态氮肥时饲草的相对饲喂价值最高,为113.34。
2.3 灰色关联度评价和聚类分析
将植物地上生物量、粗蛋白含量和中性洗涤纤维含量等7个指标纳入评价体系,对不同氮素形态和施肥水平共10个处理进行灰色关联度综合评价。由表3可知,CK处理排序第9,说明氮添加普遍提高了饲草的综合性能。综合排名前4位的处理分别是UT3、UT2、NT3和AT3。不同酰胺态氮肥处理的综合排名依次为UT3>UT2>UT1,不同铵态氮肥处理的综合排名依次为AT3>AT1>AT2,不同硝态氮肥处理的综合排名依次为NT3>NT2>NT1。
表 3 不同处理的灰色关联度综合评价Table 3. Comprehensive evaluation of gray correlation degree for different treatments施肥处理
Fertilization treatment等权关联度
Gray correlative排序
Rank权重系数
Weight coefficient加权关联度
Weighted gray correlative加权关联度排序
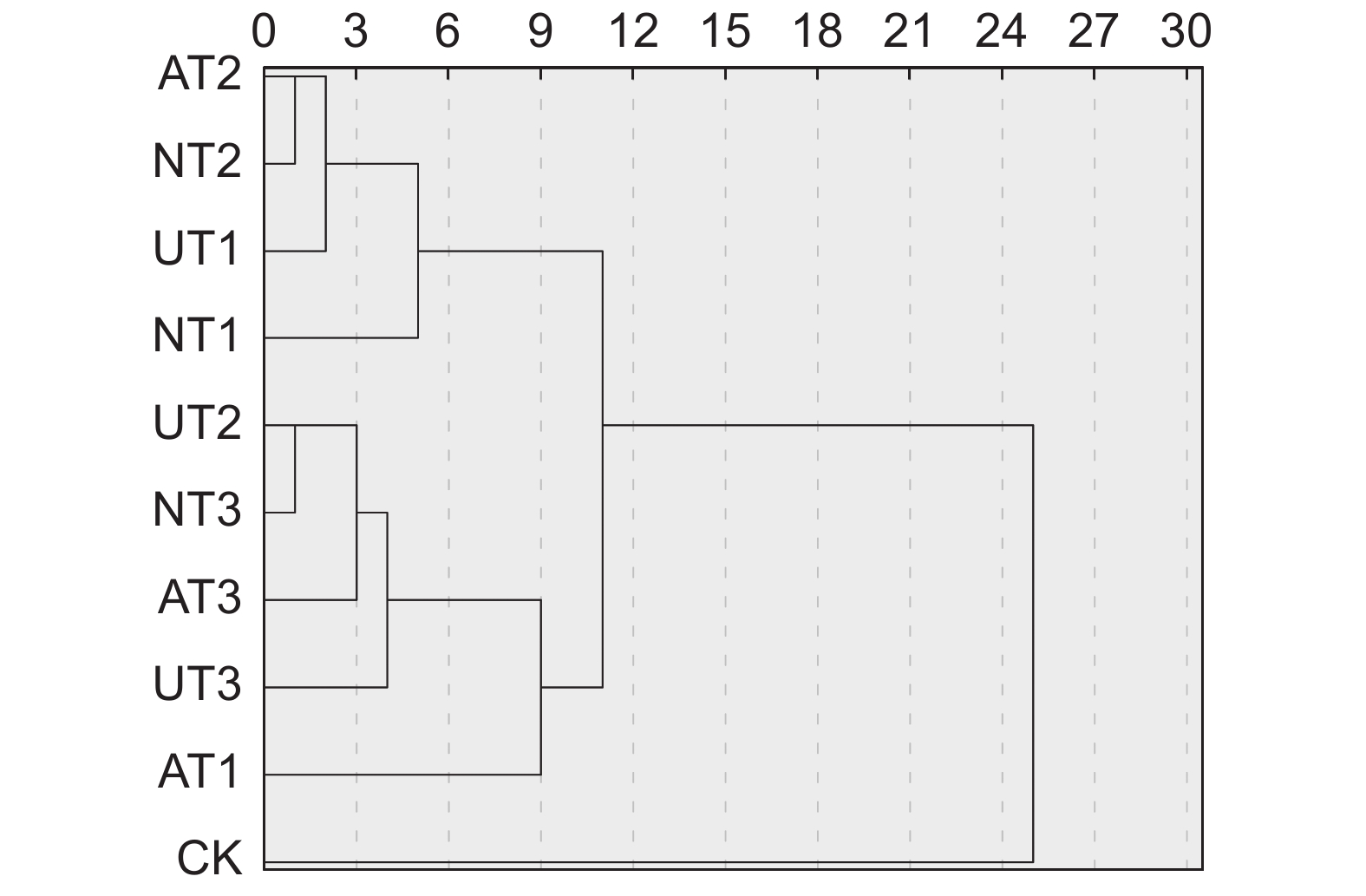
Rank of weighted gray correlativeUT3 0.871 4 1 0.126 3 0.110 0 1 UT2 0.763 3 2 0.110 6 0.084 4 2 NT3 0.753 6 3 0.109 2 0.082 3 3 AT3 0.746 1 4 0.108 1 0.080 7 4 AT1 0.718 6 5 0.104 1 0.074 8 5 UT1 0.654 1 6 0.094 8 0.062 0 6 NT2 0.633 7 7 0.091 8 0.058 2 7 AT2 0.613 0 8 0.088 8 0.054 5 8 CK 0.589 1 9 0.085 4 0.050 3 9 NT1 0.557 0 10 0.080 7 0.045 0 10 本试验将10个处理的地上生物量和营养品质进行了聚类分析,运用SPSS 27.0软件构建树形图(图6),在欧式距离为9处,可将其分为4大类。第Ⅰ类仅包括CK处理,其产量和营养品质均表现最差;第Ⅱ类只有AT1处理,其地上生物量略高于CK处理;第Ⅲ类包括UT2、UT3、AT3和NT3处理,其产量和营养品质均表现最好;第Ⅳ类包括UT1、NT1、NT2和AT2处理,其产量和营养品质仅次于第Ⅲ类。
3. 讨论
3.1 氮素形态和施氮水平对饲草生产性能的影响
众所周知,氮添加可以提高植物的生产力,但不同环境的氮添加量应有所差异[20]。施氮量较低时,土壤养分仍然不能满足植物生长,施氮量过多又会导致土壤中产生有毒的亚硝酸盐[21],进而阻碍植物生长,因此栽培草地施氮量应根据土壤氮素含量来确定。在以往的研究中,关于氮添加水平对植物地上生物量的调节作用有两种结论,第1种是地上生物量随施氮量增加而增加[22];第2种是地上生物量随施氮量的增加会出现一个峰值,然后逐渐降低[15],这是因为氮添加量有一定的环境阈值,存在一个最适施氮量,以最适施氮量为对称轴,植物的地上生物量随施氮量增加呈抛物线变化。本研究中,施氮水平对地上生物量具有极显著影响,氮添加显著提高了群落地上生物量,且随着施氮水平的提高呈递增趋势,在施氮量为67.5 kg·hm−2·a−1时达到峰值,说明本研究中设置的施氮量可能过低,在后期的试验中需要加大施氮梯度。此外,氮素形态对植物的地上生物量也产生显著影响,对地上生物量的促进作用表现为U>N>A。说明在短期内,酰胺态氮对植物生物量的促进效果更为明显,而硝态氮和铵态氮的效果相对较差,这与向雪梅等[11]和芦光新等[23]在高寒草地中的研究结论相似。尽管施加铵态氮肥补充了土壤养分,一定程度上促进了植物生长,但铵态氮肥抑制了植物对K+和Ca2+的吸收,导致NH4+的积累并产生氨害,从而限制了植物的生长[12, 24]。硝态氮肥的促产作用介于酰胺态和铵态氮肥之间。硝态氮同样也会对植物的生长产生不利影响,在还原过程中,硝态氮会消耗较多的能量。另外,在弱光条件下,植物对硝态氮的吸收也有可能会受到抑制,从而导致氮素供应不足。相比铵态氮肥和硝态氮肥,含氮量较高的酰胺态氮肥为土壤补充了充足的养分[16],更能满足植物的生长需求。由于氮素形态和氮素水平的设置还与牧草栽培方式、施氮时间和气候条件等因素相关,后期还应针对以上干扰因素设置控制试验,进行深入研究。
3.2 氮素形态和施氮水平对饲草营养品质的影响
在高寒地区,老龄人工草地牧草的营养品质较差是一个普遍现象。究其原因,土壤中营养元素含量较低,导致植物对氮、磷等元素的吸收利用效率较低。研究表明,氮素添加可迅速补充植物中的全氮含量,满足植物对营养元素的需求,进而恢复草地生产力,改善草地群落结构和植物的营养品质[25]。粗蛋白和粗脂肪含量是评价牧草营养价值的重要指标,其含量高则表明牧草营养品质较高,而粗纤维和粗灰分含量越高,则表明牧草可消化养分低,品质下降[26]。宋建超等[27]在高寒区的研究表明,氮添加显著提高了垂穗披碱草(Elymus nutans Griseb.)的粗蛋白和粗脂肪含量,与本研究结论一致。本研究中,所有施氮处理均显著提高了饲草的粗蛋白和粗脂肪含量。此外,我们还发现不同氮素形态和施氮水平对饲草的粗蛋白和粗脂肪含量具有显著影响,施用酰胺态氮肥更有利于粗蛋白和粗脂肪的积累,且高氮水平的促进作用更加明显。该现象一方面说明了高寒区氮限制非常严重,改善牧草的营养品质可能需要投入更多的氮肥;另一方面,由于不同的植物或生育期对氮肥的需求量和氮素形态具有明显差异,所以应根据实际情况选择适宜的氮素形态和施氮量。适宜的氮素形态是提高氮素利用率以及植物蛋白质含量的重要途径之一[28]。本研究中,酰胺态氮对植物粗蛋白和粗脂肪的促进效果明显高于铵态氮和硝态氮,这可能与植物的选择吸收能力以及不同氮肥的供氮能力等因素有关[29]。此外,本研究中的3种氮肥均不同程度地提高了饲草的粗灰分含量,降低了饲草的中性洗涤纤维及酸性洗涤纤维含量,与前人研究结论相似[30]。聚类分析将10个处理分为4大类,通过对比试验数据发现,这4大类可划分饲草生产性能和营养品质的优劣,基本对应了不施氮、低氮、中氮和高氮4种属性,因此,施氮水平对饲草生产性能和营养品质的影响是显而易见的。最后,本研究通过灰色关联度分析得出,选用酰胺态氮肥,施氮量为67.5 kg·hm−2·a−1时,多年生栽培草地饲草的生产性能和营养品质综合表现最优,研究结果可为青藏高原环青海湖地区人工草地生产力及营养品质的提高提供参考。
4. 结论
氮素形态和施氮水平对多年生高寒栽培草地饲草的生产性能和营养品质具有显著影响。选择酰胺态氮肥,施氮量为67.5 kg·hm−2·a−1时,多年生栽培草地饲草的生产性能和营养品质综合表现最优,说明适宜的氮肥管理制度对提高研究区饲草生产性能和营养价值具有促进作用。
-
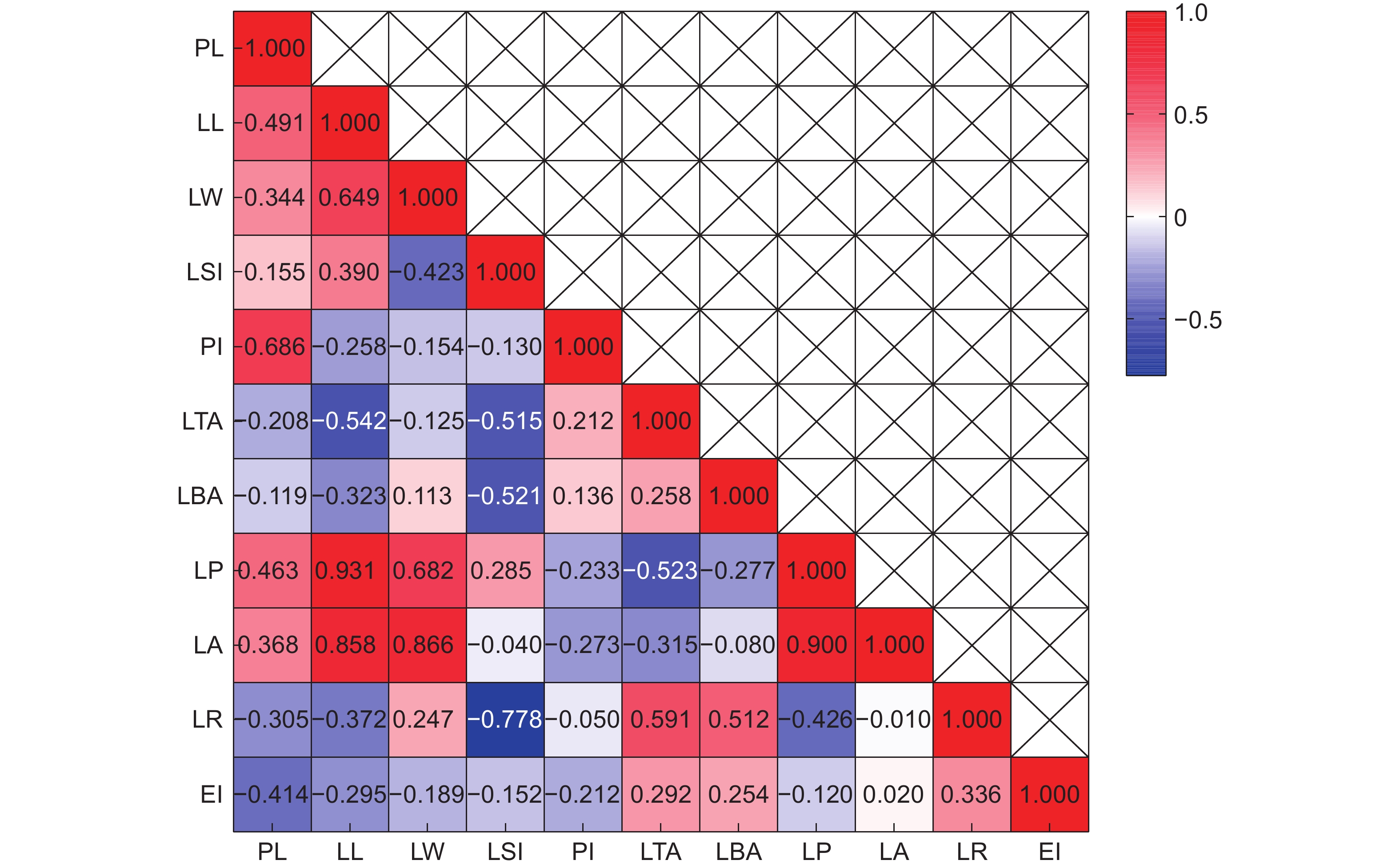
图 1 大头茶属植物叶表型性状相关性热图
PL:叶柄长;LL:叶长;LW:叶宽;LP:叶周长;LA:叶面积;LBA:叶基角;LTA:叶尖角;PI:叶柄指数;LSI:叶形指数;LR:叶圆度;EI:椭圆度。下同。
Figure 1. Correlation heatmap of leaf phenotypic traits in Polyspora
PL: Petiole length; LL: Leaf length; LW: Leaf width; LP: Leaf perimeter; LA: Leaf area; LBA: Leaf base angle; LTA: Leaf tip angle; PI: Petiole index; LSI: Leaf shape index; LR: Leaf roundnes; EI: Ellipticalness index. Same below.
表 1 大头茶属植物天然居群地理生态因子
Table 1 Geo-ecological factors of natural populations of Polyspora
序号
No.物种名称(株数)
Species (ind.)采集地点(代码)
Location (Code)纬度
Latitude
(LAT)经度
Longitude
(LONG)海拔
Altitude
(ALT) / m年均温
Mean annual temperature
(MAT)/ ℃年降水
Annual precipitation
(AP) / mm年日照
Annual sunshine
(AS) / h1 P. speciosa(22) 云南昭通盐津县(YJ) 28°2′6.51″N 104°10′44.18″E 946 17.0 676.3 966.0 2 P. speciosa(25) 重庆北碚缙云山(BB) 29°49′47.84″N 106°23′14.43″E 821 18.3 506.0 1 012.2 3 P. speciosa(24) 四川泸州叙永县(XY) 28°17′16.71″N 105°29′21.56″E 686 17.9 1 067.9 1 170.3 4 P. speciosa(21) 贵州遵义习水县(XS) 28°24′46.73″ N 106°36′4.98″E 1 370 17.0 1 933.6 1 269.0 5 P. kwangsiensis(20) 广西来宾金秀县(JX) 24°14′52.93″N 110°12′41.32″E 1 031 20.1 2 086.2 1 413.7 6 P. kwangsiensis(24) 广西桂林恭城县(GC) 24°59′53.27″N 110°56′23.30″E 460 19.9 1 558.1 1 549.1 7 P. kwangsiensis(24) 广西贺州平桂区(PG) 24°37′15.73″N 111°32′34.92″E 617 20.2 1 609.7 1 274.8 8 P. kwangsiensis(16) 广西百色那坡县(NP) 23°17′36.50″N 105°47′29.4″E 1 135 16.5 1 603.7 1 288.3 9 P. kwangsiensis(7) 广西桂林永福县(YF) 24°52′39.36″N 110°09′4.39″E 296 13.6 1 420.6 1 183.7 10 P. tonkinensis(22) 云南红河屏边县(PB) 22°54′38.64″ E 103°42′2.45″ N 2 048 18.8 1 545.6 1 937.3 表 2 大头茶属植物10个天然居群叶表型性状多重比较
Table 2 Multiple comparisons of leaf phenotypic traits among 10 natural populations of Polyspora
叶表型性状
Leaf
phenotypic
trait居群
PopulationYJ BB XY JX GC PG NP PB XS YF PL 22.33±4.06ab 21.30±4.53bc 20.35±4.77bcd 15.37±4.35g 17.86±3.63defg 17.26±3.29efg 19.72±4.61cde 16.78±3.29fg 24.68±5.58a 18.12±2.62def LL 251.28±21.98a 232.78±37.78b 219.20±36.93bc 165.05±19.96e 208.44±21.88cd 198.99±32.13d 222.36±36.36bc 211.72±26.61cd 208.37±49.64bc 199.34±17.73cd LW 69.45±9.20a 67.87±13.71ab 59.47±8.75c 52.96±11.01d 62.85±5.58bc 61.42±6.66c 61.37±9.60c 51.69±7.87d 57.46±13.30cd 59.95±10.88de LSI 3.66±0.41bc 3.47±0.43bcd 3.71±0.48b 3.25±0.78d 3.33±0.36cd 3.25±0.49d 3.66±0.59bc 4.14±0.49a 3.65±0.43ab 3.63±0.22bc PI 0.09±0.02abc 0.09±0.01abc 0.09±0.02abc 0.09±0.02ab 0.09±0.02bc 0.09±0.02bc 0.09±0.02bc 0.08±0.02c 0.12±0.03c 0.09±0.01d LTA 32.30±7.15e 32.52±9.82e 34.51±13.37de 62.96±23.85b 53.08±14.25c 60.33±20.50bc 42.89±14.81d 36.81±11.42de 50.60±15.33c 41.57±13.80d LBA 36.20±6.25e 55.57±7.04abc 47.21±10.15cd 62.43±22.83a 52.04±14.96bcd 55.19±12.30abc 60.66±19.16ab 45.58±12.13d 46.71±7.92d 47.37±10.17de LP 62.88±6.25a 57.14±9.76b 54.11±8.51bc 40.86±4.74e 50.94±4.56cd 48.21±6.90d 53.75±7.16bc 52.28±6.79c 48.64±10.56d 48.66±5.23cd LA 101.85±20.15a 94.13±25.26bc 79.04±24.07c 54.87±14.26e 80.63±13.18c 76.87±16.88cd 85.68±23.81bc 67.64±18.56d 67.99±30.13de 65.98±10.88e LR 0.32±0.03f 0.36±0.04cd 0.34±0.05de 0.41±0.07b 0.39±0.04bc 0.42±0.05b 0.37±0.06c 0.31±0.03f 0.35±0.05ef 0.35±0.03d EI 0.74±0.03e 0.76±0.06de 0.76±0.03de 0.80±0.03b 0.78±0.02bc 0.80±0.03b 0.79±0.03bc 0.78±0.03cd 0.71±0.13d 0.76±0.02de 注:同行不同小写字母表示差异显著(P<0.05)。PL:叶柄长;LL:叶长;LW:叶宽;LP:叶周长;LA:叶面积;LBA:叶基角;LTA:叶尖角;PI:叶柄指数;LSI:叶形指数;LR:叶圆度;EI:椭圆度。居群缩写为样本采集地代码,其含义与表1相同,下同。 Notes: Different lowercase letters in the same line indicate significant difference (P<0.05). PL: Petiole length; LL: Leaf length; LW: Leaf width; LP: Leaf perimeter; LA: Leaf area; LBA: Leaf base angle; LTA: Leaf tip angle; PI: Petiole index; LSI: Leaf shape index; LR: Leaf roundnes; EI: Ellipticalness index. Abbreviations of population indicate sampling locations as in Table 1. Same below. 表 3 大头茶属植物天然居群表型性状变异系数
Table 3 Coefficients of variation of phenotypic traits of natural populations of Polyspora
居群
Population叶表型性状变异系数Coefficients of variation of leaf phenotypic traits / % PL LL LW LSI PI LTA LBA LP LA LR EI 均值Mean YJ 17.80 8.57 12.98 11.11 20.17 21.69 16.93 9.75 19.39 7.75 0.04 13.29 BB 20.84 15.90 19.80 12.25 17.93 29.59 12.41 16.74 26.29 11.07 0.07 16.63 XY 22.95 16.51 14.41 12.67 19.67 37.97 21.06 15.4 29.83 14.43 0.04 18.63 JX 27.72 11.85 20.38 23.58 24.26 37.11 35.84 11.36 25.47 17.01 0.04 21.33 GC 19.92 10.29 8.70 10.50 17.40 26.30 28.17 8.77 16.02 9.92 0.02 14.18 PG 18.67 15.82 10.62 14.80 17.77 33.29 21.87 14.02 21.52 11.66 0.03 16.37 NP 22.89 16.02 15.32 15.79 20.33 33.84 30.94 13.05 27.23 15.88 0.03 19.21 PB 19.22 12.31 14.92 11.67 19.62 30.39 26.07 12.72 26.89 11.03 0.04 16.81 XS 22.60 23.82 23.15 11.80 21.04 30.30 16.96 21.70 44.32 13.53 0.18 20.85 YF 14.45 8.89 8.99 6.04 14.16 33.20 21.48 10.75 16.48 9.06 0.03 13.05 均值 20.70 14.00 14.93 13.02 19.24 31.37 23.17 13.43 25.34 12.13 0.05 17.03 表 4 大头茶属植物居群表型性状的巢式方差分析
Table 4 Nested variance analysis of phenotypic traits of populations of Polyspora
表型性状
Phenotypic trait均方Mean square F值 F value 居群间
Inter-population居群内
Intra-population居群间
Inter-population居群内
Intra-populationPL 202.340 8.760 11.111** 0.481 LL 13036.751 698.822 12.626** 0.677 LW 871.434 53.598 9.250** 0.569 LSI 1.780 0.175 7.226** 0.710 PI 0.003 0 9.233** 1.035 LTA 3 234.154 151.352 13.586** 0.636 LBA 1 547.572 90.130 8.298** 0.483 LP 871.083 31.426 15.609** 0.563 LA 4 947.772 268.632 11.261** 0.611 LR 0.034 0.002 15.320** 0.880 EI 0.019 0.002 7.377** 0.850 Note: **, P<0.01. 表 5 大头茶属植物叶表型性状的方差分量与表型分化系数
Table 5 Variance components and phenotypic differentiation coefficients of leaf phenotypic traits in Polyspora
表型性状
Phenotypic trait方差分量
Variance component方差分量百分比
Percentage of variance components / %表型分化系数
Phenotypic differentiation
coefficient / %居群间
Inter-population居群内
Intra-population随机误差
Random errors居群间
Inter-population居群内
Intra-populationPL 7.403 17.266 4.967 30.01 69.99 30.00 LL 481.503 999.186 38.480 32.52 67.48 32.52 LW 31.252 90.147 11.018 25.74 74.26 25.74 LSI 0.062 0.239 0.549 20.49 79.51 20.60 PI 0 0 0.021 24.70 75.30 0 LTA 120.191 229.373 18.697 34.38 65.62 34.38 LBA 54.829 176.858 15.221 23.66 76.34 23.67 LP 32.709 53.370 9.278 38.00 62.00 38.00 LA 181.019 422.297 24.562 30.00 70.00 30.00 LR 0.001 0.002 0.059 36.72 63.28 33.33 EI 0.001 0.002 0.056 20.61 79.39 33.33 均值 82.630 180.790 11.170 28.80 71.20 27.42 表 6 大头茶属植物叶表型性状的主成分分析
Table 6 Principal component analysis of leaf phenotypic traits of Polyspora
叶表型性状
Leaf phenotypic trait主成分Principal component PC1 PC2 PC3 PL 0.389 −0.151 0.868 LL 0.873 −0.427 0.083 LW 0.915 0.320 0.096 LSI −0.073 −0.918 −0.019 PI −0.278 0.174 0.897 LTA −0.363 0.673 0.006 LBA −0.053 0.686 0.003 LP 0.897 −0.371 0.042 LA 0.982 −0.002 −0.048 LR −0.018 0.896 −0.210 EI −0.115 0.312 −0.559 特征值 4.368 2.616 1.841 贡献率 / % 39.712 23.778 16.738 累计贡献率 / % 39.712 63.489 80.228 注:粗体表示该性状在PCA轴上的最大载荷。 Note: Bold indicates maximum load on PCA axis for the trait. -
[1] 张睿,国春策,山红艳,孔宏智. 发育重塑与生物多样性[J]. 生物多样性,2014,22(1):66−71. doi: 10.3724/SP.J.1003.2014.13248 Zhang R,Guo CC,Shan HY,Kong HZ. Developmental repatterning and biodiversity[J]. Biodiversity Science,2014,22(1):66−71. doi: 10.3724/SP.J.1003.2014.13248
[2] Li YG,Liu XH,Ma JW,Zhang XM,Xu LA. Phenotypic variation in Phoebe bournei populations preserved in the primary distribution area[J]. J FR,2018,29(1):35−44.
[3] Morton CV. Botany:Principles of Angiosperm Taxonomy. P. H. Davis and V. H. Heywood. Van Nostrand,Princeton,N. J. ,1963. xx + 556 pp. Illus. $15. [J]. Science,1964,144(3618):531.
[4] Wang ML,Zhang JX,Guo ZP,Guan YZ,Qu G, et al. Morphological variation in Cynodon dactylon (L.) Pers. ,and its relationship with the environment along a longitudinal gradient[J]. Hereditas,2020,157(1):4.
[5] 牛雪婧,聂靖,赵雪利,高信芬. 河北木蓝的叶表型可塑性研究[J]. 植物科学学报,2020,38(1):97−104. doi: 10.11913/PSJ.2095-0837.2020.10097 Niu XJ,Nie J,Zhao XL,Gao XF. Leaf-level phenotypic plasticity of Indigofera bungeana Walp[J]. Plant Science Journal,2020,38(1):97−104. doi: 10.11913/PSJ.2095-0837.2020.10097
[6] 郑孙元,朱弘,金思雨,王梦娟,孙杰,等. 桂花表型变化的环境依赖特征[J]. 南京林业大学学报(自然科学版),2019,43(2):38−46. Zheng SY,Zhu H,Jin SY,Wang MJ,Sun J,et al. Environment-dependent phenotypic variation of Osmanthus fragrans[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2019,43(2):38−46.
[7] 杨世雄. 国产大头茶属的分类处理[J]. 热带亚热带植物学报,2005,13(4):363−365. doi: 10.3969/j.issn.1005-3395.2005.04.017 Yang SX. Taxonomic treatment of Chinese Polyspora Sweet (Theaceae)[J]. Journal of Tropical and Subtropical Botany,2005,13(4):363−365. doi: 10.3969/j.issn.1005-3395.2005.04.017
[8] 马长乐,李靖,白琼,黄晓霞,程小毛. 云南省乡土树种大头茶属植物资源分布与利用探讨[J]. 黑龙江农业科学,2015(5):78−80. Ma CL,Li J,Bai Q,Huang XX,Cheng XM. Distribution and utilization of the indigenous tree species of genus Polyspora in Yunnan province[J]. Heilongjiang Agricultural Sciences,2015(5):78−80.
[9] 陈新艳. 福建省五种植物新记录[J]. 广西植物,2020,40(8):1127−1131. doi: 10.11931/guihaia.gxzw201901022 Chen XY. New records of five species of plants in Fujian province[J]. Guihaia,2020,40(8):1127−1131. doi: 10.11931/guihaia.gxzw201901022
[10] 樊智丰,韩露,马长乐. 大头茶属植物研究进展[J]. 广西植物,2021,41(10):1755−1766. doi: 10.11931/guihaia.gxzw202010042 Fan ZF,Han L,Ma CL. Research advances of Polyspora Sweet (Theaceae)[J]. Guihaia,2021,41(10):1755−1766. doi: 10.11931/guihaia.gxzw202010042
[11] 中华人民共和国生态环境部,中国科学院. 中国生物多样性红色名录——高等植物卷(2020)[M]. 北京:生态环境部,中国国科学院,2023:795,2356−2357. [12] Beech E,Barstow M,Rivers M. The Red List of Theaceae[M]. Richmond,UK:Botanic Gardens Conservation International,2017:32−37.
[13] Fan ZF,Qian SJ,Zhang YH,Ma CL. Characterization of the complete chloroplast genome of Polyspora tiantangensis (Theaceae),an endemic and endangered species in southwestern China[J]. Mitochondrial DNA Part B,2021,6(3):814−815. doi: 10.1080/23802359.2021.1884013
[14] 高灿,樊智丰,马长乐. 黄药大头茶叶绿体基因组密码子偏好性分析[J]. 西南林业大学学报,2023,43(5):66−76. doi: 10.11929/j.swfu.202203018 Gao C,Fan ZF,Ma CL. Analysis of codon usage bias in chloroplast genome of Polyspora chrysandra[J]. Journal of Southwest Forestry University,2023,43(5):66−76. doi: 10.11929/j.swfu.202203018
[15] Athukoralage PS,Herath HMTB,Deraniyagala SA,Wijesundera RLC,Weerasinghe PA. Antifungal constituent from Gordonia dassanayakei[J]. Fitoterapia,2001,72(5):565−567. doi: 10.1016/S0367-326X(00)00339-7
[16] Fu HZ,Li CJ,Yang JZ,Shen ZF,Zhang DM. Potential anti-inflammatory constituents of the stems of Gordonia chrysandra[J]. J Nat Prod,2011,74(5):1066−1072. doi: 10.1021/np200021f
[17] 穆兵,李茂,杨成华,邓伦秀,潘德权,等. 习水国家级自然保护区四川大头茶群落研究[J]. 种子,2011,30(12):62−66. doi: 10.3969/j.issn.1001-4705.2011.12.018 Mu B,Li M,Yang CH,Deng LX,Pan DQ,et al. Study on Sichuan big head tea community in Xishui national nature reserve[J]. Seed,2011,30(12):62−66. doi: 10.3969/j.issn.1001-4705.2011.12.018
[18] Fan ZF,Zhou BJ,Ma CL,Gao C,Han DN,et al. Impacts of climate change on species distribution patterns of Polyspora Sweet in China[J]. Ecol Evol,2022,12(12):e9516. doi: 10.1002/ece3.9516
[19] Zhang Q,Zhao L,Folk RA,Zhao JL,Zamora NA,et al. Phylotranscriptomics of Theaceae:generic-level relationships,reticulation and whole-genome duplication[J]. Ann Bot,2022,129(4):457−471. doi: 10.1093/aob/mcac007
[20] Ming TL,Bartholomew B. Polyspora,Flora of China 12[M]. Beijing:Science Press,2007:418−419.
[21] 姚程程,王俊臣,胡继文,肖遥,杨桂娟,等. 香椿种质生长及叶部表型性状的遗传变异分析[J]. 植物科学学报,2020,38(1):112−122. doi: 10.11913/PSJ.2095-0837.2020.10112 Yao CC,Wang JC,Hu JW,Xiao Y,Yang GJ,et al. Genetic variation of growth and leaf phenotypic traits of Toona sinensis (A. Juss.) Roem. germplasms[J]. Plant Science Journal,2020,38(1):112−122. doi: 10.11913/PSJ.2095-0837.2020.10112
[22] 彭丽平,成仿云,钟原,徐兴兴,鲜宏利. 凤丹栽培群体的表型变异研究[J]. 植物科学学报,2018,36(2):170−180. doi: 10.11913/PSJ.2095-0837.2018.20170 Peng LP,Cheng FY,Zhong Y,Xu XX,Xian HL. Phenotypic variation in cultivar populations of Paeonia ostii T. Hong et J. X. Zhang[J]. Plant Science Journal,2018,36(2):170−180. doi: 10.11913/PSJ.2095-0837.2018.20170
[23] Sun CW,Wang JW,Duan J,Zhao GC,Weng XH,Jia LM. Association of fruit and seed traits of Sapindus mukorossi germplasm with environmental factors in southern China[J]. Forests,2017,8(12):491. doi: 10.3390/f8120491
[24] 朱弘,朱淑霞,李涌福,伊贤贵,段一凡,等. 尾叶樱桃天然种群叶表型性状变异研究[J]. 植物生态学报,2018,42(12):1168−1178. doi: 10.17521/cjpe.2018.0196 Zhu H,Zhu SX,Li YF,Yi XG,Duan YF,et al. Leaf phenotypic variation in natural populations of Cerasus dielsiana[J]. Chinese Journal of Plant Ecology,2018,42(12):1168−1178. doi: 10.17521/cjpe.2018.0196
[25] 张腾驹,陈小红,康喜坤,刘静. 四川省珙桐天然种群叶表型多样性[J]. 生态学杂志,2019,38(1):35−43. Zhang TJ,Chen XH,Kang XK,Liu J. Phenotypic diversity of leaf morphologic traits of Davidia involucrata natural populations in Sichuan Province[J]. Chinese Journal of Ecology,2019,38(1):35−43.
[26] 艾喆,徐婷婷,周兆娜,马飞. 小叶锦鸡儿天然居群叶形态性状变异研究[J]. 西北植物学报,2020,40(9):1595−1604. doi: 10.7606/j.issn.1000-4025.2020.09.1595 Ai Z,Xu TT,Zhou ZN,Ma F. Leaf morphological trait variations in natural populations of Caragana microphylla[J]. Acta Botanica Boreali-Occidentalia Sinica,2020,40(9):1595−1604. doi: 10.7606/j.issn.1000-4025.2020.09.1595
[27] 汪洋,陈文学,明安觉,雍军,宋丛文,等. 湖北红椿天然种群小叶表型性状变异研究[J]. 植物资源与环境学报,2019,28(2):96−105. doi: 10.3969/j.issn.1674-7895.2019.02.13 Wang Y,Chen WX,Ming AJ,Yong J,Song CW,et al. Study on variation of leaflet phenotypic traits of natural populations of Toona ciliata in Hubei Province[J]. Journal of Plant Resources and Environment,2019,28(2):96−105. doi: 10.3969/j.issn.1674-7895.2019.02.13
[28] 张晓骁,宋超,张延龙,牛立新,张庆雨,等. 秦岭与子午岭地区紫斑牡丹居群表型多样性研究[J]. 园艺学报,2017,44(1):139−150. Zhang XX,Song C,Zhang YL,Niu LX,Zhang QY,et al. Phenotypic diversity of Paeonia rockii populations in Qinling and Ziwuling Mountain areas[J]. Acta Horticulturae Sinica,2017,44(1):139−150.
[29] 张元燕,虞木奎,方炎明. 麻栎不同种源的表型性状变异分析[J]. 植物资源与环境学报,2014,23(3):36−44. doi: 10.3969/j.issn.1674-7895.2014.03.05 Zhang YY,Yu MK,Fang YM. Analysis on phenotypic trait variation of different provenances of Quercus acutissima[J]. Journal of Plant Resources and Environment,2014,23(3):36−44. doi: 10.3969/j.issn.1674-7895.2014.03.05
[30] 李伟,林富荣,郑勇奇,李斌. 皂荚南方天然群体种实表型多样性[J]. 植物生态学报,2013,37(1):61−69. doi: 10.3724/SP.J.1258.2013.00007 Li W,Lin FR,Zheng YQ,Li B. Phenotypic diversity of pods and seeds in natural populations of Gleditsia sinensis in southern China[J]. Chinese Journal of Plant Ecology,2013,37(1):61−69. doi: 10.3724/SP.J.1258.2013.00007



 下载:
下载: