Distribution patterns of the soil seed bank of Crataegus songarica K. Koch with altitude in the western Tianshan wild fruit forest
-
摘要:
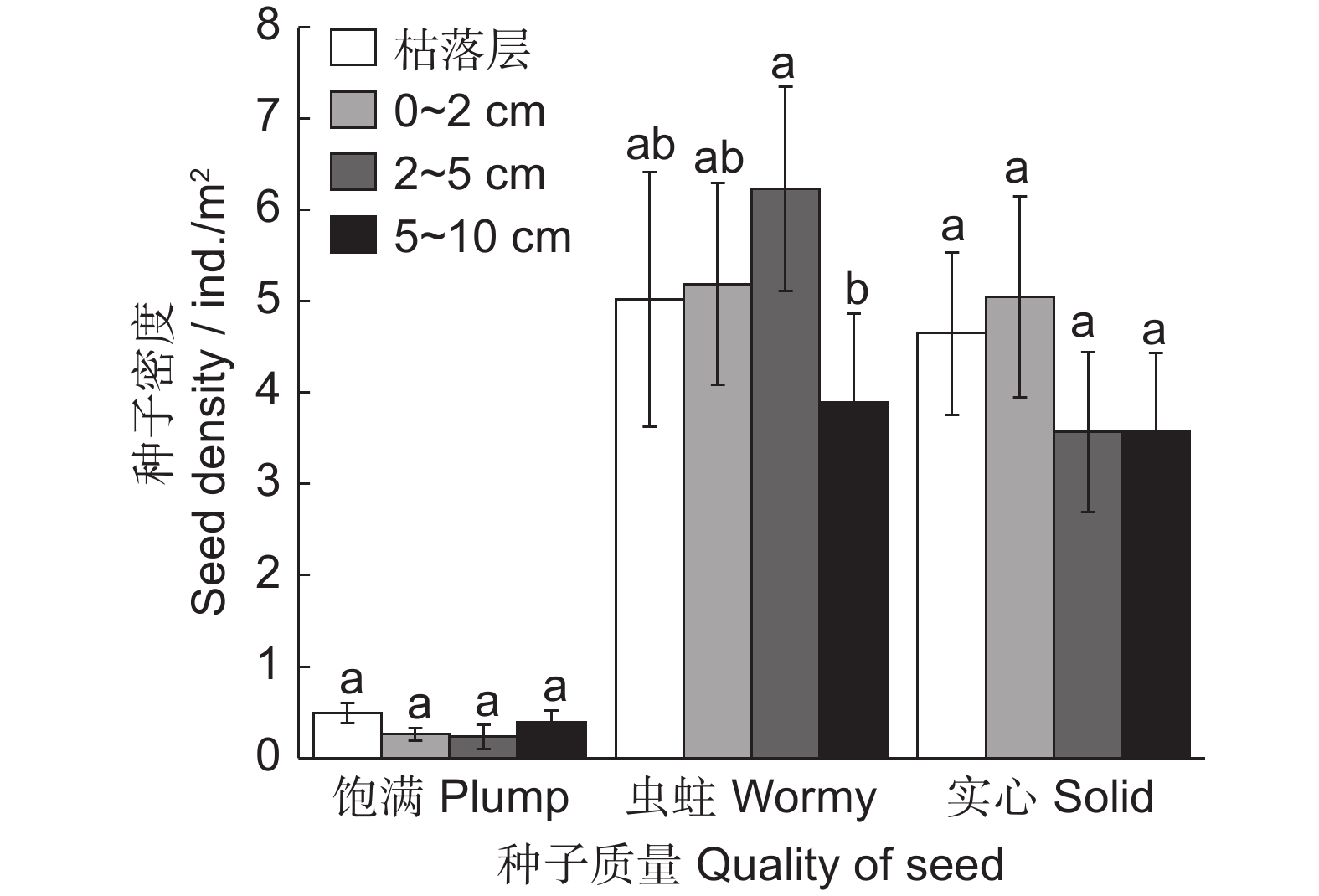
通过野外调查采样和室内实验的方法,对西天山野果林中新疆特有珍稀植物准噶尔山楂(Crataegus songarica K. Koch)土壤种子库组成、空间分布特征及其幼苗更新情况进行分析,并对该物种土壤种子库海拔梯度分布格局进行探讨。结果显示:(1)准噶尔山楂土壤种子库中虫蛀种子、实心种子和饱满种子分别占总种子数的50.83%、46.22%和2.95%;各海拔内饱满种子数量极少,随着海拔上升基本呈现先降后增再降的波动变化趋势,最高密度为(2.36 ± 0.71)粒/m2,出现在海拔1400 ~ 1500 m处。(2)土壤种子库垂直分布中,各土层内以虫蛀种子居多,其次为实心种子,饱满种子密度极显著低于前二者,且各土层间饱满种子密度差异不显著;水平分布上,随着离母树距离的增加,土壤种子库虫蛀、实心和饱满种子密度基本上呈递减的趋势,约94%的饱满种子分布在距母树3 m冠幅范围内。(3)幼苗为近母树分布(2.5 m内),幼苗数量少,实生苗更少,不足1株/50 m2,种苗转化率仅为5‰,趋向于以萌生的无性繁殖为主,实生的有性繁殖为辅。研究结果表明,自然条件下准噶尔山楂种子密度受海拔梯度影响小,种子更新能力差。可以通过调节立地环境因子、改善种子的着地生境,从而提高种苗转化率,促进种群的良好更新。
Abstract:We studied the composition and spatial distribution characteristics of the soil seed bank and seedling renewal rate of the rare Crataegus songarica plant in the Western Tianshan Wild Fruit Forest in Xinjiang along the altitudinal gradient, combining field sampling, laboratory experiments, and data analysis. Results showed that: (1) Wormy seeds, solid seeds, and plump seeds accounted for 50.83%, 46.22%, and 2.95% of the total C. songarica soil seed bank, respectively. The number of plump seeds at each altitude was very low, but showed a fluctuating trend with altitude (first decreasing, then increasing, then decreasing again), reaching a maximum density of (2.36 ± 0.71) grains/m2 at 1400–1500 m. (2) For vertical distribution of the soil seed bank, wormy seeds were dominant in each soil layer, followed by solid seeds, with the density of plump seeds significantly lower than both. The density of plump seeds did not differ significantly between soil layers. For horizontal distribution, the density of wormy seeds, solid seeds, and plump seeds in the soil seed bank showed a decreasing trend with increasing distance from the C. songarica mother plant, with 94% of plump seeds distributed within 3 m of the mother plant. (3) Seedlings were also distributed near the mother plant (within 2.5 m). There were few seedlings, and the number of seed seedlings was even less (< one strain/50 m2). The seedling conversion rate was only 5‰, dominated by emergent asexual reproduction supplemented with native sexual reproduction. In conclusion, C. songarica seed density was not significantly affected by the altitudinal gradient and seed renewal ability was poor under natural conditions. Thus, C. songarica seedling conversion and renewal could be promoted by regulating environmental factors and improving seed habitat.
-
除了产生诸如氧气与二氧化碳等无机挥发物以外,植物还可以合成大量挥发性有机化合物(Volatile organic compounds,VOCs)[1]。其中最广为人知的植物VOCs是由花朵合成的花VOCs。这些花VOCs共同构成了植物独特的花气味,并对吸引传粉者有着重要作用[2]。绝大多数开花植物以昆虫作为传粉者,昆虫具有灵敏的嗅觉系统,可以从空气中获取有效信息,以便于进行觅食、交配、筑巢和防御[3, 4]。花气味的相关代谢早在昆虫传粉进化出现之前就已经存在[5],二者彼此之间经历了漫长的共同进化。通过空气中的花气味与空气流向,昆虫可以在远距离锁定植物方位[6]。此外,研究表明,通过后天学习,昆虫可以在花气味与花报酬之间建立起记忆关联,以便于自身更好地觅食[7]。Kantsa等[8]的研究指出,花气味可以诚实地反映花蜜的存在;而花蜜是全球动植物互利互作的重要媒介,也是植物吸引传粉者的一种昂贵的生理成本。不同的昆虫对花气味具有不同的偏好性[9, 10];在自然群落中,植物与传粉者的互作是非随机分布的,花气味对维持植物与传粉者互作的特异性具有重要贡献,且有时比花色更为有效[10]。因此,花VOCs的分离与鉴定,在传粉生物学精细化研究中具有重要意义。
气相色谱-质谱联用(GC-MS)技术的快速发展,极大地推进了人类对花VOCs的认识。人类开发出了多种方法对花VOCs进行收集以用于科学研究或香水产品开发,包括:蒸汽蒸馏、萃取、溶剂提取、静态和动态顶空吸附法等方法[1, 9, 11-13];随后,收集的花VOCs通常通过GC-MS技术进行化学分析。由于野外操作方便,且对植物组织不具有破坏性,动态顶空吸附法得到了广泛使用[14]。在这种采样方法中,连续的气流作为载气经过含有样品的顶空空间,随后通过吸附剂。当VOCs被吸附剂捕获时,载气在密闭式装置中循环或从开放式装置中排出,从而收集到足够用于检测甚至结构解析的待测物质[1]。相比于密闭式装置,开放式装置可以通过恒定的气流有效消除顶空空间中气体代谢物(如二氧化碳)的累积,并减小环境温度或湿度的改变。但研究者应注意提供经过过滤的清洁空气,例如通过活性炭过滤,以避免空气中的杂质干扰化学分析[1]。
虽然动态顶空吸附法应用广泛,但是具体操作通常缺乏统一标准,研究者们使用的吸附剂、洗脱溶液甚至连接方式各不相同。因此,有必要通过更系统的实验对已发表的动态顶空吸附法的不同操作方法进行全面比较:一方面,便于研究者们在面对不同的实验材料与实验目的时,选择更适合的吸附剂、溶剂以及连接方式。另一方面,对于涉及大量物种的群落水平实验,研究者们也需要选择最为普适的实验方法。我们调查了国内外的相关研究(表1),总结了动态顶空吸附法中常用的3种吸附剂(Propak Q、Tenax TA和活性碳)、两种洗脱溶液(正己烷与二氯甲烷)和3种不同的连接方式(推拉法、闭环法、循环法)。在此基础上,我们以标准混合物或大花六道木(Abelia×grandiflora (André) Rehder)作为气味来源,分别在室内和室外条件下对3种吸附剂、两种洗脱溶液和3种不同连接方式的收集效果进行了对比,以便于后续研究者选择最为合适的研究方法。
表 1 使用动态顶空吸附法的花气味研究方案差异示例Table 1. Examples of differences in floral scent research protocols using dynamic headspace collection1. 材料与方法
1.1 气味来源
在实验中,我们采用了两种不同的样品作为气味来源:含有典型花气味成分的标准混合物和大花六道木。该物种来自于武汉大学校园中。标准品的具体成分为以下4种物质:1-辛烯(O108660,Aladin)、苯甲醛(B110459,Aladdin)、芳樟醇(L106905,Aladdin)和法尼醇(F113776,Aladdin),体积分数均为0.04%,溶剂为甲醇(M116118,Aladdin)。这4种物质分别代表了花气味组分中最主要的4类物质:脂肪族、苯类、单萜与倍半萜[9],可以较好地反映花气味的真实情况。在实验中,将200 μL的标准品滴加在洁净的称量纸上用于代替真实的植物作为气味来源,而大花六道木则作为天然的气味来源使用。选择该物种的原因在于其可挥发出可被人类感官感知的浓郁花气味,是一种优秀的天然气味来源。
1.2 气味收集
天然或人工的气味来源被封闭在25 cm×38 cm柔性烤肉袋构成的顶空空间中,用于进行后续3种连接方式的吸附实验。推拉法利用硅胶管依次连接大气采样仪出气口、活性炭、顶空空间、吸附剂以及第2台大气采样仪的进气口(图1)。新鲜的空气经过活性炭过滤之后,以250 mL/min的流速进入顶空空间,随后以200 mL/min的流速通过吸附剂离开装置,而花气味成分被截留在吸附剂中。这种不平衡的流速设定有助于维持顶空空间的正压状态,减少污染,同时有助于烤肉袋维持膨胀状态,避免由于烤肉袋收缩,挤压并损坏植物导致实验失败。
闭环法与循环法整体相似,均在密闭的环境中完成吸附过程(图1)。闭环法仅由大气采样仪、吸附剂与顶空空间3部分组成,内部空气以200 mL/min的流速循环流动,依次通过大气采样仪、顶空空间和吸附剂,循环收集气味。循环法则在大气采样仪与顶空空间之间增加了活性炭,对回流气体进行进一步过滤,这种方法在国内被大量使用(表1)。
采集结束后,采用1 mL洗脱溶液进行洗脱,随后加入4 μL体积分数为0.04%的癸酸乙酯(E101444,Aladdin)[19]作为内参,通过气相色谱-质谱联用仪进行分析。实验中,吸附剂与活性炭均被填装在外径为6 mm的玻璃吸附管中使用,填装量均为150 mg。
1.3 室内实验
1.3.1 实验1:不同吸附剂-洗脱溶液组合吸附气味标准混合物的效果对比
实验首先在环境条件更为稳定可控的室内环境下进行。在实验1中,我们统一按照循环法组装了收集装置,采集时间为3 h,气味来源为典型花气味成分的标准混合物。利用Propak Q、Tenax TA以及活性碳3种不同的吸附剂,与正己烷(
32293 ,Sigma-Aldrich)以及二氯甲烷(D116147,Aladdin)两种不同洗脱溶液的成对组合进行测试。然而,当使用二氯甲烷作为洗脱溶液进行洗脱时,Tenax TA吸附剂发生了溶解,因此该组合的实验无法开展。最终,本研究对比了5种吸附剂-洗脱溶液组合(表2),每个实验组设置4个重复。表 2 室内或室外实验中不同实验组的实验方案差异Table 2. Differences in experimental schemes for different experimental groups in indoor or outdoor experiments实验
Experiment实验组ID
Group ID吸附剂
Sorbent trap洗脱溶液
Elution solvent连接方式
Connection method实验1 1 活性炭 二氯甲烷 循环法 2 活性炭 正己烷 循环法 3 Propak Q 二氯甲烷 循环法 4 Propak Q 正己烷 循环法 5 Tenax TA 正己烷 循环法 实验2 4 Propak Q 正己烷 循环法 6 Propak Q 正己烷 推拉法 7 Propak Q 正己烷 闭环法 实验3 8 Charcoal 二氯甲烷 推拉法 9 Charcoal 正己烷 推拉法 10 Propak Q 二氯甲烷 推拉法 11 Propak Q 正己烷 推拉法 12 Tenax TA 正己烷 推拉法 实验4 13 Propak Q 正己烷 循环法 11 Propak Q 正己烷 推拉法 14 Propak Q 正己烷 闭环法 1.3.2 实验2:不同连接方式吸附气味标准混合物的效果对比
在实验2中,统一采用典型花气味成分的标准混合物作为气味来源,以Propak Q作为吸附剂,并以正己烷作为洗脱溶液。连接方式分别按照循环法、闭环法以及推拉法组装(表2),对气味均进行3 h的收集。循环法与闭环法设置4个重复,推拉法设置了3个重复。
1.4 室外实验
1.4.1 实验3:不同吸附剂-洗脱溶液组合吸附自然花气味的效果对比
由于动态吸附法通常被用于野外实验,本研究以大花六道木为实验材料在室外进行了相关实验。采样时间为9 h,起始时间为早晨8:00-10:00,每个实验组设置3个重复,同时设置1组没有花朵的空白对照组。我们同样测试了5种吸附剂-洗脱溶液组合,但不同于以上室内实验,在连接方式上我们仅使用推拉法(表2)。因为相比于密闭的循环法与闭环法,推拉法能够保持植物的自然鲜活状态[1]。由于自然花气味浓度相对较低,在进行GC-MS分析之前,洗脱液通过氮吹浓缩至50 μL。
1.4.2 实验4:不同连接方式吸附自然花气味的效果对比
在室外实验中,本研究同样对比了不同连接方式的吸附效果。实验操作与实验2大致相同:统一采用Propak Q作为吸附剂,以正己烷作为洗脱溶液;但气味来源为自然生长的活体大花六道木。将大花六道木2 ~ 5个花序封闭在顶空空间内,随后分别按照循环法,闭环法以及推拉法组装连接方式(表2),对其持续采样9 h。采样结束后,其余实验步骤与实验3相同。
1.5 气相色谱-质谱联用技术分析
室内实验,按照以下流程通过GC-MS(Trace GC Ultra,ISQ单四极质谱,Themo Scientist)分析:柱温箱在40 ℃保留3 min后,以10 ℃/min的速度升温到250 ℃,进样体积为1 μL,载气流速为1.5 mL/min,分流流速为11 mL/min,离子源与传输线温度均为250 ℃,质谱扫描范围为:33~550[19],色谱柱型号为DB-5MS(30 m×0.25 mm×0.25 μm)。由于法尼醇的挥发性较差,我们随后将洗脱液氮吹浓缩至约50 μL后,采取不分流进样,对其进行了2次检测。为了确定不同物质的保留时间,对以上4种物质的0.04%的标准溶液进行了检测,并通过与NIST08数据库比对确定物质种类。
室外实验为非靶向实验,为了尽可能区分物质,我们参照前人的研究[19],降低了GC-MS的升温速度与气流速度。柱温箱在40 ℃保留2 min后,以4 ℃/min升温到120 ℃,不进行保留,随后以5 ℃/min升温至250 ℃,最后于250 ℃保留4 min,载气流速为1 mL/min。在与空白组对比后,实验组中存在而空白组中不存在的色谱峰被视为目标物质。最终通过与NIST08数据库比对,确定物质种类。
1.6 数据分析
对于室内实验,我们通过待测物质与内参之间相对峰面积的大小衡量实验效果[14]。由于法尼醇含量过低,且有其他杂质与其共流出;为降低背景噪声,我们进一步提取了69特征峰作为参考。对于室外实验,我们通过相对峰面积与顶空空间内花组织鲜重的比值作为参考值。这种计算方式可反映单位质量花组织的气味挥发量,也是计算植物气味挥发量的常用方法。参考值乘以内参质量,并除以采样时间后,即为理论挥发速率。如果采用推拉法则需要进一步乘以进气流速与出气流速的比值进行调整。我们通过单因素方差分析与Tukey HSD事后检验,详细对比了不同吸附剂-洗脱溶液组合与连接方式在不同物质类型上的表现优劣。其中,吸附剂-洗脱溶液组合或连接方式作为预测变量,不同种类物质的参考值作为响应变量,参考值在室内实验中为相对面积,在室外实验中为相对峰面积与花组织鲜重的比值。所有数据均经过log10转换,以满足正态性。方差分析与Tukey HSD事后检验,分别通过R语言“stats”包中的aov函数与TukeyHSD函数进行。
2. 结果与分析
2.1 室内实验
2.1.1 实验1:不同吸附剂-洗脱溶液组合吸附气味标准混合物的效果对比
与室外实验相比,室内环境稳定可控,有利于更为详实地判断不同变量对结果的影响。根据实验1的结果,Propak Q的综合表现最为良好,其相较于另外两种吸附剂,在不同气味物质层面均展现出了明显的吸附优势。活性炭对苯类物质的吸附效果较差(F4,15=12.46,P<0.001,图2:B),而对于苯类物质,除Tenax TA-正己烷与活性碳-二氯甲烷之间在成对对比中无显著差异以外,活性炭无论采取何种洗脱溶液,其苯类物质的相对面积均显著低于其他组(图2:B)。Tenax TA吸附剂对脂肪族的吸附效果同样较差(F4,15=11.96,P<0.001,图2:A),其吸附的脂肪族物质的相对面积显著低于其他所有组(图2:A)。对于单萜类物质,不同组间无显著差异(F4,15=0.921,P=0.478, 图2:C)。在倍半萜层面,吸附剂-洗脱溶液组合的不同仍显著影响实验结果(F4,15=3.844,P=0.0241,图2:D)。Tenax TA-正己烷对倍半萜的吸附效果显著低于活性炭-正己烷(P=0.043)和Propak Q-二氯甲烷(P=0.032)两个组合(图2:D)。检测结果差异基本均来自于吸附剂的不同——对于所有气味物质标品,当吸附剂相同时,不同组合之间并不具有显著差异。
![]() 图 2 室内实验中5种吸附剂-洗脱溶液组合在不同物质层面的表现散点位置代表平均值,线条长度代表标准误。不同字母代表在Tukey HSD成对检验中P<0.05。下同。Figure 2. Performance of five sorbent trap-elution solvent combinations across different substances in indoor experimentsDot represents average value and line length represents standard error. Different letters indicate significant differences (P<0.05) in the Tukey HSD pairwise test. Same below.
图 2 室内实验中5种吸附剂-洗脱溶液组合在不同物质层面的表现散点位置代表平均值,线条长度代表标准误。不同字母代表在Tukey HSD成对检验中P<0.05。下同。Figure 2. Performance of five sorbent trap-elution solvent combinations across different substances in indoor experimentsDot represents average value and line length represents standard error. Different letters indicate significant differences (P<0.05) in the Tukey HSD pairwise test. Same below.2.1.2 实验2:不同连接方式吸附气味标准混合物的效果对比
循环法在所有物质层面,均展现了最高的平均相对面积。但在所有物质层面,推拉法与循环法、推拉法与闭环法之间均不具有显著差异(P>0.05,图3)。方差分析结果显示,连接方式对脂肪族物质(F2,8=4.108,P=0.059,图3:A)以及倍半萜类物质(F2,8=2.195,P=0.174,图3:D)的吸附效果不具有显著影响,但却显著影响对苯类物质(F2,8=9.947,P=0.008,图3:B)与单萜类物质(F2,8=7.12,P=0.017,图3:C)的吸附效果。进一步的成对对比结果显示,在这两种物质中循环法显著优于闭环法(图3)。但值得注意的是,循环法中苯甲醛的相对面积高于沸点更低的辛烷。苯甲醛具有更高的沸点,Raguso和Pellmyr[14]的研究显示,当物质总量相同时,物质的相对面积通常随沸点上升逐步下降,因为沸点更高的物质通常更加难以挥发;这或许是因为吸附剂与过滤器之间的吸附效果不同,导致气味物质在吸附剂与过滤器之间发生了进一步分配,或改变了回流空气中残余气味物质的成分比例。以上现象的具体原因尚需进一步研究,但如果选择循环法进行实验,实验者需要更加慎重。此外,长时间的封闭环境偏离了植物的自然条件,对于活体植物的影响也不可忽视[1]。为此,本研究在实验3中优先选择了推拉法。
2.2 室外实验
2.2.1 实验3:不同吸附剂-洗脱溶液组合吸附自然花气味的效果对比
与室内实验相比,室外环境复杂多变,但室外环境通常是动态吸附法最真实的工作环境。实验结果显示,大花六道木以苯类与单萜类物质为主要挥发物。在实验3与实验4的所有结果中,这两类物质的挥发量平均占比均在94.7%以上(表3)。在实验3中,我们再一次对比了不同吸附剂-洗脱溶液组合的差异性。从检测出的物质种类数目来看,被检测的物质数目均为10种左右。其中,Propak Q-正己烷以及活性碳-二氯甲烷组合检测出了最多的物质成分(11种),而Propak Q-二氯甲烷组合与活性炭-正己烷组合只检测出9种物质成分(表3)。只有两种采用活性炭作为吸附剂的实验组以及Propak Q-正己烷组合,同时检测出了苯类、单萜、倍半萜与脂肪族4个功能群。在稀有成分上,Tenax TA组以及Propak Q-二氯甲烷组合均未检测出脂肪族物质(表3)。实验环境多变以及材料本身的生物学变异,均可能造成微量物质的较差的重复性。但值得注意的是,无论采用正己烷洗脱还是采用二氯甲烷洗脱的活性炭组,均未检测出主要挥发物苯乙醛,在其他3组实验中,苯乙醛的平均挥发量占比为25%~45%。
表 3 不同方法检测大花六道木花气味的实验结果Table 3. Experimental results of detecting floral scents in Abelia×grandiflora using different methods实验组
Group物质数字识别号码
CAS number名称
Name参考值
Value标准误
Standard error挥发速率
Emission rate / ng∙g−1∙h−1活性碳-
二氯甲烷100-51-6 苯甲醇 0.61 0.36 116.75 100-52-7 苯甲醛 9.98 6.66 1 913.80 123-35-3 月桂烯 0.06 0.01 12.25 140-11-4 乙酸苄酯 0.16 0.06 31.24 18172-67-3 β-蒎烯 3.03 0.64 580.63 23470-00-0 2-单棕榈酸甘油 0.35 0.35 67.05 3387-41-5 桧烯 0.12 0.04 23.85 5208-59-3 β-波旁烯 0.15 0.05 27.99 60-12-8 苯乙醇 0.74 0.3 141.77 80-56-8 α-蒎烯 11.09 1.86 2 127.34 87-44-5 β-石竹烯 0.39 0.13 74.67 活性碳-
正己烷100-51-6 苯甲醇 0.05 0.03 10.01 100-52-7 苯甲醛 2.23 1.92 428.56 18172-67-3 β-蒎烯 3.08 1.67 591.16 2867-05-2 α-thujene 0.04 0.02 7.08 3387-41-5 桧烯 0.08 0.04 16.24 5208-59-3 β-波旁烯 0.08 0.04 15.04 60-12-8 苯乙醇 0.11 0.09 21.07 72237-36-6 4-己烯-醋酸酯 0.03 0.01 6.57 80-56-8 α-蒎烯 6.94 3.67 1 330.45 Propak Q-
二氯甲烷100-51-6 苯甲醇 0.43 0.2 82.65 100-52-7 苯甲醛 5.69 2.43 1 090.83 119-36-8 水杨酸甲酯 0.06 0.05 10.59 122-78-1 苯乙醛 9.34 3.09 1 791.32 18172-67-3 β-蒎烯 0.92 0.5 177.23 3387-41-5 桧烯 0.02 0.02 4.18 60-12-8 苯乙醇 2.94 1.58 564.48 80-56-8 α-蒎烯 2.15 1.23 411.54 87-44-5 β-石竹烯 0.05 0.03 10.47 Propak Q-
正己烷100-51-6 苯甲醇 0.36 0.09 69.51 100-52-7 苯甲醛 6.07 1.38 1 164.27 119-36-8 水杨酸甲酯 0.05 0.02 9.24 122-78-1 苯乙醛 9.96 2.39 1 909.73 18172-67-3 β-蒎烯 0.81 0.33 155.24 2867-05-2 α-thujene 0.02 0.01 3.46 3387-41-5 桧烯 0.07 0.02 12.58 36653-82-4 十六醇 1.17 1.87 223.88 60-12-8 苯乙醇 2.35 0.97 450.36 80-56-8 α-蒎烯 2.57 1.03 492.12 87-44-5 β-石竹烯 0.07 0.02 13.50 Tenax TA-
正己烷100-51-6 苯甲醇 1.00 0.36 191.97 100-52-7 苯甲醛 16.98 4.82 3 256.74 119-36-8 水杨酸甲酯 0.11 0.02 21.65 122-78-1 苯乙醛 8.40 1.8 1 610.69 18172-67-3 β-蒎烯 1.10 0.28 211.58 2867-05-2 α-thujene 0.02 0.02 3.81 5208-59-3 β-波旁烯 0.19 0.06 37.35 60-12-8 苯乙醇 2.18 0.49 418.78 80-56-8 α-蒎烯 1.82 1.62 348.15 87-44-5 β-石竹烯 0.27 0.15 52.65 闭环法 100-51-6 苯甲醇 0.52 0.14 79.86 100-52-7 苯甲醛 4.18 1.09 641.61 122-78-1 苯乙醛 0.58 0.23 89.67 1686-14-2 α-氧化蒎烯 0.07 0.04 11.33 18172-67-3 β-蒎烯 1.95 2.00 299.25 23470-00-0 2-单棕榈酸甘油 0.58 0.58 89.03 2867-05-2 α-thujene 0.02 0.03 2.90 3779-61-1 反式-β-罗勒烯 0.07 0.07 10.41 4501-58-0 龙脑烯醛 0.09 0.06 13.95 80-56-8 α-蒎烯 3.79 3.63 581.63 循环法 100-51-6 苯甲醇 0.20 0.04 30.68 100-52-7 苯甲醛 7.35 1.08 1 127.83 119-36-8 水杨酸甲酯 0.02 0.01 3.64 122-78-1 苯乙醛 1.55 0.26 237.5 1686-14-2 α-氧化蒎烯 0.03 0.01 4.51 18172-67-3 β-蒎烯 3.15 2.51 482.86 2867-05-2 α-thujene 0.03 0.02 5.00 3387-41-5 桧烯 0.11 0.07 17.01 60-12-8 苯乙醇 0.12 0.05 18.21 80-56-8 α-蒎烯 7.79 5.52 1 195.40 87-44-5 β-石竹烯 0.03 0.01 3.89 注:挥发速率 = (参考值×内参质量) ÷ 采样时间×(进气流速 ÷ 出气流速)。Propak Q-正己烷组合在实验4中代表推拉法。闭环法以及循环法的进气流速及出气流速均为200 mL/min。 Notes: Emission rate = (reference value×internal reference mass) ÷ sampling time×(push rate ÷ pull rate). Propak Q-hexane represents the push-pull method in Experiment 4. Push and pull rates were 200 mL/min in the closed-loop and circulation methods. 我们通过方差分析对比了不同吸附剂-洗脱溶液组合解析大花六道木两类主要挥发物的表现差异。结果显示,对于苯类物质,活性碳表现较差(F4,10=6.692,P=0.007,图4:A)。在成对对比中,采用正己烷洗脱的活性炭显著低于采用其他吸附剂的3个实验组,但与二氯甲烷洗脱的活性炭之间并不存在显著差异(图4:A),这与室内实验结果相同。而对于单萜类物质,活性碳首次展现出了一定的优势(F4,10=6.402,P=0.008,图4:B)。采用二氯甲烷洗脱的活性碳对单萜类物质的吸附效果显著高于采用不同吸附剂的3个实验组(图4:B)。
2.2.2 实验4:连接方式吸附自然花气味的效果对比
本研究同样在室外检测了3种连接方式的影响。相比于无代谢变化的人工气味来源,应注意密闭式的闭环法与循环法在真实条件下的工作表现。从物质种类上,推拉法与循环法均检测出了11种物质,而闭环法只检测出9种物质(表3)。与实验3相同,我们通过方差分析比对了不同实验组对苯类物质与单萜类物质的表现差异。结果显示,只有苯类物质受到连接方式的显著影响(F2,6=43.17,P<0.001,图5:B)。在成对对比中,对于苯类物质,3种连接方式彼此之间均具有显著差异(图5:A),按照吸附效果从高到低,依次为推拉法、循环法和闭环法。单萜类物质从高到低,依次为循环法、闭环法和推拉法,但彼此之间不具有显著差异(F2,6=1.315,P=0.336,图5:B)。而在室内实验中,循环法在各类物质中均具有最高的吸附效果,尽管循环法与推拉法在室内实验中不具有显著差异。这种变化可能是因为密闭环境中积蓄的气味物质引起了代谢改变[1]。
3. 讨论
相比于其他吸附剂与连接方式,本研究推荐使用Propak Q吸附剂和推拉法进行花气味研究。该方案具有最为广泛的适用性,尤其是进行群落水平研究时,该方案适合作为统一标准进行大规模的气味收集。而不同洗脱溶液在本研究中没有表现出显著差异。
3种吸附剂中,Propak Q的综合表现最为优秀。在室内实验中,Propak Q是唯一没有表现出明显缺陷的吸附剂。而活性炭与Tenax TA分别在苯类与脂肪族层面表现出了明显的缺陷(图2)。在室外实验中,Propak Q与Tenax TA表现类似。尽管室外实验中,二者均在单萜类物质层面显著低于活性炭-二氯甲烷组合(图4),但活性炭未能吸附部分主要成分(表3),展现出不理想的结果。在实验材料气味组成未知的情况下,或需要进行大规模的群落水平研究中,Propak Q是3种吸附剂中的最佳选择。
在过去的研究中, Raguso和Pellmyr [14]曾指出正己烷作为洗脱溶液更为优异。但在本研究中,洗脱溶液对于实验结果的影响十分有限,两种洗脱溶液的表现类似,这可能与实验材料的不同有关。当吸附剂相同时,无论室内实验还是室外实验,正己烷与二氯甲烷对于各类物质的洗脱效果接近。考虑到相似相溶原理,我们同样更加倾向于极性更低的正己烷作为洗脱溶液。虽然不具有显著性,但在实验中,Propak Q-正己烷组合通常比Propak Q-二氯甲烷组合表现优异。
连接方式同样是影响实验结果的重要因素。闭环法在3种连接方式中表现最差。无论室内实验还是室外实验,闭环法均是3种连接方式中表现最差的方法。在室内实验中,推拉法与循环法在各类物质层面的表现均不具有显著差异。但在室外实验中,推拉法的表现显著优于其他两种方法。这可能是因为顶空空间在密闭的环境下,积蓄的气味物质引起了植物的代谢变化,如负反馈调节。此外,或许是由于过滤器截留了部分气味物质,即使在采取人工气味源的室内实验中,循环法也表现出了偏离真实气味的可能。根据我们的实验结果,推拉法是3种装置中最为优秀的连接方式。同时,推拉法也是最为接近植物自然状态的连接方式。
由于实验条件限制,我们没有对比不同的色谱柱对于实验结果的影响。作为GC-MS的重要组件,色谱柱或许是影响实验结果的一个关键因素。不同的色谱柱对于不同物质的保留效果不同。保留效果较差的物质,往往会在最初溶剂保留的时间内直接流出。这些物质往往彼此之间混杂在一起,或与溶剂混杂在一起,导致无法检测。色谱柱的选择通常与待测物质的种类有关,不同物种的花气味不同,需要使用不同的色谱柱进行检测。在未来进一步的研究中,可以尝试探讨不同色谱柱对于实验结果的影响,以便于选择一个广泛适用的色谱柱,从而帮助群落研究统一标准。
-
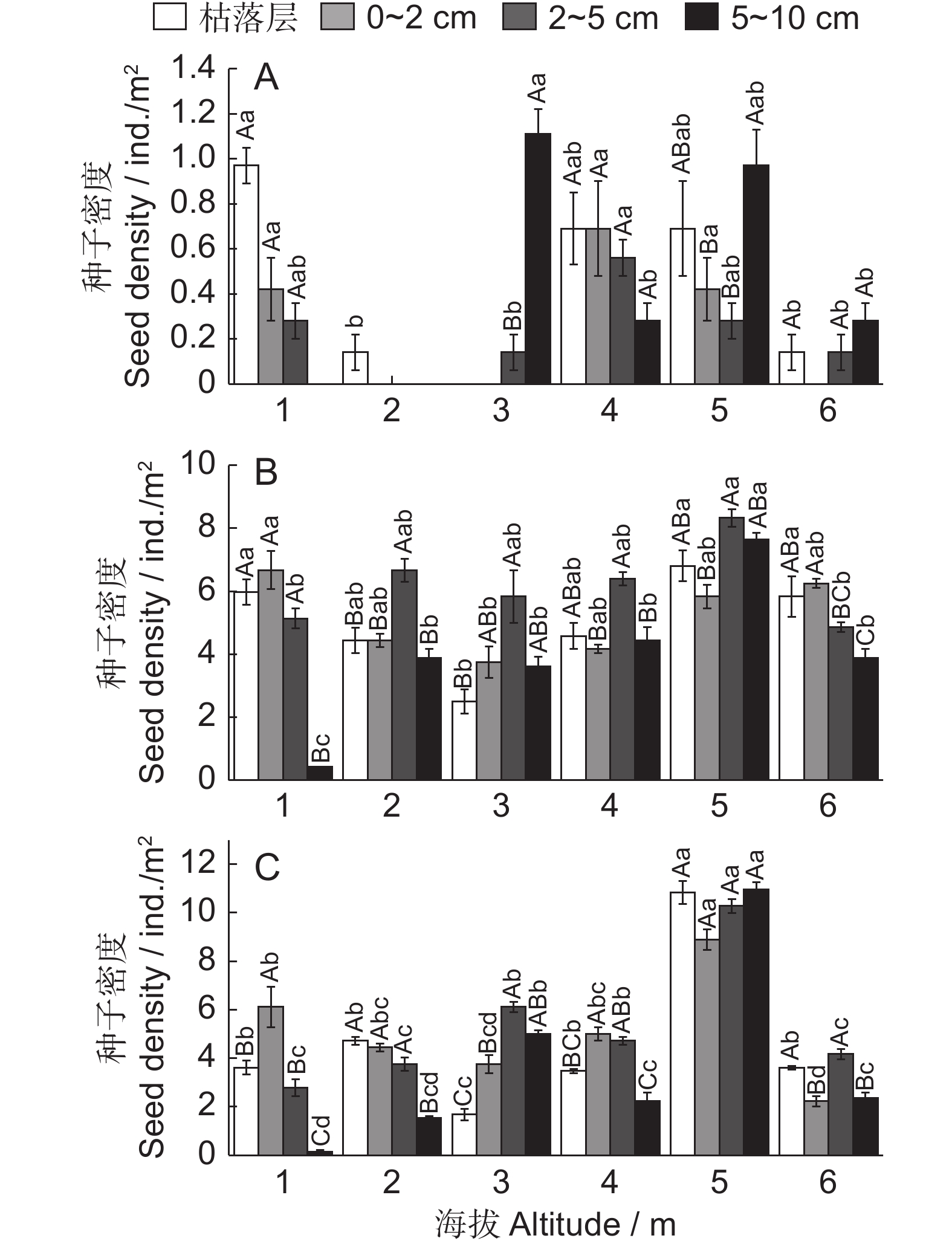
图 3 不同海拔梯度准噶尔山楂种子垂直分布特征
A:饱满种子,B:虫蛀种子,C:实心种子。大写字母分别表示同一海拔不同土层间差异显著(P < 0.05);小写字母表示不同海拔同一土层间差异显著(P < 0.05)。
Figure 3. Vertical distribution characteristics of Crataegus songarica seeds at different altitudes
A: Plump seeds, B: Wormy seeds, C: Solid seeds. Different capital letters indicate significant differences between different soil layers at the same altitude (P < 0.05). Different lowercase letters indicate significant differences between different altitudes in the same soil layer (P < 0.05).
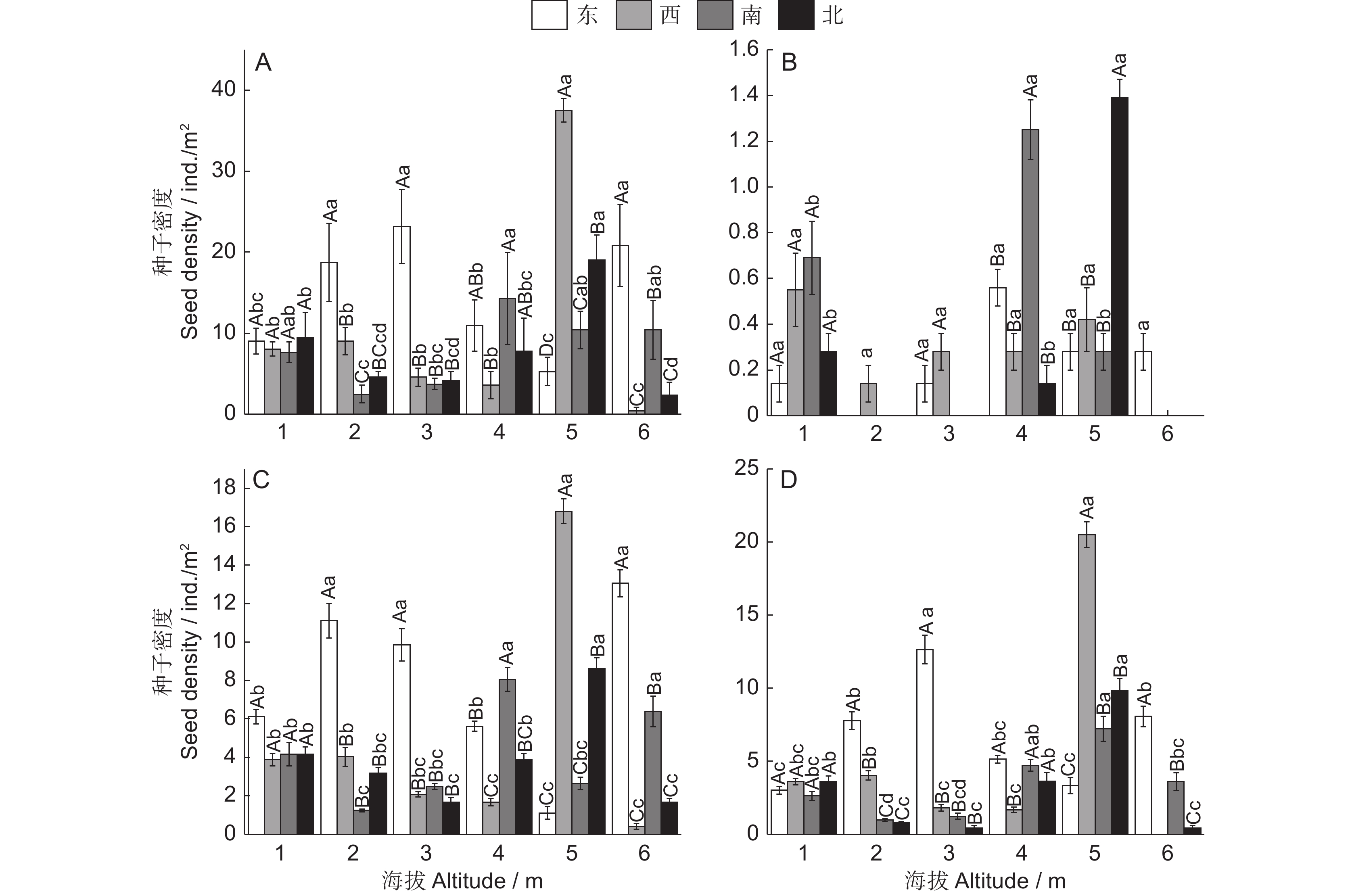
图 4 准噶尔山楂种子水平方向分布特征
A:总种子,B:饱满种子,C:虫蛀种子,D:实心种子。大写字母表示同一海拔不同方向种子间差异显著(P < 0.05);小写字母表示不同海拔同一方向间差异显著(P < 0.05)。
Figure 4. Horizontal distribution characteristics of Crataegus songarica seeds
A: Total seeds; B: Plump seeds; C: Wormy seeds; D: Solid seeds. Different capital letters indicate significant differences between seeds in different directions at the same altitude (P < 0.05). Different lowercase letters indicate significant differences between seeds in the same direction at different altitudes (P < 0.05).
表 1 不同海拔准噶尔山楂土壤种子库组成
Table 1 Composition of soil seed bank of Crataegus songarica at different altitudes
海拔梯度
Altitudinal gradient / m种子密度 Seed density / ind./m2 虫蛀 Wormy 实心 Solid 饱满 Plump 总计 Total 1000~1100 18.33 ± 0.29Abc 12.64 ± 0.17Bb 1.67 ± 0.29Cab 31.25 ± 3.06b 1100~1200 19.44 ± 0.38Abc 13.62 ± 0.53Bb 0.1 4 ± 0.10Cb 34.03 ± 2.64b 1200~1300 16.11 ± 0.58Ac 16.22 ± 1.13Ab 0.42 ± 0.14Bab 30.55 ± 4.10b 1300~1400 19.03 ± 1.09Abc 15.42 ± 0.93Bb 2.22 ± 0.45Ca 36.67 ± 2.07b 1400~1500 28.61 ± 1.76Ba 40.98 ± 3.73Aa 2.36 ± 0.71Ca 71.95 ± 3.41a 1500~1600 20.83 ± 2.65Ab 12.36 ± 2 .39Bb 0.28 ± 0.19Cb 33.75 ± 5.08b 百分比 / % 50.83 46.22 2.95 注:大写字母表示同一海拔不同类种子密度间存在显著差异(P < 0.05);小写字母表示不同海拔同类种子密度间存在显著差异(P < 0.05)。 Notes: Different capital letters represent significant differences between different seeds at the same altitude (P < 0.05). Different lowercase letters represent significant differences between the same seeds at different altitudes (P < 0.05). 表 2 不同海拔梯度内准噶尔山楂种子距离分布特征
Table 2 Distance distribution characteristics of Crataegus songarica seeds at different altitudinal gradients
海拔梯度
Altitudinal gradient / m距离
Distance / m种子密度 Seed density / ind./m2 虫蛀 Wormy 实心 Solid 饱满 Plump 1000~1100 1 9.31 ± 0.92Aa 6.39 ± 0.47Ab 0.42 ± 0.3Bc 2 5.83 ± 0.52Ba 3.89 ± 0.24Bb 0.97 ± 0.11Ac 3 2.5 ± 0.50Ca 2.5 ± 0.61ABa 0.28 ± 0.01Bb 4 0.69 ± 0.04Ca 0.14 ± 0.10Cb 0 5 0 0 0 1100~1200 1 10.56 ± 0.98Aa 7.64 ± 0.52Aa 0 2 5.69 ± 0.13Ba 3.89 ± 0.09Bb 0.14 ± 0.10c 3 2.92 ± 0.05Ca 0.14 ± 0.10Ca 0 4 0.14 ± 0.10Da 0.14 ± 0.10Ca 0 5 0.14 ± 0.10Da 0.14 ± 0.10Ca 0 1200~1300 1 5.97 ± 0.34Aa 5.83 ± 0.54Aa 0.14 ± 0.10Ab 2 4.31 ± 0.32Ba 3.19 ± 0.07Ba 0.14 ± 0.10Ab 3 3.33 ± 0.32Ba 1.94 ± 0.19Bb 0 4 1.11 ± 0.17Cb 3.19 ± 0.17Ba 0.14 ± 0.10Ac 5 1.39 ± 0.18Ca 3.19 ± 0.17Ba 0 1300~1400 1 7.36 ± 0.93Aa 7.36 ± 0.93Aa 1.25 ± 0.12Ac 2 5.97 ± 0.56Aa 5.97 ± 0.93Aa 0.42 ± 0.04Bb 3 4.17 ± 08Ba 3.33 ± 0.09Ba 0.56 ± 0.11Bb 4 2.22 ± 0.06Ca 2.22 ± 0.06Ba 0 5 0 0 0 1400~1500 1 13.19 ± 0.98Ab 21.67 ± 1.22Aa 0.97 ± 0.09Ac 2 6.39 ± 0.78Bb 9.17 ± 0.56Ba 0.42 ± 0.02Bc 3 5.28 ± 0.54Ba 5.14 ± 0.34Ba 0.42 ± 0.11Bb 4 2.36 ± 0.21BCa 2.08 ± 0.21Ba 0.14 ± 0.17Bb 5 0.42 ± 0.03Ca 1.53 ± 0.15Ba 0.14 ± 0.10Ba 1500~1600 1 8.61 ± 0.88Aa 4.03 ± 0.54Ab 0 2 4.44 ± 0.54Ba 1.39 ± 0.33Bb 0.14 ± 0.10c 3 4.17 ± 0.33Ba 2.36 ± 0.45ABb 0 4 2.64 ± 0.81Ca 3.33 ± 0.33Aa 0 5 1.67 ± 0.22Ca 0.97 ± 0.09Ca 0 注:大写字母表示同一海拔不同距离相同种子间有显著差异(P < 0.05);小写字母表示同一海拔相同距离不同种子间有显著差异(P < 0.05)。 Notes: Different capital letters indicate significant differences between the same seeds at the same altitude and different distance (P < 0.05). Different lowercase letters indicate significant differences between seeds at the same altitude and distance (P < 0.05). 表 3 准噶尔山楂幼苗分布特征
Table 3 Seedling characteristics of Crataegus songarica
海拔梯度
Altitudinal gradient / m距离
Distance / m株高
Plant height / cm基径
Base diameter / mm实生苗
Seedling萌生苗
Sprout每平方的苗
Seedling / m21000~1100 1.28 ± 0.59 7.97 ± 0.81 1.04 ± 0.04 0 6 0.27 1100~1200 1.08 ± 0.17 6.92 ± 0.81 1.05 ± 0.04 2 8 0.68 1200~1300 1.27 ± 0.32 8.26 ± 0.51 1.05 ± 0.04 1 10 0.48 1300~1400 0.74 ± 0.11 5.48 ± 0.34 1.03 ± 0.03 0 7 0.30 1400~1500 0.86 ± 0.08 6.30 ± 0.41 0.87 ± 0.06 1 8 0.19 1500~1600 2.24 ± 0.72 7.25 ± 0.60 1.05 ± 0.05 1 7 0.22 -
[1] 高郯,李照青,卢杰,李江荣,郑维列. 西藏工布自然保护区高山松林土壤种子库空间分布动态特征[J]. 林业科学研究,2021,34(2):158−165. Gao T,Li ZQ,Lu J,Li JR,Zheng WL. Study on spatial distribution dynamic characteristics of soil seed bank of Pinus densata forest in Gongbu Nature Reserve,Tibet[J]. Forest Research,2021,34 (2):158−165.
[2] 刘进娣,马红彬,周瑶,马菁,沈艳,等. 轮牧时间对荒漠草原土壤种子库特性的影响[J]. 应用生态学报,2021,32(7):2378−2388. Liu JD,Ma HB,Zhou Y,Ma J,Shen Y,et al. Effects of rotation grazing time on the characteristics of soil seed bank in desert steppe[J]. Chinese Journal of Applied Ecology,2021,32 (7):2378−2388.
[3] Chalermsri A,Ampornpan LA,Purahong W. Seed rain,soil seed bank,and seedling emergence indicate limited potential for self-recovery in a highly disturbed,tropical,mixed deciduous forest[J]. Plants,2020,9 (10):1391. doi: 10.3390/plants9101391
[4] 邢旭明,马晓东,张元明. 古尔班通古特沙漠生物土壤结皮对土壤种子库多样性与分布特征的影响[J]. 生态学杂志,2016,35(3):612−620. Xing XM,Ma XD,Zhang YM. Effects of biological soil crusts on soil seed bank diversity and distribution characteristics in Gurbantunggut Desert[J]. Chinese Journal of Ecology,2016,35 (3):612−620.
[5] Williams LK,Kristiansen P,Sindel BM,Wilson SC,Shaw JD. Quantifying the seed bank of an invasive grass in the sub-Antarctic:seed density,depth,persistence and viability[J]. Biol Invasions,2016,18 (7):2093−2106. doi: 10.1007/s10530-016-1154-x
[6] Fernanda MG,Clemir CDO,Roberta DRM,Rafael CDC,Maria IBL,Loiola MIB. Relationships between soil seed bank composition and standing vegetation along chronosequences in a tropical dry forest in north-eastern Brazil[J]. J Trop Ecol,2019,35 (4):173−184. doi: 10.1017/S0266467419000130
[7] 朱晨曦,刘志刚,王昌辉,王大洋,郭思,等. 土壤种子库特征及与地上植被的关系:以福建省三明市杉木人工林为例[J]. 中国环境科学,2019,39(10):4416−4423. Zhu CX,Liu ZG,Wang CH,Wang DY,Guo S,et al. Characteristics of soil seed bank and its relationship with aboveground vegetation:a case study of Chinese fir plantations in Sanming City,Fujian Province[J]. China Environmental Science,2019,39 (10):4416−4423.
[8] 蔡杰,张挺,刘成,张桥蓉,郭永杰,杨湘云. 野生植物种子采集技术规范[J]. 植物分类与资源学报,2013,35(3):221−233. Cai J,Zhang T,Liu C,Zhang QR,Guo YJ,Yang XY. Synopsis of technical standards for collecting seeds from wild plants[J]. Plant Diversity and Resources,2013,35 (3):221−233.
[9] 刘影,赵玉,闫俊杰,李海冰,丛桂芝. 新疆野生樱桃李天然林土壤种子库特征[J]. 干旱区研究,2013,30(4):666−673. Liu Y,Zhao Y,Yan JJ,Li HB,Cong GZ. Soil seed bank under natural forest of Prunus divaricata in Xinjiang,China[J]. Arid Zone Research,2013,30 (4):666−673.
[10] 邹林林. 不同海拔梯度蒙古扁桃种子库的研究[D]. 呼和浩特: 内蒙古师范大学, 2009: 1-55. [11] 李照青,高郯,张铎,卢杰. 西藏林芝高山松土壤种子库空间分布特征研究[J]. 西北林学院学报,2019,34(4):43−48. Li ZQ,Gao T,Zhang D,Lu J. Spatial distribution characteristics of soil seed bank of Pinus densata in Linzhi,Tibet[J]. Journal of Northwest Forestry University,2019,34 (4):43−48.
[12] 田晓萍,马力,占玉芳. 祁连山祁连圆柏土壤种子库海拔梯度分布格局[J]. 山地学报,2019,37(5):662−668. doi: 10.16089/j.cnki.1008-2786.000457 Tian XP,Ma L,Zhan YF. Distribution patterns of soil seed bank of Sabina przewalskii along altitudinal gradient in the Qilian Mountains,China[J]. Mountain Research,2019,37 (5):662−668. doi: 10.16089/j.cnki.1008-2786.000457
[13] 谭向前,陈芳清,王稷,熊丹伟,许建新. 川西山区自然边坡土壤种子库随海拔梯度的变化[J]. 山地学报,2019,37(4):508−517. Tan XQ,Chen FQ,Wang J,Xiong DW,Xu JX. Variations of soil seed bank of natural slopes in the western Sichuan mountainous region along altitude gradient[J]. Mountain Research,2019,37 (4):508−517.
[14] 张敏,宋晓阳. 热带森林群落土壤种子库对海拔梯度的响应[J]. 生态学杂志,2015,34(9):2390−2400. Zhang M,Song XY. Responses of soil seed banks in tropical forests to an elevational gradient[J]. Chinese Journal of Ecology,2015,34 (9):2390−2400.
[15] 范贺娟,来风兵,曹家睿,陈蜀江,许超宗. 天山野果林区滑坡景观时空演变及生态风险预测[J]. 山地学报,2020,38(2):231−240. Fan HJ,Lai FB,Cao JR,Chen SJ,Xu CZ. Spatio-temporal evolution and ecological risk prediction of landslide landscape in the Tianshan wild fruit forest area[J]. Mountain Research,2020,38 (2):231−240.
[16] 方紫妍,李林瑜,艾克拜尔·毛拉,周龙,陆彪. 人为干扰对西天山野果林群落结构和物种多样性的影响[J]. 水土保持通报,2019,39(2):267−274. Fang ZY,Li LY,Aikebaier·Maola,Zhou L,Lu B. Effects of human disturbance on plant diversity of wild fruit forests in western Tianshan Mountain[J]. Bulletin of Soil and Water Conservation,2019,39 (2):267−274.
[17] 阎国荣,张立运,许正. 天山野果林生态系统受损现状及其保护[J]. 干旱区研究,1999,16(4):1−4. Yan GR,Zhang LY,Xu Z. The suffer losses for wild fruits forest ecosystem of Tianshan Mts in Xinjiang and its conservation[J]. Arid Zone Research,1999,16 (4):1−4.
[18] 杨蕾,吕海英,李进,马雪,艾克拜尔·依米提. 新疆天山野果林准噶尔山楂种群结构与动态分析[J]. 西北植物学报,2018,38(12):2314−2323. Yang L,Lü HY,Li J,Ma X,Akbar · Yimit. Structure and dynamic analysis of Crataegus songarica K. Koch population in Tianshan wild fruit forest of Xinjiang[J]. Acta Botanica Boreali-Occidentalia Sinica,2018,38 (12):2314−2323.
[19] 吕海英,周露露,李进,张瑾. 准噶尔山楂果实色素提取工艺研究[J]. 安徽农学通报,2011,17(9):25−27. Lü HY,Zhou LL,Li J,Zhang J. The studies on extracting technology of pigments from Crataegus Songorica K. Koch[J]. Anhui Agricultural Science Bulletin,2011,17 (9):25−27.
[20] 盛芳,陈淑英,田嘉,李鹏,秦雪,等. 新疆准噶尔山楂不同居群的遗传多样性[J]. 生物多样性,2017,25(5):518−530. doi: 10.17520/biods.2016369 Sheng F,Chen SY,Tian J,Li P,Qin X,et al. Genetic diversity of Crataegus songorica in Xinjiang[J]. Biodiversity Science,2017,25 (5):518−530. doi: 10.17520/biods.2016369
[21] 张侠,李进,吕海英,李志成,周燕荣,赵颖. 准噶尔山楂种壳、种皮、种胚特性与种子休眠的关系[J]. 植物生理学报,2014,50(6):867−874. Zhang X,Li J,Lü HY,Li ZC,Zhou YR,Zhao Y. Relationship between characteristic of Crataegus songorica husk,seed coat,embryo and seed dormancy[J]. Plant Physiology Journal,2014,50 (6):867−874.
[22] 刘欢,廖康,刘娟,赵世荣,孙琪,曹倩. 新疆野生山楂资源遗传多样性及亲缘关系的ISSR分析[J]. 经济林研究,2016,34(2):19−23. Liu H,Liao K,Liu J,Zhao SR,Sun Q,Cao Q. Analysis of genetic diversity and genetic relationship of wild hawthorn resources in Xinjiang by ISSR markers[J]. Nonwood Forest Research,2016,34 (2):19−23.
[23] 尚天翠,刘影,赵玉. 新疆野生樱桃李林自然保护区不同海拔梯度土壤养分特征及相关性分析[J]. 中国农业科技导报,2018,20(8):119−127. Shang TC,Liu Y,Zhao Y. Nutrient Characteristics and correlation analysis of soil under Prunus divaricata in Xinjiang[J]. Journal of Agricultural Science and Technology,2018,20 (8):119−127.
[24] 林培均, 崔乃然. 天山野果林资源-伊犁野果林综合研究[M]. 北京: 中国林业出版社, 2000: 22-24. [25] 刘影,张相锋,赵玉,甘宇平. 新疆濒危野生樱桃李的种群结构与动态[J]. 生态学杂志,2013,32(7):1762−1769. Liu Y,Zhang XF,Zhao Y,Gan YP. Population structure and its dynamics of wild Prunus divaricata in Xinjiang,Northwest China[J]. Chinese Journal of Ecology,2013,32 (7):1762−1769.
[26] 赵玉,刘影,尚天翠,刘波. 新疆野生樱桃李在不同微生境中的根蘖繁殖特性[J]. 干旱区研究,2015,32(5):947−952. Zhao Y,Liu Y,Shang TC,Liu B. Root sucker propagation of wild Prunus divaricata in different micro-habitats in Xinjiang,China[J]. Arid Zone Research,2015,32 (5):947−952.
[27] 毛君竹,郑卫国,王定跃,曾鹏飞,王业春. 土壤种子库在生态园林工程中的应用潜力研究[J]. 中国园林,2020,36(9):122−126. doi: 10.19775/j.cla.2020.09.0122 Mao JZ,Zheng WG,Wang DY,Zeng PF,Wang YC. Research on the application potential of soil seed bank in ecological landscape engineering[J]. Chinese Landscape Architecture,2020,36 (9):122−126. doi: 10.19775/j.cla.2020.09.0122
[28] 卢彦磊,张文辉,杨斌,王亚楠. 秦岭中段不同坡向锐齿栎种子雨、土壤种子库与幼苗更新[J]. 应用生态学报,2019,30(6):1965−1973. Lu YL,Zhang WH,Yang B,Wang YN. Seed rain,soil seed bank and seedling regeneration of Quercus aliena var. acureserrata in different slope directions on the middle Qinling Mountains,China[J]. Chinese Journal of Applied Ecology,2019,30 (6):1965−1973.
[29] 白文娟,章家恩,全国明. 土壤种子库研究的热点问题及发展趋向[J]. 土壤,2012,44(4):562−569. Bai WJ,Zhang JE,Quan GM. Hot topics and developing trends in soil seed bank[J]. Soils,2012,44 (4):562−569.
[30] 张玲,方精云. 太白山南坡土壤种子库的物种组成与优势成分的垂直分布格局[J]. 生物多样性,2004,12(1):123−130. doi: 10.17520/biods.2004015 Zhang L,Fang JY. Composition and dominant species of soil seed bank along an altitudinal gradient in Mt. Taibai,Qinling Mountains[J]. Biodiversity Science,2004,12 (1):123−130. doi: 10.17520/biods.2004015
[31] 刘颖,贺静雯,李松阳,余杭,吴建召,等. 蒋家沟流域不同海拔梯度的土壤种子库与地上植被的关系[J]. 西南林业大学学报,2021,41(2):54−67. Liu Y,He JW,Li SY,Yu H,Wu JZ,et al. Relationship between soil seed bank and aboveground vegetation along an altitude gradient in the Jiangjia Gully[J]. Journal of Southwest Forestry University,2021,41 (2):54−67.
[32] Maun MA. Adaptations enhancing survival and establishment of seedlings on coastal dune systems[J]. Vegetatio,1994,111 (1):59−70. doi: 10.1007/BF00045577
[33] 郭连金,徐卫红,房会普,肖志鹏,田玉清,等. 不同年龄香果树种子雨和种子库及其更新特征[J]. 西北植物学报,2016,36(11):2273−2282. Guo LJ,Xu WH,Fang HP,Xiao ZP,Tian YQ,et al. Seed rain,seed bank and natural regeneration of Emmenopterys henryi in different age classes[J]. Acta Botanica Boreali-Occidentalia Sinica,2016,36 (11):2273−2282.
[34] 李林瑜,方紫妍,艾克拜尔·毛拉,周龙,陆彪. 西天山野果林不同居群黑果小檗土壤种子库及幼苗更新研究[J]. 植物科学学报,2018,36(4):534−540. Li LY,Fang ZY,Aikebaier · Maola,Zhou L,Lu B. Research on the soil seed bank and seedling renewal of different populations of Berberis atrocarpa in the western Tianshan wild fruit forest[J]. Plant Science Journal,2018,36 (4):534−540.
[35] Gasparin E,Faria JMR,José AC,Tonetti OAO,de Melo RA,Hilhorst HWM. Viability of recalcitrant Araucaria angustifolia seeds in storage and in a soil seed bank[J]. J For Res,2020,31 (6):2413−2422. doi: 10.1007/s11676-019-01001-z
[36] 陈本学,李雁冰,范少辉,刘广路,申景昕. 海南甘什岭白藤土壤种子库特征及幼苗更新能力[J]. 生态学杂志,2020,39(4):1091−1100. Chen BX,Li YB,Fan SH,Liu GL,Shen JX. Seed bank and seedling regeneration of Calamus tetradactylus in Ganzhaling,Hainan Province[J]. Chinese Journal of Ecology,2020,39 (4):1091−1100.
[37] 吴春燕,陈永富,陈巧,洪小江,韩文涛,李晓成. 海南霸王岭陆均松种子雨和土壤种子库特征[J]. 热带亚热带植物学报,2018,26(1):13−23. Wu CY,Chen YF,Chen Q,Hong XJ,Han WT,Li XC. Characteristics of seed rain and soil seed bank of Dacrydium pierrei in Bawangling,Hainan[J]. Journal of Tropical and Subtropical Botany,2018,26 (1):13−23.
[38] Nathan R,Safriel UN,Noy-Meir I,Schiller G. Spatiotemporal variation in seed dispersal and recruitment near and far from Pinus halepensis trees[J]. Ecology,2000,81 (8):2156−2169. doi: 10.1890/0012-9658(2000)081[2156:SVISDA]2.0.CO;2
[39] 帕瑞,董连新,张银来,牟畅. 新疆变色石竹土壤种子库特征及其对种子萌发的影响[J]. 新疆农业大学学报,2016,39(6):458−462. Pa R,Dong LX,Zhang YL,Mu C. Characteristics of soil seed bank of Dianthus versicolor and their effects on seed germination[J]. Journal of Xinjiang Agricultural University,2016,39 (6):458−462.
[40] 金屿淞,李慧仁,张培林. 天然偃松土壤种子库空间分布研究[J]. 林业调查规划,2015,40(4):30−33. Jin YS,Li HR,Zhang PL. Soil seed bank spatial distribution of natural Pinus pumila[J]. Forest Inventory and Planning,2015,40 (4):30−33.
[41] Baskin CC, Baskin JM. Seeds: Ecology, Biogeography, and Evolution of Dormancy and Germination[M]. 2nd ed. Amsterdam: Elsevier, 2014: 1-10.
[42] 许建伟,沈海龙,张秀亮,张鹏. 我国东北东部林区花楸树的天然更新特征[J]. 应用生态学报,2010,21(1):9−15. Xu JW,Shen HL,Zhang XL,Zhang P. Natural regeneration characteristics of Sorbus pohuashanensis in forest region of eastern Northeast China[J]. Chinese Journal of Applied Ecology,2010,21 (1):9−15.



 下载:
下载: