Research progress on the mechanism of fruit abscission regulation in fruit trees
-
摘要:
果实脱落是果树生长发育过程中非常重要的一个阶段,是指果实脱离树体的过程,关乎果树生存、生长、繁殖和经济价值,因此解析调控果树果实脱落的分子机制对改良果树品种、提高果实品质显得尤为重要。果实脱落一般发生在离区,离区的产生和接受脱落刺激信号导致果实脱落是一个多种基因参与的调控过程,是细胞结构、碳水化合物、细胞壁代谢酶、乙烯合成及信号转导过程等多种因素作用的结果,但各影响因素的功能有待进一步挖掘,各影响因素之间的关系也有待进一步完善。基于此,本文通过对果树果实脱落过程中离区的形成和结构变化、碳水化合物、乙烯等物质的含量及相关基因的表达进行综述,以期为果实脱落机理研究提供新思路,也为果树生产过程中科学调控果实脱落、提高果实品质、减少损失提供理论依据。
Abstract:The abscission of fruit is a crucial stage in the ontogeny of fruit trees, signifying the detachment of fruit from the tree body. This process is integral to the survival, growth, reproduction, and economic value of fruit trees. As such, analyzing the molecular mechanisms that regulate fruit abscission is important for improving fruit tree varieties and fruit quality. Fruit abscission predominantly occurs in the abscission zone, a region in which the generation and reception of abscission-stimulating signals are regulated by multiple genes. This regulatory process is the outcome of the joint action of various factors, including cellular structure, carbohydrates, cell wall metabolic enzymes, ethylene synthesis, and signal transduction pathways. The functional dynamics and interrelationships of these factors warrant further exploration. In light of this, the present paper provides a comprehensive review of the formation and structural changes of the abscission zone, concentrations of carbohydrates, ethylene, and other substances, and expression of related genes during the fruit abscission process in fruit trees. This review aims to provide novel insights into the study of the fruit abscission mechanism and to lay a theoretical foundation for the scientific regulation of fruit abscission, improvement of fruit quality, and reduction of losses in fruit tree production.
-
Keywords:
- Fruit abscission /
- Off-zone /
- Pectinase /
- Cellulase /
- Ethylene /
- Transcription factors
-
外来植物入侵已成为一个全球性的严峻问题。入侵植物往往通过快速生长和繁殖优势占据本地植物的生态位,降低本地生物多样性,破坏生态系统结构和功能[1],对环境、经济和社会造成极大的危害[2, 3]。因此,揭示外来植物成功入侵的机制一直是入侵生态学的核心问题。外来植物的成功入侵与其自身生长速度快、竞争力强、化感作用强、资源获取与利用能力高效[4, 5]密切相关。此外,非生物因素(如地上、地下资源变化)和其他生物因素(如共生微生物)也对外来植物入侵过程具有重要的调控作用[6, 7]。理解这些因素的调控机制将有助于全面系统地解析外来植物成功入侵的过程。
在各种地下资源中,磷(P)是陆地植物的主要限制养分之一[8],也是构成植物光合作用中高能化合物ATP的必需元素[9]。人类活动引起的氮沉降的增加可能加剧土壤磷限制,进而加剧入侵植物与本地植物的竞争[10]。有研究指出,提高氮有效性水平能够加剧入侵植物与本地植物对磷的竞争[11],从而比本地植物获得更多的竞争优势[12, 13]。另外,磷可显著促进豆科植物根瘤的形成,并提高其固氮能力[14]。因此,豆科植物在入侵过程中可能更易受到磷的限制。
作为最重要的地上资源,光照(L)影响入侵植物的生长发育过程。譬如,在正常光照条件下,入侵植物通常比本地植物具有更高的生物量和生长速率;而在低光照条件下,入侵植物的生长可能低于本地植物。光照不仅能够单独影响入侵植物的生长,还可与地下资源耦合,调控其生长发育,进而影响入侵过程[15]。Zhang等[15]对比了4种入侵植物与4种本地植物对不同光照强度与养分水平的响应,发现高光强对入侵植物生长的促进效应要强于本地植物,且在高养分水平下二者的差异更加明显。因此,在探究土壤磷水平对豆科入侵植物生长发育的影响时,也需考虑地上光照强度的差异。
入侵植物生长发育所需要的磷元素不仅可以通过自身根系的吸收获得,还可以通过一些互惠共生的微生物如菌根真菌获得[16]。研究发现,丛枝菌根真菌(Arbuscular mycorrhizal fungal,AMF)在植物入侵过程中发挥着重要作用。大多数入侵植物不仅能够迅速与AMF结合,而且能破坏本地植物与AMF的共生关系,进而促进入侵植物的入侵[17]。AMF对入侵植物入侵的促进作用还取决于土壤养分的高低,因为随着土壤磷可利用性的增加,AMF与植物的相互关系可能从互利共生转化为弱共生或寄生[18, 19]。基于此,在低磷环境中AMF可能促进入侵植物的生长,而在高磷环境中AMF对入侵植物生长的影响可能会减弱。另外,AMF与植物的互惠共生主要体现在AMF可帮助植物吸收土壤中的营养元素(尤其是磷),同时依赖获取植物的光合产物来维持自身的生长和繁殖[17, 20]。因此,AMF与植物的互惠共生关系也会受光照强度的影响。随着光照强度的降低,植物与AMF的共生关系通常会减弱[21]。综上,AMF可能有助于豆科植物在高光强下的生长,且该过程可能还会受到地下磷资源的耦合调控。但在光异质性及养分富集不断加剧的背景下,AMF如何与地下磷水平及地上光照水平相耦合,进而调控入侵植物的生长发育,目前还未见报道。
白车轴草(Trifolium repens L.)为豆科车轴草属多年生草本植物,原产于欧洲,早期作为优质牧草引入我国,逸生为杂草。其匍匐茎生长快,与周围其他植物竞争空间、营养和水分,有较强的竞争能力及很强的入侵性和排他性,极易对周边生态环境和本地植物产生负面影响,从而显著降低本地群落的生物多样性[22, 23]。目前,白车轴草已被列为严重入侵类植物[24]。尽管有研究表明,养分或光照限制均可显著抑制白车轴草的生长[25, 26],而AMF则能显著促进其生长[27],但三者之间的交互作用对白车轴草的生长及其成功入侵的影响却很少受到关注。因此,本文以白车轴草为研究对象,探究光照、磷、AMF及其交互作用对白车轴草生长及其地上、地下性状的影响,研究结果旨在揭示光照、磷和AMF等多因素互作对白车轴草入侵成功的影响机制,以期为入侵植物的防控与治理提供科学依据。
1. 材料与方法
1.1 实验材料
本研究所用的白车轴草种子采购于北京创绿种业。挑选大小一致且籽粒饱满的200粒种子,均匀播撒在经高温灭菌的草炭土表面,保持土壤湿润,待种子萌发,生长至两片子叶完全展开后,进行后续实验。
本研究使用的AMF为Rhizophagus intraradices,采用白车轴草在实验室中进行培养,沙子、蛭石和黑土(体积比为1∶1∶1)混合,经高压灭菌90 min后,作为培养基质。称量25 g菌种,与灭菌培养基质充分混合均匀后,装入体积为2.5 L的花盆中进行培养。培养4个月后,去除白车轴草的地上部分,将其根系剪碎,与培养基质混合均匀,放置于4 ℃冰箱中备用。
盆栽所用的培养基为沙子和蛭石(体积比为1∶1)的混合物,并经121 ℃灭菌30 min。所用容器为高12 cm、顶部直径9 cm、容积为1 L的圆形塑料花盆。
1.2 实验设计与方法
本实验采用光照强度(高光强和低光强)×磷水平(低磷和高磷)×AMF(接种与不接种AMF菌剂)的三因子两水平的完全交互设计,设15个重复,共120盆。
通过不遮阴与遮阴模拟高光强与低光强处理,所用装置为PVC管搭建的6个塑料框架(1 m×0.9 m×1.2 m),其中3个框架罩上两层遮阴网,作为低光强处理,另外3个不罩遮阴网,作为高光强处理。为消除位置效应的影响,材料在温室内完全随机摆放。在晴朗的中午用SpectraPen LM500手持式光谱仪测量框架内的光照强度,遮阴框架内光照强度为(49.0±6.1) μmol·m−2·s−1,不遮阴处理框架内光照强度为(137.4±9.3)μmol·m−2·s−1。
基于前期研究结果[28],低磷和高磷处理为分别在整个实验周期内添加28 mg与2.8 mg的磷。分别使用磷浓度为1 mol/L和0.1 mol/L的改良版霍格兰营养液进行配置,低磷营养液添加4 mL 0.1 mol/L的CaHPO4·2H2O溶液,而高磷营养液添加4 mL 1.0 mol/L的CaHPO4·2H2O溶液,定容至1 L备用。处理时每盆施加16 mL高磷或低磷营养液,每周1次,共10次。
接种AMF处理为向花盆中接种预先培养的20 g AMF菌剂,不接种AMF处理的花盆中加入的是经高温灭菌的20 g AMF菌剂。称取120份低温保存的菌剂,每份20 g(约含300个AMF孢子),将其中60份121 ℃灭菌30 min。再分别将120份AMF菌剂与120份1 L的灭菌基质充分混合,装入花盆中备用。
挑选120株长势一致且健壮的白车轴草幼苗,分别移栽到120个花盆中央,为避免交叉污染,先移栽不接种AMF的花盆,移苗装置经消毒处理后,再移栽接种AMF的花盆。缓苗7 d,期间死亡的幼苗及时选择大小相当、长势一致的幼苗替换。幼苗成活后,测量初始株高,然后进行遮阴和施肥处理。分别将AMF接种或不接种处理的花盆平均分配到光照处理的6个架子中,每个架子包含10个接种与10个不接种AMF的花盆。再分别将接种或不接种AMF的花盆随机分成两组,进行高磷和低磷处理,即每个光照架子下面有5个重复。实验中每个光照水平有3个架子,因此每个处理有15个重复。为了降低位置效应的影响,遮阴处理下的花盆完全随机摆放,且在实验的第30天对每个框架及其中的花盆再进行一次随机摆放。实验于2021年9月25日-12月5日在中国科学院东北地理与农业生态研究所温室(43°59'49"N,125°24'4 "E)进行,温室透光率约为51%,湿度为14%~15%,平均温度为20.3 ℃。
1.3 测定指标与方法
移苗时挑选30株与移栽植株长势一致的幼苗,置于烘箱内65 ℃烘干72 h,称重,用其平均生物量表示白车轴草初始总生物量。处理10周后,所有植株按叶、茎和根分别收获,65 ℃烘干72 h后称重,按如下公式计算植株相对生长率(RGR):
RGR=(M1−M0)/t (1) 式中,
M0 为白车轴草平均初始总生物量,M1 为收获时总生物量,t 为生长时间,单位为d。同时,收获时测量植物地上生长相关指标,包括:叶片数、比叶面积(Specific leaf area,SLA)、叶质量分数(Leaf mass fraction,LMF)、总叶面积(Total leaf area,TLA)和叶厚;地下生长相关指标,包括:比根长(Specific root length,SRL)、根平均直径、细根长占比(Fine root length ratio,FRLR)、根平均表面积和根质量分数。每株选取3~5片健康叶片,测定叶片厚度、叶面积、比叶面积。叶片厚度用叶厚仪测定,叶面积用Canon Lide 220扫描仪扫描,然后用ImageJ软件计算,SLA=扫描叶面积/扫描叶生物量,LMF=叶生物量/总生物量,TLA= SLA×叶生物量;用根系扫描仪对根系进行扫描,然后用WinRHIZO软件对扫描的根部影像进行分析,SRL=扫描根根长/扫描根生物量,FRLR=扫描细根长/扫描总根长。
1.4 数据分析
采用线性混合模型,检验光照、磷、AMF及其交互作用对白车轴草总生物量、相对生长速率、地上生长指标和地下生长指标的影响。将植株初始株高作为协变量,光照水平的架子编号作为随机因子。此外,为确保残差的正态性,对根质量分数、根表面积、根平均直径和细根长占比进行了平方根转化,对总生物量、相对生长速率、叶片数、比根长和叶厚进行了对数转化,对总叶面积进行了立方根转换。使用R 4.1.2软件进行统计分析和绘图。
2. 结果与分析
2.1 3种因素对白车轴草总生物量和相对生长速率的影响
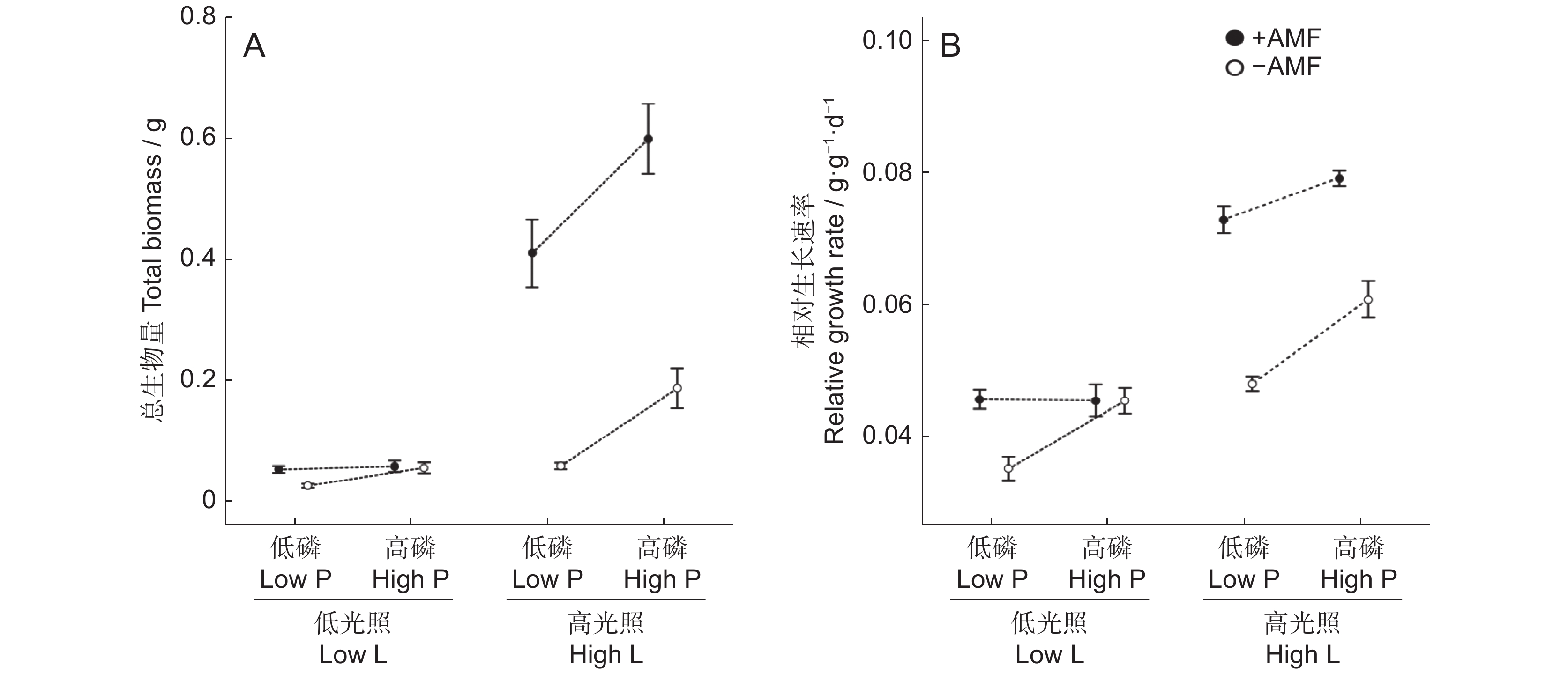
在正常光照条件下,随着磷水平的增加,白车轴总生物量显著增加。在高光照条件下,接种AMF显著提高总生物量和相对生长速率,而在低光照条件下,AMF对总生物量和相对生长速率的促进效应减弱。高磷提高了白车轴草的相对生长速率,特别是在未接种AMF处理中。高光照、高磷和接种AMF均使白车轴草总生物量和相对生长速率显著增加(表1、图1),但三者对白车轴草总生物量和相对生长速率没有明显的交互作用(表1)。
表 1 光照强度、磷和AMF及其交互作用对总生物量和相对生长率的影响Table 1. Effects of light intensity, P, AMF and their interactions on total biomass and relative growth rate固定因子
Fixed effectsdf 总生物量
Total biomass相对生长速率
Relative growth rateχ2 P χ2 P 协变量 1 7.390 0.007 12.088 0.001 光强(L) 1 17.581 <0.001 13.189 <0.001 磷(P) 1 22.612 <0.001 20.820 <0.001 丛植菌根真菌 AMF(A) 1 47.281 <0.001 54.187 <0.001 L×P 1 4.108 0.043 0.342 0.558 L×A 1 20.254 <0.001 8.819 0.003 P×A 1 9.612 0.002 15.332 <0.001 L×P×A 1 0.289 0.591 1.696 0.193 随机因子 SD SD 区组 0.206 0.079 残差 0.552 0.166 注:粗体表示效应显著(P<0.05)。下同。 Note: Bold shows significant effects (P<0.05). Same below. 2.2 光照、磷和AMF对白车轴草地上性状的影响
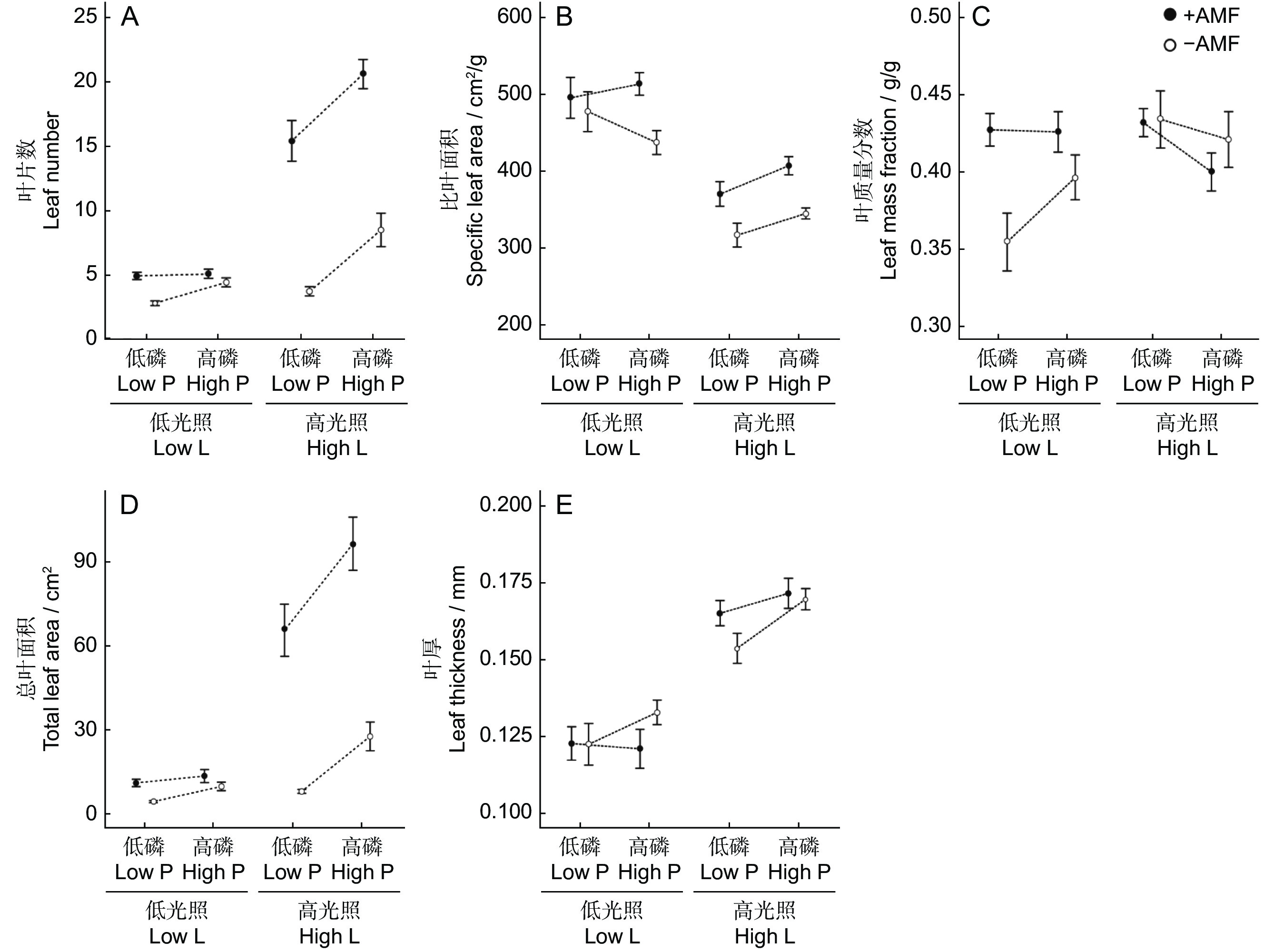
光照强度和磷对白车轴草叶片数、SLA、总叶面积和叶质量分数表现出显著的交互作用。高光照水平下,高磷显著提高SLA,且对叶片数和总叶面积的促进效应更强,但对叶质量分数则表现出相反的效应。同样,高光照水平下,AMF对叶片数和总叶面积的促进效应更加明显,而在低光照水平下AMF仅提高了叶质量分数(表2、图2)。除SLA显著降低外,高光照显著提高了叶片数、总叶面积和叶厚;高磷提高了叶片数、总叶面积和叶厚;接种AMF则使SLA、叶片数、总叶面积和叶质量分数显著增加(表2、图2)。但光照强度、磷和AMF的交互效应对白车轴草叶片性状的影响不显著(表2)。
表 2 3种因素及其交互作用对叶片数、比叶面积、叶质量分数、总叶面积和叶厚的影响Table 2. Effects of light intensity, P, AMF and their interactions on leaf number, SLA, leaf mass fraction, total leaf area, and leaf thickness固定因子
Fixed effectsdf 叶片数
Leaf number比叶面积
SLA叶质量分数
Leaf mass fraction总叶面积
Total leaf area叶厚
Leaf thicknessχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 − 2.891 0.089 0.405 0.525 1.958 0.162 2.983 0.084 0.301 0.583 光强(L) 1 19.366 <0.001 12.801 <0.001 1.342 0.247 18.849 <0.001 11.930 0.001 磷(P) 1 21.918 <0.001 1.664 0.197 0.433 0.511 17.330 <0.001 7.075 0.008 丛植菌根真菌
AMF(A)1 56.500 <0.001 31.216 <0.001 6.644 0.010 44.478 <0.001 0.257 0.612 L×P 1 5.823 0.016 4.305 0.038 4.082 0.043 6.095 0.014 0.542 0.462 L×A 1 30.580 <0.001 1.207 0.272 6.418 0.011 36.884 <0.001 3.582 0.058 P×A 1 13.130 <0.001 1.952 0.162 2.845 0.092 4.871 0.027 3.512 0.061 L×P×A 1 0.029 0.866 1.237 0.266 0.630 0.427 0.132 0.716 0.422 0.516 随机因子 SD SD SD SD SD 区组 0.054 0.122 0.001 0.119 0.066 残差 0.415 0.250 0.027 0.623 0.103 2.3 光照、磷和AMF对白车轴草地下性状的影响
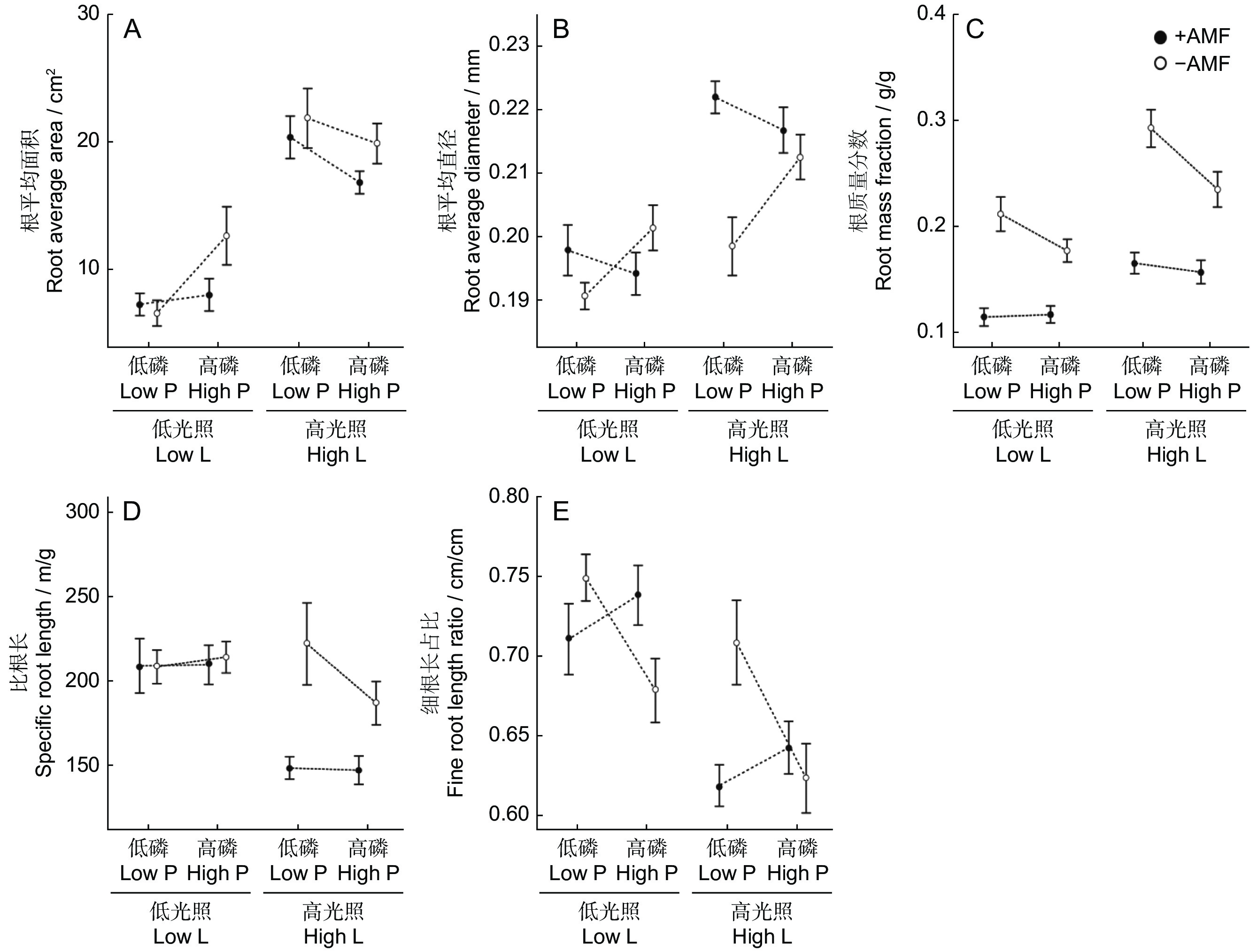
光照强度和磷对根平均面积具有显著的交互作用,低磷水平下,高光照对根平均面积的促进效应更强(表3、图3)。光照和AMF对根平均直径和比根长的影响具有显著的交互作用,高光照水平下,AMF对根平均直径的增加以及对比根长的降低效应均更强。在根平均面积、根平均直径、根质量分数和细根长占比等性状上,磷和AMF均具有显著的交互作用。AMF在高磷下降低根平均面积,但在低磷下影响不显著;AMF在低磷下提高根平均直径,但在高磷下不显著。AMF在低磷下降低细根长占比,但在高磷下提高细跟长占比。在低磷下,接种AMF使根质量分数下降更多(表3、图3)。高光照降低白车轴草的比根长和细根长占比,但增加根平均面积、根平均直径和根质量分数。高磷显著降低根质量分数。AMF显著增加根平均直径,但降低比根长和根质量分数。光照强度、磷和AMF三者的交互效应对白车轴草根系性状的影响不显著(表3)。
表 3 3种因素及其交互作用对根平均表面积、平均直径、质量分数、比根长和细根长占比的影响Table 3. Effects of light intensity, P, AMF and their interactions on root average area, root average diameter, root mass fraction, specific root length and fine root length ratio固定因子
Fixed effectsdf 根平均面积
Root average area根平均直径
Root average diameter根质量分数
Root mass fraction比根长
Specific root length细根长占比
Fine root length ratioχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 1 0.001 0.971 5.060 0.025 2.114 0.146 7.498 0.006 1.495 0.222 光强(L) 1 14.893 <0.001 9.694 0.002 6.837 0.009 8.471 0.004 7.718 0.006 磷(P) 1 0.015 0.904 2.633 0.105 6.632 0.010 0.253 0.615 3.425 0.064 丛植菌根真菌
AMF(A)1 3.129 0.077 5.015 0.025 79.024 <0.001 6.762 0.009 0.338 0.561 L×P 1 7.840 0.005 0.031 0.861 1.007 0.316 1.338 0.248 0.100 0.752 L×A 1 0.078 0.780 5.776 0.016 1.175 0.278 6.695 0.010 1.620 0.203 P×A 1 4.204 0.040 13.063 <0.001 4.330 0.037 0.338 0.561 15.017 <0.001 L×P×A 1 1.654 0.198 0.234 0.629 0.019 0.890 0.731 0.393 0.040 0.843 随机因子 SD SD SD SD SD 区组 0.245 0.004 0.024 0.049 0.008 残差 0.616 0.014 0.052 0.246 0.024 3. 讨论
土壤磷元素作为植物的主要限制养分之一,对入侵植物的生长具有显著影响。本研究结果表明,土壤磷的增加可显著提高白车轴草生物量及一些地上性状的表现。包国章等[25]研究发现,与低磷相比,高磷显著提高了白车轴草茎、叶、分株及分枝密度。我们的研究显示,尽管高磷改善了白车轴草地上性状的表现,但却降低了其根质量分数。这是因为土壤磷水平的提高缓解了地下资源对植物生长的限制,因此植物倾向于将光合产物分配转向地上部分,以获取更多的光资源,同时降低其根生物量分配,最终优化其整体的资源获取能力[29, 30]。实际上,一些研究也表明,低磷环境下植物会增加根系质量、减小根直径、提高细根数量和比根长,以最低能量损耗来取得最大的吸收表面积[31, 32]。从这个角度来讲,土壤磷变化对豆科入侵植物白车轴草生长的影响与其他植物存在相似之处。
光照作为重要的地上资源,对植物生长的影响存在较强的物种差异性。在低光照条件下,耐阴植物通常能够获得更多的生长优势,而喜阳植物的生物量积累以及地上、地下部的生长则容易受到低光照的负面影响[33-35]。本研究中的白车轴草属喜阳植物,低光照显著抑制了其生物量的积累及相对生长速率,同时,低光照抑制了大部分地上及地下性状的表现,与前人研究结果一致[23, 35]。其主要原因可能是在低光照条件下,地上光资源受限强度超过地下养分限制,因此植物将更多的资源投资于地上性状,或提高原有资源投资的利用效率,如扩展叶片面积、增大比叶面积等,从而使其在低光照环境下获取更多的光资源[36]。光照和磷的变化均会影响植物资源的分配,因此,二者对入侵植物白车轴草的生长可能存在交互效应。本研究发现,高磷对白车轴草生长的促进效应在高光照条件下强于低光照,即磷限制对白车轴草生长的影响存在光照强度依赖性。Baeten等[37]的研究也证实,光限制降低了高磷与低磷对植株生长的影响差异。这与土壤氮素和光照的交互效应对白车轴草生长影响的结果一致,即高氮的促生效应在高光照水平下更加明显[23]。根据李比希的木桶理论,在低光照水平下光资源是植物生长的主要限制因子,因此,养分的增加并不能有效缓解光限制对植物生长的负面效应[38]。
AMF通常与植物形成共利互惠关系,其对外来入侵植物生长的促进作用已得到证实[10, 32]。本研究结果发现,接种AMF能显著促进白车轴草生物量的积累和生长速率,与前人研究结果一致[24]。接种AMF显著提高了叶片数、比叶面积等性状,但降低了地下根质量分数、比根长等。其主要原因可能是当植物与AMF形成互惠共生关系时,植物根系的部分光合产物(4%~20%)用于与AMF的共生消耗,在根外形成庞大的菌丝网络,延伸了根系养分吸收区域[17, 20];同时,较高的地上光合产物有利于促进地上性状[39],因此养分吸收和光合作用同时提高,从而达到资源快速获取和快速生长的目的。Veresoglou等[21]的研究指出,随着光照强度的降低,AMF对植物的促进作用减弱,即AMF对植物的促进作用存在光照强度依赖性。本研究也发现,在低光照水平下,AMF对白车轴草生物量、地上性状以及地下性状的影响减弱。这可能是因为低光照下植物光合产物向共生AMF的转运受限,使其生长受到限制[40, 41],进而削弱了AMF对植物生长的促进作用。但该推论还需要结合测定入侵植物根系的菌根侵染率来进一步验证。
此外,本研究发现AMF和磷对白车轴草的地下性状具有显著的交互作用。总体而言, 不接种AMF时,高磷处理增加了根平均面积与平均直径,降低了细根长占比和根质量分数。该结果符合植物的资源优化策略,即当地下磷受限得到缓解时,优先地上光资源的获取。而在AMF接种后,这些性状的响应不敏感或者朝着资源优化相反的方向进行。因此,最终导致高磷对生长速率的促进效应在不接种AMF时更强,即AMF对白车轴草生长速率的促进效应在低磷水平下更强。Chen等[42]在研究AMF对入侵植物南美蟛蜞菊(Wedelia trilobata (L.) A. S. Hitchc.)的影响时也发现,AMF显著提高了低磷水平下植株的生长速度和抗病性。AMF主要促进植物对土壤中磷的吸收,当土壤磷受限时,植物会增加向AMF的成本投资,进而通过AMF的菌丝网络获取最大的养分吸收效益;而当磷限制缓解时,植株则逐渐减少向AMF的成本投入,从而使AMF的生长受到限制。因此,高磷削弱了AMF对植物生长的促进效应[17, 43]。
外来植物在入侵过程中会同时受到非生物因子和生物因子的影响。本研究发现土壤磷水平和AMF对白车轴草生长的影响存在光照强度依赖性,即在高光照水平下其促进效应更强。此外,AMF对白车轴草的促进效应也具有土壤磷依赖性,在低磷水平下AMF对生长的促进作用更强。本研究结果有助于理解光照、养分等非生物因子和AMF等生物因子变化背景下的外来植物入侵过程。
-
[1] Finazzo SF,Davenport TL,Schaffer B. Partitioning of photoassimilates in avocado (Persea americana Mill. ) during flowering and fruit set[J]. Tree Physiol,1994,14(2):153−164. doi: 10.1093/treephys/14.2.153
[2] Li CQ,Zhao ML,Ma XS,Wen ZX,Ying PY,et al. The HD-Zip transcription factor LcHB2 regulates litchi fruit abscission through the activation of two cellulase genes[J]. J Exp Bot,2019,70(19):5189−5203. doi: 10.1093/jxb/erz276
[3] Hu X,Yang M,Gong SF,Li HB,Zhang J,et al. Ethylene-regulated immature fruit abscission is associated with higher expression of CoACO genes in Camellia oleifera[J]. Roy Soc Open Sci,2021,8(6):202340. doi: 10.1098/rsos.202340
[4] Ma XS,Li CQ,Huang XM,Wang HC,Wu H,et al. Involvement of HD-ZIP Ⅰ transcription factors LcHB2 and LcHB3 in fruitlet abscission by promoting transcription of genes related to the biosynthesis of ethylene and ABA in litchi[J]. Tree Physiol,2019,39(9):1600−1613. doi: 10.1093/treephys/tpz071
[5] 王新力,彭学贤. 香蕉果实成熟相关基因ACO1启动子区的克隆及其功能初探[J]. 生物工程学报,2001,17(4):428−431. Wang XL,Peng XX. Cloning of promoter of banana fruit ripening-related ACO1 and primary study on its function[J]. Chinese Journal of Biotechnology,2001,17(4):428−431.
[6] Kućko A,Wilmowicz E,Pokora W,de Dios Alché J. Disruption of the auxin gradient in the abscission zone area evokes asymmetrical changes leading to flower separation in yellow lupine[J]. Int J Mol Sci,2020,21(11):3815. doi: 10.3390/ijms21113815
[7] Patterson SE. Cutting Loose. Abscission and dehiscence in Arabidopsis[J]. Plant Physiol,2001,126(2):494−500. doi: 10.1104/pp.126.2.494
[8] Estornell LH,Agustí J,Merelo P,Talón M,Tadeo FR. Elucidating mechanisms underlying organ abscission[J]. Plant Sci,2013,199-200:48−60. doi: 10.1016/j.plantsci.2012.10.008
[9] Rascio N,Casadoro G,Ramina A,Masia A. Structural and biochemical aspects of peach fruit abscission (Prunus persica L. Batsch)[J]. Planta,1985,164(1):1−11. doi: 10.1007/BF00391019
[10] Wilmowicz E,Kućko A,Ostrowski M,Panek K. Inflorescence deficient in abscission-like is an abscission-associated and phytohormone-regulated gene in flower separation of Lupinus luteus[J]. Plant Growth Regul,2018,85(1):91−100. doi: 10.1007/s10725-018-0375-7
[11] Dunlap JR,Wang YT,Skaria A. Abscisic acid- and ethylene-induced defoliation of Radermachera sinica L.[J]. Plant Growth Regul,1994,14(3):243−248. doi: 10.1007/BF00024799
[12] Zhu H,Dardick CD,Beers EP,Callanhan AM,Xia R,Yuan RC. Transcriptomics of shading-induced and NAA-induced abscission in apple (Malus domestica) reveals a shared pathway involving reduced photosynthesis,alterations in carbohydrate transport and signaling and hormone crosstalk[J]. BMC Plant Biol,2011,11(1):138. doi: 10.1186/1471-2229-11-138
[13] Li CQ,Wang Y,Huang XM,Li J,Wang HC,Li JG. An improved fruit transcriptome and the identification of the candidate genes involved in fruit abscission induced by carbohydrate stress in litchi[J]. Front Plant Sci,2015,6:439.
[14] Yang ZQ,Zhong XM,Fan Y,Wang HC,Li JG,Huang XM. Burst of reactive oxygen species in pedicel-mediated fruit abscission after carbohydrate supply was cut off in Longan (Dimocarpus longan)[J]. Front Plant Sci,2015,6:360.
[15] Lakso AN,Robinson TL,Greene DW. Integration of environment,physiology and fruit abscission via carbon balance modeling-implications for understanding growth regulator responses[J]. Acta Hortic,2006,727:321−326.
[16] 郭春苗,朱正阳,木巴热克·阿尤普,许娟,肖丽,等. 扁桃蔗糖合成酶对幼果生理脱落的响应研究[J]. 新疆农业科学,2018,55(11):2012−2020. Guo CM,Zhu ZY,Mubareke · Ayoupu,Xu J,Xiao L,et al. Response of the sucrose synthase (SuSy) to physiological fruit shedding of almond young fruit[J]. Xinjiang Agricultural Sciences,2018,55(11):2012−2020.
[17] 郭春苗,杨波,木巴热克·阿尤普,车玉红,肖丽,等. 扁桃酸性转化酶在生理落果期的特征分析及与落果的关系[J]. 分子植物育种,2019,17(14):4785−4790. Guo CM,Yang B,Mubareke · Ayoupu,Che YH,Xiao L,et al. Characteristics of acid invertase (AcAI) and its relationship with fruit drop during the physiological fruit drop of almond[J]. Molecular Plant Breeding,2019,17(14):4785−4790.
[18] 黄永敬,吴文,曾继吾,陈杰忠,张瑞敏,朱从一. 夏梢生长条件下树干供糖对‘砂糖橘’幼果糖代谢及脱落的影响[J]. 热带作物学报,2019,40(8):1522−1528. Huang YJ,Wu W,Zeng JW,Chen JZ,Zhang RM,Zhu CY. Effects of trunk injection sucrose on sugar metabolism and abscission of fruitlet in ‘Shatangju’ under summer shoot growth condition[J]. Chinese Journal of Tropical Crops,2019,40(8):1522−1528.
[19] 徐昌杰,张上隆. 柑橘幼果发育期碳水化合物代谢及其与生长发育的关系[J]. 果树学报,2001,18(1):20−23. Xu CJ,Zhang SL. Carbohydrate metabolism of citrus fruitlets in relation to growth and abscission[J]. Journal of Fruit Science,2001,18(1):20−23.
[20] Botton A,Eccher G,Forcato C,Ferrarini A,Begheldo M,et al. Signaling pathways mediating the induction of apple fruitlet abscission[J]. Plant Physiol,2011,155(1):185−208. doi: 10.1104/pp.110.165779
[21] 潘瑞炽. 植物生理学[M]. 6版. 北京: 高等教育出版社, 2008: 184-188. [22] Kim D,Langmead B,Salzberg SL. HISAT:a fast spliced aligner with low memory requirements[J]. Nat Methods,2015,12(4):357−360. doi: 10.1038/nmeth.3317
[23] Carpita NC,Gibeaut DM. Structural models of primary cell walls in flowering plants:consistency of molecular structure with the physical properties of the walls during growth[J]. Plant J,1993,3(1):1−30. doi: 10.1111/j.1365-313X.1993.tb00007.x
[24] Awad M,Young RE. Postharvest variation in cellulase,polygalacturonase,and pectinmethylesterase in avocado (Persea americana Mill.,cv. Fuerte) fruits in relation to respiration and ethylene production[J]. Plant Physiol,1979,64(2):306−308. doi: 10.1104/pp.64.2.306
[25] Abbott DW,Boraston AB. The structural basis for exopolygalacturonase activity in a family 28 glycoside hydrolase[J]. J Mol Biol,2007,368(5):1215−1222. doi: 10.1016/j.jmb.2007.02.083
[26] 敖雁,杨淼焱,张驰,吴启. 番茄果实成熟软化过程中细胞壁作用机制研究进展[J]. 保鲜与加工,2021,21(12):118−125. Ao Y,Yang MY,Zhang C,Wu Q. Research progress on the mechanisms of cell wall actions during ripening and softening processes of tomato fruits[J]. Storage and Process,2021,21(12):118−125.
[27] 刘化禹,娄爽,秦栋,张妍,谢佳璇,霍俊伟. 蓝果忍冬果柄离区形成中内源激素含量与细胞壁相关酶活性的变化特征[J]. 西北植物学报,2019,39(1):110−120. Liu HY,Lou S,Qin D,Zhang Y,Xie JX,Huo JW. Characteristics of endogenous hormones and cell wall-related enzymes activities during formation of carpopodium abscission zone in blue honeysuckle[J]. Acta Botanica Boreali-Occidentalia Sinica,2019,39(1):110−120.
[28] Trainotti L,Rascio N,Casadoro G. Expression of an endopolygalacturonase gene during growth and abscission of peach fruits[J]. Hereditas,1993,119(3):301−304.
[29] 王雪. 观赏海棠果实脱落相关酶活测定及转录组分析[D]. 秦皇岛: 河科技师范学院, 2021: 23-30. [30] Xie RJ,Ge T,Zhang J,Pan XT,Ma YY,et al. The molecular events of IAA inhibiting citrus fruitlet abscission revealed by digital gene expression profiling[J]. Plant Physiol Biochem,2018,130:192−204. doi: 10.1016/j.plaphy.2018.07.006
[31] 葛廷,黄雪,谢让金. 柑橘CitPG34的克隆、定位与表达分析[J]. 中国农业科学,2019,52(19):3404−3416. Ge T,Huang X,Xie RJ. Cloning,subcellular localization and expression analysis of CitPG34 in citrus[J]. Scientia Agricultura Sinica,2019,52(19):3404−3416.
[32] Li JG,Yuan RC. NAA and ethylene regulate expression of genes related to ethylene biosynthesis,perception,and cell wall degradation during fruit abscission and ripening in ‘delicious’ apples[J]. J Plant Growth Regul,2008,27(3):283−295. doi: 10.1007/s00344-008-9055-6
[33] Brummell DA,Harpster MH. Cell wall metabolism in fruit softening and quality and its manipulation in transgenic plants[J]. Plant Mol Biol,2001,47(1-2):311−339.
[34] Horton RF,Osborne DJ. Senescence,abscission and cellulase activity in Phaseolus vulgaris[J]. Nature,1967,214(5093):1086−1088. doi: 10.1038/2141086a0
[35] Greenberg J,Goren R,Riov J. The role of cellulase and polygalacturonase in abscission of young and mature shamouti orange fruits[J]. Physiol Plant,1975,34(1):1−7. doi: 10.1111/j.1399-3054.1975.tb01845.x
[36] 杨子琴,李茂,章笑赟,余意,王惠聪,黄旭明. 饥饿胁迫对龙眼果实脱落及糖代谢的影响[J]. 果树学报,2011,28(3):428−432. Yang ZQ,Li M,Zhang XY,Yu Y,Wang HC,Huang XM. Effects of starvation stress on fruit abscission and sugar metabolism in Longan[J]. Journal of Fruit Science,2011,28(3):428−432.
[37] 应培源. 荔枝果实脱落调控因子LcIDL1及转录因子LcKNOX23的功能鉴定及分子机理解析[D]. 广州: 华南农业大学, 2017: 94-112. [38] Qiu ZL,Wen Z,Hou QD,Qiao G,Yang K,et al. Cross-talk between transcriptome,phytohormone and HD-ZIP gene family analysis illuminates the molecular mechanism underlying fruitlet abscission in sweet cherry (Prunus avium L.)[J]. BMC Plant Biol,2021,21(1):173. doi: 10.1186/s12870-021-02940-8
[39] Yi JW,Wang Y,Ma XS,Zhang JQ,Zhao ML,et al. LcERF2 modulates cell wall metabolism by directly targeting a UDP-glucose-4-epimerase gene to regulate pedicel development and fruit abscission of litchi[J]. Plant J,2021,106(3):801−816. doi: 10.1111/tpj.15201
[40] Johnson PR,Ecker JR. The ethylene gas signal transduction pathway:a molecular perspective[J]. Annu Rev Genet,1998,32:227−254. doi: 10.1146/annurev.genet.32.1.227
[41] 杨晓颖,胡伟,徐碧玉,金志强. 乙烯与果实成熟关系的研究进展[J]. 热带农业科学,2008,28(2):70−75. Yang XY,Hu W,Xu BY,Jin ZQ. Advances on the relationship between ethylene and fruit ripening[J]. Chinese Journal of Tropical Agriculture,2008,28(2):70−75.
[42] Beyer EM. Abscission:support for a role of ethylene modification of auxin transport[J]. Plant Physiol,1973,52(1):1−5. doi: 10.1104/pp.52.1.1
[43] Zhu ZQ,An FY,Feng Y,Li PP,Xue L,et al. Derepression of ethylene-stabilized transcription factors (EIN3/EIL1) mediates jasmonate and ethylene signaling synergy in Arabidopsis[J]. Proc Natl Acad Sci USA,2011,108(30):12539−12544. doi: 10.1073/pnas.1103959108
[44] Wang X,Liu DM,Li AL,Sun XL,Zhang RZ,et al. Transcriptome analysis of tomato flower pedicel tissues reveals abscission zone-specific modulation of key meristem activity genes[J]. PLoS One,2013,8(2):e55238. doi: 10.1371/journal.pone.0055238
[45] Gil-Amado JA,Gomez-Jimenez MC. Regulation of polyamine metabolism and biosynthetic gene expression during olive mature-fruit abscission[J]. Planta,2012,235(6):1221−1237. doi: 10.1007/s00425-011-1570-1
[46] 郑志慧. 荔枝落果相关LcHAE/HSLs基因的筛选[D]. 广州: 华南农业大学, 2019: 18-34. [47] Yildiz K,Ozturk B,Ozkan Y. Effects of aminoethoxyvinylglycine (AVG) on preharvest fruit drop,fruit maturity,and quality of ‘Red Chief’ apple[J]. Sci Hortic,2012,144:121−124. doi: 10.1016/j.scienta.2012.07.005
[48] Goren R. Anatomical, physiological, and hormonal aspects of abscission in citrus[M]//Janick J, ed. Horticultural Reviews. New York: John Wiley & Sons, Ltd., 1993: 145-182.
[49] 刘进平. 乙烯生物合成关键酶基因研究进展[J]. 热带农业科学,2013,33(1):51−57. Liu JP. Advances in research on key enzyme genes of ethylene biosynthesis[J]. Chinese Journal of Tropical Agriculture,2013,33(1):51−57.
[50] Kolarič J,Mavrič Pleško I,Tojnko S,Stopar M. Apple fruitlet ethylene evolution and MdACO1,MdACS5A,and MdACS5B expression after application of naphthaleneacetic acid,6-benzyladenine,ethephon,or shading[J]. HortScience,2011,46(10):1381−1386. doi: 10.21273/HORTSCI.46.10.1381
[51] Cin VD,Danesin M,Boschetti A,Dorigoni A,Ramina A. Ethylene biosynthesis and perception in apple fruitlet abscission (Malus domestica L. Borck)[J]. J Exp Bot,2005,56(421):2995−3005. doi: 10.1093/jxb/eri296
[52] 吴建阳,李彩琴,陆旺金,李建国. 荔枝ACO1基因克隆及其与幼果落果的关系[J]. 果树学报,2013,30(2):207−213. Wu JY,Li CQ,Lu WJ,Li JG. Cloning of Lc-ACO1 and its expression related to fruitlet abscission in litchi[J]. Journal of Fruit Science,2013,30(2):207−213.
[53] 吴建阳,李彩琴,李建国. 荔枝ACS1基因的分离及其与幼果脱落的关系[J]. 果树学报,2017,34(7):817−827. Wu JY,Li CQ,Li JG. Isolation of ACS1 gene and the relationship between its expression and fruitlet abscission in litchi[J]. Journal of Fruit Science,2017,34(7):817−827.
[54] Ma XS,Yuan Y,Li CQ,Wu Q,He ZD,et al. Brassinosteroids suppress ethylene-induced fruitlet abscission through LcBZR1/2-mediated transcriptional repression of LcACS1/4 and LcACO2/3 in litchi[J]. Hortic Res,2021,8(1):105.
[55] 刘元风,李晓方,李玲. 乙烯受体与信号转导成员的研究进展[J]. 生命科学研究,2003(S1):70−74. Liu YF,Li XF,Li L. Research advances of ethylene receptors and components of the ethylene singal transduction pathway[J]. Life Science Research,2003(S1):70−74.
[56] 牟望舒,应铁进. 植物乙烯信号转导研究进展[J]. 园艺学报,2014,41(9):1895−1912. Mou WS,Ying TJ. Study progress on ethylene signal transduction[J]. Acta Horticulturae Sinica,2014,41(9):1895−1912.
[57] Hua J,Chang C,Sun Q,Meyerowitz EM. Ethylene insensitivity conferred by Arabidopsis ERS gene[J]. Science,1995,269(5231):1712−1714. doi: 10.1126/science.7569898
[58] Ish-Shalom M,Dahan Y,Maayan I,Irihimovitch V. Cloning and molecular characterization of an ethylene receptor gene,MiERS1,expressed during mango fruitlet abscission and fruit ripening[J]. Plant Physiol Biochem,2011,49(8):931−936. doi: 10.1016/j.plaphy.2011.05.010
[59] 徐倩,殷学仁,陈昆松. 基于乙烯受体下游转录因子的果实品质调控机制研究进展[J]. 园艺学报,2014,41(9):1913−1923. Xu Q,Yin XR,Chen KS. EIN3/EIL and AP2/ERF are involved in transcriptional regulation on fruit quality[J]. Acta Horticulturae Sinica,2014,41(9):1913−1923.
[60] 王彦杰,张超,王晓庆,董丽. 高等植物EIN3/EILs转录因子研究进展[J]. 生物技术通报,2012(3):1−8. Wang YJ,Zhang C,Wang XQ,Dong L. Research advances of EIN3/EIL transcription factors in higher plants[J]. Biotechnology Bulletin,2012(3):1−8.
[61] Ma XS,Li CQ,Yuan Y,Zhao ML,Li JG. Xyloglucan endotransglucosylase/hydrolase genes LcXTH4/7/19 are involved in fruitlet abscission and are activated by LcEIL2/3 in litchi[J]. Physiol Plantarum,2021,173(3):1136−1146. doi: 10.1111/ppl.13509
[62] Ma XS,Yuan Y,Wu Q,Wang J,Li GJ,Zhao ML. LcEIL2/3 are involved in fruitlet abscission via activating genes related to ethylene biosynthesis and cell wall remodeling in litchi[J]. Plant J,2020,103(4):1338−1350. doi: 10.1111/tpj.14804
[63] Zhao ML,Li CQ,Ma XS,Xia R,Chen JY,et al. KNOX protein KNAT1 regulates fruitlet abscission in litchi by repressing ethylene biosynthetic genes[J]. J Exp Bot,2020,71(14):4069−4082. doi: 10.1093/jxb/eraa162
[64] Nie G,Yang XY,Yang ZF,Zhong MY,Zhu YQ,et al. Genome-wide investigation of the NAC transcript factor family in perennial ryegrass (Lolium perenne L. ) and expression analysis under various abiotic stressor[J]. Genomics,2020,112(6):4224−4231. doi: 10.1016/j.ygeno.2020.06.033
[65] Li CQ,Wang Y,Ying PY,Ma WQ,Li JG. Genome-wide digital transcript analysis of putative fruitlet abscission related genes regulated by ethephon in litchi[J]. Front Plant Sci,2015,6:502.
[66] Zhang JY,Wang T,Zhang F,Liu YZ,Wang G. Comparative analysis of the transcriptomes of persisting and abscised fruitlets:insights into plant hormone and carbohydrate metabolism regulated self-thinning of pecan fruitlets during the early stage[J]. Curr Issues Mol Biol,2021,44(1):176−193. doi: 10.3390/cimb44010013
[67] Cheng CZ,Zhang LY,Yang XL,Zhong GY. Profiling gene expression in citrus fruit calyx abscission zone (AZ-C) treated with ethylene[J]. Mol Genet Genomics,2015,290(5):1991−2006. doi: 10.1007/s00438-015-1054-2
[68] Ferrero S,Carretero-Paulet L,Mendes MA,Botton A,Eccher G,et al. Transcriptomic signatures in seeds of apple(Malus domestica L. Borkh) during fruitlet abscission[J]. PLoS One,2015,10(3):e0120503. doi: 10.1371/journal.pone.0120503
-
期刊类型引用(0)
其他类型引用(1)
计量
- 文章访问数: 0
- HTML全文浏览量: 0
- PDF下载量: 0
- 被引次数: 1



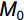
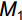
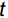
 下载:
下载: