Study on non-structural carbohydrate allocation strategies of psammophytes induced by drought stress in southeastern Xizang
-
摘要:
植物各组织中的非结构性碳水化合物(Non-structural carbohydrates,NSC)含量能反映植物对能量物质的分配策略,揭示干旱胁迫下植物NSC的动态变化有助于了解干旱环境下植物生存的资源分配策略。本研究以藏东南地区两种沙生植物白莲蒿(Artemisia gmelinii Weber)和云南沙棘(Hippophae rhamnoides subsp. yunnanensis Rousi)为研究对象,探讨在不同程度干旱胁迫下植物各器官(叶片、枝条、粗根、细根)中的非结构性碳水化合物含量的分配动态。结果显示:(1)干旱胁迫导致植物的根冠比显著增加,枝条、粗根和细根中的可溶性糖和NSC含量亦随干旱胁迫强度的增加而增加;(2)干旱胁迫发生后,NSC及其组分优先被分配至地下部位,叶片和细根中的NSC主要以可溶性糖的形式累积;(3)干旱胁迫下,白莲蒿细根的可溶性糖、淀粉及NSC的占比随干旱胁迫强度的增加而降低,而云南沙棘则与之相反。研究结果表明,植物通过储存更多的可溶性糖来抵御干旱胁迫,并且主动将NSC储存至根部来提升植物应对干旱的能力。
Abstract:The content of non-structural carbohydrates (NSC) in different plant tissues reflects the energy allocation strategies within plant individuals. Understanding the dynamic changes in NSC under drought stress can provide insights into how plants manage resource distribution in drought conditions. In this study, two psammophyte species from southeastern Xizang (Artemisia gmelinii Weber and Hippophae rhamnoides subsp. Yunnanensis Rousi) were selected to explore the distribution dynamics of NSC in different organs (leaves, branches, coarse roots, and fine roots) under varying drought intensities. Results showed that: (1) Intensified drought stress significantly increased the root-to-shoot ratio and the accumulation of soluble sugars and NSC in branches, coarse roots, and fine roots; (2) Under drought stress, there was a preferential allocation of NSC to underground parts, with leaves and fine roots primarily accumulating NSC in the form of soluble sugars; (3) In the fine roots of A. gmelinii, the proportion of soluble sugars, starch, and NSC decreased with intensifying drought, whereas in H. yunnanensis, the proportion of soluble sugars, starch, and NSC increased with intensifying drought. This study suggests that plants mitigate drought stress by storing more soluble sugars and enhance their drought resilience by allocating more NSC to the roots.
-
非结构性碳水化合物(Non-structural carbohydrate,NSC)是植物光合作用后暂时储存的物质[1],其储量可以表示植物生长、存活以及抵御干旱等胁迫可用的能量物质水平[2, 3]。NSC主要由可溶性糖和淀粉组成[4],不同成分具有不同的功能。可溶性糖是植物用来抵御逆境的重要成分;淀粉是植物中重要的储能物质。NSC作为植物生长代谢的重要底物与中间储存物质,是植物生长存活的关键[5],其积累与分配特性是植物综合调配供需平衡的结果,也是植物适应所处环境的最佳选择[6]。
沙生植物生长于沙地,它们的生存经常受到水分的限制。因此,它们会通过一系列的表型变化和生理响应来适应干旱[7-9]。在干旱胁迫下,沙生植物的生长会放缓[10],并通过生物量分配来适应干旱,如增加根部的生物量来提高生长竞争力[11],甚至通过减少地上组织,仅保留具有再生能力的地下器官来保证生存[12]。此外,植物的形态也会有所改变,如缩小叶型[13]、延伸根系[14]等。沙生植物也会通过生理生化的调节来抵御干旱[9]。主要通过调控光合作用[15]、抗氧化能力[16]、激素水平[17]以及渗透物质[18]来抵御干旱。
NSC作为植物生存的重要物质,其动态变化与适应干旱时的NSC分配策略息息相关。植物受到干旱胁迫时,通过调控体内NSC含量及组分抵御胁迫[19],例如植物的NSC储量可能减少、增加或保持稳定[20-24],或者通过可溶性糖和淀粉的相互转化来抵御胁迫[25]。此外,干旱胁迫还会影响植物在器官间的分配策略。一般来说,NSC的分配会优先供应给最需要的器官[26],当干旱发生时,植物会将NSC储存在根部[27],但当干旱强度持续增加时,NSC也会聚集在地上组织[28],如聚集在可以发芽的幼芽中[23]。枝条是植物的运输器官,干旱胁迫对枝条中NSC储量的影响存在差异[29-31]。叶片是植物的“碳源”器官[32],在受到干旱胁迫后,植物叶片中可溶性糖的浓度通常会增加,以此维持正常的生理活动[23, 33]。因此,研究沙生植物在面对干旱胁迫时NSC的分配权衡,以及NSC在不同器官的分配格局,有助于了解沙生植物在干旱胁迫发生时选择的能量物质分配平衡策略。
多年生木质草本白莲蒿(Artemisia gmelinii Weber)和多年生灌木云南沙棘(Hippophae rhamnoides subsp. yunnanensis Rousi)是藏东南地区的本土沙生植物,具有较强的抗旱性,可作为防风固沙、改善土壤的优良物种。目前关于这两个物种的研究多集中在物种抗旱性的比较[34, 35],但对于干旱胁迫下NSC的分配权衡与不同器官间NSC分配格局的研究鲜有报道。因此,本研究选择白莲蒿和云南沙棘为研究对象,通过干旱控制实验,分析各器官(叶片、枝条、粗根和细根)的NSC分配,讨论不同强度干旱胁迫下两种植物的NSC动态变化和分配特征,探明干旱胁迫下沙生植物的NSC分配格局,以期为揭示沙生植物在干旱环境下生存的资源投资策略,并为藏东南地区沙地生态修复的物种选择提供理论依据。
1. 材料与方法
1.1 实验材料
于2023年3月,在藏东南地区的林芝( 29°19′11″N, 94°20′52″E)选取自然生长于河岸沙地大小、长势相近的白莲蒿和云南沙棘实生苗,用原生境土壤种植在花盆(15.5 cm×17.5 cm)内,每盆种植1株,置于人工气候箱(光照:16 h,18.5 ℃;黑暗:8 h,18 ℃)内缓苗3个月左右。待植物长出叶片且生长良好后对植株施加不同强度的干旱胁迫。
1.2 实验设计
本实验设置了3个强度的干旱胁迫:非干旱胁迫(CK)、中度干旱胁迫(MD)与重度干旱胁迫(SD),分别为田间持水量(20.8%)的80%、50%和15%,即土壤的含水率为16%、10%和3%。干旱处理持续一个完整生长季。田间持水量用环刀法测定。
1.3 样品采集与测定
实验结束后取样分析。取样时将植株分为叶片、枝条、粗根(>2 mm)和细根(≤2 mm)4个部分,置于105 ℃烘箱杀青20 min,后在65 ℃烘箱内烘干至恒重,用于测定各器官的生物量。整株的总生物量为各器官生物量的总和。将烘干后的植株组织粉碎过筛(60目)后用于非结构性碳水化合物的测定。可溶性糖的含量采用苯酚-硫酸法[36]测定,淀粉通过淀粉酶和糖化酶提取,其浓度利用分光光度计在525 nm处测定[37]。NSC浓度为可溶性糖和淀粉浓度之和,糖占比为可溶性糖与NSC浓度的比值;各器官的可溶性糖库、淀粉库、NSC库为各浓度与相应器官生物量的乘积。整株可溶性糖库、淀粉库、NSC库为各器官相应库之和,各器官可溶性糖占比、淀粉占比、NSC占比为各器官的可溶性糖库、淀粉库、NSC库与整株可溶性糖库、淀粉库、NSC库的比值。
1.4 数据统计分析
采用SPSS 25.0 和R 4.0.1软件进行统计分析。采用方差分析(ANOVA)和多重比较(LSD法)检验不同干旱处理以及不同器官间NSC含量及其组分的差异。
2. 结果与分析
2.1 干旱胁迫下各器官生物量的变化
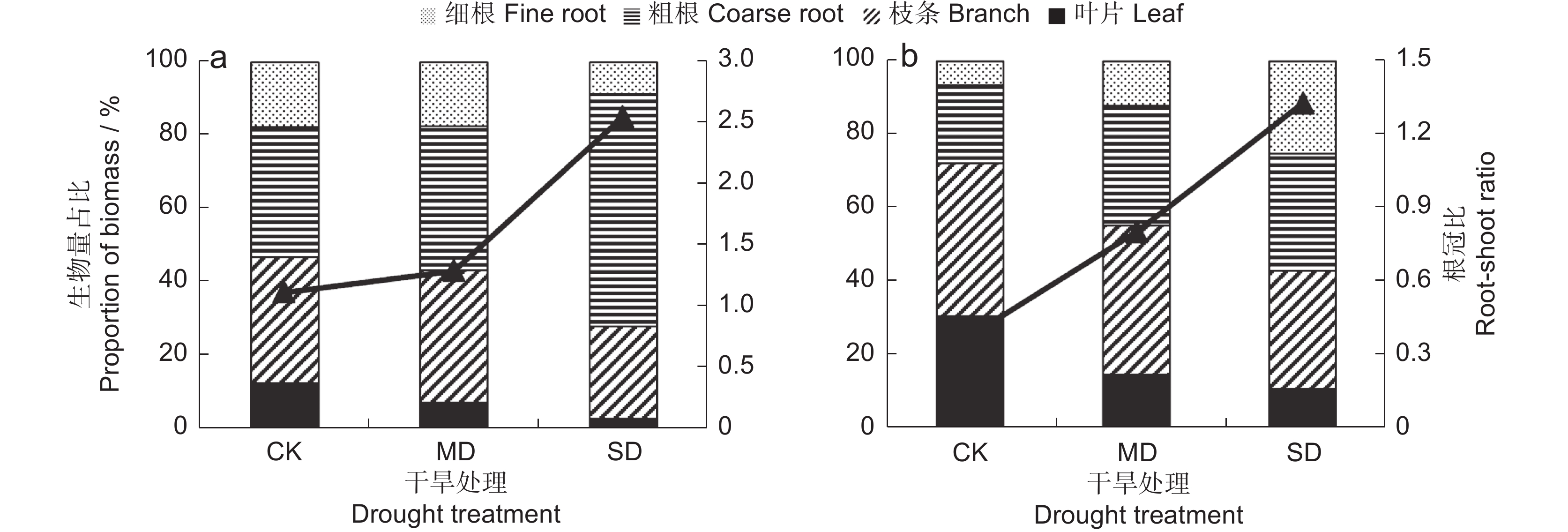
随着干旱胁迫强度的增加,白莲蒿叶片、枝条、细根的生物量占比显著下降(图1:a)。重度干旱胁迫下的叶片、枝条、细根的生物量占比降至3.18%、24.96%和8.66%;粗根生物量的占比显著增加。在同一干旱胁迫下,不同器官的生物量积累差异显著(附表1
1 )),粗根的生物量占比最大。随着干旱胁迫强度的增加,白莲蒿的根冠比显著增加,从1.12(非干旱胁迫)增加至2.55(重度干旱胁迫)(图1:a)。![]() 图 1 不同强度的干旱胁迫下白莲蒿和云南沙棘不同器官的生物量占比和根冠比a:白莲蒿的生物量占比;b:云南沙棘的生物量占比。CK:非干旱处理;MD:中度干旱处理;SD:重度干旱处理;下同。Figure 1. Biomass proportion and root-to-shoot ratio in different organs of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stressesa: Biomass proportion in A. gmelinii; b: Biomass proportion in H. yunnanensis. CK: Non-drought treatment; MD: Moderate drought treatment; SD: Severe drought treatment; same below.
图 1 不同强度的干旱胁迫下白莲蒿和云南沙棘不同器官的生物量占比和根冠比a:白莲蒿的生物量占比;b:云南沙棘的生物量占比。CK:非干旱处理;MD:中度干旱处理;SD:重度干旱处理;下同。Figure 1. Biomass proportion and root-to-shoot ratio in different organs of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stressesa: Biomass proportion in A. gmelinii; b: Biomass proportion in H. yunnanensis. CK: Non-drought treatment; MD: Moderate drought treatment; SD: Severe drought treatment; same below.随着干旱胁迫强度的增加,云南沙棘叶片和枝条生物量的占比显著降低(图1:b)。重度干旱胁迫下叶片和枝条生物量的占比下降至10.98%和31.96%;细根生物量的占比显著增加。云南沙棘的根冠比随着干旱胁迫强度的增加而显著增加,从0.39(非干旱胁迫)增加至1.33(重度干旱胁迫)(图1:b)。
2.2 干旱胁迫下各器官NSC及其组分含量的变化
2.2.1 可溶性糖含量的变化
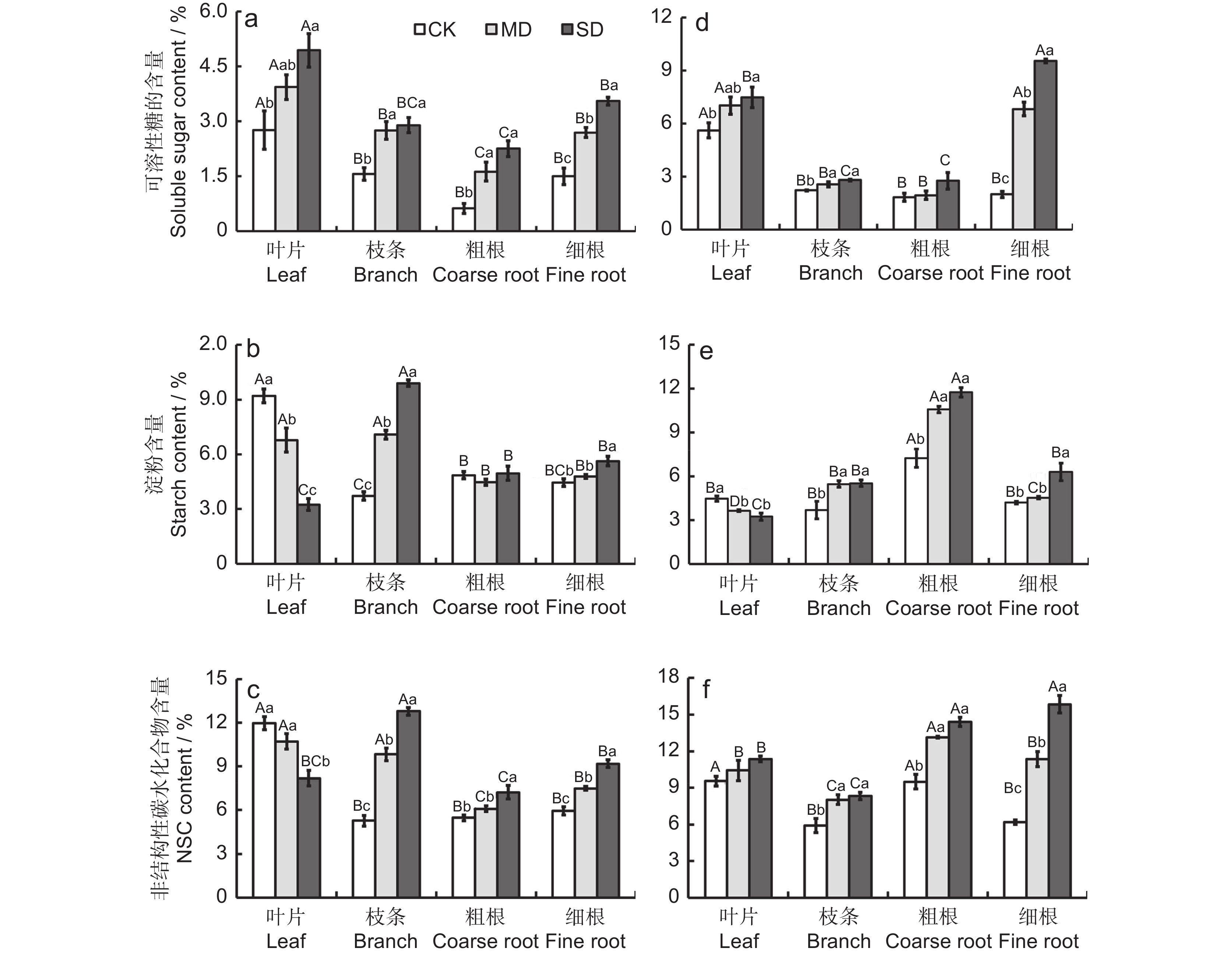
干旱胁迫对植物可溶性糖的含量有显著影响,随着干旱胁迫强度的增加,白莲蒿和云南沙棘叶片、细根中的可溶性糖含量均显著增加(图2:a、d)。干旱胁迫下,枝条的可溶性糖含量均显著增加,白莲蒿粗根的可溶性糖含量显著增加。非干旱胁迫下,两个物种叶片的平均可溶性糖含量最高,其次是枝条和细根,粗根中可溶性糖含量最少(图2:a、d)。中度干旱胁迫下,平均可溶性糖含量为:叶片>细根>枝条>粗根。重度干旱胁迫下,白莲蒿平均可溶性糖含量由高到低为:叶片、细根、枝条、粗根;云南沙棘各器官平均可溶性糖含量由高到低为:细根、叶片、枝条、粗根(图2:a、d)。
![]() 图 2 不同强度干旱胁迫下白莲蒿和云南沙棘不同器官的NSC含量a、b、c分别为白莲蒿的可溶性糖、淀粉和NSC含量;d、e、f分别为云南沙棘的可溶性糖、淀粉和NSC含量;不同小写字母表示同一器官不同干旱处理之间的显著差异,不同大写字母表示同一干旱处理下不同器官之间的显著差异, P<0.05。下同。Figure 2. NSC contents in different organs of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stressesa, b and c are soluble sugar, starch and NSC content in A. gmelinii, respectively; d, e and f are soluble sugar, starch and NSC content in H. yunnanensis, respectively. Different lowercase letters indicate significant differences between different drought treatment in the same organ, and different uppercase letters indicate significant differences between different organs under the same drought treatment, P<0.05. Same below.
图 2 不同强度干旱胁迫下白莲蒿和云南沙棘不同器官的NSC含量a、b、c分别为白莲蒿的可溶性糖、淀粉和NSC含量;d、e、f分别为云南沙棘的可溶性糖、淀粉和NSC含量;不同小写字母表示同一器官不同干旱处理之间的显著差异,不同大写字母表示同一干旱处理下不同器官之间的显著差异, P<0.05。下同。Figure 2. NSC contents in different organs of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stressesa, b and c are soluble sugar, starch and NSC content in A. gmelinii, respectively; d, e and f are soluble sugar, starch and NSC content in H. yunnanensis, respectively. Different lowercase letters indicate significant differences between different drought treatment in the same organ, and different uppercase letters indicate significant differences between different organs under the same drought treatment, P<0.05. Same below.2.2.2 淀粉含量的变化
施加干旱胁迫后,2个物种叶片、枝条的淀粉含量显著降低,云南沙棘粗根的淀粉含量显著增加(图2:b、e)。重度干旱胁迫下,细根中淀粉含量显著增加。非干旱胁迫下,白莲蒿淀粉含量为:叶片>粗根>细根>枝条;云南沙棘淀粉含量为粗根>叶片>细根>枝条。中度干旱胁迫下,白莲蒿的淀粉含量为:枝条>叶片>细根>粗根;云南沙棘淀粉含量为:粗根>枝条>细根>叶片。重度干旱胁迫下,白莲蒿淀粉含量为:枝条>细根>粗根>叶片;云南沙棘淀粉含量为:粗根>细根>枝条>叶片(图2:b、e)。
2.2.3 NSC含量的变化
施加干旱胁迫后,白莲蒿叶片中的NSC含量显著降低(图2:c、f)。施加干旱胁迫后,两个物种枝条中NSC含量显著增加,白莲蒿枝条中NSC含量随胁迫强度的增加显著增加;粗根中NSC含量显著增加。随着干旱胁迫强度的增加,两个物种细根中NSC含量均显著增加(图2:c、f)。
非干旱胁迫下,白莲蒿各器官NSC含量为:叶片>细根>粗根>枝条;云南沙棘叶片和粗根的NSC含量最高,其次是细根和枝条(图2:c、f)。中度干旱胁迫下,白莲蒿叶片和枝条中NSC含量最高,其次是细根,粗根中NSC含量最低;云南沙棘粗根中NSC含量最高,其次是叶片和细根,枝条中NSC含量最低。重度干旱胁迫下,白莲蒿中NSC含量为:枝条>细根>叶片>粗根;云南沙棘中NSC含量为:细根>粗根>叶片>枝条(图2:c、f)。
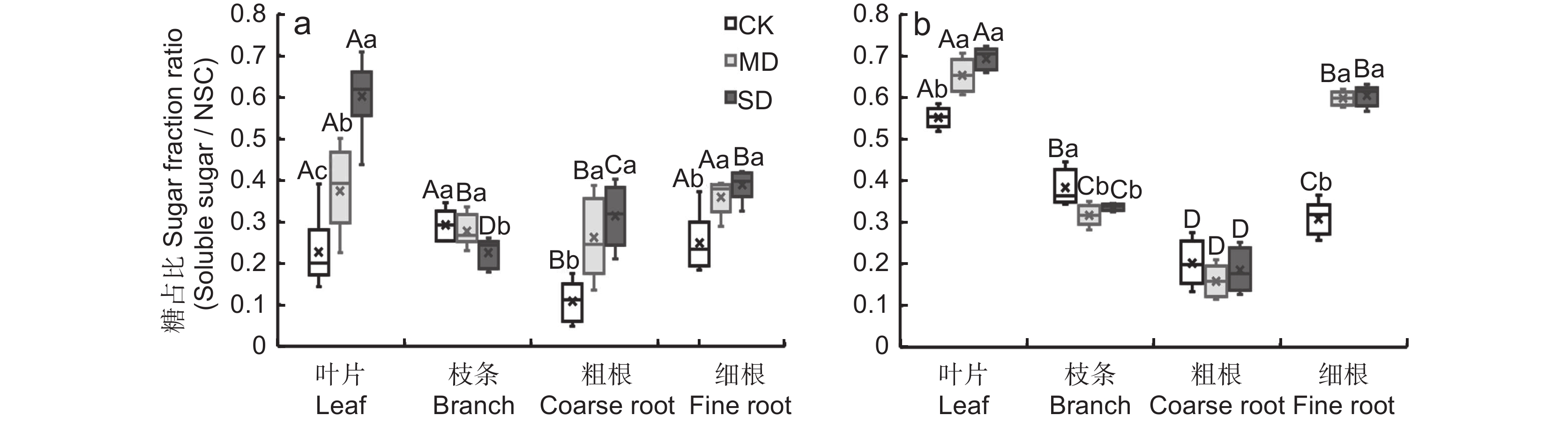
2.2.4 糖占比的变化
施加干旱胁迫后,两个物种叶片、粗根和细根的糖占比(可溶性糖含量/NSC含量)显著增加,枝条糖占比显著降低;随干旱胁迫强度的增加,白莲蒿叶片的糖占比显著增加(图3)。非干旱胁迫下,白莲蒿各器官的糖占比为:枝条>细根>叶片>粗根;云南沙棘各器官的糖占比为:叶片>枝条>细根>粗根。中度干旱胁迫下,各器官的糖占比为:叶片>细根>枝条>粗根。重度干旱胁迫下,白莲蒿中各器官糖占比为:叶片>细根>粗根>枝条,云南沙棘中各器官的糖占比顺序与中度干旱胁迫一致(图3)。
2.3 干旱胁迫下各器官NSC库及其组分的分配特征
2.3.1 可溶性糖库的分配特征
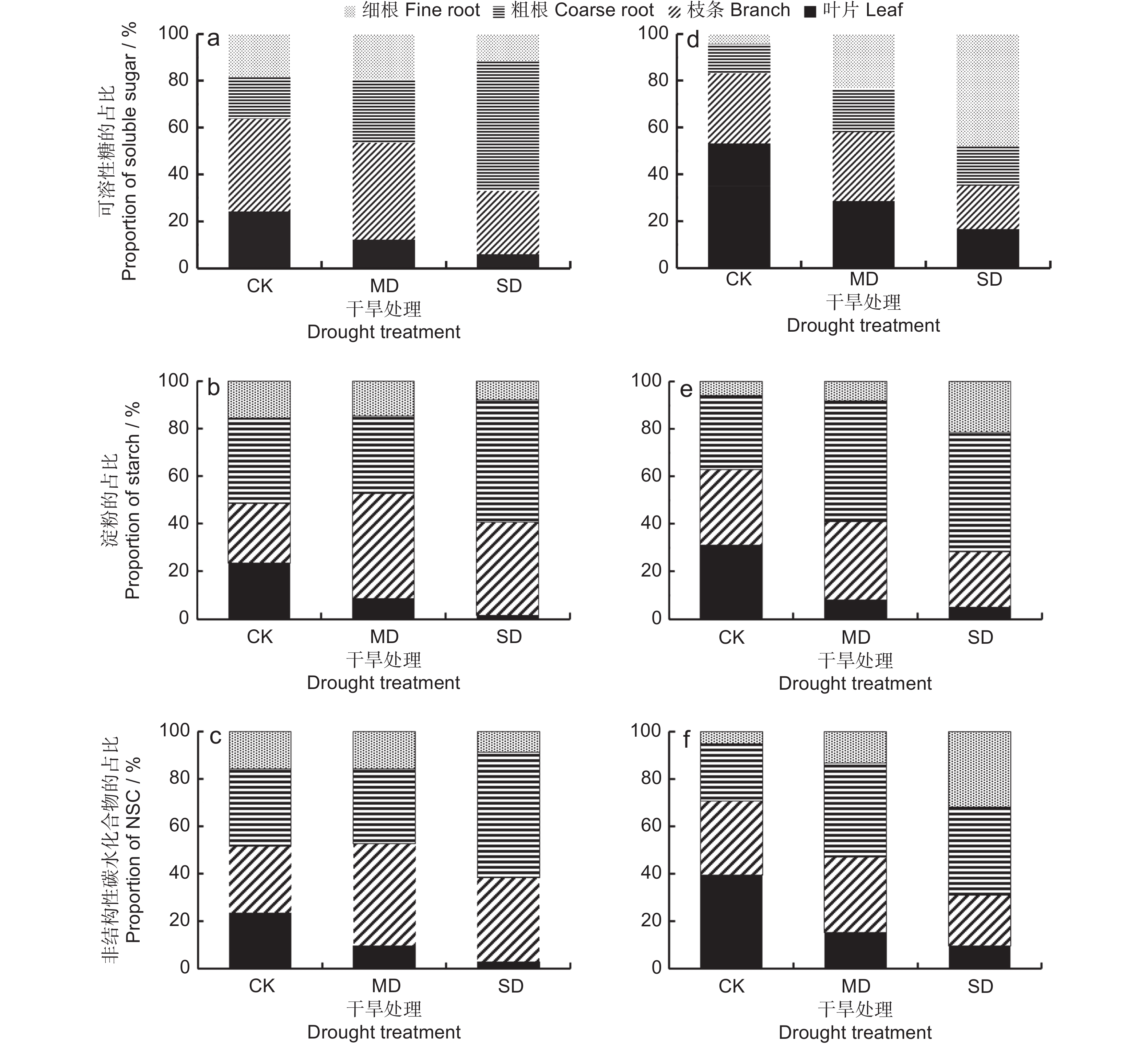
随着干旱胁迫强度增加,白莲蒿叶片、枝条和细根的可溶性糖库占整株可溶性糖库的比值(可溶性糖占比)降低,粗根的可溶性糖占比增加(图4:a)。非干旱胁迫下,白莲蒿的可溶性糖占比为:枝条>叶片>粗根>细根;地上部分(叶片与枝条之和)的可溶性糖占比为地下部分(粗根与细根之和)的1.75倍。处于中度干旱胁迫时,可溶性糖占比为:枝条>粗根>细根>叶片;地上部分可溶性糖占比为地下部分的1.15倍。处于重度干旱胁迫时,可溶性糖占比为:粗根>枝条>细根>叶片;地上部分的可溶性糖占比为地下部分的49%(图4:a)。
![]() 图 4 不同干旱胁迫下白莲蒿和云南沙棘各器官NSC库占整株NSC库的占比a、b、c分别为白莲蒿的可溶性糖、淀粉和NSC的占比;d、e、f分别为云南沙棘的可溶性糖、淀粉和NSC的占比。Figure 4. Proportion of NSC pool of each organ to the NSC pool of the whole plant of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stressesa, b and c are soluble sugar, starch and NSC proportion in A. gmelinii, respectively; d, e and f are soluble sugar, starch and NSC proportion in H. yunnanensis, respectively.
图 4 不同干旱胁迫下白莲蒿和云南沙棘各器官NSC库占整株NSC库的占比a、b、c分别为白莲蒿的可溶性糖、淀粉和NSC的占比;d、e、f分别为云南沙棘的可溶性糖、淀粉和NSC的占比。Figure 4. Proportion of NSC pool of each organ to the NSC pool of the whole plant of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stressesa, b and c are soluble sugar, starch and NSC proportion in A. gmelinii, respectively; d, e and f are soluble sugar, starch and NSC proportion in H. yunnanensis, respectively.随着干旱胁迫强度的增加,云南沙棘叶片、枝条的可溶性糖占比降低,细根和粗根的可溶性糖占比增加(图4:d)。非干旱胁迫下,云南沙棘的可溶性糖占比为:叶片>枝条>粗根>细根;地上部分的可溶性糖占比是地下部分的4.92倍。中度干旱胁迫下,可溶性糖占比为:叶片>枝条>细根>粗根;地上部分的可溶性糖占比是地下部分的1.39倍。重度干旱胁迫下,可溶性糖占比为:细根>枝条>粗根>叶片;地上部分的可溶性糖占比为地下部分的54%(图4:d)。
2.3.2 淀粉库的分配特征
随着干旱胁迫强度增加,白莲蒿叶片、细根的淀粉库占整株淀粉库的比值(淀粉占比)降低,枝条、粗根中淀粉占比增加(图4:b)。非干旱胁迫下,白莲蒿的淀粉占比为:粗根>叶片>枝条>细根;地上部分的淀粉占比为地下部分的91%。中度干旱胁迫下,淀粉占比为:枝条>粗根>细根>叶片;地上部分淀粉占比是地下部分的1.11倍。重度干旱胁迫下,淀粉占比为:粗根>枝条>细根>叶片;地上部分淀粉占比是地下部分的69%(图4:b)。
随着干旱胁迫强度的增加,云南沙棘叶片、枝条的淀粉占比下降,细根、粗根的淀粉占比增加(图4:e)。非干旱胁迫下,云南沙棘叶片、枝条和粗根中淀粉占比接近,细根的淀粉占比最小;地上部分淀粉占比是地下部分的1.69倍。施加干旱胁迫后,淀粉占比为:粗根>枝条>细根>叶片。中度干旱胁迫下,地上部分淀粉占比是地下部分的70%;重度干旱胁迫下,地上部分淀粉占比是地下部分的40%(图4:e)。
2.3.3 NSC库的分配特征
随着干旱胁迫强度的增加,白莲蒿叶片、细根的NSC库占整株NSC库的比值(NSC占比)降低;粗根的NSC占比显著增加(图4:c)。非干旱胁迫下,白莲蒿NSC占比为:粗根>枝条>叶片>细根;地上部分NSC占比是地下部分的1.07倍。中度干旱胁迫下,NSC占比为:枝条>粗根>细根>叶片;地上部分NSC占比是地下部分的1.11倍。重度干旱胁迫下,NSC占比为:粗根>枝条>细根>叶片;地上部分NSC占比是地下部分的62%(图4:c)。
随着干旱胁迫强度的增加,云南沙棘叶片的NSC占比降低,细根、粗根的NSC占比增加,枝条的NSC占比先增加,后降低(图4:f)。非干旱胁迫下,云南沙棘NSC占比为:叶片>枝条>粗根>细根;地上部分的NSC占比是地下部分的2.39倍。中度干旱胁迫下,NSC占比为:粗根>枝条>叶片>细根;地上部分NSC占比是地下部分的89%。重度干旱胁迫下,粗根>细根>枝条>叶片;地上部分NSC占比是地下部分的45%(图4:f)。
3. 讨论
3.1 不同器官中NSC含量对干旱胁迫强度的响应
干旱胁迫会诱导植物不同器官的NSC含量发生变化,并且通过可溶性糖调节,来维持植物在干旱胁迫下的生存[38]。可溶性糖是植物体内重要的调节因子,在逆境中可以调节植物的渗透压而保持植物在胁迫下的正常生命活动[39, 40];而淀粉作为不活跃的储存物质,在一定条件下,可以与可溶性糖互相转换,以维持植物生存[41]。
本研究发现,白莲蒿和云南沙棘不同器官NSC及其组分的含量对干旱胁迫的响应具有一定的差异性(图2)。重度干旱胁迫下,两种植物根部和枝条中的NSC含量显著高于非干旱胁迫组(图2:c、f),重度干旱胁迫促进植物根部和枝条的NSC积累,这与其他学者的研究结果相似,他们认为NSC含量的增加可以提高植物在胁迫下的生存[42, 43]。Hartmann等[44]研究发现,与良好的水分条件下相比,植物不同组织的NSC含量在受到干旱胁迫后呈增加的趋势。植物受到干旱胁迫后,各器官的可溶性糖含量均呈现增加的趋势(图2:a、d),说明干旱胁迫可以促进器官可溶性糖的积累,并在叶片和细根积累得更多(图2:a、d),可能是在干旱胁迫下,叶片和细根对水分的缺乏更为敏感,需要更多的可溶性糖来增强对干旱的适应,维持植物正常生理活动[45, 46]。两个物种的可溶性糖含量在相同器官的积累速度存在差异(图2:a、d),这可能是物种间抗旱能力不同引起的[47]。施加干旱胁迫后,两个物种叶片的淀粉含量显著降低,叶片中淀粉含量的降低可能是干旱胁迫强度的增加使叶片中的淀粉转化为可溶性糖来维持正常的生理活动[48];枝条与根部的淀粉含量呈增加的趋势(图2:b、e)。枝条中淀粉增加可能是枝条中淀粉的运输受损,从而导致淀粉在枝条的积累[44];根部淀粉的积累可能是为增强对干旱的抵抗能力,运输至根部的淀粉增加,从而导致根部淀粉的积累[49]。可溶性糖与NSC的比值可以反映可溶性糖与淀粉之间相互转化的权衡[50]。本研究结果显示,随着干旱胁迫强度增加,叶片、细根的糖占比显著增加(图3)。这可能是叶片是“碳源”器官,细根是“吸水”器官,在干旱胁迫下,植物会转化出更多的可溶性糖,保证器官正常的生理功能,维持植物生存[42]。枝条中糖占比在施加干旱胁迫后降低(图3),可能原因是枝条作为运输通道,在干旱胁迫发生后,地上地下部分淀粉的运输更为频繁,从而令枝条中的淀粉积累[44]。
3.2 整株NSC分配对干旱胁迫的响应
植物中NSC分配格局的变化会受到环境因素的影响,也可以反映植物在面对环境变化时选择的适应策略。可溶性糖是植物体内主要的能源物质,其分配与植物息息相关[50]。本研究发现,受到干旱胁迫后两种植物地上部分的可溶性糖的占比降低,受到干旱胁迫后,植株地上部分为了减少水分散失而限制其生长,导致其占比降低[51];在重度干旱胁迫下,白莲蒿的粗根成为了主要的可溶性糖库,可能是粗根的生物量占比较大。云南沙棘的细根成为了最大的可溶性糖库,可能是为了增加细根的吸水能力,从而储存了更多的可溶性糖[52, 53]。两种植物在面对干旱胁迫时,可溶性糖倾向于向地下部分积累,确保地下部分的生长消耗。
淀粉是植物体内不活跃的碳储存,可以作为植物受胁迫后的缓冲物质,其分配变化与植物体内的储存策略相关[26]。随着干旱胁迫强度的增加,两种植物叶片中淀粉的占比降低,除了转化为可溶性糖之外,生物量的减少也可能是原因之一;枝条中的淀粉占比为先增加后降低的趋势,可能因为在中度干旱胁迫时,枝条通过积累淀粉来增强对干旱的抵御能力[23],但干旱胁迫增加后,枝条的生长受到限制,从而令其占比降低。随着干旱胁迫强度的增加,两种植物的淀粉都倾向于向地下部分积累,粗根是最大的淀粉库。不同的是白莲蒿细根淀粉的占比逐渐降低,而云南沙棘细根的占比逐渐增加,可能是白莲蒿细根的生长更容易受到水分的胁迫,因为在干旱胁迫下,白莲蒿细根的生物量占比显著降低,而云南沙棘则与之相反。
NSC是可溶性糖与淀粉的总和,是植物存活和生长的关键[54]。研究发现,当干旱发生时,植物地上部分的NSC占比迅速降低,尤其是叶片,可能是由于在干旱胁迫下,导致了叶片的死亡。地下部分的NSC占比在干旱胁迫发生后,逐渐增加,粗根成为最主要的NSC库。重度干旱胁迫下,NSC倾向于向地下部分积累,从而保证根部的正常生长[55, 56],此外还可以将根部储存的NSC作为碳源,待水分条件改善后,迅速恢复正常的生长[52]。
4. 结论
本研究深入探究了干旱胁迫条件下沙生植物白莲蒿和云南沙棘非结构性碳水化合物的分配格局。研究发现干旱胁迫下白莲蒿和云南沙棘的叶片和细根中可溶性糖含量显著增加,且NSC更多地储存于根部,以增强对干旱环境的适应能力。研究结果不仅揭示了沙生植物在面对干旱环境时具体的适应机制与生存策略,同时为生态修复工作中的物种选择提供了科学依据,特别是对于推动藏东南沙化地区生态恢复具有重要意义。未来可进一步探讨不同干旱强度和植物种类间NSC分配的差异性,以全面理解植物在极端环境下的生存策略,为生态保护和修复工作提供参考。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
图 1 不同强度的干旱胁迫下白莲蒿和云南沙棘不同器官的生物量占比和根冠比
a:白莲蒿的生物量占比;b:云南沙棘的生物量占比。CK:非干旱处理;MD:中度干旱处理;SD:重度干旱处理;下同。
Figure 1. Biomass proportion and root-to-shoot ratio in different organs of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stresses
a: Biomass proportion in A. gmelinii; b: Biomass proportion in H. yunnanensis. CK: Non-drought treatment; MD: Moderate drought treatment; SD: Severe drought treatment; same below.
图 2 不同强度干旱胁迫下白莲蒿和云南沙棘不同器官的NSC含量
a、b、c分别为白莲蒿的可溶性糖、淀粉和NSC含量;d、e、f分别为云南沙棘的可溶性糖、淀粉和NSC含量;不同小写字母表示同一器官不同干旱处理之间的显著差异,不同大写字母表示同一干旱处理下不同器官之间的显著差异, P<0.05。下同。
Figure 2. NSC contents in different organs of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stresses
a, b and c are soluble sugar, starch and NSC content in A. gmelinii, respectively; d, e and f are soluble sugar, starch and NSC content in H. yunnanensis, respectively. Different lowercase letters indicate significant differences between different drought treatment in the same organ, and different uppercase letters indicate significant differences between different organs under the same drought treatment, P<0.05. Same below.
图 4 不同干旱胁迫下白莲蒿和云南沙棘各器官NSC库占整株NSC库的占比
a、b、c分别为白莲蒿的可溶性糖、淀粉和NSC的占比;d、e、f分别为云南沙棘的可溶性糖、淀粉和NSC的占比。
Figure 4. Proportion of NSC pool of each organ to the NSC pool of the whole plant of Artemisia gmelinii and Hippophae rhamnoides subsp. yunnanensis under different drought stresses
a, b and c are soluble sugar, starch and NSC proportion in A. gmelinii, respectively; d, e and f are soluble sugar, starch and NSC proportion in H. yunnanensis, respectively.
-
[1] Kozlowski TT. Carbohydrate sources and sinks in woody plants[J]. Bot Rev,1992,58(2):107−222. doi: 10.1007/BF02858600
[2] Würth MKR,Peláez-Riedl S,Wright SJ,Körner C. Non-structural carbohydrate pools in a tropical forest[J]. Oecologia,2005,143(1):11−24. doi: 10.1007/s00442-004-1773-2
[3] Myers JA,Kitajima K. Carbohydrate storage enhances seedling shade and stress tolerance in a neotropical forest[J]. J Ecol,2007,95(2):383−395. doi: 10.1111/j.1365-2745.2006.01207.x
[4] Hoch G,Richter A,Körner C. Non-structural carbon compounds in temperate forest trees[J]. Plant Cell Environ,2003,26(7):1067−1081. doi: 10.1046/j.0016-8025.2003.01032.x
[5] Barbaroux C,Bréda N,Dufrêne E. Distribution of above-ground and below-ground carbohydrate reserves in adult trees of two contrasting broad-leaved species (Quercus petraea and Fagus sylvatica)[J]. New Phytol,2003,157(3):605−615. doi: 10.1046/j.1469-8137.2003.00681.x
[6] Cannell MGR,Dewar RC. Carbon allocation in trees:a review of concepts for modelling[J]. Adv Ecol Res,1994,25:59−104.
[7] Cooper DJ,D'amico DR,Scott ML. Physiological and morphological response patterns of Populus deltoides to alluvial groundwater pumping[J]. Environ Manage,2003,31(2):215−226. doi: 10.1007/s00267-002-2808-2
[8] Yang XY,Lu MQ,Wang YF,Wang YR,Liu ZJ,Chen S. Response mechanism of plants to drought stress[J]. Horticulturae,2021,7(3):50. doi: 10.3390/horticulturae7030050
[9] 刘亚楠,陈晓娜,郭跃,段娜,郝需婷,等. 沙旱生灌木对干旱胁迫的响应研究进展[J]. 世界林业研究,2023,36(5):21−26. Liu YN,Chen XN,Guo Y,Duan N,Hao XT,et al. Research progress in response of sandy xerophytic shrubs to drought stress[J]. World Forestry Research,2023,36(5):21−26.
[10] 魏晓芸. 干旱胁迫下红砂幼苗的生理和转录组学分析[D]. 兰州:甘肃农业大学,2021:1−10. [11] 王雅芸. 梭梭与骆驼刺水分运输和碳代谢特征对干旱胁迫的响应[D]. 乌鲁木齐:新疆大学,2021:1−10. [12] Chen YJ,Choat B,Sterck F,Maenpuen P,Katabuchi M,et al. Hydraulic prediction of drought-induced plant dieback and top-kill depends on leaf habit and growth form[J]. Ecol Lett,2021,24(11):2350−2363. doi: 10.1111/ele.13856
[13] 段娜,王佳,刘芳,陈海玲,孙非,徐军. 植物抗旱性研究进展[J]. 分子植物育种,2018,16(15):5093−5099 Duan N,Wang J,Liu F,Chen HL,Sun F,Xu J. Research progress on drought resistance of plant[J]. Molecular Plant Breeding,2018,16(15):5093−5099.
[14] 张耀甲. 甘肃民勤地区主要沙区植物的生态生理特性[J]. 生态学杂志,1984(1):1−4,54. Zhang YJ. Ecological and physiological characteristics of main desert plants in Minqin district of Gansu Province[J]. Chinese Journal of Ecology,1984(1):1−4,54.
[15] 张恒硕,查同刚,李肖,彭栋,冀晓东,等. 冀北地区6种灌木对干旱胁迫的光合及生理响应[J]. 生态学杂志,2021,40(2):352−362. Zhang HS,Zha TG,Li X,Peng D,Ji XD,et al. Photosynthetic and physiological responses of six shrub species to drought dress in northern Hebei Province[J]. Chinese Journal of Ecology,2021,40(2):352−362.
[16] 张玉,冷海楠,曹宏杰,徐明怡. 干旱胁迫对植物的影响研究[J]. 黑龙江科学,2022,13(14):22−24,47. Zhang Y,Leng HN,Cao HJ,Xu MY. Study on the influence of drought stress on botany[J]. Heilongjiang Science,2022,13(14):22−24,47.
[17] 何建社,张利,刘千里,朱欣伟,刘兴良,等. 岷江干旱河谷区典型灌木对干旱胁迫的生理生化响应[J]. 生态学报,2018,38(7):2362−2371. He JS,Zhang L,Liu QL,Zhu XW,Liu XL,et al. Physiological and biochemical response of typical shrubs to drought stress in the Minjiang River dry valley[J]. Acta Ecologica Sinica,2018,38(7):2362−2371.
[18] 李佳泳. 川西北高寒区治沙灌木的筛选及其抗旱性研究[D]. 雅安:四川农业大学,2020:1−10. [19] Li WB,Hartmann H,Adams HD,Adams HX,Zhang C,et al. The sweet side of global change-dynamic responses of non-structural carbohydrates to drought,elevated CO2 and nitrogen fertilization in tree species[J]. Tree Physiol,2018,38(11):1706−1723.
[20] Dickman LT,McDowell NG,Grossiord C,Collins AD,Wolfe BT,et al. Homoeostatic maintenance of nonstructural carbohydrates during the 2015-2016 El Niño drought across a tropical forest precipitation gradient[J]. Plant Cell Environ,2019,42(5):1705−1714. doi: 10.1111/pce.13501
[21] Adams HD,Germino MJ,Breshears DD,Barron-Gafford GA,Guardiola-Claramonte M,et al. Nonstructural leaf carbohydrate dynamics of Pinus edulis during drought-induced tree mortality reveal role for carbon metabolism in mortality mechanism[J]. New Phytol,2013,197(4):1142−1151. doi: 10.1111/nph.12102
[22] Correia B,Hancork RD,Amaral J,Gomez-Cadenas A,Vallendor L,Pinto G. Combined drought and heat activates protective responses in Eucalyptus globulus that are not activated when subjected to drought or heat stress alone[J]. Front Plant Sci,2018,9:819. doi: 10.3389/fpls.2018.00819
[23] Liu HY,Shang-Guan HL,Zhou M,Airebule P,Zhao PW,et al. Differentiated responses of nonstructural carbohydrate allocation to climatic dryness and drought events in the Inner Asian arid timberline[J]. Agric For Meteorol,2019,271:355−361. doi: 10.1016/j.agrformet.2019.03.008
[24] Jin YQ,Li J,Liu CG,Liu YT,Zhang YP,et al. Carbohydrate dynamics of three dominant species in a Chinese savanna under precipitation exclusion[J]. Tree Physiol,2018,38(9):1371−1383. doi: 10.1093/treephys/tpy017
[25] Latt CR,Nair PKR,Kang BT. Reserve carbohydrate levels in the boles and structural roots of five multipurpose tree species in a seasonally dry tropical climate[J]. For Ecol Manage,2001,146(1-3):145−158. doi: 10.1016/S0378-1127(00)00456-4
[26] Dietze MC,Sala A,Carbone MS,Czimczik CI,Mantooth JA,et al. Nonstructural carbon in woody plants[J]. Annu Rev Plant Biol,2014,65:667−687. doi: 10.1146/annurev-arplant-050213-040054
[27] Kannenberg SA,Novick KA,Phillips RP. Coarse roots prevent declines in whole-tree non-structural carbohydrate pools during drought in an isohydric and an anisohydric species[J]. Tree Physiol,2018,38(4):582−590. doi: 10.1093/treephys/tpx119
[28] Reinhardt K,Germino MJ,Kueppers LM,Domec JC,Mitton J. Linking carbon and water relations to drought-induced mortality in Pinus flexilis seedlings[J]. Tree Physiol,2015,35(7):771−782. doi: 10.1093/treephys/tpv045
[29] Anderegg WRL. Complex aspen forest carbon and root dynamics during drought:a letter[J]. Climatic Change,2012,111(3-4):983−991. doi: 10.1007/s10584-012-0421-9
[30] Nikinmaa E,Hölttä T,Hari P,Kolari P,Mäkelä A,et al. Assimilate transport in phloem sets conditions for leaf gas exchange[J]. Plant Cell Environ,2013,36(3):655−669. doi: 10.1111/pce.12004
[31] Royo A,Gil L,Pardos JA. Effect of water stress conditioning on morphology,physiology and field performance of Pinus halepensis Mill. seedlings[J]. New For,2001,21(2):127−140. doi: 10.1023/A:1011892732084
[32] Chapin FS,Schulze E,Mooney HA. The ecology and economics of storage in plants[J]. Annu Rev Ecol Syst,1990,21:423−447. doi: 10.1146/annurev.es.21.110190.002231
[33] Piper FI. Drought induces opposite changes in the concentration of non-structural carbohydrates of two evergreen Nothofagus species of differential drought resistance[J]. Ann For Sci,2011,68(2):415−24. doi: 10.1007/s13595-011-0030-1
[34] 南吉斌,杨广环,吴天彧,林玲. 西藏3种沙棘属植物抗旱性比较研究[J]. 西北农林科技大学学报(自然科学版),2021,49(1):37−47. Nan JB,Yang GH,Wu TY,Lin L. Comparison of drought resistance of three Hippophae species in Tibet[J]. Journal of Northwest A&F University (Natural Science Edition),2021,49(1):37−47.
[35] 周帅,杨依康,李国营,林玲. 西藏5种沙棘属植物根形态和解剖结构比较研究[J]. 高原农业,2023,7(2):178−186. Zhou S,Yang YK,Li GY,Lin L. Comparative study on root morphology and anatomical structure of five species of Hippophae in Tibet[J]. Journal of Plateau Agriculture,2023,7(2):178−186.
[36] Zhang HY,Wang CK,Wang XC. Spatial variations in non-structural carbohydrates in stems of twelve temperate tree species[J]. Trees,2014,28(1):77−89. doi: 10.1007/s00468-013-0931-8
[37] Chow PS,Landhäusser SM. A method for routine measurements of total sugar and starch content in woody plant tissues[J]. Tree Physiol,2004,24(10):1129−1136. doi: 10.1093/treephys/24.10.1129
[38] He WQ,Liu HY,Qi Y,Liu F,Zhu XR. Patterns in nonstructural carbohydrate contents at the tree organ level in response to drought duration[J]. Global Change Biol,2020,26(6):3627−3638. doi: 10.1111/gcb.15078
[39] Fox H,Ben-Dor S,Doron-Faigenboim A,Goldsmith M,Klein T,David-Schwartz R. Carbohydrate dynamics in Populus trees under drought:an expression atlas of genes related to sensing,translocation,and metabolism across organs[J]. Physiol Plant,2023,175(5):e14001. doi: 10.1111/ppl.14001
[40] Blumstein M,Gersony J,Martínez-Vilalta J,Sala A. Global variation in nonstructural carbohydrate stores in response to climate[J]. Global Change Biol,2023,29(7):1854−1869. doi: 10.1111/gcb.16573
[41] Singh V,Gupta K,Singh S,Jain M,Garg R. Unravelling the molecular mechanism underlying drought stress response in chickpea via integrated multi-omics analysis[J]. Front Plant Sci,2023,14:19.
[42] 师亚婷,单立山,解婷婷,马静,杨洁,王红永. 干旱胁迫下红砂幼苗非结构性碳水化合物动态变化特征[J]. 西北植物学报,2023,43(1):116−126. Shi YT,Shan LS,Xie TT,Ma J,Yang J,Wang HY. Dynamic changes of non-structural carbohydrate in Reaumuria soongorica seedlings under drought stress[J]. Acta Botanica Boreali-Occidentalia Sinica,2023,43(1):116−126.
[43] 陈图强,徐贵青,刘深思,李彦. 干旱胁迫下梭梭水力性状调整与非结构性碳水化合物动态[J]. 植物生态学报,2023,47(10):1407−1421. doi: 10.17521/cjpe.2022.0276 Chen TQ,Xu GQ,Liu SS,Li Y. Hydraulic traits adjustments and nonstructural carbohydrate dynamics of Haloxylon ammodendron under drought stress[J]. Chinese Journal of Plant Ecology,2023,47(10):1407−1421. doi: 10.17521/cjpe.2022.0276
[44] Hartmann H,Ziegler W,Kolle O,Trumbore S. Thirst beats hunger-declining hydration during drought prevents carbon starvation in Norway spruce saplings[J]. New Phytol,2013,200(2):340−349. doi: 10.1111/nph.12331
[45] Blum A. Osmotic adjustment is a prime drought stress adaptive engine in support of plant production[J]. Plant Cell Environ,2017,40(1):4−10. doi: 10.1111/pce.12800
[46] Von Arx G,Archer SR,Hughes MK. Long-term functional plasticity in plant hydraulic architecture in response to supplemental moisture[J]. Ann Bot,2012,109(6):1091−1100. doi: 10.1093/aob/mcs030
[47] 杨诗敏,骆金初,谭钠丹,李旭,罗焓毓,等. 不同强度干旱胁迫对华南地区4种乡土树种生长和碳氮磷化学计量特征的影响[J]. 应用与环境生物学报,2024,30(1):75−82. Yang SM,Luo JC,Tan ND,Li X,Luo HY,et al. Effects of drought stress on growth,nutrient content,and stoichiometry of four native tree species in South China[J]. Chinese Journal of Applied & Environmental Biology,2024,30(1):75−82.
[48] Subbarao GV,Chauhan YS,Johansen C. Patterns of osmotic adjustment in pigeonpea-its importance as a mechanism of drought resistance[J]. Eur J Agron,2000,12(3-4):239−249. doi: 10.1016/S1161-0301(00)00050-2
[49] Van der Heyden F,Stock WD. Regrowth of a semiarid shrub following simulated browsing:the role of reserve carbon[J]. Funct Ecol,1996,10(5):647−653. doi: 10.2307/2390175
[50] 王雲霞,单立山,解婷婷,马静,师亚婷. 干旱-复水对红砂幼苗各器官非结构性碳水化合物的影响[J]. 生态学杂志,2024,43(2):383−394. Wang YX,Shan LS,Xie TT,Ma J,Shi YT. The effects of drought-rehydration on non-structural carbohydrates in Reaumuria soongorica seedlings[J]. Chinese Journal of Ecology,2024,43(2):383−394.
[51] Hummel I,Pantin F,Sulpice R,Piques M,Rolland G,et al. Arabidopsis plants acclimate to water deficit at low cost through changes of carbon usage:an integrated perspective using growth,metabolite,enzyme,and gene expression analysis[J]. Plant Physiol,2010,154(1):357−372. doi: 10.1104/pp.110.157008
[52] Wang ZG,Wang CK. Individual and interactive responses of woody plants' biomass and leaf traits to drought and shade[J]. Global Ecol Biogeogra,2023,32(1):35−48. doi: 10.1111/geb.13615
[53] 张婷,曹扬,陈云明,刘国彬. 生长季末期干旱胁迫对刺槐幼苗非结构性碳水化合物的影响[J]. 水土保持学报,2016,30(5):297−304. Zhang T,Cao Y,Chen YM,Liu GB. Effects of drought stress on non-structural carbohydrates of Robinia pseudoacacia saplings at the end of the growing season[J]. Journal of Soil and Water Conservation,2016,30(5):297−304.
[54] Kozlowski TT,Pallardy SG. Acclimation and adaptive responses of woody plants to environmental stresses[J]. Bot Rev,2002,68(2):270−334. doi: 10.1663/0006-8101(2002)068[0270:AAAROW]2.0.CO;2
[55] Zhao YJ,Wang DF,Duan HL. Effects of drought and flooding on growth and physiology of Cinnamomum camphora seedlings[J]. Forests,2023,14(7):1343. doi: 10.3390/f14071343
[56] Martínez-Vilalta J,Sala A,Asensio D,Galiano L,Hoch G,et al. Dynamics of non-structural carbohydrates in terrestrial plants:a global synthesis[J]. Ecol Monogr,2016,86(4):495−516. doi: 10.1002/ecm.1231
-
期刊类型引用(2)
1. 吴娇,张大才. 高寒草甸圆穗蓼非结构性碳水化合物对土壤含水率的响应. 农业与技术. 2025(07): 86-89 .  百度学术
百度学术
2. 浦强松,许克福. 隶属函数法对干旱地区木本园林植物的生理生化指标分析. 哈尔滨师范大学自然科学学报. 2025(02): 89-94 .  百度学术
百度学术
其他类型引用(0)
-
其他相关附件
-
PDF格式
艾盈-附表1 点击下载(161KB)
-



 下载:
下载: