Photosynthetic limitation in soybean in response to soil water-nitrogen interactions and its relationship with leaf water use efficiency
-
摘要:
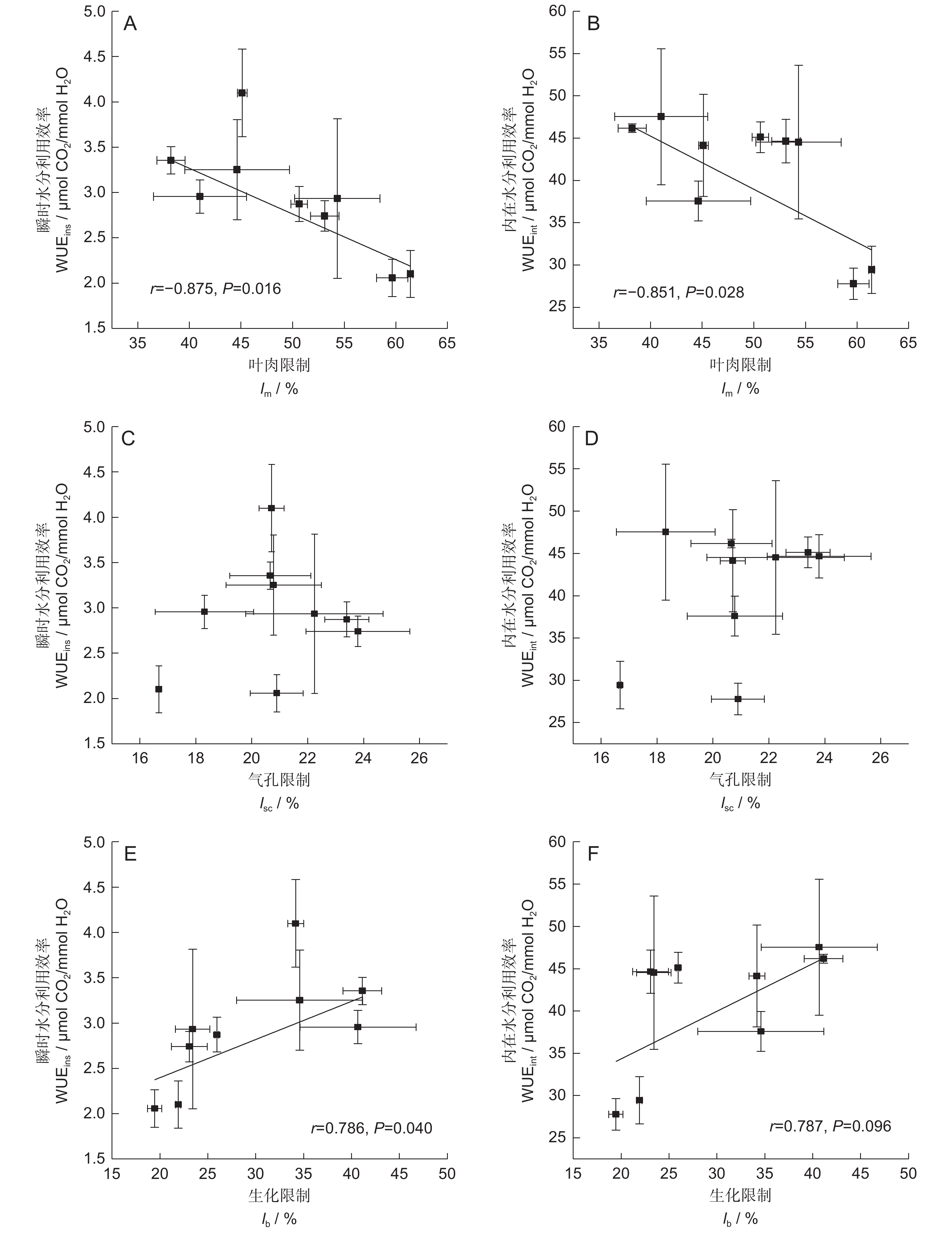
本文以我国北方旱地大豆(Glycine max (L.) Merr.)为材料,以光合限制作用为研究对象,设计土壤水-氮交互实验,探究其光合限制作用的水-氮交互响应及其与叶片瞬时水分利用效率(WUEins)和内在水分利用效率(WUEint)的相关性。结果显示:(1)大豆叶内CO2扩散性限制作用(叶肉限制,lm;气孔限制,lsc)随水分胁迫逐渐增大,生化限制(lb)逐渐减小;(2)土壤水-氮交互后,植株lm和lsc均减小,而lb显著增大;(3)lm和lb分别与WUEins及WUEint呈显著的负、正相关(P<0.05),而lsc与二者的相关性不显著;(4)相较lsc和lb,lm对植株光合碳同化与叶片水分利用效率的贡献率最大,为大豆光合与水分利用能力变化的主导限制因子。研究结果旨在揭示土壤干旱与大气氮沉降双因子交互调控作物光合碳同化的生态效应,并分析该效应与作物水分利用能力的内在关系。
Abstract:Glycine max (L.) Merr. in northern China were selected as the experimental materials, with photosynthetic limitation as the primary focus of this study. A soil water-nitrogen interaction experiment was designed to explore the relationship between photosynthetic limitation and leaf instantaneous (WUEins) and intrinsic water use efficiency (WUEint). Results showed that: (1) CO2 diffusion limitations, including mesophyll limitation (lm) and stomatal limitation (lsc), gradually increased with water stress, while biochemical limitation (lb) gradually decreased. (2) The interaction between water and nitrogen reduced lm and lsc, while lb significantly increased. (3) lm and lb were negatively and positively correlated with WUEins and WUEint, respectively (P<0.05), while lsc showed no significant correlation with either. (4) Among the limiting factors, lm contributed most to soybean photosynthetic carbon assimilation and leaf water use efficiency, making it the dominant constraint on photosynthetic and water use capacity. These findings reveal the ecological effects of soil drought and atmospheric nitrogen deposition on crop photosynthetic carbon assimilation and their intrinsic relationship with water use capacity.
-
外来植物入侵已成为一个全球性的严峻问题。入侵植物往往通过快速生长和繁殖优势占据本地植物的生态位,降低本地生物多样性,破坏生态系统结构和功能[1],对环境、经济和社会造成极大的危害[2, 3]。因此,揭示外来植物成功入侵的机制一直是入侵生态学的核心问题。外来植物的成功入侵与其自身生长速度快、竞争力强、化感作用强、资源获取与利用能力高效[4, 5]密切相关。此外,非生物因素(如地上、地下资源变化)和其他生物因素(如共生微生物)也对外来植物入侵过程具有重要的调控作用[6, 7]。理解这些因素的调控机制将有助于全面系统地解析外来植物成功入侵的过程。
在各种地下资源中,磷(P)是陆地植物的主要限制养分之一[8],也是构成植物光合作用中高能化合物ATP的必需元素[9]。人类活动引起的氮沉降的增加可能加剧土壤磷限制,进而加剧入侵植物与本地植物的竞争[10]。有研究指出,提高氮有效性水平能够加剧入侵植物与本地植物对磷的竞争[11],从而比本地植物获得更多的竞争优势[12, 13]。另外,磷可显著促进豆科植物根瘤的形成,并提高其固氮能力[14]。因此,豆科植物在入侵过程中可能更易受到磷的限制。
作为最重要的地上资源,光照(L)影响入侵植物的生长发育过程。譬如,在正常光照条件下,入侵植物通常比本地植物具有更高的生物量和生长速率;而在低光照条件下,入侵植物的生长可能低于本地植物。光照不仅能够单独影响入侵植物的生长,还可与地下资源耦合,调控其生长发育,进而影响入侵过程[15]。Zhang等[15]对比了4种入侵植物与4种本地植物对不同光照强度与养分水平的响应,发现高光强对入侵植物生长的促进效应要强于本地植物,且在高养分水平下二者的差异更加明显。因此,在探究土壤磷水平对豆科入侵植物生长发育的影响时,也需考虑地上光照强度的差异。
入侵植物生长发育所需要的磷元素不仅可以通过自身根系的吸收获得,还可以通过一些互惠共生的微生物如菌根真菌获得[16]。研究发现,丛枝菌根真菌(Arbuscular mycorrhizal fungal,AMF)在植物入侵过程中发挥着重要作用。大多数入侵植物不仅能够迅速与AMF结合,而且能破坏本地植物与AMF的共生关系,进而促进入侵植物的入侵[17]。AMF对入侵植物入侵的促进作用还取决于土壤养分的高低,因为随着土壤磷可利用性的增加,AMF与植物的相互关系可能从互利共生转化为弱共生或寄生[18, 19]。基于此,在低磷环境中AMF可能促进入侵植物的生长,而在高磷环境中AMF对入侵植物生长的影响可能会减弱。另外,AMF与植物的互惠共生主要体现在AMF可帮助植物吸收土壤中的营养元素(尤其是磷),同时依赖获取植物的光合产物来维持自身的生长和繁殖[17, 20]。因此,AMF与植物的互惠共生关系也会受光照强度的影响。随着光照强度的降低,植物与AMF的共生关系通常会减弱[21]。综上,AMF可能有助于豆科植物在高光强下的生长,且该过程可能还会受到地下磷资源的耦合调控。但在光异质性及养分富集不断加剧的背景下,AMF如何与地下磷水平及地上光照水平相耦合,进而调控入侵植物的生长发育,目前还未见报道。
白车轴草(Trifolium repens L.)为豆科车轴草属多年生草本植物,原产于欧洲,早期作为优质牧草引入我国,逸生为杂草。其匍匐茎生长快,与周围其他植物竞争空间、营养和水分,有较强的竞争能力及很强的入侵性和排他性,极易对周边生态环境和本地植物产生负面影响,从而显著降低本地群落的生物多样性[22, 23]。目前,白车轴草已被列为严重入侵类植物[24]。尽管有研究表明,养分或光照限制均可显著抑制白车轴草的生长[25, 26],而AMF则能显著促进其生长[27],但三者之间的交互作用对白车轴草的生长及其成功入侵的影响却很少受到关注。因此,本文以白车轴草为研究对象,探究光照、磷、AMF及其交互作用对白车轴草生长及其地上、地下性状的影响,研究结果旨在揭示光照、磷和AMF等多因素互作对白车轴草入侵成功的影响机制,以期为入侵植物的防控与治理提供科学依据。
1. 材料与方法
1.1 实验材料
本研究所用的白车轴草种子采购于北京创绿种业。挑选大小一致且籽粒饱满的200粒种子,均匀播撒在经高温灭菌的草炭土表面,保持土壤湿润,待种子萌发,生长至两片子叶完全展开后,进行后续实验。
本研究使用的AMF为Rhizophagus intraradices,采用白车轴草在实验室中进行培养,沙子、蛭石和黑土(体积比为1∶1∶1)混合,经高压灭菌90 min后,作为培养基质。称量25 g菌种,与灭菌培养基质充分混合均匀后,装入体积为2.5 L的花盆中进行培养。培养4个月后,去除白车轴草的地上部分,将其根系剪碎,与培养基质混合均匀,放置于4 ℃冰箱中备用。
盆栽所用的培养基为沙子和蛭石(体积比为1∶1)的混合物,并经121 ℃灭菌30 min。所用容器为高12 cm、顶部直径9 cm、容积为1 L的圆形塑料花盆。
1.2 实验设计与方法
本实验采用光照强度(高光强和低光强)×磷水平(低磷和高磷)×AMF(接种与不接种AMF菌剂)的三因子两水平的完全交互设计,设15个重复,共120盆。
通过不遮阴与遮阴模拟高光强与低光强处理,所用装置为PVC管搭建的6个塑料框架(1 m×0.9 m×1.2 m),其中3个框架罩上两层遮阴网,作为低光强处理,另外3个不罩遮阴网,作为高光强处理。为消除位置效应的影响,材料在温室内完全随机摆放。在晴朗的中午用SpectraPen LM500手持式光谱仪测量框架内的光照强度,遮阴框架内光照强度为(49.0±6.1) μmol·m−2·s−1,不遮阴处理框架内光照强度为(137.4±9.3)μmol·m−2·s−1。
基于前期研究结果[28],低磷和高磷处理为分别在整个实验周期内添加28 mg与2.8 mg的磷。分别使用磷浓度为1 mol/L和0.1 mol/L的改良版霍格兰营养液进行配置,低磷营养液添加4 mL 0.1 mol/L的CaHPO4·2H2O溶液,而高磷营养液添加4 mL 1.0 mol/L的CaHPO4·2H2O溶液,定容至1 L备用。处理时每盆施加16 mL高磷或低磷营养液,每周1次,共10次。
接种AMF处理为向花盆中接种预先培养的20 g AMF菌剂,不接种AMF处理的花盆中加入的是经高温灭菌的20 g AMF菌剂。称取120份低温保存的菌剂,每份20 g(约含300个AMF孢子),将其中60份121 ℃灭菌30 min。再分别将120份AMF菌剂与120份1 L的灭菌基质充分混合,装入花盆中备用。
挑选120株长势一致且健壮的白车轴草幼苗,分别移栽到120个花盆中央,为避免交叉污染,先移栽不接种AMF的花盆,移苗装置经消毒处理后,再移栽接种AMF的花盆。缓苗7 d,期间死亡的幼苗及时选择大小相当、长势一致的幼苗替换。幼苗成活后,测量初始株高,然后进行遮阴和施肥处理。分别将AMF接种或不接种处理的花盆平均分配到光照处理的6个架子中,每个架子包含10个接种与10个不接种AMF的花盆。再分别将接种或不接种AMF的花盆随机分成两组,进行高磷和低磷处理,即每个光照架子下面有5个重复。实验中每个光照水平有3个架子,因此每个处理有15个重复。为了降低位置效应的影响,遮阴处理下的花盆完全随机摆放,且在实验的第30天对每个框架及其中的花盆再进行一次随机摆放。实验于2021年9月25日-12月5日在中国科学院东北地理与农业生态研究所温室(43°59'49"N,125°24'4 "E)进行,温室透光率约为51%,湿度为14%~15%,平均温度为20.3 ℃。
1.3 测定指标与方法
移苗时挑选30株与移栽植株长势一致的幼苗,置于烘箱内65 ℃烘干72 h,称重,用其平均生物量表示白车轴草初始总生物量。处理10周后,所有植株按叶、茎和根分别收获,65 ℃烘干72 h后称重,按如下公式计算植株相对生长率(RGR):
RGR=(M1−M0)/t (1) 式中,
M0 为白车轴草平均初始总生物量,M1 为收获时总生物量,t 为生长时间,单位为d。同时,收获时测量植物地上生长相关指标,包括:叶片数、比叶面积(Specific leaf area,SLA)、叶质量分数(Leaf mass fraction,LMF)、总叶面积(Total leaf area,TLA)和叶厚;地下生长相关指标,包括:比根长(Specific root length,SRL)、根平均直径、细根长占比(Fine root length ratio,FRLR)、根平均表面积和根质量分数。每株选取3~5片健康叶片,测定叶片厚度、叶面积、比叶面积。叶片厚度用叶厚仪测定,叶面积用Canon Lide 220扫描仪扫描,然后用ImageJ软件计算,SLA=扫描叶面积/扫描叶生物量,LMF=叶生物量/总生物量,TLA= SLA×叶生物量;用根系扫描仪对根系进行扫描,然后用WinRHIZO软件对扫描的根部影像进行分析,SRL=扫描根根长/扫描根生物量,FRLR=扫描细根长/扫描总根长。
1.4 数据分析
采用线性混合模型,检验光照、磷、AMF及其交互作用对白车轴草总生物量、相对生长速率、地上生长指标和地下生长指标的影响。将植株初始株高作为协变量,光照水平的架子编号作为随机因子。此外,为确保残差的正态性,对根质量分数、根表面积、根平均直径和细根长占比进行了平方根转化,对总生物量、相对生长速率、叶片数、比根长和叶厚进行了对数转化,对总叶面积进行了立方根转换。使用R 4.1.2软件进行统计分析和绘图。
2. 结果与分析
2.1 3种因素对白车轴草总生物量和相对生长速率的影响
在正常光照条件下,随着磷水平的增加,白车轴总生物量显著增加。在高光照条件下,接种AMF显著提高总生物量和相对生长速率,而在低光照条件下,AMF对总生物量和相对生长速率的促进效应减弱。高磷提高了白车轴草的相对生长速率,特别是在未接种AMF处理中。高光照、高磷和接种AMF均使白车轴草总生物量和相对生长速率显著增加(表1、图1),但三者对白车轴草总生物量和相对生长速率没有明显的交互作用(表1)。
表 1 光照强度、磷和AMF及其交互作用对总生物量和相对生长率的影响Table 1. Effects of light intensity, P, AMF and their interactions on total biomass and relative growth rate固定因子
Fixed effectsdf 总生物量
Total biomass相对生长速率
Relative growth rateχ2 P χ2 P 协变量 1 7.390 0.007 12.088 0.001 光强(L) 1 17.581 <0.001 13.189 <0.001 磷(P) 1 22.612 <0.001 20.820 <0.001 丛植菌根真菌 AMF(A) 1 47.281 <0.001 54.187 <0.001 L×P 1 4.108 0.043 0.342 0.558 L×A 1 20.254 <0.001 8.819 0.003 P×A 1 9.612 0.002 15.332 <0.001 L×P×A 1 0.289 0.591 1.696 0.193 随机因子 SD SD 区组 0.206 0.079 残差 0.552 0.166 注:粗体表示效应显著(P<0.05)。下同。 Note: Bold shows significant effects (P<0.05). Same below. 2.2 光照、磷和AMF对白车轴草地上性状的影响
光照强度和磷对白车轴草叶片数、SLA、总叶面积和叶质量分数表现出显著的交互作用。高光照水平下,高磷显著提高SLA,且对叶片数和总叶面积的促进效应更强,但对叶质量分数则表现出相反的效应。同样,高光照水平下,AMF对叶片数和总叶面积的促进效应更加明显,而在低光照水平下AMF仅提高了叶质量分数(表2、图2)。除SLA显著降低外,高光照显著提高了叶片数、总叶面积和叶厚;高磷提高了叶片数、总叶面积和叶厚;接种AMF则使SLA、叶片数、总叶面积和叶质量分数显著增加(表2、图2)。但光照强度、磷和AMF的交互效应对白车轴草叶片性状的影响不显著(表2)。
表 2 3种因素及其交互作用对叶片数、比叶面积、叶质量分数、总叶面积和叶厚的影响Table 2. Effects of light intensity, P, AMF and their interactions on leaf number, SLA, leaf mass fraction, total leaf area, and leaf thickness固定因子
Fixed effectsdf 叶片数
Leaf number比叶面积
SLA叶质量分数
Leaf mass fraction总叶面积
Total leaf area叶厚
Leaf thicknessχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 − 2.891 0.089 0.405 0.525 1.958 0.162 2.983 0.084 0.301 0.583 光强(L) 1 19.366 <0.001 12.801 <0.001 1.342 0.247 18.849 <0.001 11.930 0.001 磷(P) 1 21.918 <0.001 1.664 0.197 0.433 0.511 17.330 <0.001 7.075 0.008 丛植菌根真菌
AMF(A)1 56.500 <0.001 31.216 <0.001 6.644 0.010 44.478 <0.001 0.257 0.612 L×P 1 5.823 0.016 4.305 0.038 4.082 0.043 6.095 0.014 0.542 0.462 L×A 1 30.580 <0.001 1.207 0.272 6.418 0.011 36.884 <0.001 3.582 0.058 P×A 1 13.130 <0.001 1.952 0.162 2.845 0.092 4.871 0.027 3.512 0.061 L×P×A 1 0.029 0.866 1.237 0.266 0.630 0.427 0.132 0.716 0.422 0.516 随机因子 SD SD SD SD SD 区组 0.054 0.122 0.001 0.119 0.066 残差 0.415 0.250 0.027 0.623 0.103 2.3 光照、磷和AMF对白车轴草地下性状的影响
光照强度和磷对根平均面积具有显著的交互作用,低磷水平下,高光照对根平均面积的促进效应更强(表3、图3)。光照和AMF对根平均直径和比根长的影响具有显著的交互作用,高光照水平下,AMF对根平均直径的增加以及对比根长的降低效应均更强。在根平均面积、根平均直径、根质量分数和细根长占比等性状上,磷和AMF均具有显著的交互作用。AMF在高磷下降低根平均面积,但在低磷下影响不显著;AMF在低磷下提高根平均直径,但在高磷下不显著。AMF在低磷下降低细根长占比,但在高磷下提高细跟长占比。在低磷下,接种AMF使根质量分数下降更多(表3、图3)。高光照降低白车轴草的比根长和细根长占比,但增加根平均面积、根平均直径和根质量分数。高磷显著降低根质量分数。AMF显著增加根平均直径,但降低比根长和根质量分数。光照强度、磷和AMF三者的交互效应对白车轴草根系性状的影响不显著(表3)。
表 3 3种因素及其交互作用对根平均表面积、平均直径、质量分数、比根长和细根长占比的影响Table 3. Effects of light intensity, P, AMF and their interactions on root average area, root average diameter, root mass fraction, specific root length and fine root length ratio固定因子
Fixed effectsdf 根平均面积
Root average area根平均直径
Root average diameter根质量分数
Root mass fraction比根长
Specific root length细根长占比
Fine root length ratioχ2 P χ2 P χ2 P χ2 P χ2 P 协变量 1 0.001 0.971 5.060 0.025 2.114 0.146 7.498 0.006 1.495 0.222 光强(L) 1 14.893 <0.001 9.694 0.002 6.837 0.009 8.471 0.004 7.718 0.006 磷(P) 1 0.015 0.904 2.633 0.105 6.632 0.010 0.253 0.615 3.425 0.064 丛植菌根真菌
AMF(A)1 3.129 0.077 5.015 0.025 79.024 <0.001 6.762 0.009 0.338 0.561 L×P 1 7.840 0.005 0.031 0.861 1.007 0.316 1.338 0.248 0.100 0.752 L×A 1 0.078 0.780 5.776 0.016 1.175 0.278 6.695 0.010 1.620 0.203 P×A 1 4.204 0.040 13.063 <0.001 4.330 0.037 0.338 0.561 15.017 <0.001 L×P×A 1 1.654 0.198 0.234 0.629 0.019 0.890 0.731 0.393 0.040 0.843 随机因子 SD SD SD SD SD 区组 0.245 0.004 0.024 0.049 0.008 残差 0.616 0.014 0.052 0.246 0.024 3. 讨论
土壤磷元素作为植物的主要限制养分之一,对入侵植物的生长具有显著影响。本研究结果表明,土壤磷的增加可显著提高白车轴草生物量及一些地上性状的表现。包国章等[25]研究发现,与低磷相比,高磷显著提高了白车轴草茎、叶、分株及分枝密度。我们的研究显示,尽管高磷改善了白车轴草地上性状的表现,但却降低了其根质量分数。这是因为土壤磷水平的提高缓解了地下资源对植物生长的限制,因此植物倾向于将光合产物分配转向地上部分,以获取更多的光资源,同时降低其根生物量分配,最终优化其整体的资源获取能力[29, 30]。实际上,一些研究也表明,低磷环境下植物会增加根系质量、减小根直径、提高细根数量和比根长,以最低能量损耗来取得最大的吸收表面积[31, 32]。从这个角度来讲,土壤磷变化对豆科入侵植物白车轴草生长的影响与其他植物存在相似之处。
光照作为重要的地上资源,对植物生长的影响存在较强的物种差异性。在低光照条件下,耐阴植物通常能够获得更多的生长优势,而喜阳植物的生物量积累以及地上、地下部的生长则容易受到低光照的负面影响[33-35]。本研究中的白车轴草属喜阳植物,低光照显著抑制了其生物量的积累及相对生长速率,同时,低光照抑制了大部分地上及地下性状的表现,与前人研究结果一致[23, 35]。其主要原因可能是在低光照条件下,地上光资源受限强度超过地下养分限制,因此植物将更多的资源投资于地上性状,或提高原有资源投资的利用效率,如扩展叶片面积、增大比叶面积等,从而使其在低光照环境下获取更多的光资源[36]。光照和磷的变化均会影响植物资源的分配,因此,二者对入侵植物白车轴草的生长可能存在交互效应。本研究发现,高磷对白车轴草生长的促进效应在高光照条件下强于低光照,即磷限制对白车轴草生长的影响存在光照强度依赖性。Baeten等[37]的研究也证实,光限制降低了高磷与低磷对植株生长的影响差异。这与土壤氮素和光照的交互效应对白车轴草生长影响的结果一致,即高氮的促生效应在高光照水平下更加明显[23]。根据李比希的木桶理论,在低光照水平下光资源是植物生长的主要限制因子,因此,养分的增加并不能有效缓解光限制对植物生长的负面效应[38]。
AMF通常与植物形成共利互惠关系,其对外来入侵植物生长的促进作用已得到证实[10, 32]。本研究结果发现,接种AMF能显著促进白车轴草生物量的积累和生长速率,与前人研究结果一致[24]。接种AMF显著提高了叶片数、比叶面积等性状,但降低了地下根质量分数、比根长等。其主要原因可能是当植物与AMF形成互惠共生关系时,植物根系的部分光合产物(4%~20%)用于与AMF的共生消耗,在根外形成庞大的菌丝网络,延伸了根系养分吸收区域[17, 20];同时,较高的地上光合产物有利于促进地上性状[39],因此养分吸收和光合作用同时提高,从而达到资源快速获取和快速生长的目的。Veresoglou等[21]的研究指出,随着光照强度的降低,AMF对植物的促进作用减弱,即AMF对植物的促进作用存在光照强度依赖性。本研究也发现,在低光照水平下,AMF对白车轴草生物量、地上性状以及地下性状的影响减弱。这可能是因为低光照下植物光合产物向共生AMF的转运受限,使其生长受到限制[40, 41],进而削弱了AMF对植物生长的促进作用。但该推论还需要结合测定入侵植物根系的菌根侵染率来进一步验证。
此外,本研究发现AMF和磷对白车轴草的地下性状具有显著的交互作用。总体而言, 不接种AMF时,高磷处理增加了根平均面积与平均直径,降低了细根长占比和根质量分数。该结果符合植物的资源优化策略,即当地下磷受限得到缓解时,优先地上光资源的获取。而在AMF接种后,这些性状的响应不敏感或者朝着资源优化相反的方向进行。因此,最终导致高磷对生长速率的促进效应在不接种AMF时更强,即AMF对白车轴草生长速率的促进效应在低磷水平下更强。Chen等[42]在研究AMF对入侵植物南美蟛蜞菊(Wedelia trilobata (L.) A. S. Hitchc.)的影响时也发现,AMF显著提高了低磷水平下植株的生长速度和抗病性。AMF主要促进植物对土壤中磷的吸收,当土壤磷受限时,植物会增加向AMF的成本投资,进而通过AMF的菌丝网络获取最大的养分吸收效益;而当磷限制缓解时,植株则逐渐减少向AMF的成本投入,从而使AMF的生长受到限制。因此,高磷削弱了AMF对植物生长的促进效应[17, 43]。
外来植物在入侵过程中会同时受到非生物因子和生物因子的影响。本研究发现土壤磷水平和AMF对白车轴草生长的影响存在光照强度依赖性,即在高光照水平下其促进效应更强。此外,AMF对白车轴草的促进效应也具有土壤磷依赖性,在低磷水平下AMF对生长的促进作用更强。本研究结果有助于理解光照、养分等非生物因子和AMF等生物因子变化背景下的外来植物入侵过程。
1 如需查阅附图内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
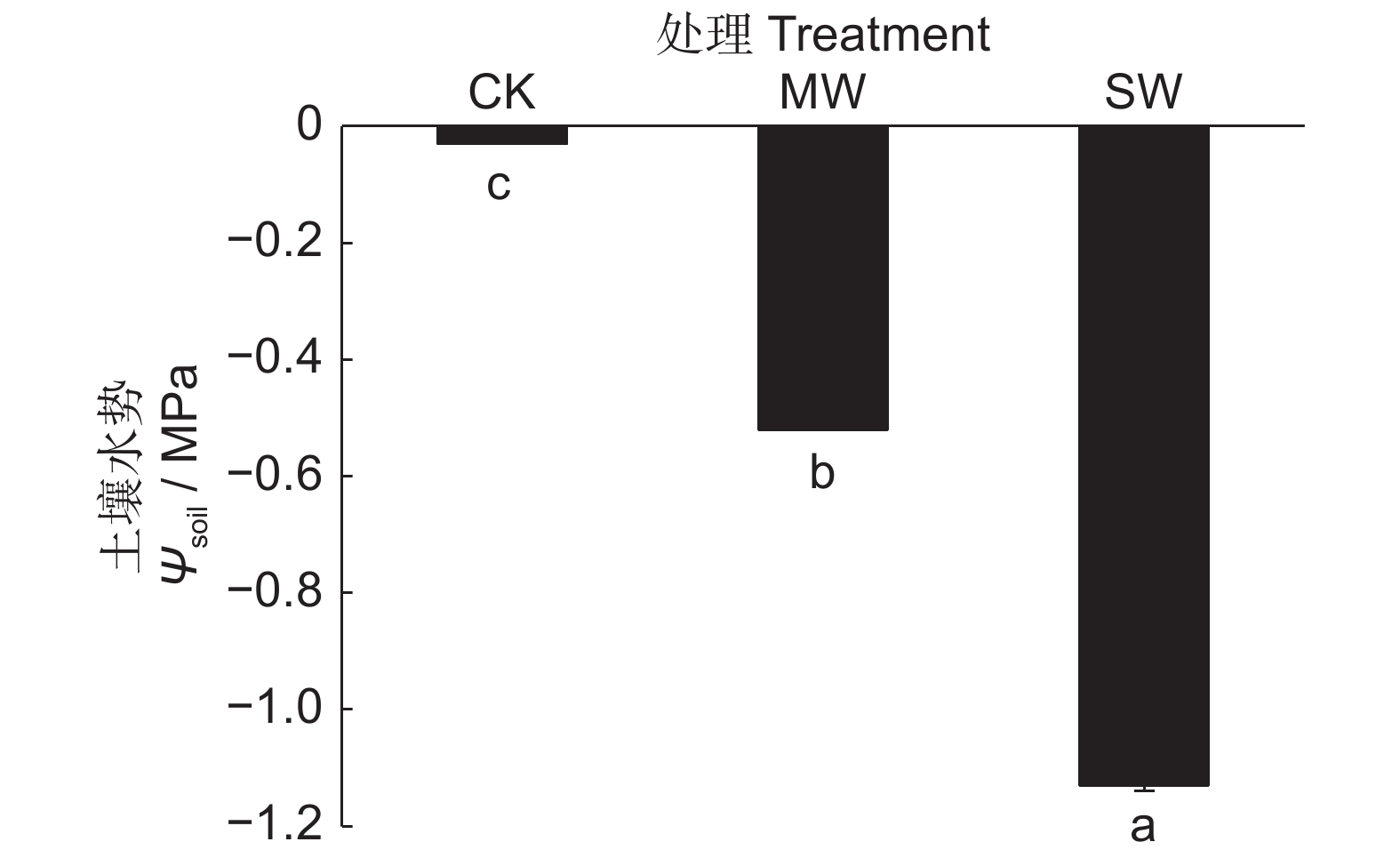
图 1 不同控水处理土壤水势(Ψsoil)变化
CK为对照,MW为轻度水分胁迫,SW为重度水分胁迫。下同。不同小写字母表示不同处理间差异显著(n=3,P<0.05)。
Figure 1. Changes in soil water potential (Ψsoil) under different water control treatments
CK: Control; MW: Moderate water stress; SW: Severe water stress. Same below. Lowercase letters indicate significant differences (n=3, P<0.05).
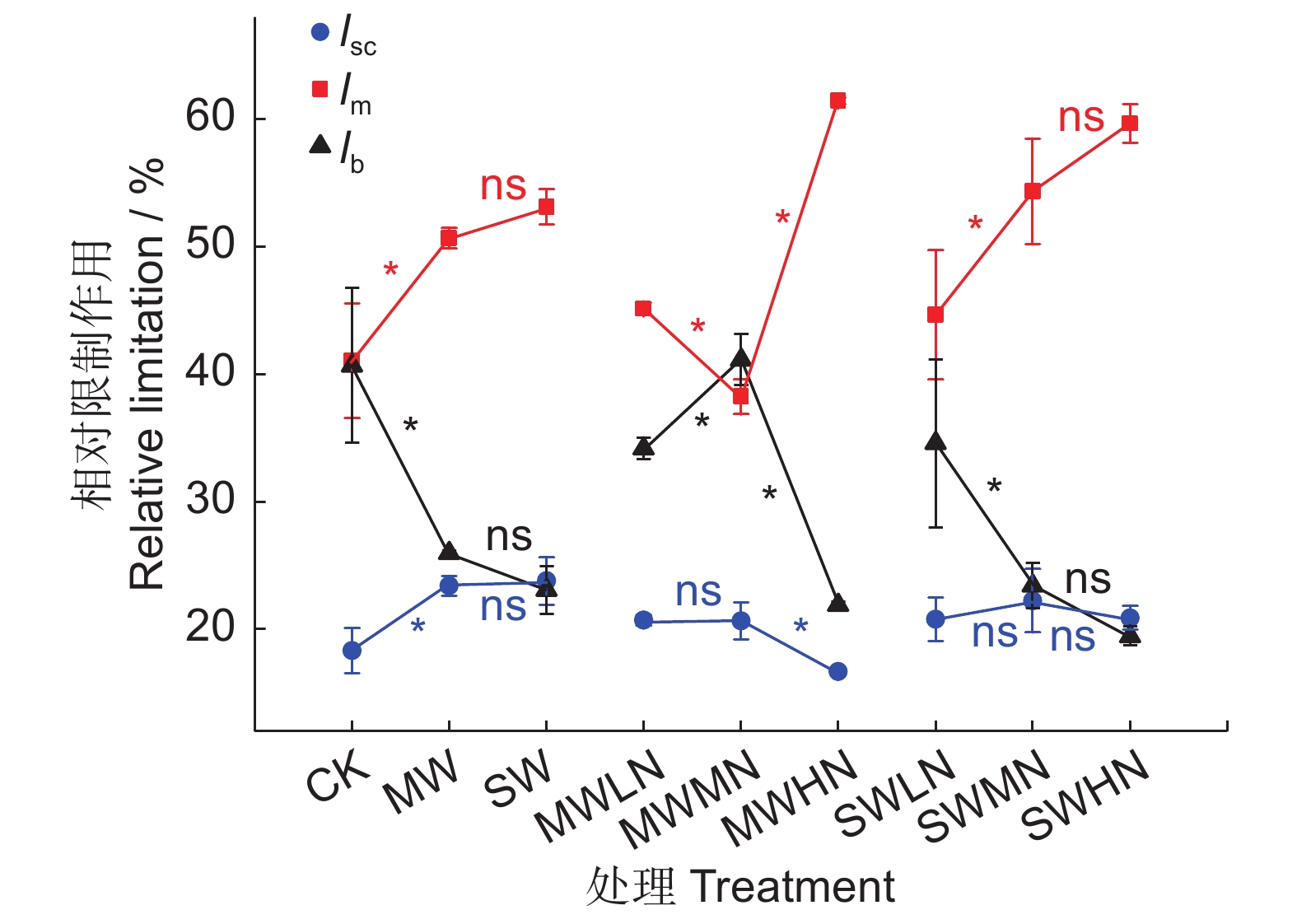
图 2 大豆光合相对限制作用随土壤水、氮含量的变化
MWLN为轻度水分胁迫,低氮添加;MWMN为轻度水分胁迫,中氮添加;MWHN为轻度水分胁迫,高氮添加;SWLN为重度水分胁迫,低氮添加;SWMN为重度水分胁迫,中氮添加;SWHN为重度水分胁迫,高氮添加。下同。*表示不同处理间在P<0.05水平上(n=3)差异显著,ns表示在该水平下差异不显著。
Figure 2. Changes in relative limitations of gsc, gm, and biochemical capacity with soil water and nitrogen in Glycine max seedlings
MWLN: Moderate water stress×low N addition; MWMN: Moderate water stress×medium N addition; MWHN: Moderate water stress×high N addition; SWLN: Severe water stress×low N addition; SWMN: Severe water stress×medium N addition; SWHN: Severe water stress×high N addition. Same below. * indicates significant difference between treatments at P<0.05 (n=3), ns indicates no significant difference at this level.
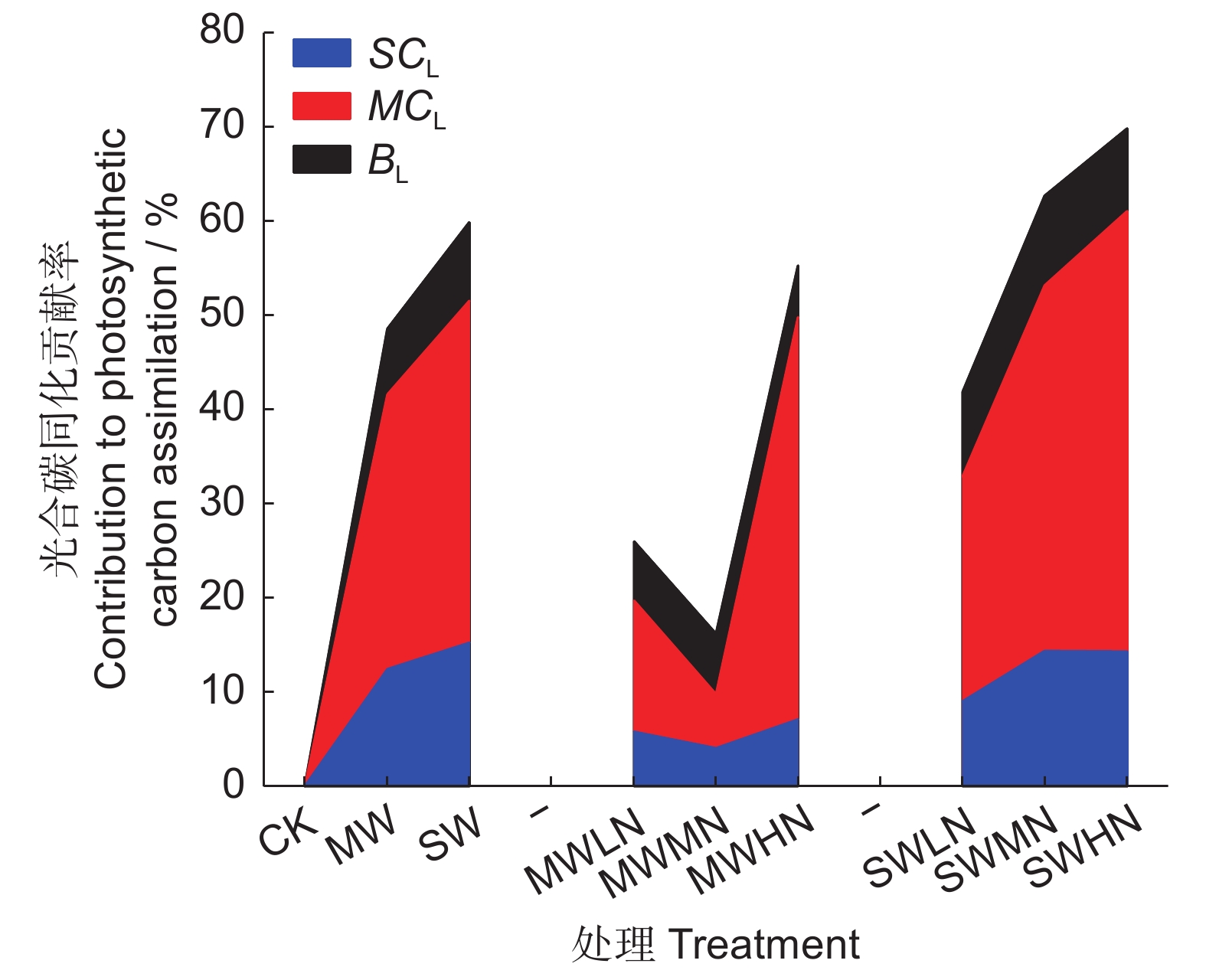
图 3 gsc、gm及生化能力对植株饱和光碳同化贡献率随土壤水、氮含量的变化
SCL、MCL和BL分别为gsc、gm和生化能力对叶片dAn/An的贡献率。
Figure 3. Changes in contributions of gsc, gm, and biochemical capacity to light-saturated assimilation with soil water and nitrogen in Glycine max seedlings
SCL, MCL, and BL are contributions of gsc, gm, and biochemical capacity to dAn/An, respectively.
表 1 叶片气孔形态特征值
Table 1 Anatomical morphological features of leaf stomata
处理
Treatment气孔密度
Ds / ind./mm2气孔大小
Ssize / μm2气孔开度
SS / μm2叶片厚度
Tleaf / μmCK 291.7±87.4a 141.2±34.4a 17.8±3.6a 192.7±24.1a MW 266.7±37.3a 141.4±42.2a 14.0±5.3ab 158.6±26.1b SW 250.0±96.2a 129.7±9.7a 8.6±1.5b 160.6±12.1b MWLN 208.3±45.0a 139.0±5.7a 11.3±2.2b 187.3±20.9ab MWMN 215.3±42.9a 147.6±37.5a 7.8±2.0bc 182.6±9.7ab MWHN 233.8±34.2a 103.7±10.8a 4.3±1.2d 192.2±18.8a SWLN 277.8±43.0a 130.4±15.8a 4.6±1.6cd 171.9±16.0ab SWMN 263.9±34.0a 145.3±16.4a 6.1±0.9cd 196.4±12.8a SWHN 222.2±96.2a 114.1±32.6a 2.2±0.1e 170.6±16.1ab 注:MWLN为轻度水分胁迫,低氮添加;MWMN为轻度水分胁迫,中氮添加;MWHN为轻度水分胁迫,高氮添加;SWLN为重度水分胁迫,低氮添加;SWMN为重度水分胁迫,中氮添加;SWHN为重度水分胁迫,高氮添加。同列不同小写字母表示处理间在P<0.05水平上差异显著。下同。 Notes: MWLN: Moderate water stress×low N addition; MWMN: Moderate water stress×medium N addition; MWHN: Moderate water stress×high N addition; SWLN: Severe water stress×low N addition; SWMN: Severe water stress×medium N addition; SWHN: Severe water stress×high N addition.Different lowercase letters in same column indicate significant differences at P<0.05 level. Same below. 表 2 不同水氮条件下土壤全氮、硝态氮、全磷、全钾、速效钾含量
Table 2 Key soil nutrient content of nitrate N, total P, total K, and available K under different water and nitrogen conditions
处理
Treatment全氮
Total nitrogen / g/kg硝态氮
Nitrate nitrogen / mg/kg全磷
Total P / g/kg全钾
Total K / g/kg速效钾
Available K / mg/kgCK 1.12±0.00a 12.4±0.3d 2.49±0.18b 30.3±1.9c 157.4±5.3d MW 1.06±0.15a 11.2±0.5d 2.37±0.15bc 29.5±1.2c 150.4±2.1d SW 1.02±0.14ab 11.0±0.4d 2.22±0.08c 29.0±1.8c 147.4±4.0d MWLN 1.26±0.14a 33.2±0.4c 2.92±0.06a 33.3±0.1b 200.7±30.9c MWMN 0.84±0.00bc 49.1±13.6b 2.91±0.02a 32.7±0.4b 163.3±3.8d MWHN 1.12±0.28a 58.6±4.6a 2.87±0.12a 35.3±0.7a 289.7±5.9a SWLN 1.12±0.00a 44.8±1.9b 2.79±0.29a 32.8±0.5b 239.9±13.2b SWMN 0.70±0.14c 55.3±2.4ab 2.91±0.16a 32.8±0.8b 222.9±6.3bc SWHN 1.12±0.00a 51.1±3.8ab 2.83±0.03a 33.6±0.2ab 240.3±20.0b -
[1] 刘平,刘学军,刘恩科,韩彦龙,李丽君,等. 山西省太原市旱作农区大气活性氮干湿沉降年度变化特征[J]. 中国生态农业学报,2017,25(5):625−633. Liu P,Liu XJ,Liu EK,Han YL,Li LJ,et al. Temporal variation of atmospheric wet/dry reactive nitrogen deposition in Taiyuan rainfed farming area of Shanxi Province[J]. Chinese Journal of Eco-Agriculture,2017,25(5):625−633.
[2] Flexas J,Ribas-Carbó M,Diaz-Espejo A,Galmés J,Medrano H. Mesophyll conductance to CO2:current knowledge and future prospects[J]. Plant Cell Environ,2008,31(5):602−621. doi: 10.1111/j.1365-3040.2007.01757.x
[3] Grassi G,Magnani F. Stomatal,mesophyll conductance and biochemical limitations to photosynthesis as affected by drought and leaf ontogeny in ash and oak trees[J]. Plant Cell Environ,2005,28(7):834−849. doi: 10.1111/j.1365-3040.2005.01333.x
[4] Galmés J,Medrano H,Flexas J. Photosynthetic limitations in response to water stress and recovery in Mediterranean plants with different growth forms[J]. New Phytol,2007,175(1):81−93. doi: 10.1111/j.1469-8137.2007.02087.x
[5] Cai YF,Wang JH,Li SF,Zhang L,Peng LC,et al. Photosynthetic response of an alpine plant,Rhododendron delavayi Franch,to water stress and recovery:the role of mesophyll conductance[J]. Front Plant Sci,2015,6:1089.
[6] Flexas J,Barón M,Bota J,Ducruet JM,Gallé A,et al. Photosynthesis limitations during water stress acclimation and recovery in the drought-adapted Vitis hybrid richter-110 (V. berlandieri × V. rupestris)[J]. J Exp Bot,2009,60(8):2361−2377. doi: 10.1093/jxb/erp069
[7] Perez-Martin A,Michelazzo C,Torres-Ruiz JM,Flexas J,Fernández JE,et al. Regulation of photosynthesis and stomatal and mesophyll conductance under water stress and recovery in olive trees:correlation with gene expression of carbonic anhydrase and aquaporins[J]. J Exp Bot,2014,65(12):3143−3156. doi: 10.1093/jxb/eru160
[8] Zhu K,Yuan FH,Wang AZ,Wu JB,Guan DX,et al. Stomatal,mesophyll and biochemical limitations to soil drought and rewatering in relation to intrinsic water-use efficiency in Manchurian ash and Mongolian oak[J]. Photosynthetica,2021,59(1):49−60. doi: 10.32615/ps.2020.084
[9] Warren CR. The photosynthetic limitation posed by internal conductance to CO2 movement is increased by nutrient supply[J]. J Exp Bot,2004,55(406):2313−2321. doi: 10.1093/jxb/erh239
[10] Bown HE,Watt MS,Mason EG,Clinton PW,Whitehead D. The influence of nitrogen and phosphorus supply and genotype on mesophyll conductance limitations to photosynthesis in Pinus radiata[J]. Tree Physiol,2009,29(9):1143−1151. doi: 10.1093/treephys/tpp051
[11] 朱凯,左齐慧,袁凤辉,关德新,吴家兵,等. 土壤氮添加对水曲柳和蒙古栎光合限制作用的影响[J]. 植物科学学报,2023,41(4):502−512. Zhu K,Zuo QH,Yuan FH,Guan DX,Wu JB,et al. Effects of soil nitrogen addition on photosynthetic limitations in Fraxinus mandshurica Rupr. and Quercus mongolica Fish. ex Ledeb[J]. Plant Science Journal,2023,41(4):502−512.
[12] Barbour MM,Kaiser BN. The response of mesophyll conductance to nitrogen and water availability differs between wheat genotypes[J]. Plant Sci,2016,251:119−127. doi: 10.1016/j.plantsci.2016.03.012
[13] Flexas J,Niinemets Ü,Gallé A,Barbour MM,Centritto M,et al. Diffusional conductances to CO2 as a target for increasing photosynthesis and photosynthetic water-use efficiency[J]. Photosynth Res,2013,117(1-3):45−59. doi: 10.1007/s11120-013-9844-z
[14] Linderson ML,Mikkelsen TN,Ibrom A,Lindroth A,Ro-Poulsen H,Pilegaard K. Up-scaling of water use efficiency from leaf to canopy as based on leaf gas exchange relationships and the modeled in-canopy light distribution[J]. Agr Forest Meteorol,2012,152:201−211. doi: 10.1016/j.agrformet.2011.09.019
[15] 赵福年,杨红燕,王润元,张凯,齐月,等. 作物内禀水分利用效率变化[J]. 核农学报,2019,33(9):1873−1881. Zhao FN,Yang HY,Wang RY,Zhang K,Qi Y,et al. Variation of intrinsic water use efficiency for crop[J]. Journal of Nuclear Agricultural Sciences,2019,33(9):1873−1881.
[16] Li YY,Liu NN,Fan H,Su JX,Fei C,et al. Effects of deficit irrigation on photosynthesis,photosynthate allocation,and water use efficiency of sugar beet[J]. Agr Water Manag,2019,223:105701. doi: 10.1016/j.agwat.2019.105701
[17] 杨建伟,梁宗锁,韩蕊莲,孙群,崔浪军. 不同干旱土壤条件下杨树的耗水规律及水分利用效率研究[J]. 植物生态学报,2004,28(5):630−636. Yang JW,Liang ZS,Han RL,Sun Q,Cui LJ. Water use efficiency and water consumption characteristics of poplar under soil drought conditions[J]. Acta Phytoecologica Sinica,2004,28(5):630−636.
[18] 王湛,李银坤,郭文忠,韩雪. 不同灌水量对温室茄子蒸腾规律及水分利用的影响[J]. 中国农村水利水电,2019(7):6−10. Wang Z,Li YK,Guo WZ,Han X. The effect of different irrigation amount on the transpiration rate and water use efficiency of autumn eggplant in greenhouses[J]. China Rural Water and Hydropower,2019(7):6−10.
[19] 胡晓创,高婉婷,孙守家,张劲松,孟平,蔡金峰. 刺槐生长和内在水分利用效率对气候因子的响应[J]. 应用生态学报,2023,34(10):2610−2618. Hu XC,Gao WT,Sun SJ,Zhang JS,Meng P,Cai JF. Responses of tree growth and intrinsic water-use efficiency of Robinia pseudoacacia to climate factors[J]. Chinese Journal of Applied Ecology,2023,34(10):2610−2618.
[20] 朱林,许兴. 植物水分利用效率的影响因子研究综述[J]. 干旱地区农业研究,2005,23(6):204−209. Zhu L,Xu X. Review on influential factors of plant water use efficiency[J]. Agricultural Research in the Arid Areas,2005,23(6):204−209.
[21] 山仑,徐萌. 节水农业及其生理生态基础[J]. 应用生态学报,1991,2(1):70−76. Shan L,Xu M. Water-saving agriculture and its physio-ecological bases[J]. Chinese Journal of Applied Ecology,1991,2(1):70−76.
[22] Han JM,Meng HF,Wang SY,Jiang CD,Liu F,et al. Variability of mesophyll conductance and its relationship with water use efficiency in cotton leaves under drought pretreatment[J]. J Plant Physiol,2016,194:61−71. doi: 10.1016/j.jplph.2016.03.014
[23] Von Caemmerer S,Farquhar GD. Some relationships between the biochemistry of photosynthesis and the gas exchange of leaves[J]. Planta,1981,153(4):376−387. doi: 10.1007/BF00384257
[24] Zhu K,Zuo QH,Liu FW,Qin JM,Wang AZ,et al. Divergences in leaf CO2 diffusion conductance and water use efficiency of soybean coping with water stress and its interaction with N addition[J]. Environ Exp Bot,2024,217:105572. doi: 10.1016/j.envexpbot.2023.105572
[25] Cano FJ,López R,Warren CR. Implications of the mesophyll conductance to CO2 for photosynthesis and water-use efficiency during long-term water stress and recovery in two contrasting Eucalyptus species[J]. Plant Cell Environ,2014,37(11):2470−2490. doi: 10.1111/pce.12325
[26] Von Caemmerer S,Evans JR,Hudson GS,Andrews TJ. The kinetics of ribulose-1,5-bisphosphate carboxylase/oxygenase in vivo inferred from measurements of photosynthesis in leaves of transgenic tobacco[J]. Planta,1994,195(1):88−97. doi: 10.1007/BF00206296
[27] 崔兴国. 植物蒸腾作用与光合作用的关系[J]. 衡水师专学报,2002,4(3):55−56. Cui XG. Relation between the transpiration and the photosynthesis of plants[J]. Journal of Hengshui Normal College,2002,4(3):55−56.
[28] Zhu K,Yuan FH,Wang AZ,Yang H,Guan DX,et al. Effects of soil rewatering on mesophyll and stomatal conductance and the associated mechanisms involving leaf anatomy and some physiological activities in Manchurian ash and Mongolian oak in the Changbai Mountains[J]. Plant Physiol Biochem,2019,144:22−34. doi: 10.1016/j.plaphy.2019.09.025
[29] 张岁岐,李秧秧. 施肥促进作物水分利用机理及对产量影响的研究[J]. 水土保持研究,1996,3(1):185−191. Zhang SQ,Li YY. Study on effects of fertilizing on crop yield and its mechanism to raise water use efficiency[J]. Research of Soil and Water Conservation,1996,3(1):185−191.
[30] Lumactud RA,Dollete D,Liyanage DK,Szczyglowski K,Hill B,Thilakarathna MS. The effect of drought stress on nodulation,plant growth,and nitrogen fixation in soybean during early plant growth[J]. J Agron Crop Sci,2023,209(3):345−354. doi: 10.1111/jac.12627
-
期刊类型引用(0)
其他类型引用(1)
-
其他相关附件
-
PDF格式
朱凯-附图 点击下载(178KB)
-







 下载:
下载: