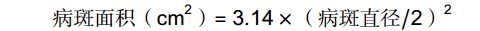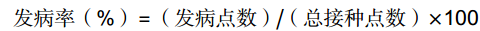Functional analysis of Solanum lycopersicum L. transcription factor SlERF.F4 against gray mold in tomato fruit
-
摘要:
番茄(Solanum lycopersicum L.)是世界上种植最广泛的经济作物之一,具有极大的经济价值,但其极易受到灰葡萄孢(Botrytis cinerea)的影响,造成严重的经济损失。ERF转录因子在植物胁迫响应中发挥关键作用。本研究通过获得番茄SlERF.F4过表达材料,比较其与野生型果实的差异,研究其介导的番茄果实抗灰霉病的功能。结果显示,与野生型番茄品种‘AC’(‘Ailsa Craig’)果实相比,SlERF.F4过表达(SlERF.F4-OE)番茄果实对灰葡萄孢的抗性较强,表现在灰葡萄孢接种后果实病斑扩展速率较慢。生理生化分析结果表明,SlERF.F4-OE果实体内的活性氧(O2−.产生速率、H2O2含量)和MDA含量低于‘AC’果实,同时,抗氧化酶活性(POD、CAT和SOD酶)高于‘AC’果实。此外,SlERF.F4-OE番茄果实体内苯丙氨酸解氨酶(PAL)活性高于‘AC’果实。研究结果说明,SlERF.F4可通过调节番茄果实活性氧稳态及防御酶活性增强果实对灰葡萄孢的抵抗能力。
Abstract:Solanum lycopersicum L. is one of the most widely cultivated cash crops globally, but its susceptibility to gray mold (Botrytis cinerea) causes significant economic losses. ERF transcription factors play a key role in plant stress responses. In this study, SlERF.F4 overexpression lines were generated and compared with wild-type tomato variety ‘AC’ (‘Ailsa Craig’) fruits to investigate the role of SlERF.F4 in mediating resistance to gray mold in tomatoes. Compared with ‘AC’ fruits, SlERF.F4-overexpressed (SlERF.F4-OE) fruits exhibited enhanced resistance to B. cinerea, as indicated by a slower lesion expansion following inoculation. Physiological and biochemical analyses revealed that the production rate of reactive oxygen species (ROS), including O2-. and H2O2 content, as well as malondialdehyde (MDA) levels, were significantly lower in SlERF.F4-OE fruits than in ‘AC’ fruits. Concurrently, antioxidant enzyme activities, including peroxidase (POD), catalase (CAT), and superoxide dismutase (SOD), were significantly elevated in SlERF.F4-OE fruits. In addition, phenylalanine ammonia-lyase (PAL) activity was higher in SlERF.F4-OE fruits than in ‘AC’ fruits. These results suggest that SlERF.F4 enhances resistance to B. cinerea in S. lycopersicum fruits by regulating reactive oxygen homeostasis and defense enzyme activity. This study provides novel insights into the function of SlERF.F4 in fruit disease resistance.
-
Keywords:
- Solanum lycopersicum /
- Botrytis cinerea /
- ERF /
- ROS
-
番茄(Solanum lycopersicum L.)是全球广泛种植的经济作物[1],1999-2019年期间,全球增加的番茄收获面积达27%,产量增加约66%[2]。2021-2022年全球番茄产量超过1.8亿吨,收获面积近500万公顷(FAO,2024年),是全球核心农业产业之一。然而,番茄极易受到灰葡萄孢(Botrytis cinerea)侵染,导致灰霉病发生[3]。灰葡萄孢属于核盘菌科,是一类死体营养型的真菌病原体。在植物中,灰葡萄孢能够感染包括番茄[4]、草莓(Fragaria ananassa Duch.)[5]、葡萄(Vitis vinifera L.)[6]、黄瓜(Cucumis sativus L.)[7]、木槿(Hibiscus syriacus L.)[8]和月季(Rosa chinensis Jacq.)[9]等约152个科、586个属的1 400多种寄主,每年全球因灰霉病造成经济损失超过100亿美元[10-12]。
ERF(Ethylene response factor)是植物特有的转录因子,属于APETALA2/ERF(AP2/ERF)转录因子大家族,主要分为4个主要亚家族:ERF(乙烯响应元件结合蛋白)、DREB(脱水反应元件结合蛋白)、AP2(APETALA2)和RAV(与ABI3/VP相关),以及Soloists(未分类的少数因子)[13, 14]。ERF亚家族识别GCC盒(AGCCGCC)这一保守的核苷酸序列,调控PR(Pathogenesis related proteins,PRs)基因启动子区在植物抗病信号通路中的表达,此外,该元件高度富集于响应病原体感染的多个基因的启动子区域[15-17]。番茄SlERF83和SlERF109通过与SlGCC2基因的GCC-box元件结合,增强对黄化曲叶病的抗性[18]。过敏性反应(Hypersensitive response,HR)是寄主抵御病原菌入侵后的防御反应,通常表现为局部坏死,这是植物对抗病原菌的重要防御机制之一[19]。通常在寄主植物对病原菌的HR中,伴随着大量ROS(Reactive oxidative species)的产生。ROS的积累与脂质的过氧化均在过敏反应之前发生,且ROS积累程度与过敏反应引起的坏死细胞数量呈正相关[20, 21]。在马铃薯(Solanum tuberosum L.)与晚疫病菌(Phytophthora infestans)互作[20]过程中和水稻(Oryza sativa L.)稻瘟病HR[22]中发现,超氧阴离子自由基(O2-.)的产生可能和寄主细胞的HR有直接关系。Doke[20]的研究发现,将SOD渗入植物体内可以清除O2-.,抑制HR的发生。在番茄中,ERF转录因子能通过ROS代谢调控其对灰葡萄孢的抗性,Ouyang等[23]的研究认为,沉默SlERF.A1、SlERF.A3、SlERF.B4或SlERF.C3基因的表达可以促进H2O2积累,导致番茄植株对灰葡萄孢的敏感性增加。
活性氧是由O2还原产生的一系列具有毒性的物质,在植物体中主要包括: O2-.、过氧化氢(H2O2)和单线态氧(1O2)等[24]。ROS可以直接抑制病菌的生长,也可以作为信号分子参与抗病过程,ROS的快速产生是植物防御系统激活的一个重要标志[25]。植物体内具有一套复杂而精密的活性氧清除系统,由抗氧化酶和抗氧化物共同组成。其中,过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸过氧化酶(APX)以及谷胱甘肽还原酶(GSH-R)等保护酶构成了抗氧化酶核心部分[26]。通过抗氧化系统的协同作用,植物能够维持体内ROS的产生与降解处于动态平衡状态,有效防止活性氧在体内积累引起损伤,维持植物细胞稳态。已有研究表明,抗氧化酶是判断植物对坏死性病原菌抗性的重要酶,能减少ROS引起的细胞损伤[27]。研究表明,ROS可诱导植物增加体内的抗氧化酶活性来抵御病原体的入侵[28, 29]。POD能够将H2O2分解成水和氧气;CAT酶的主要功能是将H2O2清除,同时对O2-.起到一定的清除作用。而在不同的植物-病原体互作系统中,SOD活性的变化是不同的[30]。Wang等[31]的研究发现抗氧化酶(POD、CAT和SOD)活性的增强是延迟辣椒(Capsicum arnuum L.)灰霉病发病的直接原因。Tenhaken等[32]认为CAT可有效抑制ROS爆发引起的细胞坏死。在番茄果实中,通过提高POD、CAT和SOD的活性可减轻灰葡萄孢引起的氧化损伤[33]。
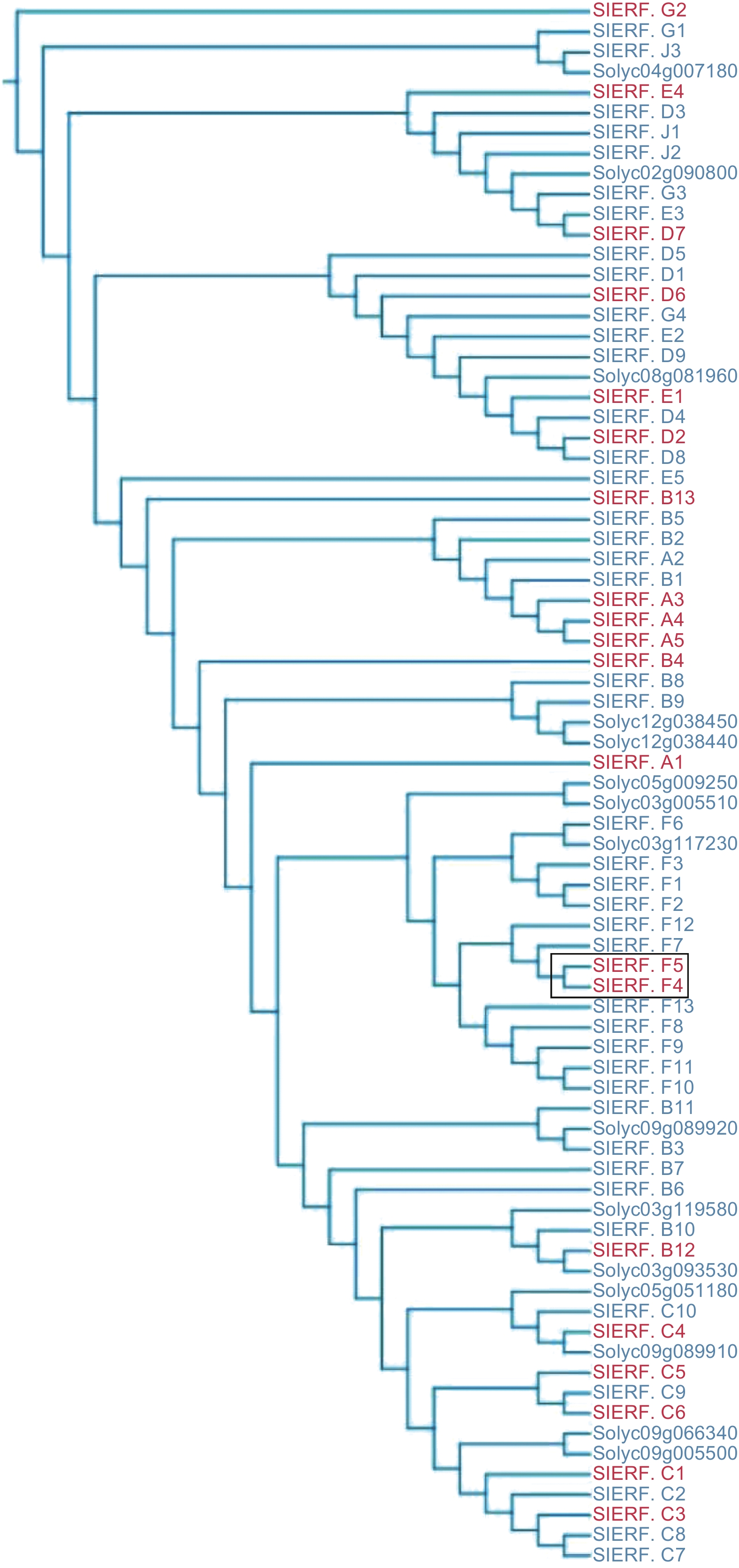
前期的研究发现,番茄果实在红熟时期受灰葡萄孢侵染后,SlERF.F4基因的表达量上调[34]。为探究SlERF.F4在胁迫响应中的功能,本文构建了SlERF.F4基因的系统进化树,分析结果显示,SlERF.F4与SlERF.A1、SlERF.A3、SlERF.B4和SlERF.C3基因具有高度的相似性,继而推测SlERF.F4在灰葡萄孢胁迫响应中发挥重要作用。为进一步验证其抗病功能,本文通过农杆菌介导的遗传转化技术构建了番茄SlERF.F4基因的过表达载体,以获得该基因的过表达植株,随后对其采后果实进行接种灰葡萄孢实验,结合抗病相关的生理生化检测方法,旨在探明番茄SlERF.F4基因在果实抗灰霉病中的功能。
1. 材料与方法
1.1 植物材料和载体
用于植物组织培养的番茄材料为野生型番茄‘AC’(Solanum lycopersicum cv. ‘Ailsa Craig’),用于灰葡萄孢处理的T1代SlERF.F4-OE转基因番茄果实均在中国科学院武汉植物园基地采摘。待果实田间热散失后,对其清洗并进行表面消毒(75%酒精喷洒),室温条件下晾干用于后续实验。
植物表达载体pCAMBIA1300-221-35S由中国科学院武汉植物园园艺基因组与分子改良实验室提供,灰葡萄孢菌株购于中国农业微生物菌种保藏管理中心(菌种编号:ACCC36028)。
1.2 系统进化树的构建
从Plant TF DB数据库(https://planttfdb.gao-lab.org/)下载番茄ERF家族基因氨基酸序列,通过iTOL(https://itol.embl.de/)在线网站,进行氨基酸序列比对,并用邻接法(Neighbor-joining)建立系统进化树。
1.3 过表达SlERF.F4(SlERF.F4-OE)转基因材料的获得
(1)目的片段扩增和载体构建
提取番茄红熟时期果实总RNA,并反转录为cDNA。以cDNA为底物,利用基因特异性引物扩增SlERF.F4的全长cDNA,引物见表1。PCR程序为:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火15 s;72 ℃延伸1 min。共循环35次,最后72 ℃延伸5 min。
表 1 引物序列Table 1. Primer sequences used in this study引物名称
Primer name引物序列(5’→3’)
Primer sequence (5’→3’)SlERF.F4-F AGAGGATCCATGGCTGTGAAAGATA SlERF.F4-R AATTCGAGCTCTTAAACTTCCATAGGT Actin-F CCTCAGCACATTCCAGCAG Actin-R CCACCAAACTTCTCCATCCC qPCR-SlERF.F4-F GAGTCATCCAGCGGAGAAACGG qPCR-SlERF.F4-R GACACCTCCACGTCCACCTTCA Hyg-F CTTGACATTGGGGAGTTTAGCGAGA Hyg-R CCCTTATCTGGGAACTACTCACACA 选取限制性内切酶BamH Ⅰ和Sac Ⅰ,对pCAMBIA1300-221-35S质粒进行酶切。反应体系总体积为50 μL:BamH Ⅰ和Sac Ⅰ各1 μL,10×Cut smart 5 μL,质粒20 μL,H2O 23 μL。将以上酶切体系于37 ℃条件下孵育3 h。酶切结束后,用1%的琼脂糖凝胶电泳进行检测,切下目的片段进行胶回收并检测浓度。
用T4连接酶连接目的片段及质粒载体,构建重组质粒pCAMBIA1300-SlERF.F4,然后将重组质粒进行大肠杆菌转化,挑选出长势良好的单菌落进行PCR鉴定,送公司测序。
(2)转基因番茄阳性植株的鉴定
遗传转化得到的植株生长至3~4片复叶时,采摘番茄植株叶片,提取DNA,通过潮霉素抗性进行PCR扩增筛选(表1),PCR扩增完成后进行琼脂凝胶电泳检验,保留阳性的遗传转化成功的番茄植株种子。实时荧光定量PCR应用武汉赛维尔生物科技有限公司的荧光定量试剂盒Hieff qPCR SYBR Green Master Mix进行。
1.4 灰葡萄孢菌培养、侵染和番茄果实取样
果实接种前用宽3 mm深3 mm的无菌打孔器在果实赤道面制造3个伤口,在伤口中接种5 μL孢子悬浮液。将接种后的果实置于塑料筐内,于24 ℃、90%~95% RH环境下贮藏,以‘AC’果实作为对照组,分析SlERF.F4过表达番茄果实对灰葡萄孢的抗性,记录发病率和病斑直径。对照组和处理组每个处理时间点都进行3次重复,每个处理90个病斑点。选取接种灰葡萄孢后0、24、48、72和96 h后番茄果实病健交界处的组织进行取样,每10果进行一次重复,液氮速冻后保存于−80 ℃条件下,用于生理指标测定。病斑面积和发病率的计算公式如下:
病斑面积(cm2)=3.14×(病斑直径/2)2 发病率(%)=(发病点数)/(总接种点数)×100 (1)果实活性氧生成量和丙二醛含量测定
O2-.产生速率测定参考Zhang等[35]和曹建康等[36]的方法,稍加修改。反应体系包含:50 mmol/L的pH值为7.8的PBS溶液,1 mol/L的盐酸羟胺溶液,17 mmol/L的对氨基苯磺酸溶液,7 mmol/L的α-萘胺,用KNO2制作标准曲线, O2-.产生速率单位为nmol·min−1·g−1。
H2O2含量的测定参照曹建康等[36]和Zhao等[37]的方法。反应体系包含:100 μmol/L 的H2O2-丙酮溶液,10%的四氯化钛-盐酸溶液,0.25 mol/L的浓氨水,2 mol/L的硫酸,用H2O2绘制标准曲线,H2O2含量单位为μmol/g。
MDA含量的测定参考Heath和Packer[38]的方法,并稍加修改。反应体系包含:500 μL 10%的TCA溶液和500 μL 6.7 g/L的硫代巴比妥酸(TBA)溶液,于95 ℃水浴20 min,然后在冰上迅速冷却。记录532 nm和600 nm处吸光值的变化,MDA单位为μmol/g。
(2)果实抗氧化酶和苯丙氨酸解氨酶活性测定
POD活性测定参考郑鄢燕[39]和Trevisan等[40]的方法,并稍加修改。以25 mmol/L愈创木酚溶液作为底物,反应体系中包含:25 μL酶提取液,30 μL 0.5 mol/LH2O2溶液,记录470 nm处吸光值的变化,以每分钟吸光度变化值增加0.01为一个活性单位(U),POD活性单位为U/g。
CAT活性测定参考Patra等[41]以及Havir和McHale[42]的方法,并稍加修改。反应体系包含:200 μL 20 mmol/L H2O2溶液,40 μL酶提取液,记录240 nm处吸光值的变化,以每分钟吸光值变化0.01为1 U,CAT活性单位为U/g。
SOD活性测定方法参照Stewart和Bewley[43]以及Toivonen和Sweeney[44]的方法。反应体系包含:50 mmol/L、PBS缓冲溶液(pH值=7.8),130 mmol/L MET溶液,750 μmol/L NBT溶液,100 μmol/L EDTA-Na2溶液,20 μmol/L核黄素溶液,33 μL酶提取液,记录560 nm处吸光值的变化,以抑制氮蓝四唑(NBT)光化还原的50%为1 U,SOD活性单位为U/g。
PAL活性测定参照Assis等[45]的方法。反应体系包含:50 mmol/L、pH值为8.8硼酸缓冲溶液和20 mmol/L L-苯丙氨酸溶液,25 μL酶提取液,记录290 nm处吸光值的变化,PAL酶活性以每小时内吸光值变化0.01为1 U,PAL活性单位为U/g。
1.5 统计分析
采用Excel 2019和GraphPad Prism 10软件进行数据整理和作图,采用SPSS 26.0软件进行统计分析。通过独立样本t检验法分析番茄植株中不同处理条件下基因表达量的差异显著性。番茄果实中不同材料间差异的显著性进行单因素方差分析(P<0.05)。
2. 结果与分析
2.1 SlERF.F4氨基酸序列比对及进化树构建
本研究发现(图1),SlERF.F4与SlERF.A1、SlERF.B4,SlERF.C3和SlERF.A3具有较高的同源性,SlERF.A1、SlERF.B4、SlERF.C3和SlERF.A3已被证明可正向调控番茄对灰葡萄孢的抗性,由此、可以推测番茄SlERF.F4蛋白在番茄中应对灰葡萄孢胁迫中可能具有类似的调节功能。
2.2 SlERF.F4基因表达模式分析
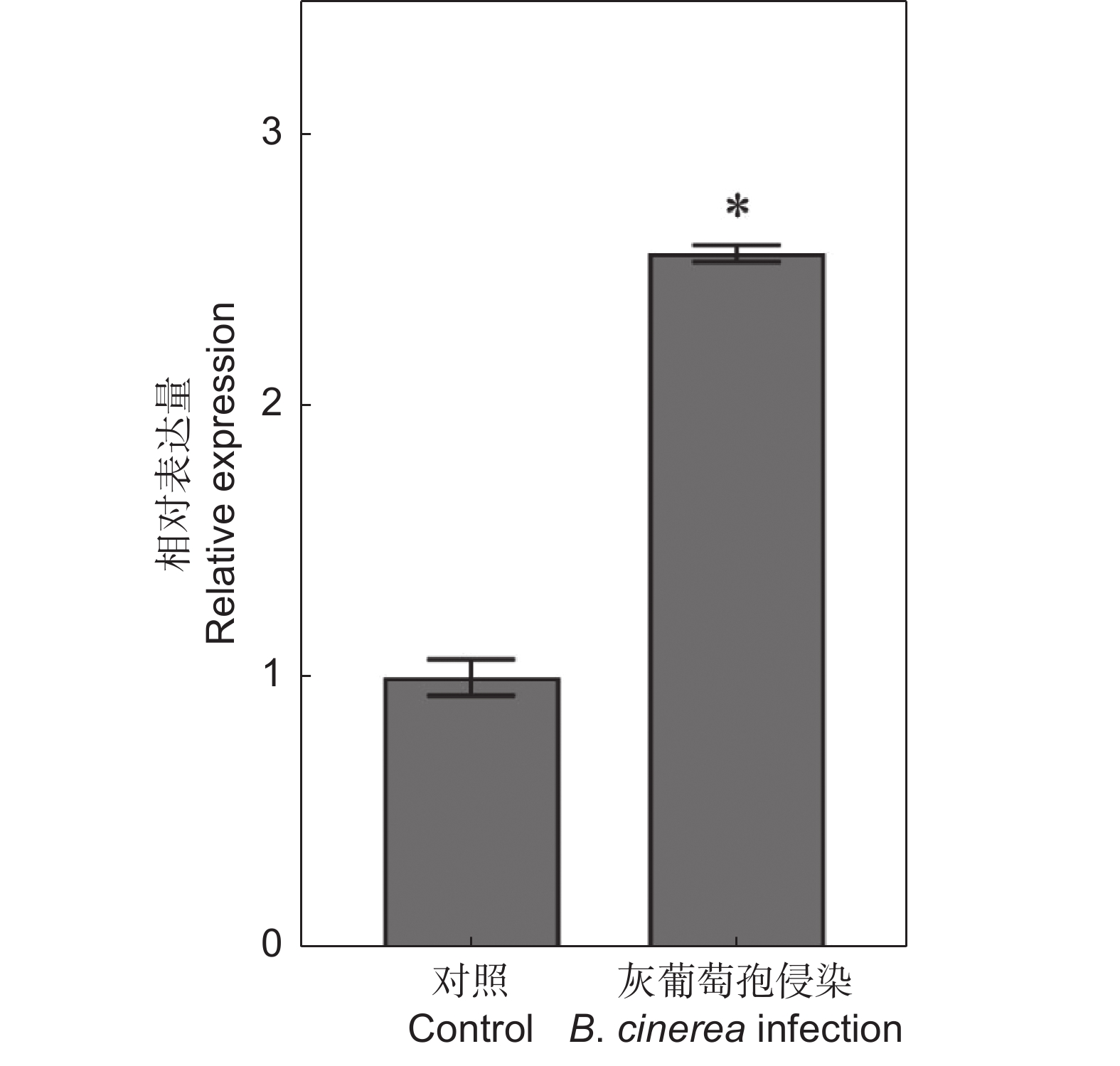
为了明确SlERF.F4是否受灰葡萄孢诱导,检测‘AC’番茄叶片在受到灰葡萄孢侵染后SlERF.F4的表达模式。如图2所示,与对照组相比,SlERF.F4的表达水平在灰葡萄孢侵染后显著上调。
2.3 SlERF.F4过表达番茄植株的鉴定
2.3.1 PCR鉴定
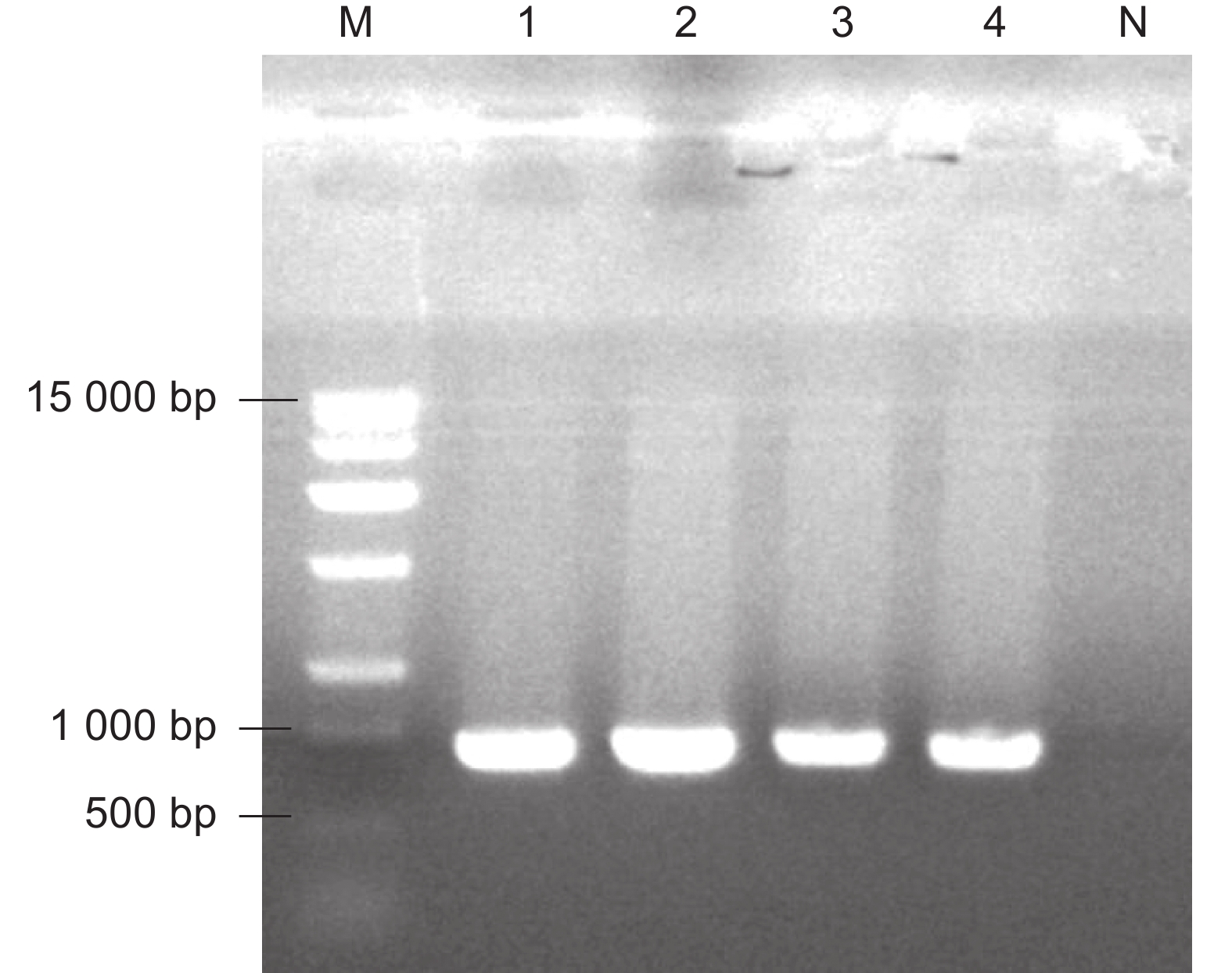
根据潮霉素基因序列设计PCR扩增引物,以非转基因植株DNA作为阴性对照,对遗传转化后的番茄植株进行潮霉素抗性筛选。如图3所示,SlERF.F4过表达的两个独立株系(SlERF.F4-OE-1、SlERF.F4-OE-2)显示潮霉素抗性阳性。
2.3.2 RT-qPCR鉴定
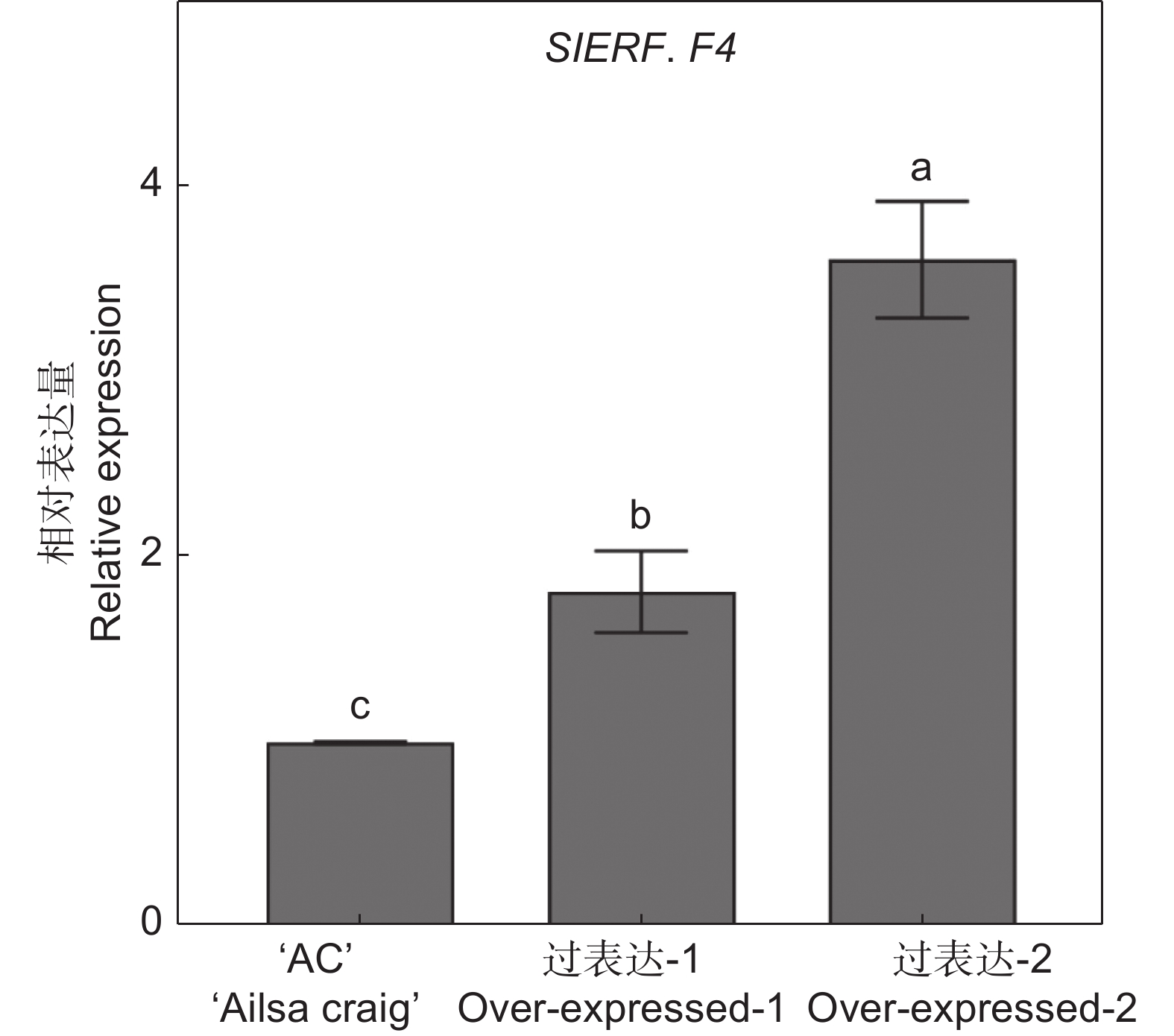
为了检测转基因植株中SlERF.F4的表达水平,利用实时荧光定量PCR检测植株叶片中SlERF.F4基因的表达量。如图4所示,与‘AC’相比,SlERF.F4过表达的两个株系中SlERF.F4基因均显著上调。过表达株系SlERF.F4-OE-1中SlERF.F4的表达量是‘AC’植株的1.8倍,过表达株系SlERF.F4-OE-2是‘AC’植株的3.6倍。
2.4 SlERF.F4过表达对采后果实抗病能力的影响
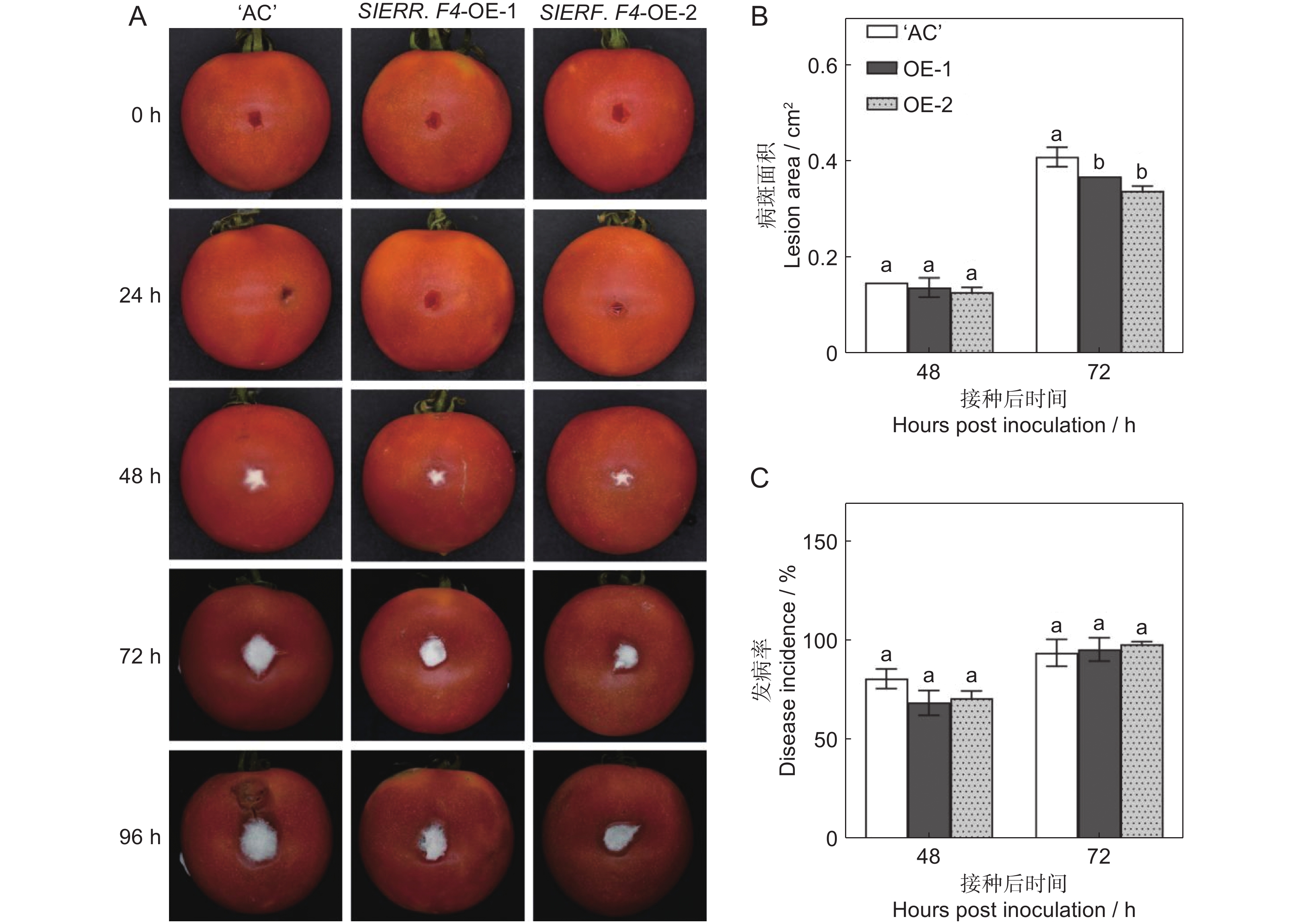
如图5所示,0~24 h时果实接种伤口未有菌丝生长,接种后48 h伤口区开始出现白色绒毛状菌丝。‘AC’和SlERF.F4-OE番茄果实均随着接菌后时间的延长,病斑面积逐渐变大,水渍状程度也逐渐加重。‘AC’果实在接种48 h后,果实接种区域有大量的丛生状白色菌丝生成,接种72 h后出现水浸状,96 h时果实病变程度更加严重(图5:A)。与‘AC’相比,SlERF.F4-OE-1和SlERF.F4-OE-2过表达番茄果实在接种72 h后的病斑面积显著低于超表达果实,且水渍程度更轻,但发病率与AC相比并无显著差异(图5:B、C)。以上结果初步表明SlERF.F4可正向调节番茄果实对灰葡萄孢的抗性。
2.5 SlERF.F4过表达对采后果实ROS生成量和MDA含量的影响
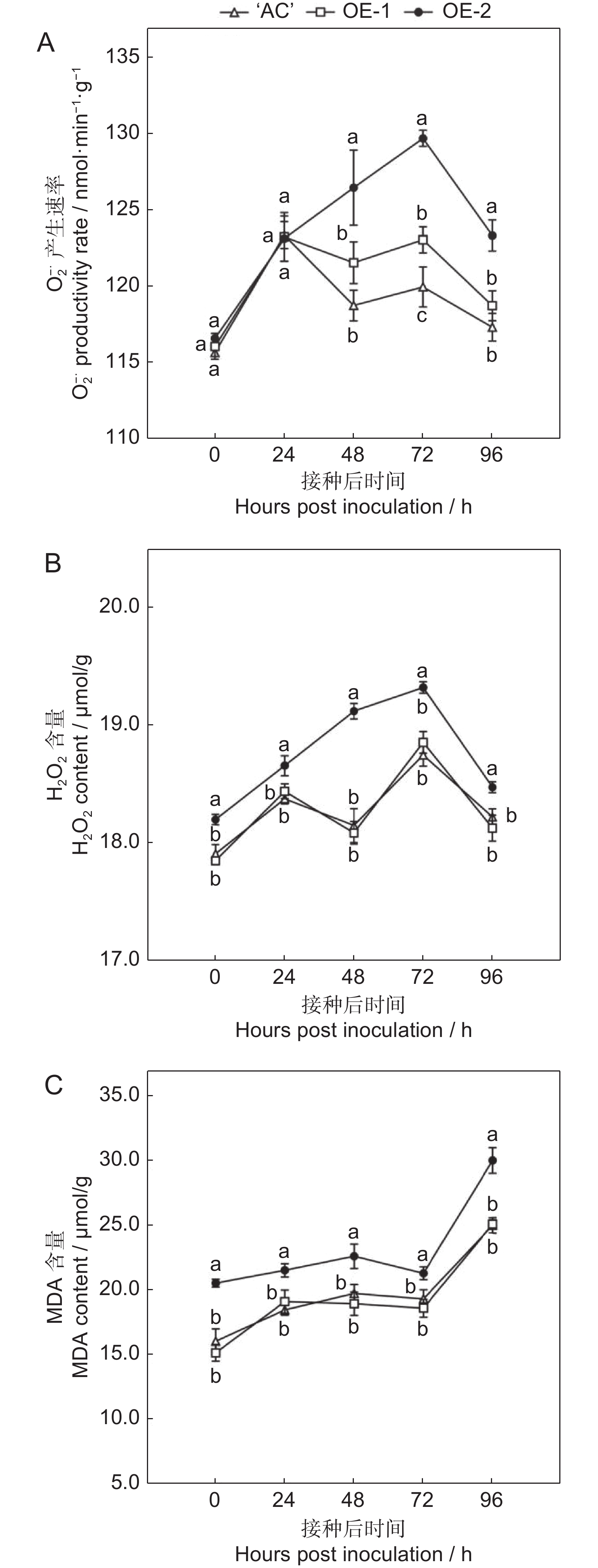
如图6所示,在接种灰葡萄孢后‘AC’果实的O2-.产生速率和H2O2含量都是先升高后降低的趋势,在72 h达到应激性高峰。然而,SlERF.F4过表达番茄果实的O2-.产生速率和H2O2含量的变化趋势与‘AC’不一致,呈上下波动的趋势,存在两个应激性高峰,分别是接种后第24和第72小时。SlERF.F4过表达番茄果实的O2-.产生速率于接种后72 h时显著低于‘AC’果实,其中SlERF.F4-OE-1果实的O2-.产生速率较‘AC’分别低5%,SlERF.F4-OE-2果实的O2-.产生速率较‘AC’分别低7%(图6:A)。SlERF.F4过表达番茄果实的H2O2含量于接种后48 h时显著低于‘AC’果实,其中SlERF.F4-OE-1和SlERF.F4-OE-2果实的H2O2含量较‘AC’均低5%(图6:B)。
‘AC’和SlERF.F4-OE番茄果实的MDA含量变化的总体趋势相似,均在0~72 h缓慢增加,随后迅速升高。在接种后的整个贮藏过程中,SlERF.F4-OE果实中的MDA含量始终显著低于‘AC’果实,SlERF.F4-OE-1果实的MDA含量较AC分别降低26%、11%、16%、13%和16%,SlERF.F4-OE-2果实的MDA含量较AC分别降低22%、14%、13%、9%和17%(图6:C)。综上所述,接种灰葡萄孢后,SlERF.F4过表达降低了果实体内的ROS生成量和MDA含量。
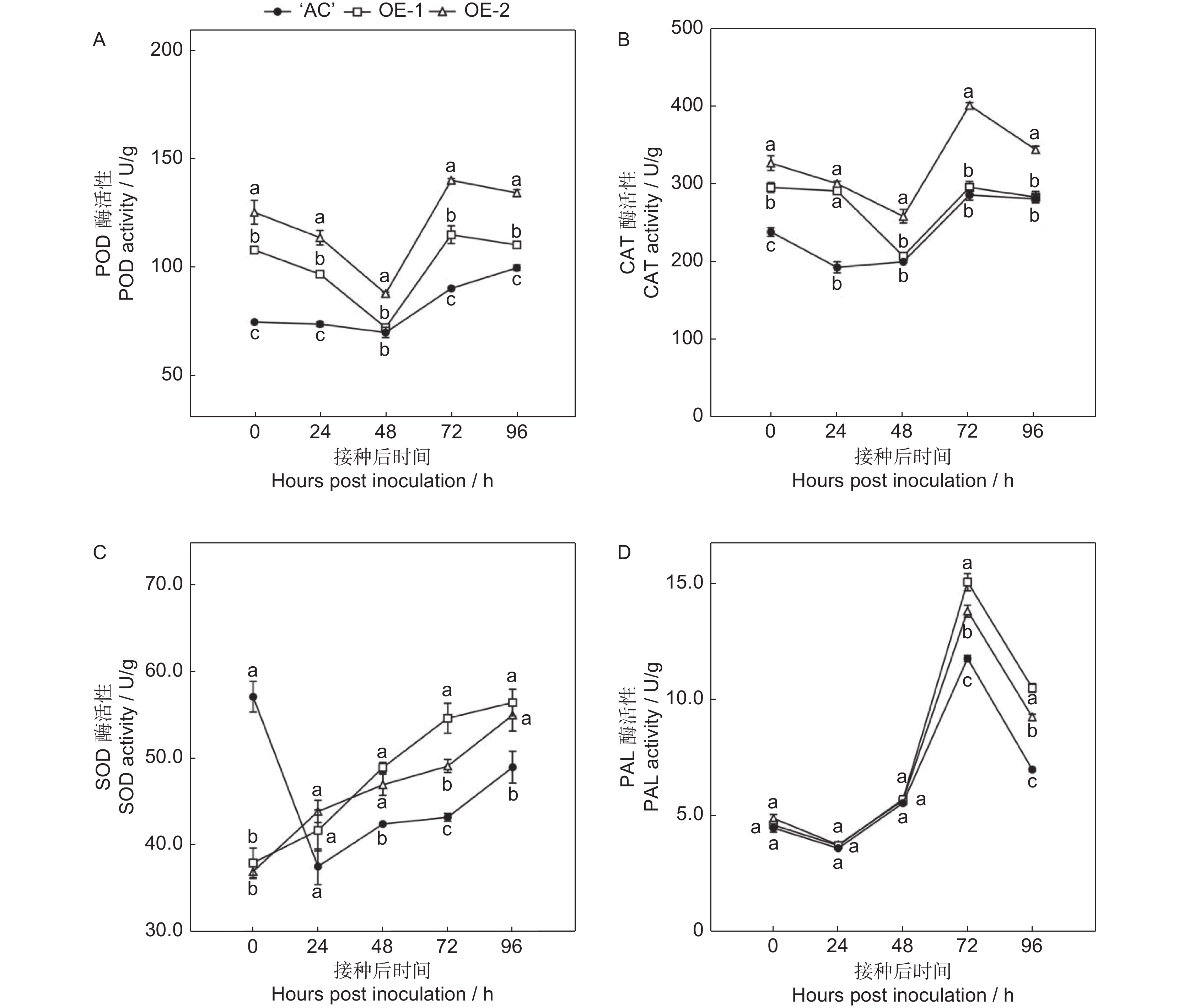
2.6 SlERF.F4过表达对采后果实抗氧化酶活性的影响
如图7所示,接种灰葡萄孢后,‘AC’果实中的POD酶和CAT酶活性在0~48 h缓慢降低,之后逐渐升高。接种灰葡萄孢后72 h时,SlERF.F4-OE-1的POD活性较AC降低27%,SlERF.F4-OE-2的POD活性较AC降低55%。另外,SlERF.F4-OE-2过表达果实的CAT活性在接种后的整个贮藏过程始终显著高于‘AC’果实(图7:A、B)。
接种灰葡萄孢后,‘AC’和SlERF.F4-OE果实中SOD酶活性变化的趋势相反,‘AC’果实中SOD活性在接种0~24 h内迅速下降,随后缓慢上升。然而,SlERF.F4-OE果实的SOD活性在接种后的整个贮藏过程中表现为上升的趋势,于接种后48、72和96 h时显著高于‘AC’果实,其中SlERF.F4-OE-1果实的SOD活性较‘AC’分别升高15%、27%和15%,SlERF.F4-OE-2果实的SOD活性较‘AC’分别升高11%、14%和12%(图7:C)。
‘AC’果实的PAL活性呈先上升后下降的趋势,接种灰葡萄孢后72 h时,果实的PAL活性达到峰值。SlERF.F4-OE果实的PAL活性变化趋势与AC相同,在接种灰葡萄孢后72 h和96 h时,其PAL活性显著高于‘AC’果实(图7:D)。上述结果表明,SlERF.F4过表达可通过提高抗氧化酶和苯丙氨酸解氨酶活性,以增强番茄果实对灰葡萄孢的抗性。
3. 讨论
ROS爆发诱导的细胞死亡是植物抵御寄生性病原微生物入侵寄主的有力武器[46]。吴顺和萧浪涛[47]认为ROS的累积对植物具有伤害作用,会引起膜脂过氧化等。研究发现,过表达SlERF.F4降低了接种灰葡萄孢后番茄果实中的ROS生成量(O2-.产生速率和H2O2含量)和MDA含量,且SlERF.F4-OE果实的抗氧化酶活性均高于‘AC’果实,表明SlERF.F4的过表达减少了ROS积累产生的膜脂过氧化。其次,SlERF.F4-OE果实中的抗氧化酶活性得到了提升,其采后果实对灰葡萄孢的抗性增强,说明抗氧化物酶可以清除果实体内ROS爆发产生的O2-.和H2O2,调节果实体内的氧化还原平衡,缓解番茄果实灰霉病的症状,类似的结论也在U0126处理影响番茄果实对灰葡萄孢的抗性研究中得到了验证[48]。这一结论与POD、CAT酶活性的增加与植物抵抗病原菌侵染的能力呈正相关的研究结论一致[49]。此外,SlERF.F4的过表达同时还影响了苯丙氨酸途径的关键酶PAL的活性。在植物在抵御真菌性病原菌的过程中,木质素的生物合成是重要的作用机制,而木质素的生物合成主要依赖于苯丙氨酸途径[50]。拟南芥(Arabidopsis thaliana L.)中PAL表达的缺失或抑制表现出生长发育迟缓、木质素积累减少和植物免疫力下降[51]。木质素在抗病响应中的重要功能在小麦(Triticum aestivum L.)抵御白粉病的研究结果中也得到了验证[52]。本研究结果初步表明,SlERF.F4可能通过苯丙氨酸途径调控番茄果实对真菌性病原菌灰葡萄孢的抗性,这与番茄植株SlWRKY46的过表达抑制了PAL酶活性,导致植株对灰葡萄孢更加敏感的结果相似[53]。且SlERF.F4可能通过苯丙氨酸途径调控番茄果实对真菌性病原菌灰葡萄孢的抗性,其具体的作用机制还有待挖掘。
综上所述,SlERF.F4通过调控ROS稳态提高了番茄果实的抗病性,可以极大地降低番茄在采后贮藏期间灰霉病的发生,有效改善番茄果实的品质,但今后仍需要进一步通过基因沉默和基因编辑技术获得转基因番茄材料,综合解析SlERF.F4调控番茄果实抵御灰葡萄孢的作用机制。
-
表 1 引物序列
Table 1 Primer sequences used in this study
引物名称
Primer name引物序列(5’→3’)
Primer sequence (5’→3’)SlERF.F4-F AGAGGATCCATGGCTGTGAAAGATA SlERF.F4-R AATTCGAGCTCTTAAACTTCCATAGGT Actin-F CCTCAGCACATTCCAGCAG Actin-R CCACCAAACTTCTCCATCCC qPCR-SlERF.F4-F GAGTCATCCAGCGGAGAAACGG qPCR-SlERF.F4-R GACACCTCCACGTCCACCTTCA Hyg-F CTTGACATTGGGGAGTTTAGCGAGA Hyg-R CCCTTATCTGGGAACTACTCACACA -
[1] Ranjan A,Ichihashi Y,Sinha NR. The tomato genome:implications for plant breeding,genomics and evolution[J]. Genome Biol,2012,13(8):167. doi: 10.1186/gb-2012-13-8-167
[2] Chitwood-Brown J,Vallad GE,Lee TG,Hutton SF. Breeding for resistance to Fusarium wilt of tomato:a review[J]. Genes (Basel),2021,12(11):1673. doi: 10.3390/genes12111673
[3] Escobar-Niño A,Morano Bermejo IM,Carrasco Reinado R,Fernandez-Acero FJ. Deciphering the dynamics of signaling cascades and virulence factors of B. cinerea during tomato cell wall degradation[J]. Microorganisms,2021,9(9):1837. doi: 10.3390/microorganisms9091837
[4] Tian S,Liu BJ,Shen YN,Cao SS,Lai YY,et al. Unraveling the molecular mechanisms of tomatoes' defense against Botrytis cinerea:insights from transcriptome analysis of Micro-Tom and regular tomato varieties[J]. Plants (Basel),2023,12(16):2965. doi: 10.3390/plants12162965
[5] Yang P,Zhao ZZ,Virag A,Becker T,Zhao LJ,et al. Botrytis cinerea in vivo inoculation assays for early-,middle- and late-stage strawberries[J]. Bio-Protoc,2023,13(20):e4859.
[6] Lorenzini M,Azzolini M,Tosi E,Zapparoli G. Postharvest grape infection of Botrytis cinerea and its interactions with other moulds under withering conditions to produce noble-rotten grapes[J]. J Appl Microbiol,2013,114(3):762−770. doi: 10.1111/jam.12075
[7] Kong WW,Chen N,Liu TT,Zhu J,Wang JQ,et al. Large-scale transcriptome analysis of cucumber and Botrytis cinerea during infection[J]. PLoS One,2015,10(11):e0142221. doi: 10.1371/journal.pone.0142221
[8] Swart L,Langenhoven P. First report of Botrytis blight,caused by Botrytis cinerea,on Hibiscus in South Africa[J]. Plant Dis,2000,84(4):487.
[9] Ren HR,Bai MJ,Sun JJ,Liu JY,Ren M,et al. RcMYB84 and RcMYB123 mediate jasmonate-induced defense responses against Botrytis cinerea in rose (Rosa chinensis)[J]. Plant J,2020,103(5):1839−1849.
[10] Mercier A,Carpentier F,Duplaix C,Auger A,Pradier JM,et al. The polyphagous plant pathogenic fungus Botrytis cinerea encompasses host-specialized and generalist populations[J]. Environ Microbiol,2019,21(12):4808−4821. doi: 10.1111/1462-2920.14829
[11] Caseys C,Shi GJ,Soltis N,Gwinner R,Corwin J,et al. Quantitative interactions:the disease outcome of Botrytis cinerea across the plant kingdom[J]. G3 (Bethesda),2021,11(8):jkab175. doi: 10.1093/g3journal/jkab175
[12] Bi K,Liang Y,Mengiste T,Sharon A. Killing softly:a roadmap of Botrytis cinerea pathogenicity[J]. Trends Plant Sci,2023,28(2):211−222. doi: 10.1016/j.tplants.2022.08.024
[13] Nakano T,Suzuki K,Fujimura T,Shinshi H. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiol,2006,140(2):411−432. doi: 10.1104/pp.105.073783
[14] Feng K,Hou XL,Xing GM,Liu JX,Duan AQ,et al. Advances in AP2/ERF super-family transcription factors in plant[J]. Crit Rev Biotechnol,2020,40(6):750−776. doi: 10.1080/07388551.2020.1768509
[15] Müller M,Munné-Bosch S. Ethylene response factors:a key regulatory hub in hormone and stress signaling[J]. Plant Physiol,2015,169(1):32−41. doi: 10.1104/pp.15.00677
[16] 莫纪波,李大勇,张慧娟,宋凤鸣. ERF转录因子在植物对生物和非生物胁迫反应中的作用[J]. 植物生理学报,2011,47(12):1145−1154. Mo JB,Li DY,Zhang HJ,Song FM. Roles of ERF transcription factors in biotic and abiotic stress response in plants[J]. Plant Physiology Communications,2011,47(12):1145−1154.
[17] Ohme-Takagi M,Shinshi H. Ethylene-inducible DNA binding proteins that interact with an ethylene-responsive element[J]. Plant Cell,1995,7(2):173−182.
[18] 王雅慧,李彤,黄莹,刘洁霞,王枫,熊爱生. 番茄2个ERF-B1亚族转录因子基因的克隆及其对生物和非生物胁迫响应[J]. 核农学报,2019,33(10):1893−1904. doi: 10.11869/j.issn.100-8551.2019.10.1893 Wang YH,Li T,Huang Y,Liu JX,Wang F,Xiong AS. Cloning and expression analysis under biotic and abiotic stresses of two ERF-B1 group transcription factor genes from Solanum lycopersicum[J]. Journal of Nuclear Agricultural Sciences,2019,33(10):1893−1904. doi: 10.11869/j.issn.100-8551.2019.10.1893
[19] 王宁. 锈菌诱导的小麦TaRIPK1在小麦与条锈菌互作中的功能及作用机理研究[D]. 杨凌:西北农林科技大学,2020:1−147. [20] Doke N. Involvement of superoxide anion generation in the hypersensitive response of potato tuber tissues to infection with an incompatible race of Phytophthora infestans and to the hyphal wall components[J]. Physiol Plant Pathol,1983,23(3):345−357. doi: 10.1016/0048-4059(83)90019-X
[21] Chai HB,Doke N. Activation of the potential of potato leaf tissue to react hypersensitively to Phytophthora infestans by cytospore germination fluid and the enhancement of this potential by calcium ions[J]. Physiol Mol Plant Pathol,1987,30(1):27−37. doi: 10.1016/0885-5765(87)90080-4
[22] Sekizawa Y,Haga M,Hirabayashi E,Takeuchi N,Takino Y. Dynamic behavior of superoxide generation in rice leaf tissue infected with blast fungus and its regulation by some substances[J]. Agric Biol Chem,1987,51(3):763−770.
[23] Ouyang ZG,Liu SX,Huang LH,Hong YB,Li XH,et al. Tomato SlERF. A1,SlERF. B4,SlERF. C3 and SlERF. A3,members of B3 group of ERF family,are required for resistance to Botrytis cinerea[J]. Front Plant Sci,2016,7:1964.
[24] Wang J,Higgins VJ. Nitric oxide modulates H2O2-mediated defenses in the Colletotrichum coccodes–tomato interaction[J]. Physiol Mol Plant Pathol,2005,67(3-5):131−137. doi: 10.1016/j.pmpp.2005.11.002
[25] Wang N,Fan X,He MY,Hu ZY,Tang CL,et al. Transcriptional repression of TaNOX10 by TaWRKY19 compromises ROS generation and enhances wheat susceptibility to stripe rust[J]. Plant Cell,2022,34(5):1784−1803. doi: 10.1093/plcell/koac001
[26] 吴雪霞. 外源一氧化氮对盐胁迫下番茄幼苗生理特性影响的研究[D]. 南京:南京农业大学,2007:1−122. [27] Mittler R,Zandalinas SI,Fichman Y,van Breusegem F. Reactive oxygen species signalling in plant stress responses[J]. Nat Rev Mol Cell Biol,2022,23(10):663−679. doi: 10.1038/s41580-022-00499-2
[28] 俞禄珍,王晨,陆苗. ROS信号分子及其在植物抗病反应中的作用[J]. 陕西林业科技,2015(2):70−72. doi: 10.3969/j.issn.1001-2117.2015.02.020 Yu LZ,Wang C,Lu M. The role of ROS signaling molecules in plant disease resistance response[J]. Shaanxi Forest Science and Technology,2015(2):70−72. doi: 10.3969/j.issn.1001-2117.2015.02.020
[29] Mittler R. Oxidative stress,antioxidants and stress tolerance[J]. Trends Plant Sci,2002,7(9):405−410. doi: 10.1016/S1360-1385(02)02312-9
[30] 王晨芳. 小麦与条锈菌互作过程中活性氧迸发的组织学和细胞化学研究[D]. 杨凌:西北农林科技大学,2008:1−122. [31] Wang LY,Hu JP,Li DS,Reymick OO,Tan XL,Tao N. Isolation and control of Botrytis cinerea in postharvest green pepper fruit[J]. Sci Hortic,2022,302:111159. doi: 10.1016/j.scienta.2022.111159
[32] Tenhaken R,Levine A,Brisson LF,Dixon RA,Lamb C. Function of the oxidative burst in hypersensitive disease resistance[J]. Proc Natl Acad Sci USA,1995,92(10):4158−4163. doi: 10.1073/pnas.92.10.4158
[33] 王启方,王晓云,李浩森,杨晓玉,张锐敏,等. 芳樟醇对灰葡萄孢生长的影响及对番茄灰霉病的防控效果[J]. 应用生态学报,2023,34(1):213−220. Wang QF,Wang XY,Li HS,Yang XY,Zhang RM,et al. Effects of linalool on Botrytis cinerea growth and control of tomato gray mold[J]. Chinese Journal of Applied Ecology,2023,34(1):213−220.
[34] Li S,Wu P,Yu XF,Cao JP,Chen X,et al. Contrasting roles of ethylene response factors in pathogen response and ripening in fleshy fruit[J]. Cells,2022,11(16):2484. doi: 10.3390/cells11162484
[35] Zhang HJ,Li KL,Zhang XJ,Dong CH,Ji HP,et al. Effects of ozone treatment on the antioxidant capacity of postharvest strawberry[J]. RSC Adv,2020,10(63):38142−38157. doi: 10.1039/D0RA06448C
[36] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007:1−176. [37] Zhao HD,Liu BD,Zhang WL,Cao JK,Jiang WB. Enhancement of quality and antioxidant metabolism of sweet cherry fruit by near-freezing temperature storage[J]. Postharvest Biol Technol,2019,147:113−122. doi: 10.1016/j.postharvbio.2018.09.013
[38] Heath RL,Packer L. Photoperoxidation in isolated chloroplasts:Ⅰ. Kinetics and stoichiometry of fatty acid peroxidation[J]. Arch Biochem Biophys,1968,125(1):189−198. doi: 10.1016/0003-9861(68)90654-1
[39] 郑鄢燕. SlMPK1/2/3在外源NO诱导的采后番茄果实抗病途径中的作用[D]. 北京:中国农业大学,2015:1−136. [40] Trevisan MTS,Scheffer JJC,Verpoorte R. Effect of elicitation on the peroxidase activity in some cell suspension cultures of hop,t Humulus lupulus[J]. Plant Cell Tiss Org Culture,1997,48(2):121−126. doi: 10.1023/A:1005824927070
[41] Patra HK,Kar M,Mishra D. Catalase activity in leaves and cotyledons during plant development and senescence[J]. Biochem Physiol Pflanz,1978,172(4):385−390. doi: 10.1016/S0015-3796(17)30412-2
[42] Havir EA,McHale NA. Biochemical and developmental characterization of multiple forms of catalase in tobacco leaves[J]. Plant Physiol,1987,84(2):450−455. doi: 10.1104/pp.84.2.450
[43] Stewart RR,Bewley J D. Lipid peroxidation associated with accelerated aging of soybean axes[J]. Plant Physiol,1980,65(2):245−248. doi: 10.1104/pp.65.2.245
[44] Toivonen PMA,Sweeney M. Differences in chlorophyll loss at 13 °C for two Broccoli (Brassica oleracea L.) cultivars associated with antioxidant enzyme activities[J]. J Agric Food Chem,1998,46(1):20−24. doi: 10.1021/jf970490n
[45] Assis JS,Maldonado R,Muñoz T,Escribano MI,Merodio C. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biol Technol,2001,23(1):33−39. doi: 10.1016/S0925-5214(01)00100-4
[46] Jin HB,Wang DW,Wang XF. A novel module regulating ROS in NLR-mediated immunity[J]. Trends Plant Sci,2023,28(5):512−514. doi: 10.1016/j.tplants.2023.02.002
[47] 吴顺,萧浪涛. 植物体内活性氧代谢及其信号传导[J]. 湖南农业大学学报(自然科学版),2003,29(5):450−456. doi: 10.3321/j.issn:1007-1032.2003.05.024 Wu S,Xiao LT. Metabolism and signaling conduction of the reactive oxygen species in plant[J]. Journal of Hunan Agricultural University (Natural Sciences),2003,29(5):450−456. doi: 10.3321/j.issn:1007-1032.2003.05.024
[48] Zheng YY,Yang Y,Liu C,Chen L,Sheng JP,Shen L. Inhibition of SlMPK1,SlMPK2,and SlMPK3 disrupts defense signaling pathways and enhances tomato fruit susceptibility to Botrytis cinerea[J]. J Agric Food Chem,2015,63(22):5509−5517. doi: 10.1021/acs.jafc.5b00437
[49] Su YC,Guo JL,Ling H,Chen SS,Wang SS,et al. Isolation of a novel peroxisomal catalase gene from sugarcane,which is responsive to biotic and abiotic stresses[J]. PLoS One,2014,9(1):e84426. doi: 10.1371/journal.pone.0084426
[50] Dong NQ,Lin HX. Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions[J]. J Integr Plant Biol,2021,63(1):180−209. doi: 10.1111/jipb.13054
[51] Rohde A,Morreel K,Ralph J,Goeminne G,Hostyn V,et al. Molecular phenotyping of the pal1 and pal2 mutants of Arabidopsis thaliana reveals far-reaching consequences on phenylpropanoid,amino acid,and carbohydrate metabolism[J]. Plant Cell,2004,16(10):2749−2771. doi: 10.1105/tpc.104.023705
[52] Bhuiyan NH,Selvaraj G,Wei YD,King J. Gene expression profiling and silencing reveal that monolignol biosynthesis plays a critical role in penetration defence in wheat against powdery mildew invasion[J]. J Exp Bot,2009,60(2):509−521. doi: 10.1093/jxb/ern290
[53] Shu P,Zhang SJ,Li YJ,Wang XY,Yao L,et al. Over-expression of SlWRKY46 in tomato plants increases susceptibility to Botrytis cinerea by modulating ROS homeostasis and SA and JA signaling pathways[J]. Plant Physiol Biochem,2021,166:1−9. doi: 10.1016/j.plaphy.2021.05.021



 下载:
下载: