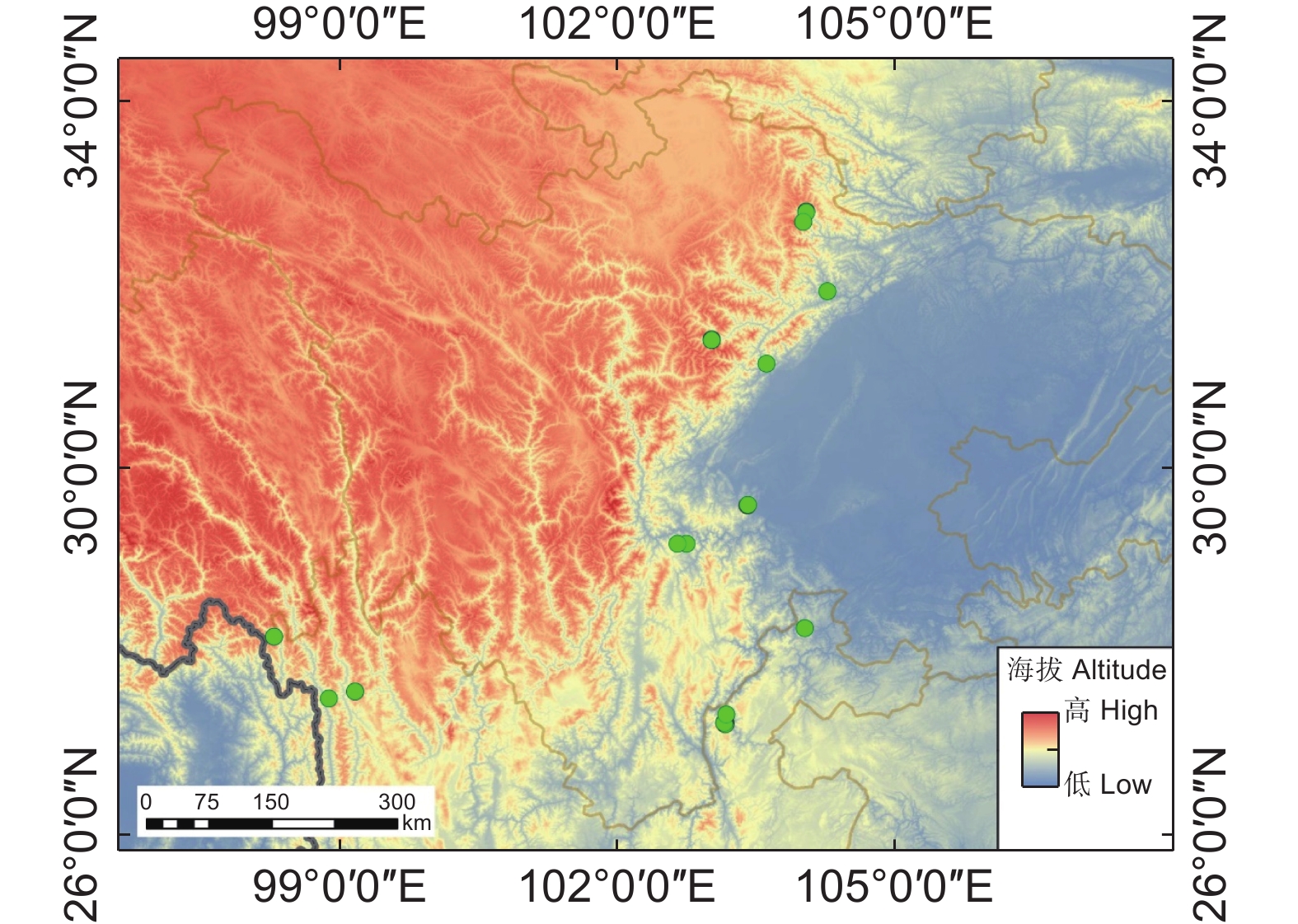
Impacts of environmental filtering and dispersal limitation on rare and endangered plant communities of the eastern margin of the Qinghai-Tibet Plateau, China
-
摘要:
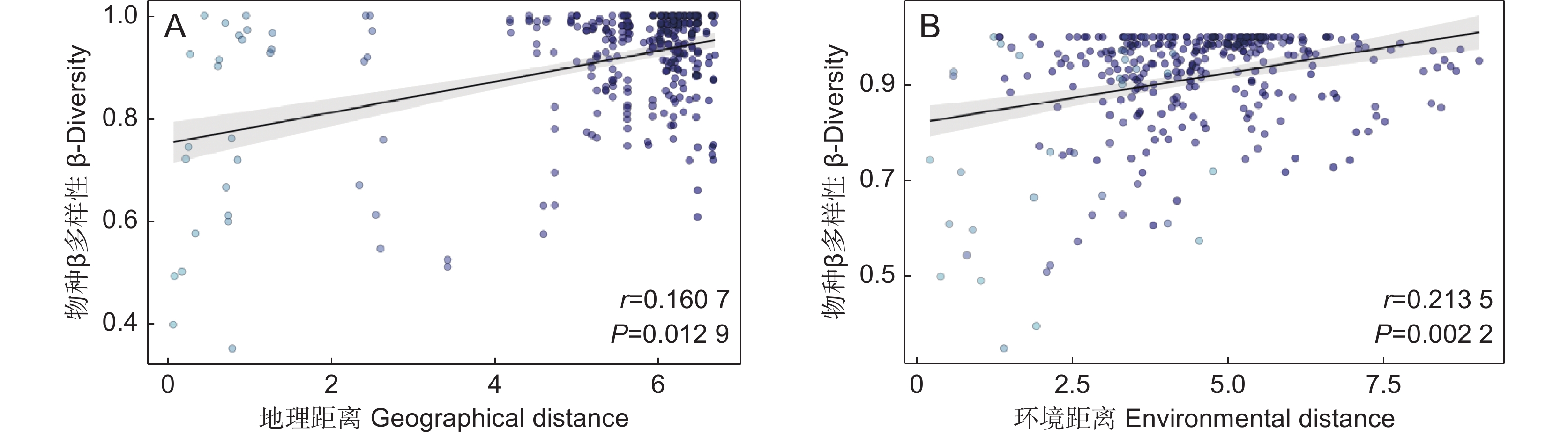
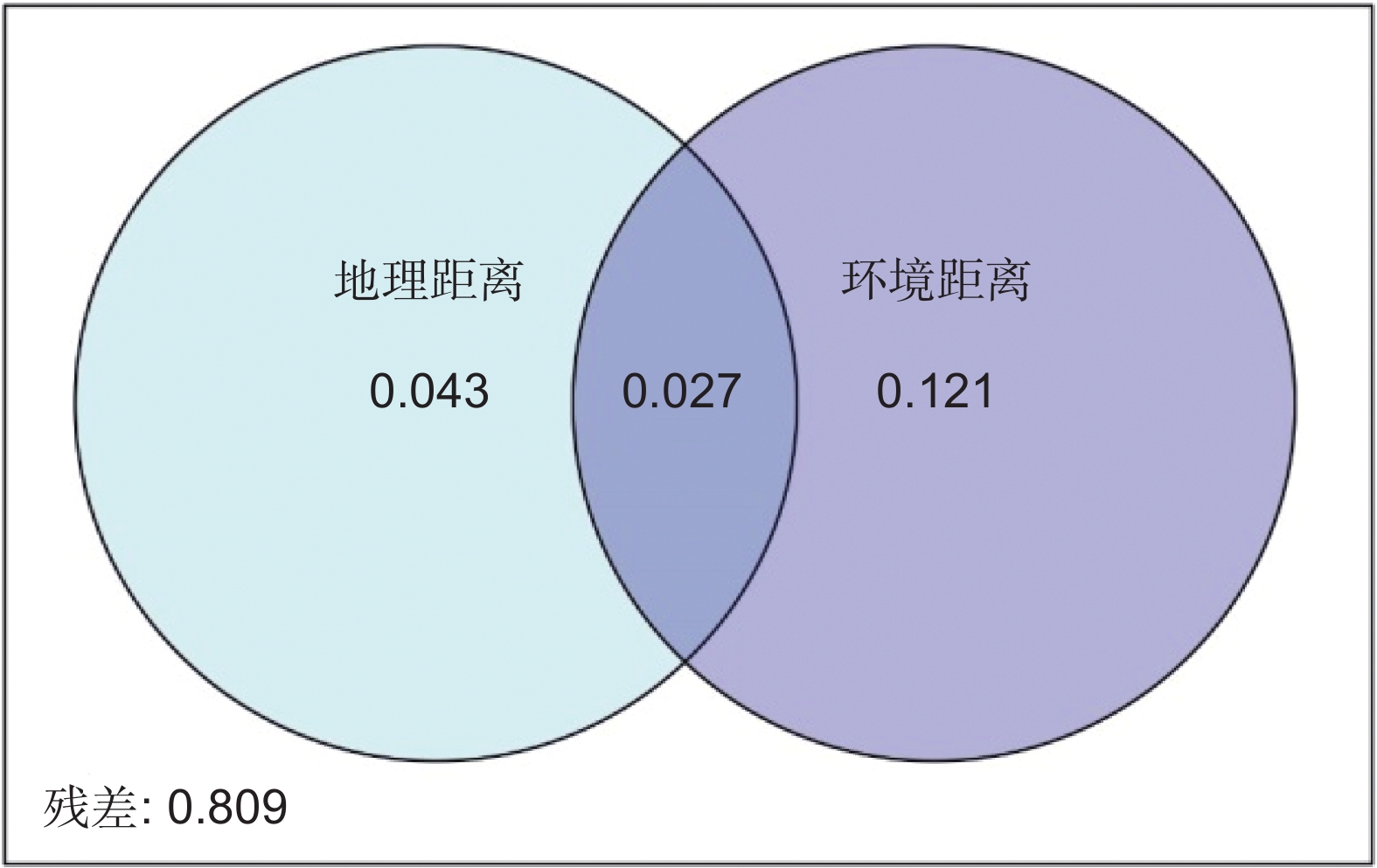
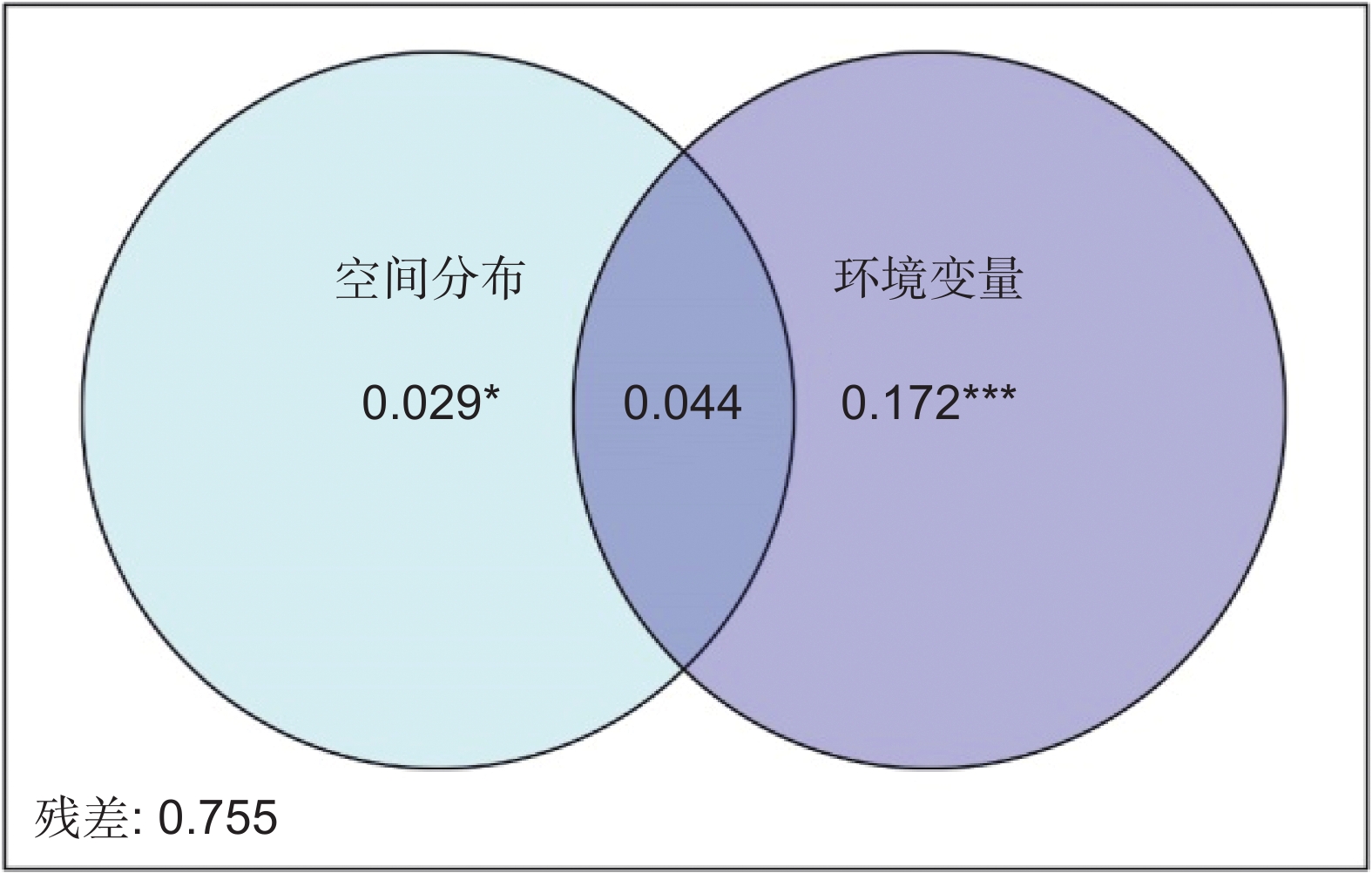
环境过滤和扩散限制是植物群落构建中β多样性形成的重要驱动机制。本研究以我国青藏高原东缘分布的珙桐(Davidia involucrata Baill.)和领春木(Euptelea pleiosperma Hook. f. & Thomson)群落为研究对象,通过分析群落β多样性与地理因素和环境因素的关系,探讨环境过滤和扩散限制在我国青藏高原东缘珍稀濒危植物群落物种周转中的相对作用。结果显示,青藏高原东缘26个珍稀植物群落样方共记录到21种珍稀濒危植物。纬度、海拔、土壤pH值、土壤铵态氮均与群落β多样性呈显著正相关。青藏高原东缘山地珍稀濒危植物群落β多样性与地理距离和环境距离呈显著正相关。基于距离矩阵多元回归(Multiple regressions on distance matrices,MRM)的方差分解结果显示,环境距离和地理距离共同对研究区域珍稀濒危植物群落β多样性做出了19.1%的解释率。基于邻体矩阵主坐标分析(Principal coordinates of neighbor matrices,PCNM)的方差分解结果表明,环境变量和空间距离联合起来对研究区域内珍稀濒危植物群落β多样性提供了24.5%的解释率。总之,环境筛选和扩散限制在塑造青藏高原东缘山地珍稀濒危植物群落方面具有协同作用,其中环境筛选的影响力更为显著。
Abstract:Environmental filtering and dispersal limitation are important drivers of beta-diversity in plant communities. This study investigated the relationships between beta-diversity, geographic distance, and environmental distance in rare and endangered plant communities associated with Davidia involucrata and Euptelea pleiosperma along the eastern margin of the Qinghai-Tibet Plateau, China. The aim was to assess the relative contributions of environmental filtering and dispersal limitation on community assembly in these threatened plant assemblages. A total of 21 rare and endangered plant species were recorded across 26 plant communities. Beta-diversity exhibited significant positive correlations with latitude, elevation, soil pH, and soil NH4 concentration. Furthermore, beta-diversity was significantly positively correlated with both geographic and environmental distances. Multiple regression analysis of distance matrices (MRM) indicated that geographic and environmental distances collectively explained 19.1% of the variation in species composition, while principal coordinates of neighbor matrices (PCNM) analysis indicated that these factors explained 24.5% of the variation. Overall, these results suggest that beta-diversity in rare and endangered plant communities along the eastern margin of the Qinghai-Tibet Plateau is shaped by both environmental filtering and dispersal limitation, with environmental filtering playing a more dominant role in structuring species composition.
-
植物在生长发育过程中会遭受多种生物与非生物胁迫的侵袭,而病程相关蛋白(Pathogenesis-related proteins,PRs)是植物受这些外界胁迫时诱导产生的一类特异性防御蛋白,是植物防御体系的重要组成部分[1, 2]。根据PRs蛋白生物活性、亲缘关系和结构的不同,可将其分为17个家族[3, 4]。PR10属病程相关蛋白第10家族,为类核糖核酸酶,是一类等电点偏酸性的小分子(分子量为15 ~ 19 kD)胞内蛋白,通常编码151 ~ 162个氨基酸,广泛存在于植物细胞质中[5-7]。研究表明,PR10能降解病原体核酸或引发植物感染部位的细胞程序性死亡(Programmed cell death, PCD)[8],帮助植物抵御病原菌的侵染。自1988年PR10基因从欧芹(Petroselinum crispum (Mill) Hill)[9]中首次分离鉴定后,该基因在不同植物中被相继发现,包括大豆(Glycine max (L.) Merr.)[10]、高粱(Sorghum Bicolor (L.) Moench)[11]、三七(Panax notoginseng (Burk) F. H. Chen)[12]、海岛棉(Gossypium barbadense L.)[13]等。松科是针叶树中最大的科,约有11属120种[14, 15]。目前松科部分属的PR10基因已被挖掘,包括松属糖松(Pinus lambertiana Dougl.)[16] 的Pinl Ⅰ基因、西部白松(Pinus monticola Dougl)[17]的Pin m Ⅲ基因,黄杉属北美黄杉(Pseudotsuga menziesii (Mirbel) Franco)[18]的Pse m Ⅰ基因,云杉属白云杉(Picea glauca (Moench) Voss)[17]的Picg1基因等。
粗枝云杉(Picea asperata Mast.)为松科云杉属植物,又名大果云杉、云杉等,多年生常绿针叶乔木,广泛分布于我国西南地区,是重要的用材树种和工业原料提取树种[19, 20]。调查发现,粗枝云杉长期遭受云杉落针病(Lophodermium piceae (Fuckel) V. Hohn)的侵扰,造成其生长受阻,用材质量大大降低[21]。抗病育种是林木病害防治的有效途径之一,挖掘粗枝云杉抗病基因资源,为培育广谱持久的抗落针病云杉树种奠定研究基础。然而目前,粗枝云杉抗病基因仅有少数报道,包括苯丙氨酸氨裂解酶基因(PaPAL)[22]和防御素基因(PaDef)[23]等,但PR10基因在粗枝云杉中还未见报道。
本实验室在前期研究中对云杉落针病菌胁迫的粗枝云杉进行了转录组测序,筛选到一个病原菌胁迫下显著上调的PaPR10-1基因(数据未发表),利用RT-PCR技术克隆获得该基因的全长cDNA序列,通过生物信息学方法分析基因序列及其编码的氨基酸序列,将PaPR10-1基因连接到pET-32a载体上并转入BL21(DE3)感受态细胞中重组表达,对其表达的IPTG诱导浓度、诱导时间和诱导温度等条件进行优化。在最佳表达条件下表达目的蛋白并纯化,并采用底物分析法检测纯化蛋白的RNase活性。研究结果旨在为进一步解析PaPR10-1基因在粗枝云杉抗病中的生物学功能奠定基础。
1. 材料与方法
1.1 实验材料
粗枝云杉一年生健康幼嫩针叶采自四川省甘孜藏族自治州泸定县二郎山林场;云杉落针病菌云杉散斑壳(Lophodermium piceae (Fuckel) V. Hohn)来源于四川农业大学微生物标本保藏室。
1.2 PaPR10-1基因的克隆
提取粗枝云杉总RNA,并反转录成cDNA。使用Primer 5.0软件设计PaPR10-1基因特异性引物,分别为PaPR10-1-F和PaPR10-1-R (表1)。以cDNA为底物,利用设计好的引物序列进行PCR扩增,程序如下:94℃预变性3 min,94℃变性30 s,54℃退火1 min,72℃延伸1.5 min,共40个循环;72℃延伸7 min,于4℃保存。扩增产物经纯化、回收后转入DH5α感受态细胞中,阳性克隆送公司测序。
表 1 引物序列Table 1. Primer sequences引物名称
Primer name引物序列 (5'→3')
Primer sequence (5'→3')PaPR10-1-F ATGGTGGCAGGGACGGTAACAAC PaPR10-1-R TTAGCAGTATAAGTCGGGGTTGGAG PaPR10-1-BamHⅠ-F GGAATTCATGGTGGCAGGGACGGTAACAAC PaPR10-1-HindⅢ-R CCGCTCGAGTTAGCAGTATAAGTCGGGGTTGGAG 1.3 生物信息学分析
通过序列分析软件DNAMAN 6.0对PaPR10-1基因的核苷酸和其编码的氨基酸序列进行比对分析,利用ESPript3.0、ScanProsite、SOPMA和SWISS-MODEL(https: //swissmodel.expasy.org/interactive)等在线工具进行序列比对、疏水性和蛋白二、三级结构等相关的生物信息学分析,利用MEGA 4.1软件绘制PaPR10-1蛋白及其同源序列的系统进化树,并于在线网站Evolview上进行美化。
1.4 PaPR10-1基因原核表达载体的构建
以纯化质粒pMD19-T-PaPR10-1为模板,利用特异性引物PaPR10-1-BamHⅠ-F和PaPR10-1-HindⅢ-R(表1)扩增含有BamHⅠ和HindⅢ酶切位点且不含信号肽的PaPR10-1基因序列。PCR反应程序同1.2。回收特异性片段,利用限制性内切酶BamHⅠ和HindⅢ双酶切目的片段和pET-32a载体,纯化回收酶切产物后转入DH5α感受态细胞中,阳性克隆送测序。
1.5 重组蛋白的诱导表达及SDS-PAGE分析
将构建好的表达载体质粒转化至BL21(DE3)感受态细胞中,挑取单菌落于含100 μg/mL Amp的LB液体培养基中,于37℃、200 r/min 过夜振荡培养。对诱导重组蛋白表达的IPTG浓度、时间和温度等条件进行优化。浓度梯度为:0.2、0.4、0.6、0.8、1.0 mmol/L;时间梯度为:2、4、6、8、10 h;温度梯度为:20℃、25℃、30℃、37℃。样品处理及SDS-PAGE参见刘裕峰等[24]的方法。
1.6 重组蛋白的纯化和RNase活性测定
利用His标签蛋白纯化试剂盒对重组蛋白进行纯化,SDS-PAGE电泳检测纯化结果。提取云杉散斑壳菌总RNA。参考谢纯政等[25]的方法,稍作修改:取5份等量的云杉散斑壳菌总RNA,分别加入5 μL DEPC水、5 μL洗脱液、2.5 μL RNA酶清除剂 + 2.5 μL纯化PaPR10-1蛋白、5 μL纯化PaPR10-1蛋白、5 μL RNA酶清除剂,37℃下反应0.5 h,1%琼脂糖凝胶电泳检测云杉散斑壳菌RNA降解效果。
参考任晋宏等[26]方法,以酵母tRNA为底物,以提前加入氯化锂的样品为对照,每个处理3个重复。 酶活定义:在37℃、pH值6.0反应条件下,每分钟使A260吸收值变化1.0的酶量定义为一个活性单位U,通过考马斯亮蓝法检测纯蛋白的浓度,换算得到PaPR10-1的比活(U/ mg)。
2. 结果与分析
2.1 PaPR10-1基因全长cDNA克隆及序列分析
本研究以粗枝云杉cDNA为模板扩增PaPR10-1基因(GenBank号:2552489),电泳检测得到一条约500 bp的条带(图1)。序列分析结果显示,该片段长度为486 bp,PaPR10-1基因序列包含一个完整的开放阅读框(ORF),共编码161个氨基酸(图2)。该基因的核苷酸序列与北美云杉(Picea sitchensis (Bong.) Carr.) (GenBank号:ABK22402.1)的PR10序列相似性高达94%以上,表明PaPR10-1基因为PR10基因家族的一员。
2.2 氨基酸理化性质分析
蛋白理化性质分析结果显示:PaPR10-1蛋白的相对分子质量为17.65 kD,分子式为C786H1254N200O245S7;理论等电点为5.02;PaPR10-1肽链由20种氨基酸组成,其中酸性氨基酸(sp + Glu)共23个,碱性氨基酸(rg + Lys)共18个;由于该肽链只含1个His,推测其对金属离子的结合能力较弱。该蛋白不稳定指数为31.87,脂肪指数为89.63,总平均亲水系数为−0.234,推测PaPR10-1蛋白是一种稳定的亲水性蛋白。在线工具SignalP和TMHMM分析结果表明,PaPR10-1蛋白无信号肽和跨膜结构域。NetPhos预测PaPR10-1蛋白氨基酸序列具有12个潜在的磷酸化位点。此外,ScanProsite分析其功能位点,发现该蛋白存在5种可能的翻译后修饰位点,包括:5个N-肉豆蔻酰化原位点、4个络蛋白激酶Ⅱ磷酸化位点、1个蛋白激酶C磷酸化位点、1个N-糖基化位点和1个ATP_GTP_A( p环)位点。
2.3 亚细胞定位预测及疏水性分析
亚细胞定位分析结果表明,该蛋白定位于细胞质和线粒体中的可能性最大,属于胞内蛋白。在PaPR10-1蛋白的34 ~ 43区域、100 ~ 104区域及115 ~ 118区域具有较强的疏水性,其中疏水性最强的是41和42个氨基酸处,疏水性高达1.767 (图3)。
2.4 蛋白质二、三级结构预测分析
PaPR10-1蛋白的二级结构主要由4部分组成(图4:A),其中α-螺旋(Alpha helix)占比最高,为29.19%;其次为无规则卷曲(Random coil),占29.19%;延伸链(Extended strand)占21.12%;最少的为β-转角(Beta turn),占比9.32%。PaPR10-1蛋白三级结构预测结果显示(图4:B),该蛋白由一个PDB号为4bkd.1的结构为模板建立,4bkd.1属于主要花粉过敏原BET V 1-A( MAJOR POLLEN ALLERGEN BET V 1-A),序列相似性为0.38,范围为2 ~ 161 aa,氨基酸覆盖率达99%。
![]() 图 4 PaPR10-1蛋白二级结构预测与分析(A)以及蛋白三级结构预测(B)A:蓝色表示α-螺旋;紫色表示无规则卷曲;红色表示延伸链;绿色表示β-转角;横向数值表示氨基酸位置。Figure 4. Secondary structure prediction and analysis of PaPR10-1 protein (A) and tertiary structure prediction of (B)A: Blue indicates α-helix; purple represents random coil; red indicates extended strand; green indicates β-turn; lateral value indicates amino acid position.
图 4 PaPR10-1蛋白二级结构预测与分析(A)以及蛋白三级结构预测(B)A:蓝色表示α-螺旋;紫色表示无规则卷曲;红色表示延伸链;绿色表示β-转角;横向数值表示氨基酸位置。Figure 4. Secondary structure prediction and analysis of PaPR10-1 protein (A) and tertiary structure prediction of (B)A: Blue indicates α-helix; purple represents random coil; red indicates extended strand; green indicates β-turn; lateral value indicates amino acid position.2.5 蛋白序列保守性及同源性分析
利用NCBI的CDD (Conserved domain database)数据库分析发现,PaPR10-1蛋白具有glycine-rich loop 保守基序和Bet_v1-like保守疏水结构域,属于SRPBCC超家族。对粗枝云杉PaPR10-1蛋白序列及北美云杉、西部白松、海岸松(Pinus pinaster Aiton)、硬粒小麦(Triticum durum Desf.)、小麦(T. aestivum L.)、高粱的PR10蛋白序列进行同源性分析(图5),发现其序列较为保守,其中粗枝云杉PR10蛋白与北美云杉的序列一致性最高,达到了94%,与海岸松的序列一致性达80%,与西部白松的一致性为76.4%,与小麦和硬粒小麦的一致性同为40.91%,与高粱的一致性为39.87%。
![]() 图 5 PaPR10-1与6种植物PR10的多重序列比对AAL50007.1:西部白松;ADJ53040.1:海岸松;QEQ43328.1:硬粒小麦;ACG68733.1:小麦;AAW83210.1:高粱;ABK22402.1:北美云杉。箭头表示β-折叠,字母TT表示β-转角,波浪线表示α-螺旋。Figure 5. Multiple alignments of amino acid sequence of PaPR10-1 and six plant PR10sAAL50007.1: Pinus monticola Dougl.; ADJ53040.1: Pinus pinaster Aiton; QEQ43328.1: Triticum durum Desf.; ACG68733.1: Triticum aestivum L.; AAW83210.1: Sorghum Bicolor (L.) Moench; ABK22402.1: Picea sitchensis (Bong.) Carr. Arrows indicate β-pleated sheets, TT indicates β-turns, squiggles indicate α-helix.
图 5 PaPR10-1与6种植物PR10的多重序列比对AAL50007.1:西部白松;ADJ53040.1:海岸松;QEQ43328.1:硬粒小麦;ACG68733.1:小麦;AAW83210.1:高粱;ABK22402.1:北美云杉。箭头表示β-折叠,字母TT表示β-转角,波浪线表示α-螺旋。Figure 5. Multiple alignments of amino acid sequence of PaPR10-1 and six plant PR10sAAL50007.1: Pinus monticola Dougl.; ADJ53040.1: Pinus pinaster Aiton; QEQ43328.1: Triticum durum Desf.; ACG68733.1: Triticum aestivum L.; AAW83210.1: Sorghum Bicolor (L.) Moench; ABK22402.1: Picea sitchensis (Bong.) Carr. Arrows indicate β-pleated sheets, TT indicates β-turns, squiggles indicate α-helix.2.6 系统进化分析
为了解粗枝云杉PaPR10-1蛋白与其他植物的PR10之间的进化关系,本研究构建了PR10蛋白家族系统进化树。结果表明(图6),该进化树主要分为双子叶植物、裸子植物和单子叶植物、苔藓植物3大支,发现PR10家族广泛分布于植物界且在进化过程中高度分化。而裸子植物与单子叶的PR10聚为一支,暗示两者的PR10蛋白可能来源于同一祖先[27]。同一科属或同一物种不同亚型的PR10大多聚在一个小支上,说明PR10蛋白具有一定的低种内变异和高种间变异特性[28]。其中粗枝云杉与海岸松的PR10蛋白亲缘关系最近,而与双子叶植物和苔藓植物亲缘关系较远。
2.7 原核表达载体的构建及诱导条件优化
本研究将扩增得到的PaPR10-1 基因片段连接到pET-32a表达载体上,得到了与目的基因大小一致的条带(图7)。将测序成功的重组质粒利用IPTG诱导优化表达。诱导浓度筛选结果显示(图8: A),对照无融合蛋白表达,不同IPTG浓度诱导下均有目的蛋白出现且无明显差别,故确定IPTG终浓度0.2 mmol/L为最佳诱导浓度进行诱导时间实验。不同诱导时间下均能诱导出目的蛋白(图8: B),但随着诱导时间的增加,目的蛋白的表达量逐渐减少,因此确定1 h为最适诱导时间并进行诱导温度实验。不同温度条件下蛋白诱导实验结果表明(图8: C),各温度下均有目的蛋白出现,而在30℃下蛋白表达最为丰富,因此确定最佳诱导温度为30℃。目的蛋白在上清液和沉淀中均存在,说明该蛋白以包涵体和溶解性蛋白两种形式共存。
![]() 图 8 pET-32a-PaPR10-1-BL21( DE3)诱导条件的优化M:蛋白质分子量标准。A:最佳IPTG诱导浓度的筛选。1:不加IPTG诱导的pET-32a空载体;2:0.5 mmol /L 的 IPTG 诱导pET-32a空载体;3 ~ 7:IPTG诱导浓度分别为 0.2、0.4、0.6、0.8、1.0 mmol /L。B:最佳诱导时间的筛选。1:0.2 mmol /L IPTG 诱导pET-32a 空载体 4 h;2:不加IPTG诱导的pET-32a空载体;3:不加IPTG诱导的菌液; 4 ~ 8:0.2 mmol /L的IPTG分别诱导 1、2、3、4、5 h。C:最佳诱导温度的筛选。1:诱导全菌液;2 ~ 5:分别以 20℃、25℃、30℃和 37℃诱导上清中的蛋白表达;6 ~ 9:分别以20℃、25℃、30℃和 37℃诱导沉淀中的蛋白表达。Figure 8. Optimization of induction conditions of pET-32a-PaPR10-1-BL21(DE3)M: Protein marker. A: Screening of optimal IPTG-induced concentration. 1: pET-32a empty vector without IPTG; 2: IPTG (0.5 mmol/L)-induced pET-32a empty vector; 3–7: pET-32a-PICHI-BL21(DE3) was induced by 0.2, 0.4, 0.6, 0.8, 1.0 mmol/L IPTG. B: Screening of optimal induction time. 1: IPTG (0.2 mmol/L)-induced pET-32a empty vector; 2: pET-32a empty vector without IPTG; 3: pET-32a-PICHI-BL21(DE3) without IPTG; 4–8: pET-32a-PICHI-BL21(DE3) was induced by IPTG (0.2 mmol/L) in 1, 2, 3, 4, 5 h. C: Screening of optimal induction temperature. 1: pET-32a-PICHI-BL21(DE3) was induced at 37℃; 2–5: Supernatant of pET-32a-PICHI-BL21(DE3) was induced at 20℃, 25℃, 30℃, and 37℃; 6–9: Precipitation of pET-32a-PICHI-BL21(DE3) was induced at 20℃, 25℃, 30℃, and 37℃.
图 8 pET-32a-PaPR10-1-BL21( DE3)诱导条件的优化M:蛋白质分子量标准。A:最佳IPTG诱导浓度的筛选。1:不加IPTG诱导的pET-32a空载体;2:0.5 mmol /L 的 IPTG 诱导pET-32a空载体;3 ~ 7:IPTG诱导浓度分别为 0.2、0.4、0.6、0.8、1.0 mmol /L。B:最佳诱导时间的筛选。1:0.2 mmol /L IPTG 诱导pET-32a 空载体 4 h;2:不加IPTG诱导的pET-32a空载体;3:不加IPTG诱导的菌液; 4 ~ 8:0.2 mmol /L的IPTG分别诱导 1、2、3、4、5 h。C:最佳诱导温度的筛选。1:诱导全菌液;2 ~ 5:分别以 20℃、25℃、30℃和 37℃诱导上清中的蛋白表达;6 ~ 9:分别以20℃、25℃、30℃和 37℃诱导沉淀中的蛋白表达。Figure 8. Optimization of induction conditions of pET-32a-PaPR10-1-BL21(DE3)M: Protein marker. A: Screening of optimal IPTG-induced concentration. 1: pET-32a empty vector without IPTG; 2: IPTG (0.5 mmol/L)-induced pET-32a empty vector; 3–7: pET-32a-PICHI-BL21(DE3) was induced by 0.2, 0.4, 0.6, 0.8, 1.0 mmol/L IPTG. B: Screening of optimal induction time. 1: IPTG (0.2 mmol/L)-induced pET-32a empty vector; 2: pET-32a empty vector without IPTG; 3: pET-32a-PICHI-BL21(DE3) without IPTG; 4–8: pET-32a-PICHI-BL21(DE3) was induced by IPTG (0.2 mmol/L) in 1, 2, 3, 4, 5 h. C: Screening of optimal induction temperature. 1: pET-32a-PICHI-BL21(DE3) was induced at 37℃; 2–5: Supernatant of pET-32a-PICHI-BL21(DE3) was induced at 20℃, 25℃, 30℃, and 37℃; 6–9: Precipitation of pET-32a-PICHI-BL21(DE3) was induced at 20℃, 25℃, 30℃, and 37℃.2.8 PaPR10-1蛋白纯化及RNase活性检测
根据His标签蛋白纯化试剂盒的说明书对PaPR10-1蛋白进行纯化(图9:A),对纯化后的PaPR10-1蛋白的RNase活性进行分析 (图9:B),发现DEPC水、洗脱液、RNA酶清除剂等对底物降解作用不明显,纯化蛋白对底物降解作用明显,而纯化蛋白加入核酸酶抑制剂后抑制了底物的降解,表明纯化后的PaPR10-1蛋白具有体外RNase活性。采用1.6所述方法,测得外源表达的PaPR10-1对酵母tRNA的水解活性(核酸酶活性)为26.6 U/mg。
![]() 图 9 PaPR10-1蛋白纯化(A)及RNase活性检测(B)M:蛋白质分子量标准;a:纯化结果。 1:DEPC水;2:洗脱液;3:RNA酶清除剂 + PaPR10-1蛋白;4:PaPR10-1蛋白;5:RNA酶清除剂。Figure 9. Purification of PaPR10-1 protein (A) and detection of ribonuclease activity (B)M: Protein marker; a: Purification result. B: 1: DEPC water; 2: Eluent; 3: RNase scavenger + PaPR10-1 protein; 4: PaPR10-1 protein; 5: RNase scavenger.
图 9 PaPR10-1蛋白纯化(A)及RNase活性检测(B)M:蛋白质分子量标准;a:纯化结果。 1:DEPC水;2:洗脱液;3:RNA酶清除剂 + PaPR10-1蛋白;4:PaPR10-1蛋白;5:RNA酶清除剂。Figure 9. Purification of PaPR10-1 protein (A) and detection of ribonuclease activity (B)M: Protein marker; a: Purification result. B: 1: DEPC water; 2: Eluent; 3: RNase scavenger + PaPR10-1 protein; 4: PaPR10-1 protein; 5: RNase scavenger.3. 讨论
本研究首次克隆得到一个响应云杉落针病菌侵染的粗枝云杉PaPR10-1基因,该基因ORF全长486 bp,编码161个氨基酸序列,序列高度保守,无信号肽、不含跨膜区且定位于细胞内,与PR10基因的基本特征相符。对PaPR10-1蛋白进行保守结构域分析可知,该蛋白存在一个完整的Bet_v1-like保守疏水结构域,在该结构域中,包含一个“P-Loop”环和3个保守氨基酸(Lys55、Glu95和Glu150)。研究发现,PR10蛋白中的“P-Loop”结构域包含1个ATP/GTP结合位点的磷酸环,具有三磷酸核苷酶(NTPase)活性,可破坏核苷酸的磷酸基团[29, 30],可能与RNase活性有关。目前,多种具有“P-Loop”环的植物PR10蛋白的RNase活性被证实,包括岷江百合(Lilium regale Wilson)[31]、小果野蕉(Musa acuminata Colla)[32]和蒙古黄芪(Astragalus mongholicus Bunge.)[33]等。然而,该环的缺失可能会导致PR10蛋白丧失RNase活性,如马铃薯(Solanum tuberosum L.)[34]和苜蓿( Medicago sativa L.)[35]。此外,Bet_v1-like结构域中还包括4个重要的保守氨基酸(Lys54、Glu96、Tyr148和Glu150)[25],这些氨基酸也可能影响RNase活性,如花生(Arachis hypogaea L.)AhPR10蛋白中的Lys55的缺失导致RNase失活[36],豆薯(Pachyrhizus erosus (L.) Urb.)SPE16蛋白中的Glu95A、Glu147A和Tyr149突变明显降低RNase活性[37]。
Biesiadka等[38]发现黄羽扇豆(Lupinus luteus L.)PR-10蛋白的晶体结构中,存在一个大型的“Y”型空腔,该空腔被7股β折叠包裹着,能结合细胞分裂素等广泛疏水配体,进而参与植物的代谢调控和生长发育等重要生理进程[39],而“P-loop”基序在β2和β3之间。本研究中,生物信息学分析发现PaPR10-1也具有7股β折叠,且β2和β3之间存在保守的“P-loop”基序,但是否形成了“Y”型空腔并发挥相应的生物学功能仍需进一步探索。
高效的蛋白质表达系统对于蛋白质的结构和功能的深入研究十分重要[40]。外源蛋白质表达常采用大肠杆菌系统,而通过改变诱导条件来提高重组蛋白的可溶性表达量是较为方便快捷且常用的手段。为确定PaPR10-1重组蛋白诱导表达的最佳条件,本研究选取5个浓度梯度IPTG对其进行诱导培养,诱导结果差异不明显,因此最终选用0.2 mmol /L IPTG对PaPR10-1蛋白进行诱导。本研究观察了1 ~ 4 h的诱导时间对重组蛋白的影响,结果显示1 h诱导表达量最高。此外,对PaPR10-1蛋白进行多个温度对比诱导时发现,在30℃和37℃时表达量都较为丰富,这与赵乐等[41]对丹参(Salvia miltiorrhiza Bunge)SmPR-10-1蛋白最佳温度诱导条件的实验结果相似,但有研究表明37℃条件下易导致重组蛋白积累形成包涵体,而25℃ ~ 30℃易增加重组蛋白的活性和可溶性[42],因此本研究选择30℃作为PaPR10-1蛋白诱导的最佳温度。然而本研究中的蛋白电泳分析结果显示,原核表达的蛋白分子量比PaPR10-1蛋白正常大小略大,这可能与pET-32a表达载体本身所带的His-Tag标签序列(约15 kD)有关[43]。
本研究在响应云杉落针病侵染的粗枝云杉转录组数据中获得一个上调表达的基因PaPR10-1,结合分子克隆方法获得该基因全长cDNA序列,对该基因进行了一系列生物信息学分析和进化树构建,并在优化条件下体外表达和纯化了PaPR10-1蛋白,验证了其核糖核酸酶活性,但该蛋白的抗菌活性及其参与的生物学功能还有待进一步研究。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。2 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
表 1 青藏高原东缘领春木和珙桐群落中的珍稀濒危植物名录
Table 1 Rare and endangered species in the plant community associated with Euptelea pleiosperma and Davidia involucrata along the east edge of the Qinghai-Tibet Plateau
中文名
Species拉丁名
Latin name科名
FamilyIUCN 红色名录
Red list红皮书
Red data book国家保护植物
National protected大叶柯 Lithocarpus megalophyllus Rehder & E. H. Wilson 壳斗科 近危 是 - - 珙桐 Davidia involucrata Baill. 蓝果树科 - - 是 Ⅰ级 红豆杉 Taxus wallichiana var. chinensis (Pilg.) Florin 红豆杉科 易危 是 - Ⅰ级 胡桃楸 Juglans mandshurica Maxim. 胡桃科 - - 是 - 华榛 Corylus chinensis Franch. 桦木科 - - 是 - 黄杉 Pseudotsuga sinensis Dode 松科 易危 - 是 Ⅱ级 黄檀 Dalbergia hupeana Hance 豆科 近危 是 - - 金钱松 Pseudolarix amabilis (J. Nelson) Rehder 松科 易危 是 是 Ⅱ级 金沙槭 Acer paxii Franch. 无患子科 近危 是 - - 阔叶槭 Acer amplum Rehder 无患子科 近危 是 - - 连香树 Cercidiphyllum japonicum Siebold & Zucc. 连香树科 - - 是 Ⅱ级 领春木 Euptelea pleiosperma Hook. f. & Thomson 领春木科 - - 是 - 楠木 Phoebe zhennan S. K. Lee & F. N. Wei 樟科 易危 是 是 Ⅱ级 润楠 Machilus nanmu (Oliv.) Hemsl. 樟科 濒危 是 - Ⅱ级 山核桃 Carya cathayensis Sarg. 胡桃科 易危 是 - - 山柳 Salix pseudotangii C. Wang & C. Y. Yu 杨柳科 易危 是 - - 山茱萸 Cornus officinalis Siebold & Zucc. 山茱萸科 近危 是 - - 水青树 Tetracentron sinense Oliv. 昆栏树科 - - 是 Ⅱ级 云南旌节花 Stachyurus yunnanensis Franch. 旌节花科 易危 是 - - 长伞梗荚蒾 Viburnum longiradiatum P. S. Hsu & S. W. Fan 五福花科 近危 是 - - 紫果冷杉 Abies recurvata Mast. 松科 易危 是 - - 注:IUCN,世界自然保护联盟(International Union for Conservation of Nature)受威胁物种红色名录(https://www.iucnredlist.org/);红色名录,《中国生物多样性红色名录-高等植物卷》;红皮书,《中国植物红皮书》;国家保护,2021版《国家重点保护野生植物名录》。 Notes: IUCN, Red List of Threatened Species Released by International Union for Conservation of Nature (https://www.iucnredlist.org/); Red list, China’s Red List of Biodiversity-Higher Plants; Red data book, China Red Data Book of Plants; National protected, List of National Key Protected Wild Plants (2021 version). 表 2 环境因子与青藏高原东缘珍稀濒危植物群落β多样性的相关性及其对群落构建的贡献率
Table 2 Correlations between environmental factors and β-diversity index and their contribution rate to rare and endangered plant community assembly along the eastern margin of the Qinghai-Tibet Plateau
环境因子
Environmental factors相关性
Correlation贡献率
Contribution rater P R2 P 经度 −0.0007 0.9557 0.0144 0.0960 纬度 0.0223 0.0056 0.0471 0.0016 海拔 0.0332 0.0088 0.0274 0.0207 年均温 −0.0079 0.7660 0.0207 0.0541 最冷季均温 −0.0068 0.7766 0.0185 0.0676 最暖季降水 −0.0144 0.1018 0.0077 0.1935 最冷季降水 0.0223 0.0853 0.0345 0.0077 土壤有机质 −0.0036 0.7073 0.0004 0.7866 土壤 0.0230 0.0173 0.0944 0.0001 土壤硝态氮 0.0088 0.3784 0.0609 0.0009 土壤铵态氮 0.0181 0.0086 0.0725 0.0003 土壤有效磷 −0.0029 0.7538 0.0048 0.3326 -
[1] Whittaker RH. Vegetation of the Siskiyou Mountains,Oregon and California[J]. Ecol Monogr,1960,30(3):279−338. doi: 10.2307/1943563
[2] Soininen J,Lennon JJ,Hillebrand H. A multivariate analysis of beta diversity across organisms and environments[J]. Ecology,2007,88(11):2830−2838. doi: 10.1890/06-1730.1
[3] Qian H,Shimono A. Effects of geographic distance and climatic dissimilarity on species turnover in alpine meadow communities across a broad spatial extent on the Tibetan Plateau[J]. Plant Ecol,2012,213(8):1357−1364. doi: 10.1007/s11258-012-0095-4
[4] He JK,Lin HX,Wang RX,Dai C,Yu HY,et al. Joint effects of environmental filtering and dispersal limitation on the species assemblage of the Tibetan Plateau[J]. J Biogeogr,2022,49(4):640−653. doi: 10.1111/jbi.14328
[5] Hubbell SP. The Unified Neutral Theory of Biodiversity and Biogeography[M]. Princeton:Princeton University Press,2001:392.
[6] Gilbert B,Lechowicz MJ. Neutrality,niches,and dispersal in a temperate forest understory[J]. Proc Natl Acad Sci USA,2004,101(20):7651−7656. doi: 10.1073/pnas.0400814101
[7] 牛克昌,刘怿宁,沈泽昊,何芳良,方精云. 群落构建的中性理论和生态位理论[J]. 生物多样性,2009,17(6):579−593. doi: 10.3724/SP.J.1003.2009.09142 Niu KC,Liu YN,Shen ZH,He FL,Fang JY. Community assembly:the relative importance of neutral theory and niche theory[J]. Biodiversity Science,2009,17(6):579−593. doi: 10.3724/SP.J.1003.2009.09142
[8] Liu YN,Tang ZY,Fang JY. Contribution of environmental filtering and dispersal limitation to species turnover of temperate deciduous broad-leaved forests in China[J]. Appl Veg Sci,2015,18(1):34−42. doi: 10.1111/avsc.12101
[9] Page NV,Shanker K. Environment and dispersal influence changes in species composition at different scales in woody plants of the Western Ghats,India[J]. J Veg Sci,2018,29(1):74−83. doi: 10.1111/jvs.12586
[10] Condit R,Pitman N,Leigh Jr EG,Chave J,Terborgh J,et al. Beta-diversity in tropical forest trees[J]. Science,2002,295(5555):666−669. doi: 10.1126/science.1066854
[11] Nekola JC,White PS. The distance decay of similarity in biogeography and ecology[J]. J Biogeog,1999,26(4):867−878. doi: 10.1046/j.1365-2699.1999.00305.x
[12] Martín-Devasa R,Jiménez-Valverde A,Leprieur F,Baselga A,Gómez-Rodríguez C. Dispersal limitation shapes distance-decay patterns of European spiders at the continental scale[J]. Global Ecol Biogeogr,2024,33(4):e13810. doi: 10.1111/geb.13810
[13] Gravel D,Canham CD,Beaudet M,Messier C. Reconciling niche and neutrality:the continuum hypothesis[J]. Ecol Lett,2006,9(4):399−409. doi: 10.1111/j.1461-0248.2006.00884.x
[14] 曲梦君,努尔依拉·阿巴拜克,邹旭阁,赵航,朱威霖,等. 地理距离和环境因子对阿拉善戈壁植物群落β多样性的影响[J]. 生物多样性,2022,30(11):22029. doi: 10.17520/biods.2022029 Qu MJ,Nueryila·Ababaike ,Zou XG,Zhao H,Zhu WL,et al. Influence of geographic distance and environmental factors on beta diversity of plants in the Alxa gobi region in northern China[J]. Biodiversity Science,2022,30(11):22029. doi: 10.17520/biods.2022029
[15] 霍兵兵,孙哲明,欧文慧,毛鸿志,胡傲,等. 环境筛选和扩散限制对长江流域湖北段湿地植物群落构建的共同影响[J]. 生态学报,2023,43(5):1804−1811. Huo BB,Sun ZM,Ou WH,Mao HZ,Hu A,et al. Environmental filtering and dispersal limitation jointly affect wetland plant community assembly in Hubei section of the Yangtze River Basin[J]. Acta Ecologica Sinica,2023,43(5):1804−1811.
[16] Kraft NJB,Comita LS,Chase JM,Sanders NJ,Swenson NG,et al. Disentangling the drivers of β diversity along latitudinal and elevational gradients[J]. Science,2011,333(6050):1755−1758. doi: 10.1126/science.1208584
[17] Sun H,Niu Y,Chen YS,Song B,Liu CQ,et al. Survival and reproduction of plant species in the Qinghai-Tibet Plateau[J]. J Syst Evol,2014,52(3):378−396. doi: 10.1111/jse.12092
[18] 王俊伟,陈永豪,拉琼. 西藏特有种子植物多样性、分布格局及区系特征[J]. 植物科学学报,2023,41(5):594−603. Wang JW,Chen YH,La Q. Diversity,distribution patterns,and floristic characteristics of seed plants endemic to Tibet,China[J]. Plant Science Journal,2023,41(5):594−603.
[19] Wang X,Zhu JL,Peng ST,Zheng TL,Qi ZY,et al. Patterns of grassland community composition and structure along an elevational gradient on the Qinghai-Tibet Plateau[J]. J Plant Ecol,2022,15(4):808−817. doi: 10.1093/jpe/rtab119
[20] 王健铭,曲梦君,王寅,冯益明,吴波,等. 青藏高原北部戈壁植物群落物种、功能与系统发育β多样性分布格局及其影响因素[J]. 生物多样性,2022,30(6):21503. doi: 10.17520/biods.2021503 Wang JM,Qu MJ,Wang Y,Feng YM,Wu B,et al. The drivers of plant taxonomic,functional,and phylogenetic β-diversity in the Gobi desert of northern Qinghai-Tibet Plateau[J]. Biodiversity Science,2022,30(6):21503. doi: 10.17520/biods.2021503
[21] 杨胜娴,杨清,李晓东,巢欣,刘惠秋,等. 确定性过程主导高原典型河流浮游植物地理分布格局和群落构建[J]. 生物多样性,2023,31(7):23092. doi: 10.17520/biods.2023092 Yang SX,Yang Q,Li XD,Chao X,Liu HQ,et al. Deterministic processes dominate the geographic distribution pattern and community assembly of phytoplankton in typical plateau rivers[J]. Biodiversity Science,2023,31(7):23092. doi: 10.17520/biods.2023092
[22] Wen L,Zhao KX,Sun HY,Feng G,Sun Q,et al. Drivers of desert plant beta diversity on the Qinghai-Tibet Plateau[J]. Ecol Evol,2024,14(2):e10993. doi: 10.1002/ece3.10993
[23] 赵济. 中国自然地理[M]. 3版. 北京:高等教育出版社,1995:306−321. [24] Xie D,Liu B,Zhao LN,Pandey TR,Liu HY,et al. Diversity of higher plants in China[J]. J Syst Evol,2021,59(5):1111−1123. doi: 10.1111/jse.12758
[25] Abbas S,Nichol JE,Zhang JL,Fischer GA. The accumulation of species and recovery of species composition along a 70 year succession in a tropical secondary forest[J]. Ecol Indic,2019,106:105524. doi: 10.1016/j.ecolind.2019.105524
[26] Borcard D,Legendre P,Drapeau P. Partialling out the spatial component of ecological variation[J]. Ecology,1992,73(3):1045−1055. doi: 10.2307/1940179
[27] Legendre P,Mi XC,Ren HB,Ma KP,Yu MJ,et al. Partitioning beta diversity in a subtropical broad-leaved forest of China[J]. Ecology,2009,90(3):663−674. doi: 10.1890/07-1880.1
[28] 柴永福,岳明. 植物群落构建机制研究进展[J]. 生态学报,2016,36(15):4557−4572. Chai YF,Yue M. Research advances in plant community assembly mechanisms[J]. Acta Ecologica Sinica,2016,36(15):4557−4572.
[29] Saito VS,Perkins DM,Kratina P. A metabolic perspective of stochastic community assembly[J]. Trends Ecol Evol,2021,36(4):280−283. doi: 10.1016/j.tree.2021.01.003
[30] 索南邓登,陈卫东,林鹏程. 青藏高原野生濒危药用植物掌裂兰的生境及濒危因素分析[J]. 广西植物,2019,39(9):1166−1179. doi: 10.11931/guihaia.gxzw201903013 Suonan DD,Chen WD,Lin PC. Habitat and factors of endangerment of wild and endangered medicinal herb Dactylorhiza hatagirea in Qinghai-Tibet Plateau[J]. Guihaia,2019,39(9):1166−1179. doi: 10.11931/guihaia.gxzw201903013
[31] Maestre FT. On the importance of patch attributes,environmental factors and past human impacts as determinants of perennial plant species richness and diversity in Mediterranean semiarid steppes[J]. Divers Distrib,2004,10(1):21−29. doi: 10.1111/j.1472-4642.2004.00057.x
[32] 李艳辉,兰天元,王月,于洋,赵常明,等. 神农架植物物种空间周转的驱动因素[J]. 生物多样性,2022,30(4):21377. doi: 10.17520/biods.2021377 Li YH,Lan TY,Wang Y,Yu Y,Zhao CM,et al. Driving factors of spatial turnover of plant species in Shennongjia[J]. Biodiversity Science,2022,30(4):21377. doi: 10.17520/biods.2021377
[33] 李林,魏识广,练据愉,曹洪麟. 亚热带不同纬度植物群落物种多样性分布规律[J]. 生态学报,2020,40(4):1249−1257. Li L,Wei SG,Lian JY,Cao HL. Distributional regularity of species diversity in plant community at different latitudes in subtropics[J]. Acta Ecologica Sinica,2020,40(4):1249−1257.
[34] Gibson N,Prober S,Meissner R,van Leeuwen S. Implications of high species turnover on the south-western Australian sandplains[J]. PLoS One,2017,12(2):e0172977. doi: 10.1371/journal.pone.0172977
[35] 张兴旺,操景景,龚玉霞,张小平. 珍稀植物青檀种子休眠与萌发的研究[J]. 生物学杂志,2007,24(1):28−31. Zhang XW,Cao JJ,Gong YX,Zhang XP. Seed dormancy and germination in rare plant Pterocektis tartarinowii Maxim[J]. Journal of Biology,2007,24(1):28−31.
[36] 杨旭,杨志玲,王洁,檀国印. 濒危植物凹叶厚朴种实特性[J]. 生态学杂志,2012,31(5):1077−1081. Yang X,Yang ZL,Wang J,Tan GY. Fruit and seed traits of endangered species Magnolia officinalis subsp. biloba[J]. Chinese Journal of Ecology,2012,31(5):1077−1081.
[37] 王丹,王孝安,郭华,王世雄,郑维娜,等. 环境和扩散对草地群落构建的影响[J]. 生态学报,2013,33(14):4409−4415. doi: 10.5846/stxb201204180559 Wang D,Wang XA,Guo H,Wang SX,Zheng WN,et al. Effect of species dispersal and environmental factors on species assemblages in grassland communities[J]. Acta Ecologica Sinica,2013,33(14):4409−4415. doi: 10.5846/stxb201204180559
-
其他相关附件
-
DOCX格式
张东附表1~2 点击下载(30KB)
-



 下载:
下载: