Metabolomic analysis of the effects of MeJA on antioxidant compound synthesis in Lavandula angustifolia Mill. cells
-
摘要:
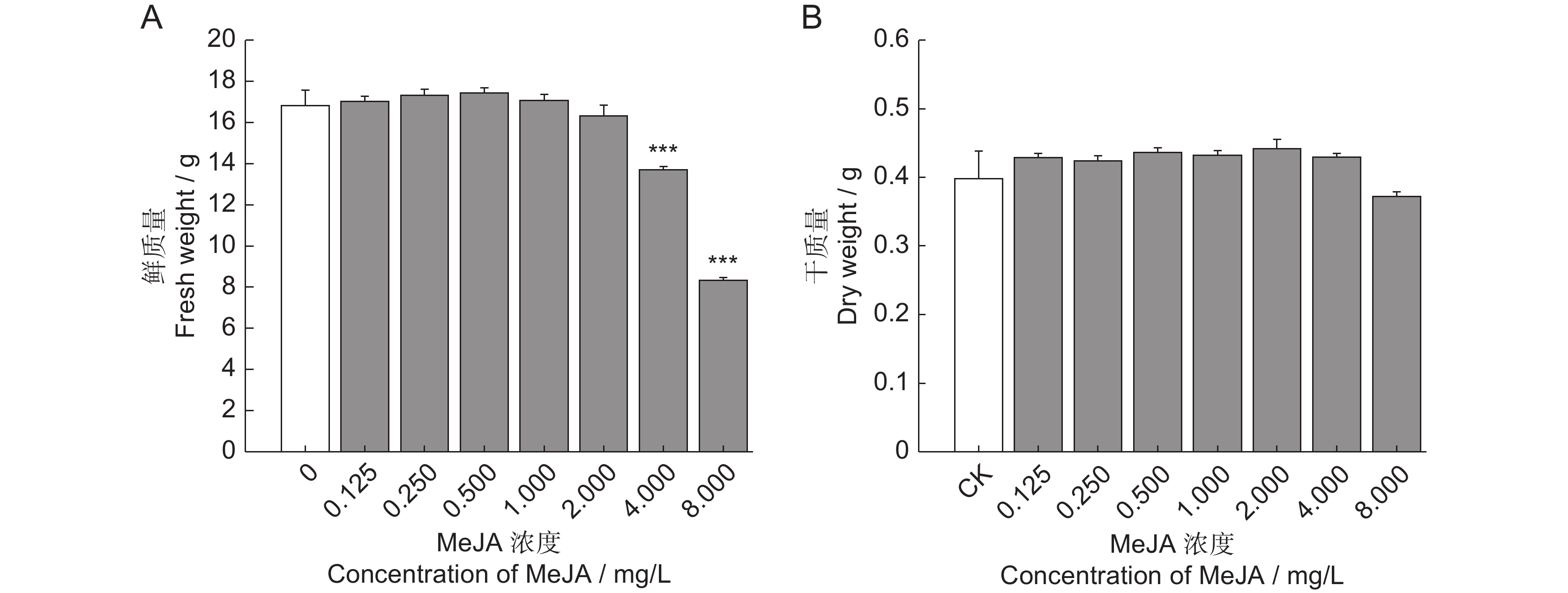
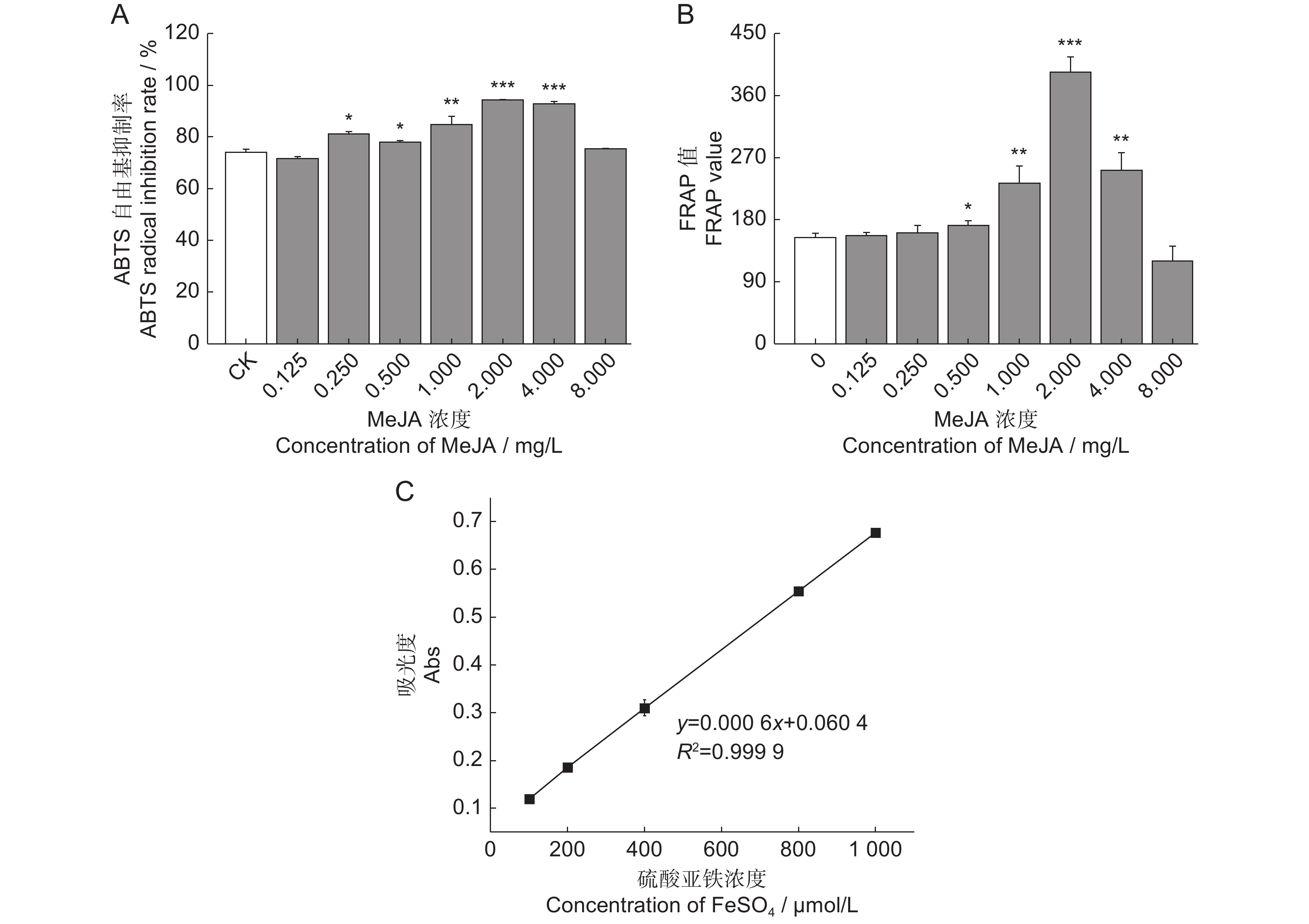
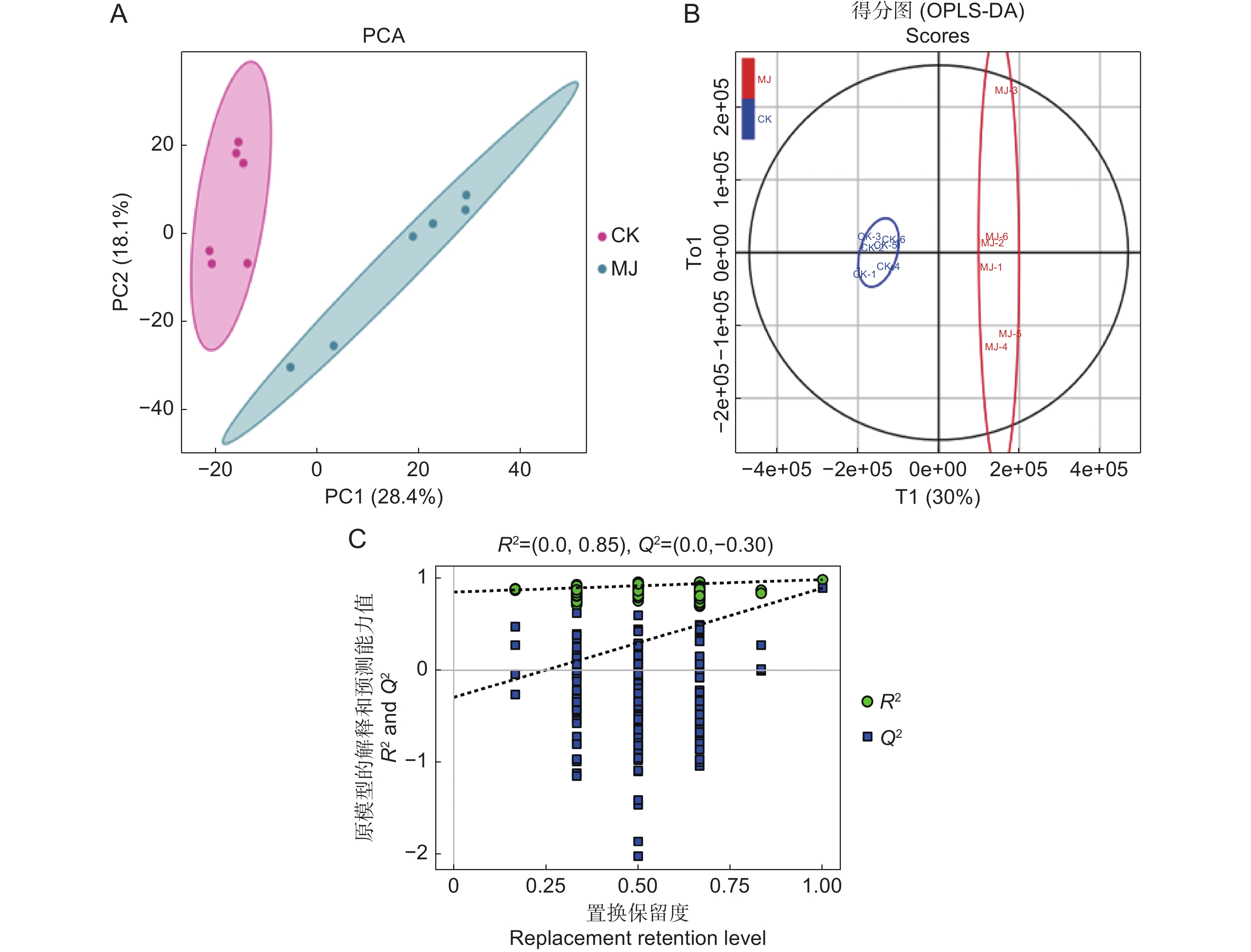
为了探究茉莉酸甲酯(MeJA)对薰衣草(Lavandula angustifolia Mill.)叶片悬浮细胞中抗氧化活性物质合成的影响,采用不同浓度的MeJA处理悬浮细胞,筛选出能够促进抗氧化物质合成的最佳条件,并通过非靶向代谢组学技术分析了MeJA对细胞代谢物合成的作用。结果显示:8 mg/L的MeJA显著抑制了薰衣草叶片悬浮细胞的生长和抗氧化活性;而2 mg/L的MeJA显著促进了抗氧化活性物的合成;与对照组相比,ABTS自由基清除率和FRAP值分别提高了1.30和2.56倍,总酚、总黄酮和总三萜含量分别增加了1.45、1.59和1.24倍。利用超高效液相色谱-四极杆飞行时间质谱(UHPLC-Q-TOF-MS)技术,对未处理组(CK)和2 mg/L MeJA处理组(MJ)进行代谢组学分析,共鉴定出1 403种代谢物,其中151种在两组间有显著差异。差异代谢物涉及177条代谢通路,主要富集于代谢信号转导通路和ABC转运蛋白通路。因此,MeJA可能主要通过影响代谢信号转导和调节ABC转运蛋白的功能影响薰衣草悬浮细胞中抗氧化活性物质的合成。
Abstract:The effects of methyl jasmonate (MeJA) on the synthesis of antioxidant compounds in Lavandula angustifolia Mill. leaf suspension cells were investigated by introducing varying concentrations of MeJA into the culture medium. The optimal conditions for enhancing antioxidant synthesis were determined, and non-targeted metabolomics was employed to analyze the impact of MeJA on metabolite production. Results demonstrated that 8 mg/L MeJA inhibited both cell growth and antioxidant activity, whereas 2 mg/L MeJA significantly promoted the biosynthesis of antioxidant compounds. Compared with the untreated group, cells treated with 2 mg/L MeJA exhibited a 1.30-fold increase in ABTS radical scavenging activity and a 2.56-fold increase in ferric reducing antioxidant power (FRAP). Additionally, total phenol, flavonoid, and triterpene contents were elevated by 1.45-fold, 1.59-fold, and 1.24-fold, respectively. Metabolomic profiling using UHPLC-Q-TOF-MS identified 1 403 metabolites, with 151 showing significant differences between untreated and MeJA-treated cells. These differential metabolites were associated with 177 metabolic pathways, predominantly enriched in metabolic pathways and ABC transporter pathways. These findings suggest that MeJA modulates antioxidant biosynthesis in L. angustifolia suspension cells primarily by influencing metabolic signal transduction and regulating ABC transporter activity.
-
Keywords:
- Lavandula angustifolia /
- Suspension culture /
- MeJA /
- Antioxidant /
- Metabolomics
-
莲(Nelumbo)是莲科莲属多年生水生植物,全世界莲属仅有亚洲莲(N. nucifera Gaertn.)和美洲黄莲(N. lutea Pers.)两个种[1]。莲集食用、观赏和药用价值于一身,是我国卫生部首批公布的既是食品又是药品的两用物种[2]。莲花花型多样且观赏性强;莲叶可食用,有益于人体健康;莲子和莲藕可鲜食或加工成农副产品进行销售。莲的各个部分均可作中药成分。如:莲子心富含黄酮和生物碱,具有清心安神、抗癌等药用功效;莲叶具有降血脂、减肥作用,常作为降脂中药的辅药;莲花粉营养价值高,能够降低血压血脂、美容养颜[3]。黄酮类化合物作为莲的重要药理活性成分之一,具有重要应用价值和广阔的开发前景。本文对莲黄酮类化合物的主要种类、提取分离技术与鉴定方法、功能特性与开发利用进行了系统总结,旨在为莲黄酮类化合物的研究、开发和利用提供参考。
1. 莲黄酮类化合物的种类
黄酮类化合物是自然界植物中常见的次生代谢物,以C6-C3-C6碳链为基本骨架,通过两个苯环(环A和B)和一个杂环(环C)组成其母核结构(图1),母核可以通过羟化、甲基化、酰化和糖基化等修饰方式来形成不同类型的黄酮类化合物。其中,糖基化黄酮类化合物最为常见,其A环可以与阿拉伯糖基、葡萄糖基、鼠李糖基、芸香糖基、木糖基等糖类结合成苷类,以黄酮苷形式来行使功能[4]。植物中黄酮类化合物的生物合成复杂且保守,其起始于苯丙氨酸,经过一系列酶基因的作用,转化为不同类型的黄酮类化合物,具有不同的生物活性[5]。此外,苯环上取代基的连接方式、位置、数目不同及水解作用的强弱也会导致黄酮类化合物药理活性的差异。
目前,莲中已鉴定出133种黄酮类化合物,其中大部分以槲皮素为基本结构形成,少数通过山奈酚和杨梅素等其他类型的母核形成[6]。莲的各个部位均有黄酮类化合物,但其含量和种类存在一定差异,其中,芦丁、槲皮素、金丝桃苷等17种黄酮类化合物含量较为丰富(表1),其结构如图2所示。莲子心中芦丁、金丝桃苷、夏佛塔苷等黄酮类次生代谢产物较为丰富[7];莲叶中主要为槲皮素、异槲皮素等黄酮醇类[8],莲花花瓣和雄蕊中黄酮类化合物含量较低,主要为山奈酚、异鼠李素等[9, 10]。
表 1 莲中常见的黄酮类化合物Table 1. Common flavonoids in Nelumbo序号
No.名称
Name分子式
Molecular formula部位
Part参考文献
References1 木犀草素-7-O-芸香糖苷 C27H30O15 莲子心 [11] 2 槲皮素-3-O-芸香糖苷 C27H30O16 莲子心 [11] 3 异鼠李素-3-O-葡萄糖苷 C22H22O12 莲叶 [12] 4 牡荆素 C21H20O10 莲叶、莲子心 [13] 5 芹菜素 C15H10O5 莲子心 [14] 6 夏佛塔苷 C26H28O14 莲花、莲子心 [4] 7 异夏佛塔苷 C26H28O14 莲花、莲子心 [4] 8 芦丁 C27H30O16 莲子心 [15] 9 金丝桃苷 C21H20O12 莲子心 [11] 10 鼠李素 C16H12O7 莲叶、莲子心 [4] 11 异鼠李素 C16H12O7 莲花、莲花粉 [10] 12 香叶木素 C16H12O6 莲叶、莲子心 [6] 13 山奈酚 C15H10O6 莲花、莲花粉 [10] 14 杨梅素 C15H10O8 莲叶、莲花粉 [12] 15 槲皮素 C15H10O7 莲叶、莲子心、莲花、莲梗 [16] 16 槲皮苷 C21H20O11 莲叶、莲花 [11] 17 异槲皮素 C21H18O13 莲叶、莲花 [4] 2. 莲黄酮类化合物的提取与分离
黄酮类化合物的提取与分离是了解其功能的前提,不同的提取方法对黄酮的提取率和纯度影响不同。植物中黄酮类化合物的提取与分离技术主要是基于其极性、分子量、吸附性、特殊结构与金属盐络合能力等特性而开发。
2.1 有机溶剂提取法
有机溶剂提取法是将黄酮类化合物溶于有机溶液中,再进行萃取或吸附,从而实现分离提取,主要适用于易溶于乙醇、甲醇、乙酸乙酯、乙醚等有机溶剂的黄酮类化合物,如黄酮苷类或极性较大的苷元等。Chen等[17]从溶剂、料液比、提取时间和提取温度等4个方面对莲叶黄酮的提取工艺进行优化,发现溶剂是影响产量的最重要的因素,认为最佳提取条件如下:溶剂为70%甲醇,料液比为30∶1,提取温度为4 ℃,提取时间为36 h。有机溶剂提取法是传统且成熟的黄酮提取技术,成本低、操作简便,但耗时长、效率低,且提取后溶剂需进行处理,因而无法大面积推广使用。后期可对此技术进行改进或与其他技术相结合,以获得更好的提取效果。
2.2 超声波辅助提取法
超声波辅助提取法主要利用超声波破坏植物细胞壁,无需对样品进行加热处理,从而降低温度对提取成分的影响,该方法在莲不同组织总黄酮的提取中均有应用。郭兴峰[18]以干燥的莲花瓣为材料,利用该技术提取黄酮,并结合聚酰胺和高速逆流色谱进行分离纯化,获得的总黄酮浓度最高可达60.20 mg/g。龚明贵等[19]以莲花粉为实验对象,使用70%乙醇,设置料液比为1∶12,提取3次,每次20 min,总黄酮提取率可达9.13 mg/g。而禹淞文等[20]比较了超声时间、超声功率、料液比等3种因素对莲叶黄酮提取率的影响,结果表明,超声时间 > 超声功率 > 料液比,莲叶黄酮的平均提取率最高可达2.75%。
2.3 大孔树脂色谱法
大孔树脂色谱法(Microporous resin chromatography, MPRC)具有吸附容量高、稳定性好、操作成本低和操作简单的特性,已广泛应用于黄酮类、皂苷类等化合物的分离制备[21]。曾绍校等[22]使用大孔树脂对莲叶黄酮进行纯化,发现莲叶提取液浓度、pH值以及流速对于大孔树脂的吸附量和分离纯化效果都会产生一定的影响。Zhu等[23]用70%乙醇在室温下利用超声法对莲叶总黄酮进行提取,通过石油醚洗脱去除叶绿素,蒸发后结合D101大孔树脂色谱法对总黄酮进行分离纯化,获得了较高纯度的莲叶总黄酮,为后续的抗氧化活性分析提供了便利。
2.4 高速逆流色谱法
高速逆流色谱法(High-speed countercurrent chromatography,HSCCC)是一种液-液分配色谱技术,其固定相与流动相均为液体,无不可逆吸附,能够连续高效地分离混合物质。目前,高速逆流色谱法已成为莲黄酮类化合物分离、纯化的有效手段。潘汇等[24]利用HSCCC分离纯化得到紫英云苷、异槲皮苷及槲皮素等3种莲叶黄酮,其纯度分别达92.67%、90.43%和87.52%。盛达成等[25]利用HSCCC分离纯化莲叶黄酮粗粉,优化参数后得到的莲叶槲皮素单体纯度最高可达99%。郭兴峰[18]利用HSCCC建立了莲花黄酮类化合物的高效分离方法,将预处理后的莲花样品总黄酮进行分离,得到4种黄酮类化合物,其纯度范围在97% ~ 99%。高速逆流色谱法适用范围广,操作简单,回收得率高,可以较好地对黄酮单体进行分离,但其局限性在于后期需要色谱技术的支持,对仪器的精密度要求较高,样品流速较慢。
除了上述方法外,水提法、酶提取法、微波提取法、水提固相萃取法、碱提酸析法等也被应用于莲黄酮提取。根据操作流程,可将其分为单一提取法和辅助提取法两种类型(表2)。单一提取法操作简单易行,但提取得率与纯度不尽人意。辅助提取法在单一提取法的基础上,加入其他手段,如超声波、微波、大孔树脂等,在提取纯度方面有了很大的提升,能够较好地维持黄酮的生物活性。因此,辅助提取法在莲黄酮提取中的应用更为广泛,但针对莲不同组织中黄酮类化合物的提取,还需进一步优化提取条件和参数,以达到最佳提取效果。
表 2 莲黄酮类化合物的提取与分离方法Table 2. Extraction and isolation methods of flavonoids in Nelumbo序号
No.方法
Method提取类型
Extraction type优点
Advantages缺点
Disadvantages参考文献
References1 水提取法 单一提取法 操作简单、无污染 耗时长、效率低 [26] 2 有机溶剂提取法 单一提取法 操作简单、低成本 所需溶剂量大、耗时长、提取率低 [17] 3 超声波辅助提取法 辅助提取法 操作方便、节能省时、产率高、无需加热 作用范围有限,容易形成超声空白区 [20] 4 微波提取法 辅助提取法 灵敏度高,加热均匀 萃取温度高,容易破坏有效成分 [27] 5 酶提取法 单一提取法 低成本、高效无毒、反应条件温和 有机溶剂残留,得率低 [28] 6 大孔树脂色谱法 辅助提取法 吸附性好、操作简便、成本低、稳定性强 预处理复杂、有机残留物高 [23] 7 高速逆流色谱法 辅助提取法 操作简便、适用范围广、损耗低、回收率高 流速低、体系不成熟、仪器设备要求高 [25] 8 固相萃取法 辅助提取法 操作简单、无需特殊装置、重现性好 容量小、溶剂损耗大 [17] 9 碱溶酸析提取法 单一提取法 操作简单 耗时长、提取液稳定性差,易出现沉淀物 [29] 3. 莲黄酮类化合物的鉴定方法
对植物总黄酮进行提取后,研究者还需要从化学结构及生物活性等方面入手,对其中的物质类型作进一步的区分。目前,莲黄酮类化合物的鉴定主要通过质谱分析和核磁共振等方法进行。
3.1 高效液相色谱-质谱联用法
高效液相色谱-质谱联用法(High-performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS),其中液相色谱为分离系统,质谱为检测系统,色谱和质谱技术优势互补,色谱先将混合物的成分分离,再经过质谱得到离子碎片的质谱图,从而推测物质的分子量和结构信息,具有高通量、高灵敏度、高分辨率、高可靠性的特点,是鉴定莲黄酮类化合物的一种高效可靠的方法。Chen等[17]利用HPLC-MS/MS在莲叶中检测到13种黄酮类化合物,其中山奈酚-3-O-半乳糖苷、山奈酚-3-O-葡萄糖苷、薯蓣皂苷-7-O-己糖苷和异鼠李素-3-O-葡萄糖苷为莲叶中新发现。Liu等[30]优化了莲黄酮化合物的提取参数,利用高效液相色谱-二极管阵列检测-质谱联用技术从不同地区采集的莲雄蕊样品中鉴定出11种黄酮类化合物。Zhu等[13, 23]利用HPLC-MS/MS对莲叶和莲子心的黄酮类成分进行了分析,在莲叶中鉴定得到槲皮素-3-O-鼠李糖苷、槲皮素-3-O-阿拉伯糖苷、山奈酚-3-O-葡萄糖苷等14种黄酮类化合物,在莲子心中鉴定出16种黄酮类化合物,包括8种黄酮碳苷和8种黄酮氧苷,其中,木犀草素-7-O-新橙皮糖苷和山奈酚-7-O-葡萄糖苷为莲子心中首次报道。Yang等[31]采用高效液相色谱-光电二极管阵列检测/质谱法建立了一种高效可靠且能同时分析莲黄酮醇和花青素的方法,从莲花花瓣中鉴定出15种黄酮类化合物,其中两种花色苷和9种黄酮醇为首次报道。
3.2 核磁共振波谱法
核磁共振波谱法(Nuclear magnetic resonance spectroscopy,NMRS)是在磁场作用下确定有机分子的微观结构,准确性和可重复性高,不破坏样品结构,目前已被应用于莲黄酮类化合物的鉴定。Kashiwada等[32]以莲叶为材料,通过NMRS技术分离并鉴定了5种黄酮苷类物质,发现槲皮素-3-O-β-D-葡萄糖苷为莲叶中主要的黄酮类化合物。Jiang等[33]利用1D、2D核磁共振波谱和高分辨电喷雾质谱技术(High-resolution electrospray ionization mass spectrometry,HR-ESI-MS),从莲子心中鉴定出4种新的黄酮苷。杨超[15]通过NMRS技术对莲子心黄酮提取物进行了分析,确定了18种黄酮化合物的结构,并认为夏佛塔苷和异夏佛塔苷是莲子心主要的黄酮成分。刘婷[34]利用NMRS技术成功鉴定了莲子心中11个黄酮类化合物的结构,其中,金丝桃苷、木犀草素-7-O-新橙皮糖苷和淫羊藿次苷为莲子心中首次报道。
3.3 其他方法
除了上述方法外,紫外光谱检测、亲和超滤质谱、超高效液相色谱-四极杆-静电场轨道阱高分辨率质谱(Ultra-performance liquid chromatography coupled with hybrid quadrupole orbitrap high-resolution mass spectrometry,UHPLC/Q-Orbitrap HRMS)、反相高效液相色谱(Reversed-phase high-performance liquid chromatography,RP-HPLC)等也可用于莲黄酮类化合物的鉴定[35-38]。
基于以上鉴定方法,目前已在莲中成功鉴定出超过百种黄酮类化合物。但单一方法仍存在较大的局限性。如:液相色谱-质谱联用分析法成本较高;紫外光谱检测法灵敏度较低,存在个别黄酮苷元检测不到的情况。此外,莲黄酮类化合物在分离过程存在分离不彻底、化合物具有同分异构体等问题。为此,可以通过优化液相色谱和质谱的实验体系,提高黄酮类化合物的分离度和质谱的分辨率,以获得准确而全面的鉴定结果。超高效液相色谱串联质谱分析(Ultra-performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)同时具备高效率和高灵敏度,可用于复杂黄酮类化合物的鉴定,未来应建立和优化UPLC-MS/MS技术体系,以应用于莲各组织黄酮类化合物的鉴定。同时,还可以将不同的鉴定技术进行组合,如可将高效液相色谱-质谱联用技术、紫外光谱检测与亲和超滤技术相结合,亲和超滤技术可以高效地分离不同分子量的化合物,而高效液相色谱-质谱联用技术、紫外光谱检测可以提高鉴定的精确性,从而实现高通量筛选和快速鉴定莲中复杂或微量的黄酮类化合物。
4. 莲黄酮类化合物的功能作用
4.1 抗氧化、延缓衰老
黄酮类化合物是一种天然抗氧化成分,能够有效清除活性氧,延缓衰老。田文月[38]采用自由基清除能力测定法(DPPH)分析了13个不同产地莲子心总黄酮的抗氧化活性,发现总黄酮抗氧化能力随着浓度的增加而增强,存在浓度依赖性。杨超[15]对夏佛塔苷、异夏佛塔苷、牡荆素、异牡荆素、芦丁、金丝桃苷和芹菜素-6,8-二吡喃葡萄糖苷等7个莲子心黄酮单体进行DPPH测定,发现金丝桃苷和芦丁的抗氧化活性较好,与其浓度呈正相关,且当浓度为120 μmol/L时,其氧自由基清除能力可达到抗坏血酸Vc的同等水平。宗灿华等[39]发现莲叶黄酮可以通过降低氧化自由基和脂质过氧化物的积累来延缓小鼠衰老。此外,莲雄蕊提取物富含杨梅素-3-O-葡萄糖苷、槲皮素-3-O-葡萄糖苷、山奈酚-3-O-葡萄糖苷和异鼠李素-3-O-葡萄糖苷等黄酮类化合物,具有很高的抗氧化能力,可以通过调节sir2和sod2基因表达及酶的活性水平进而延缓酵母细胞的衰老[40]。
4.2 抑菌和抗炎作用
黄酮类化合物属于酚类衍生物,呈弱酸性,能够通过使蛋白质变性来达到抑菌或杀菌作用。莲子心黄酮的抑菌作用具有差异性,对真菌抑制作用不明显,但能够有效地抑制细菌的生长,且其抑菌能力受温度和pH值的影响较小[41]。陈勇[42]研究了金丝桃苷、异槲皮苷和槲皮素等5种莲叶黄酮对常见食品腐败菌的抑制作用,发现槲皮素的抑菌活性最高,对金黄色葡萄球菌的抑制作用最强,但当温度超过80℃时,其抑菌活性显著下降。黄酮类化合物可以通过抑制炎症介质的释放来调节炎症相关信号通路,从而抑制炎症的发生[43]。相关研究表明,莲子心黄酮可以抑制脂多糖(LPS)诱导炎症过程中炎症介质(NO、PGE2)和炎症因子(TNF-α、IL-1β和IL-6)的作用,发挥良好的抗炎活性[36];也能通过抑制炎症因子的表达,减缓由佛波酯(TPA)诱导的小鼠耳肿胀[38]。此外,莲子心黄酮夏佛塔苷是重要的抗炎活性成分之一,可显著抑制炎性介质NO的生成,减少炎症因子的合成[44, 45]。
4.3 降血糖、降脂减肥
黄酮类化合物可以干扰多糖的分解和葡萄糖的吸收,调节血糖、血脂水平,在糖尿病的预防与治疗方面发挥着一定作用[35, 46]。高剂量的莲叶黄酮和黄酮苷元可显著降低血糖水平,并能抑制糖尿病小鼠的体重减轻,缓解糖尿病的并发症[47]。莲子心黄酮可提高小鼠的糖耐受量和胰岛素水平,从而调节糖尿病小鼠的血脂代谢,降低其血糖水平[48]。莲蓬提取物中含有丰富的槲皮素-3-葡萄糖苷等黄酮类衍生物,可通过下调凋亡和上调自噬来保护胰腺β细胞免受氧化应激相关的凋亡和损伤,对糖尿病和胰腺细胞损伤的治疗效果优于常规药物二甲双胍[49]。莲叶黄酮具有明显的降血脂和减肥功效。刘嵩[50]通过实验对比了莲叶黄酮对高血脂小鼠模型与正常小鼠模型的降脂作用,发现其能显著降低两种高血脂小鼠血清中甘油三酯(TG)、胆固醇(TC)、丙二醛(MDA)和低密度脂蛋白(LDL)的含量。胡榴燕[51]发现莲叶黄酮可以降低大鼠血清中TC和TG的水平,具有保护血管、辅助胆固醇分解、降低体重等作用。此外,莲叶黄酮可显著降低营养性肥胖大鼠血清、血脂指标的浓度,抑制体重增加,且不影响其食欲,提升其体质[52]。
4.4 其他作用
除了上述功能,莲黄酮类化合物还具有治疗肝损伤、提高记忆力、改善心肌供血、抗抑郁等作用。莲叶黄酮不仅可以降低D-半乳糖诱导的肝损伤小鼠肝细胞中的MDA和NO含量,降低细胞和组织结构的破坏速度,延缓肝细胞的衰老[53],还可以显著降低四氯化碳(CCl4)诱导的肝损伤小鼠的血清肝脏指数,有效抑制肝细胞坏死,保持肝脏的完整性[54]。莲叶黄酮能显著提高过氧化氢(H2O2)损伤的大鼠肾上腺嗜铬细胞瘤细胞(PC12)的存活率,减少细胞凋亡,对神经元具有良好的保护作用[55]。莲叶黄酮可通过上调凋亡调控基因Bcl-2和抑制Bax、Caspase-3的表达,抑制心肌缺血再灌注损伤大鼠心肌细胞的凋亡[56]。通过明暗箱、高架十字迷宫等实验研究发现,3 g/kg的莲叶黄酮可有效缓解小鼠状态性与特质性焦虑行为,对缓解焦虑有一定作用[57]。
5. 莲黄酮类化合物的开发利用
5.1 用于治疗疾病
莲是一种全株皆可入药的典型药用植物。在药理学研究中,莲各组织部位因其发育和代谢机制的不同,功效存在差异,因而用途不同。莲叶黄酮常用于制备中药、胶囊等,通过中药煎剂、莲叶合剂、莲叶水煎剂或制作祛脂汤等方式来防治冠心病、动脉粥样硬化及高脂血症等疾病[58]。莲子心黄酮类化合物丰富,是我国传统中药之一,可作为辅助药剂用于治疗心脑血管疾病或降血糖。其中,木犀草素常被用于止咳祛痰消炎;金丝桃苷具有镇静止痛的效用,也可用于修复缺血性脑损伤;芦丁可防止血管破裂,具有止血功能[59]。此外,莲花花瓣和雄蕊富含黄酮类和生物碱等活性成分,可用于治疗组织炎症、癌症、皮肤病和用作解毒剂[60]。
5.2 用作天然保健品
近年来,以黄酮类化合物为主要成分,利用莲不同组织制成的保健茶饮料开始流行于市场,广受消费者的青睐。利用银杏叶与莲叶总黄酮开发的保健饮料,酸甜适中,色泽均匀,其黄酮含量可达0.68 mg/mL,适量饮用,有助于身体健康[61]。采用超声波辅助乙醇提取法提取莲叶黄酮,干燥后回填到茶饮料中,可提升其降脂效果[62]。在东南亚地区,泰国人常使用莲雄蕊制成草药茶饮来改善身体的循环系统,因其富含黄酮类化合物,在降低血糖和血脂方面具有一定作用[63]。冯丹[64]研制了一种以莲叶、绿豆为主要成分的营养保健酒,产品稳定性好,具有一定的降血脂、降血压和抗氧化功效。另外,通过优化糯米糕的制作工艺,添加10%的莲叶黄酮提取液制作成莲叶糯米糕,色香味更佳,更具有营养保健价值[65]。
5.3 制作日用品、化妆品
黄酮类化合物具有良好的抑菌作用和抗氧化能力,可作为有效成分应用于日用品和化妆品的研发。陈健芬等[66]从莲叶黄酮类提取物中分离出金丝桃苷成分,并将其添加至牙膏中,制作的天然中草药牙膏能够有效抑制口腔细菌的滋生,缓解牙周炎、牙龈炎及口臭等症状,这也是国内关于莲叶金丝桃苷在牙膏中应用的首次报道,对于莲叶提取物有效成分的应用意义重大。王晓娜等[67]将质量分数为0.03% ~ 1.00%的莲叶黄酮应用于化妆品中,可有效抑制酪氨酸酶的活力,减少黑色素的积累,清除氧自由基,对皮肤美白具有一定功效。
6. 结语与展望
莲是我国重要的水生经济作物,集食用、药用和观赏于一身。当前,在国家大力推动特色农业发展的背景下,国内莲种植面积逐步增加,在带动莲生产区经济发展、增加农民收入方面发挥着积极作用。莲黄酮类化合物因其具有广泛的生物活性和药理功能,在医疗保健和疾病治疗等方面发挥着重要的作用,已被应用于生物制药、保健品开发和日用化妆品研发等多个领域,具有巨大的市场开发潜能(图3)。本文围绕莲黄酮类化合物的提取鉴定技术、生物学功能及应用现状等3个方面的研究进展进行了系统总结,为莲黄酮类化合物的开发利用提供了参考。然而,关于莲黄酮类化合物的开发利用还存在一些问题亟需解决。首先,莲黄酮类化合物的提取、分离与鉴定方法应基于环保、高效、低成本的原则,改进提取方法、优化提取工艺中的条件和参数、开发新型鉴定方法等。目前,尚未发现莲中存在独特的黄酮类化合物,这可能是由于黄酮类化合物合成和修饰途径在植物中较为保护所导致的。值得注意的是,目前鉴定的多数莲黄酮类化合物含量相对丰富,是否存在独特的微量黄酮类化合物还需进一步研究。莲黄酮类化合物的提取、分离与鉴定体系的优化将为解决这一科学问题提供机遇。其次,尽管目前已经鉴定到许多莲黄酮类化合物,但相关研究多集中在莲叶与莲子心中开展,对于莲房、莲梗、莲花、莲藕等组织的研究较少。未来亟需开展莲不同组织的研究,以鉴定更多具有药用活性的黄酮类化合物,并进行有效地开发、加工和使用,最终改善莲不同组织的利用率,提高莲在农业生产中的附加值。
我国莲种质资源丰富,种植面积广,这是开展莲黄酮类化合物相关研究的有利基础。未来需深入阐明其药理活性及其作用机制,研究其生物合成途径相关结构基因的功能,揭示其生物合成和代谢相关的分子机理,从而为莲黄酮类化合物的全面研究与综合利用奠定坚实的理论基础,助力莲黄酮类化合物的合成生物学研究以及规模化生产,经济效益与社会效益巨大。
-
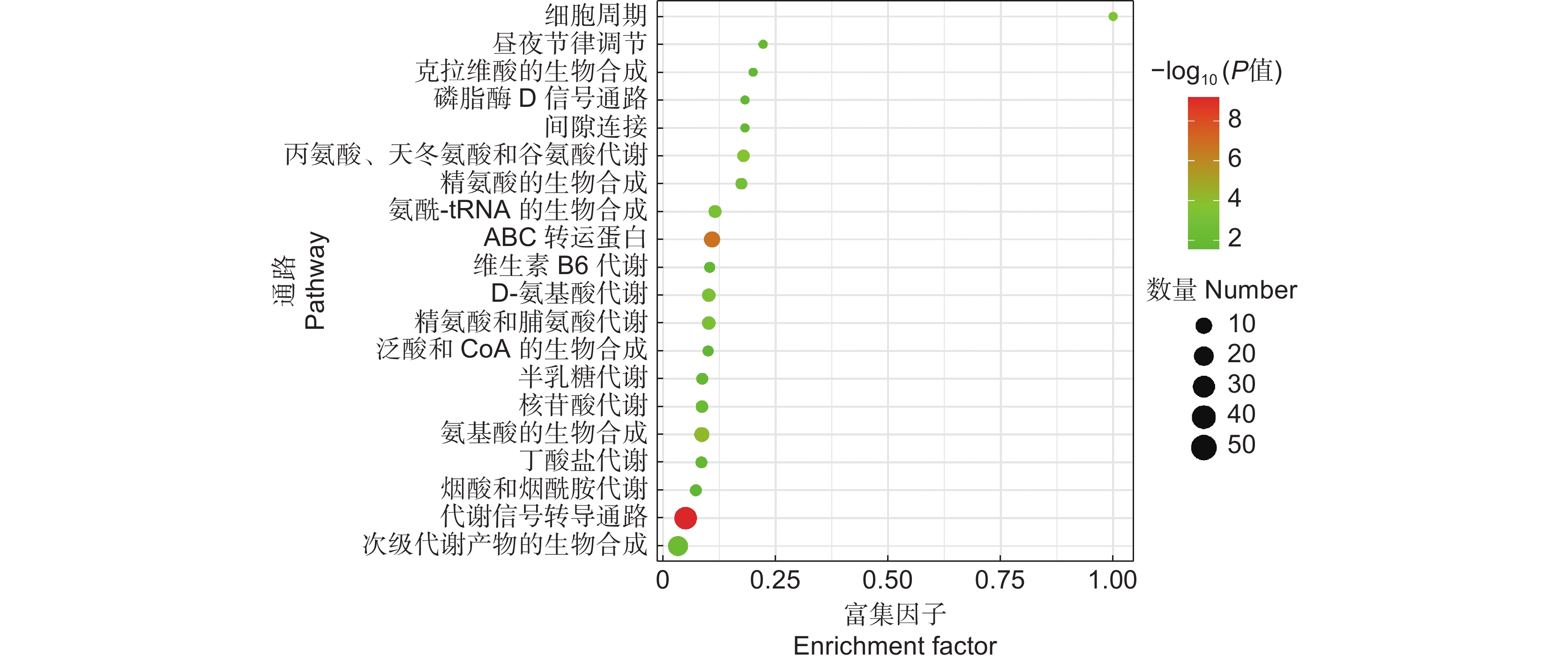
图 7 CK和MJ的差异代谢物KEGG通路富集
气泡越大,表示该通路中富集到的差异代谢物数量越多;颜色越红,表示差异代谢物在该通路上的富集越显著。
Figure 7. KEGG pathway enrichment analysis of differential metabolites in CK and MJ
Larger bubbles indicate greater amount of differential metabolite enriched in the pathway; redder color indicates more significant enrichment of differential metabolite in the pathway.
表 1 MeJA对叶片悬浮细胞总酚、总黄酮、总三萜含量的影响
Table 1 Effects of MeJA on total phenol, flavonoid, and triterpene contents in leaf suspension cells
MeJA浓度
Concentration of MeJA / mg/L总酚含量
Phenol content / mg/g总黄酮含量
Flavonoid content / mg/g总三萜含量
Terpenoid content / mg/g0 54.60±1.08 240.07±32.53 133.45±12.29 0.125 53.05±1.69 284.23±29.26 161.11±15.42 0.25 63.10±1.36** 324.46±16.54* 166.90±4.57* 0.5 59.35±2.48* 277.01±12.29 147.61±1.71 1 63.31±1.59*** 330.00±8.41** 188.54±7.08** 2 79.41±1.48*** 380.77±0.65** 165.63±10.92* 4 69.59±1.43*** 415.46±4.03** 151.95±17.95 8 57.11±0.58* 245.64±19.39 110.19±9.39 Notes: *, P<0.05; **, P<0.01; ***, P<0.001. 表 2 CK和MJ的生物活性差异代谢物
Table 2 Bioactive differential metabolites of CK and MJ
类别
Category化合物名称
Compound name化学式
Chemical formula加合离子
AdductP值
P valueVIP值
VIP value差异倍数
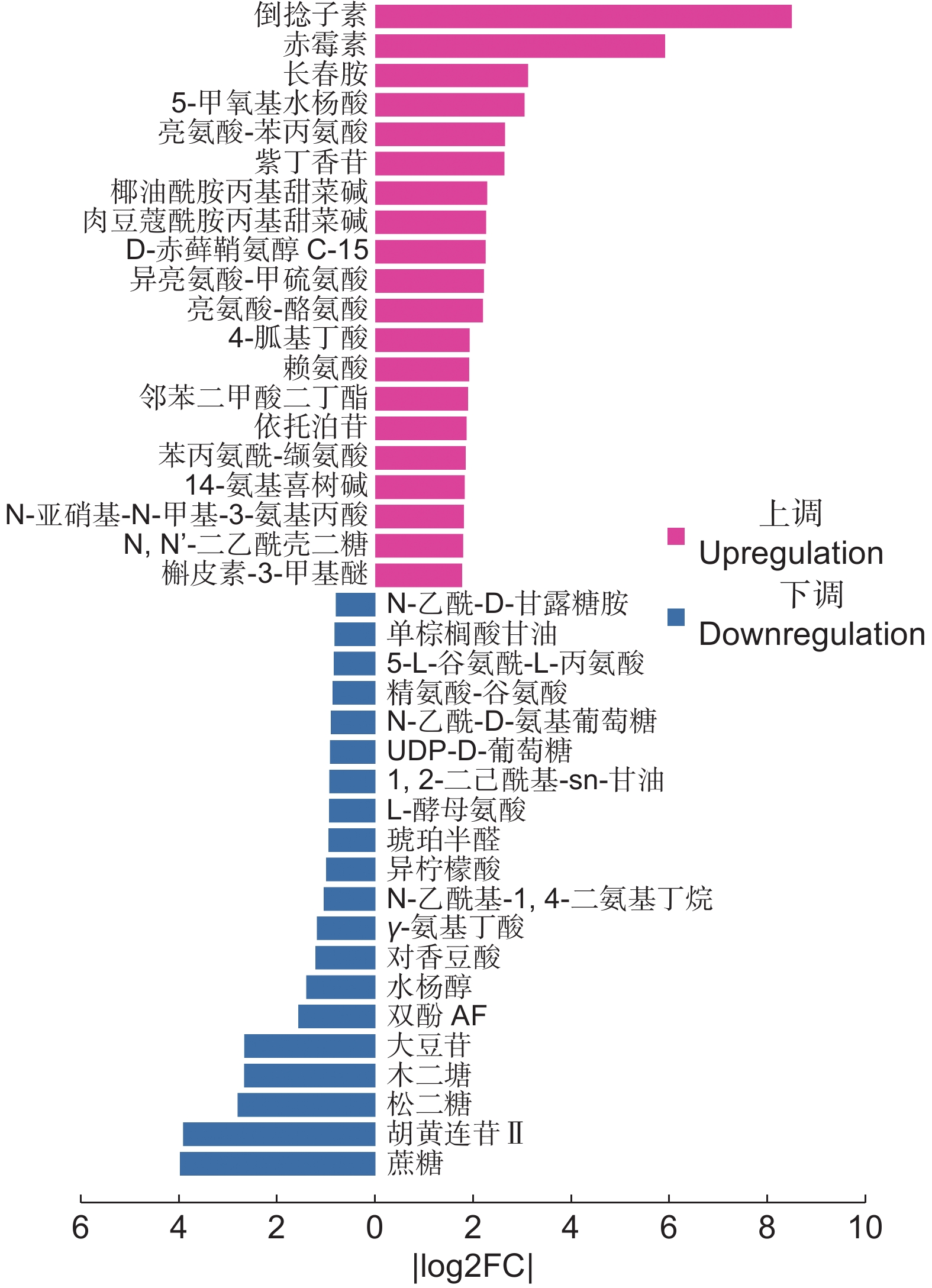
Fold change黄酮类 表儿茶素 C15H14O6 [M+H]+ 7.10×10−4 2.41 2.04 3,4,6-三甲氧基异黄酮-7-O-β-D-吡喃葡萄糖苷 C24H26O11 [M+Na]+ 9.54×10−4 1.11 1.74 丁香亭 C17H14O8 [M+H]+ 1.58×10−3 1.16 1.80 栀子黄素B C19H18O7 [M+H]+ 1.04×10−2 1.01 0.93 次野鸢尾黄素 C20H18O8 [M+Na]+ 1.06×10−5 1.65 2.47 根皮苷 C21H24O10 [M+H]+ 3.08×10−5 1.25 2.84 补骨脂定 C20H16O5 [M+H]+ 7.56×10−5 1.03 1.84 槲皮素-3-甲基醚 C17H14O7 [M+H]+ 1.31×10−4 1.69 2.97 大豆苷 C21H20O9 [M+Cl]− 6.64×10−3 1.28 0.16 酚酸类 倒捻子素 C24H26O6 [M+H]+ 4.62×10−7 4.01 359.35 蛇床子素 C15H16O3 [M+H]+ 2.49×10−3 1.19 2.52 胡黄连苷II C23H28O13 [M+H-H2O]+ 4.02×10−5 1.30 0.07 佛手酚 C11H6O4 [M+H]+ 7.26×10−4 5.38 1.50 紫丁香苷 C17H24O9 [M+Na]+ 1.48×10−3 1.28 4.85 依托泊苷 C29H32O13 [M+H]+ 4.96×10−3 1.14 3.57 阿魏酸 C10H10O4 [M-H]− 2.89×10−2 3.03 2.53 凯林 C14H12O5 [M+H]+ 6.88×10−5 1.09 2.09 状芸香素 C16H14O3 [M-H]− 5.07×10−5 1.25 1.56 对香豆酸 C9H8O3 [M-H-H2O]− 4.34×10−2 1.03 0.43 奎尼酸 C11H9NO3 [M-H]− 2.52×10−4 1.49 1.34 萜类 紫罗兰酮 C13H20O [M+H-H2O]+ 1.87×10−2 1.08 1.69 儿茶酚 C6H6O2 [M+H-3H2O]+ 6.89×10−4 1.47 2.18 球姜酮 C15H22O [M+H-H2O]+ 1.88×10−2 2.83 1.86 18β-甘草次酸 C30H46O4 [M-H]− 1.89×10−4 4.85 2.15 刺囊酸-3-O-葡萄糖苷 C36H58O9 [M-H]− 4.75×10−5 2.24 1.93 人参皂苷F3 C41H70O13 [M+FA-H]− 1.72×10−2 5.13 0.68 苜蓿酸+o-hex C35H54O11 [M-H]− 9.41×10−4 1.82 3.35 罗莎白素 C36H58O10 [M+Cl-]− 4.35×10−3 2.21 1.99 生物碱类 14-氨基喜树碱 C20H17N3O4 [M+H]+ 8.18×10−7 4.40 3.45 托品酮 C8H13NO [M+H]+ 1.43×10−2 2.24 2.46 长春胺 C21H26N2O3 [M+H]+ 4.03×10−6 1.29 8.23 醌类 恩贝灵 C17H26O4 [M-H]− 3.60×10−3 3.40 1.40 芪类 紫檀芪 C16H16O3 [M+H]+ 7.51×10−4 1.37 1.55 -
[1] Habán M,Korczyk-szabó J,Čerteková S,Ražná K. Lavandula species,their bioactive phytochemicals,and their biosynthetic regulation[J]. Int J Mol Sci,2023,24(10):8831. doi: 10.3390/ijms24108831
[2] Dobros N,Zawada KD,Paradowska K. Phytochemical profiling,antioxidant and anti-inflammatory activity of plants belonging to the Lavandula genus[J]. Molecules,2022,28(1):256. doi: 10.3390/molecules28010256
[3] Diass K,Merzouki M,Elfazazi K,Azzouzi H,Challioui A,et al. Essential oil of Lavandula officinalis:Chemical composition and antibacterial activities[J]. Plants (Basel),2023,12(7):1571. doi: 10.3390/plants12071571
[4] 陈日道,段瑞刚,邹建华,李军伟,刘晓月,等. 八角莲愈伤组织中黄酮苷类化学成分研究[J]. 中国中药杂志,2016,41(1):87−91. Chen RD,Duan RG,Zou JH,Li JW,Liu XY,et al. Flavonoid glycosides from callus cultures of Dysosma versipellis[J]. China Journal of Chinese Materia Medica,2016,41(1):87−91.
[5] Guerriero G,Berni R,Armando Muñoz-Sanchez J,Apone F,Abdel-Salam EM,et al. Production of plant secondary metabolites:examples,tips and suggestions for biotechnologists[J]. Genes (Basel),2018,9(6):309. doi: 10.3390/genes9060309
[6] 冯晓晖,闫学彤,郑珂媛,周强,张伟中,等. 富含紫杉烷类红豆杉的离体培养[J]. 植物学报,2023,58(6):917−925. doi: 10.11983/CBB22228 Feng XH,Yan XT,Zhen KY,Zhou Q,Zhang WZ,et al. In vitro culture of Taxus rich in taxanes[J]. Chinese Bulletin of Botany,2023,58(6):917−925. doi: 10.11983/CBB22228
[7] Xu F,Valappil AK,Mathiyalagan R,Tran TNA,Ramadhania ZM,et al. In vitro cultivation and ginsenosides accumulation in Panax ginseng:a review[J]. Plants (Basel),2023,12(17):3165. doi: 10.3390/plants12173165
[8] Luo C,Qiu JF,Zhang Y,Li MY,Liu P. Jasmonates coordinate secondary with primary metabolism[J]. Metabolites,2023,13(9):1008. doi: 10.3390/metabo13091008
[9] Serna-escolano V,Valverde JM,García-pastor ME,Valero D,Castillo S,et al. Pre-harvest methyl jasmonate treatments increase antioxidant systems in lemon fruit without affecting yield or other fruit quality parameters[J]. J Sci Food Agric,2019,99(11):5035−5043. doi: 10.1002/jsfa.9746
[10] Durand M,Besseau S,Papon N,Courdavault V. Unlocking plant bioactive pathways:omics data harnessing and machine learning assisting[J]. Curr Opin Biotechnol,2024,87:103135. doi: 10.1016/j.copbio.2024.103135
[11] Durmaz G. Freeze-dried ABTS+ method:a ready-to-use radical powder to assess antioxidant capacity of vegetable oils[J]. Food Chem,2012,133(4):1658−1663. doi: 10.1016/j.foodchem.2012.02.064
[12] Benzie IF,Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J]. Anal Biochem,1996,239(1):70−76. doi: 10.1006/abio.1996.0292
[13] 林月乔,张子桦,续文丽,李楠,刘辉,陈鑫. 莽吉柿果壳不同萃取物中总黄酮、总酚含量及抗菌活性[J]. 食品工业,2022,43(12):130−133. Lin YQ,Zhang ZH,Xu WL,Li N,Liu H,Chen X. Content of total flavonoids,phenols and its antibacterial activities of different extracts from Garcinia mangostana[J]. The Food Industry,2022,43(12):130−133.
[14] 黄梅桂,徐云巧,张忠明,应瑞峰,王耀松,王强. 薰衣草残渣中黄酮的超声辅助提取工艺及其抗氧化活性[J]. 食品工业科技,2018,39(1):214−220. Huang MG,Xu YQ,Zhang ZM,Ying RF,Wang YS,Wang Q. Flavonoids extracted by ultrasonic assisted method from lavender residue and its antioxidant activity[J]. Science and Technology of Food Industry,2018,39(1):214−220.
[15] 陈楠,吴潇霞,白冰瑶,陈计峦. 响应面法优化枣渣总三萜提取工艺及其抗氧化、抗增殖活性[J]. 食品研究与开发,2022,43(10):147−155. doi: 10.12161/j.issn.1005-6521.2022.10.020 Chen N,Wu XX,Bai BY,Chen JL. Optimization of extraction process of total triterpenoids from jujube residue by response surface methodology and the antioxidant and anti-proliferation activity[J]. Food Research and Development,2022,43(10):147−155. doi: 10.12161/j.issn.1005-6521.2022.10.020
[16] Nyamundanda G,Brennan L,Gormley IC. Probabilistic principal component analysis for metabolomic data[J]. BMC Bioinformatics,2010,11(1):571. doi: 10.1186/1471-2105-11-571
[17] Worley B,Powers R. Multivariate analysis in metabolomics[J]. Curr Metabolomics,2013,1(1):92−107.
[18] Wishart DS,Feunang YD,Marcu A,Guo AC,Liang K,et al. HMDB 4.0:the human metabolome database for 2018[J]. Nucleic Acids Res,2018,46(D1):D608−D617. doi: 10.1093/nar/gkx1089
[19] Kanehisa M,Furumichi M,Sato K,Kawashima M,Ishiguro-Watanabe M. KEGG for taxonomy-based analysis of pathways and genomes[J]. Nucleic Acids Res,2023,51(D1):D587−D592. doi: 10.1093/nar/gkac963
[20] Świątek A,Lenjou M,van Bockstaele D,Inzé D,van Onckelen HA. Differential effect of jasmonic acid and abscisic acid on cell cycle progression in tobacco BY-2 cells[J]. Plant Physiol,2002,128(1):201−211. doi: 10.1104/pp.010592
[21] Munteanu IG,Apetrei C. Analytical methods used in determining antioxidant activity:a review[J]. Int J Mol Sci,2021,22(7):3380. doi: 10.3390/ijms22073380
[22] Tjahjani S,Widowati W,Khiong K,Suhendra A,Tjokropranoto R. Antioxidant properties of Garcinia mangostana L. (mangosteen) rind[J]. Procedia Chemistry,2014(13):198−203.
[23] 杨东沛,张媛媛,叶火春,辜柳霜,冯岗,张静. α-倒捻子素对10种植物病原细菌的杀菌活性[J]. 热带农业科学,2023,43(6):45−50. Yang DP,Zhang YY,Ye HC,Gu LS,Feng G,Zhang J. Bactericidal activity of α-mangostin against ten kinds of plant pathogenic bacteria[J]. Chinese Journal of Tropical Agriculture,2023,43(6):45−50.
[24] 马林伟,徐红涛,戴小丽,韩中保. α-倒捻子素对MCF-7乳腺癌增殖、生长和侵袭的影响及其作用机制[J]. 中国现代医学杂志,2018,28(1):30−36. doi: 10.3969/j.issn.1005-8982.2018.01.007 Ma LW,Xu HT,Dai XL,Han ZB. Effect of α-mangostin on proliferation,growth and invasion of MCF-7 breast cancer and its mechanism[J]. China Journal of Modern Medicine,2018,28(1):30−36. doi: 10.3969/j.issn.1005-8982.2018.01.007
[25] Huang YQ,Cai SG,Ye LZ,Hu HL,Li CD,et al. The effects of GA and ABA treatments on metabolite profile of germinating barley[J]. Food Chem,2016(192):928−933.
[26] Dong YJ,Wu YX,Zhang ZX,Wang SC,Cheng J,et al. Transcriptomic analysis reveals GA3 is involved in regulating flavonoid metabolism in grape development for facility cultivation[J]. Mol Genet Genomics,2023,298(4):845−855. doi: 10.1007/s00438-023-02019-z
[27] Yao XH,Nie J,Bai RX,Sui XL. Amino acid transporters in plants:identification and function[J]. Plants (Basel),2020,9(8):972. doi: 10.3390/plants9080972
[28] Arruda P,Barreto P. Lysine catabolism through the saccharopine pathway:Enzymes and intermediates involved in plant responses to abiotic and biotic stress[J]. Front Plant Sci,2020,11:587. doi: 10.3389/fpls.2020.00587
[29] Galili G,Amir R,Fernie AR. The regulation of essential amino acid synthesis and accumulation in plants[J]. Annu Rev Plant Biol,2016,67:153−178. doi: 10.1146/annurev-arplant-043015-112213
[30] Yang QQ,Zhao DS,Zhang CQ,Wu HY,Li QF,et al. A connection between lysine and serotonin metabolism in rice endosperm[J]. Plant Physiol,2018,176(3):1965−1980. doi: 10.1104/pp.17.01283
[31] Forde BG,Lea PJ. Glutamate in plants:metabolism,regulation,and signalling[J]. J Exp Bot,2007,58(9):2339−2358. doi: 10.1093/jxb/erm121
[32] Van den Ende W,El-esawe SK. Sucrose signaling pathways leading to fructan and anthocyanin accumulation:a dual function in abiotic and biotic stress responses?[J]. Environ Exp Bot,2014,108:4−13. doi: 10.1016/j.envexpbot.2013.09.017
[33] Emanuelle S,Doblin MS,Stapleton DI,Bacic A,Gooley PR. Molecular insights into the enigmatic metabolic regulator,SnRK1[J]. Trends Plant Sci,2016,21(4):341−353. doi: 10.1016/j.tplants.2015.11.001
[34] Yu SM,Lo SF,Ho THD. Source-sink communication:regulated by hormone,nutrient,and stress cross-signaling[J]. Trends Plant Sci,2015,20(12):844−857. doi: 10.1016/j.tplants.2015.10.009
[35] Wurtzel ET,Kutchan TM. Plant metabolism,the diverse chemistry set of the future[J]. Science,2016,353(6305):1232−1236. doi: 10.1126/science.aad2062
[36] Do THT,Martinoia E,Lee Y,Hwang JU. 2021 update on ATP-binding cassette (ABC) transporters:how they meet the needs of plants[J]. Plant Physiol,2021,187(4):1876−1892. doi: 10.1093/plphys/kiab193
[37] Shitan N,Bazin I,Dan K,Obata K,Kigawa K,et al. Involvement of CjMDR1,a plant multidrug-resistance-type ATP-binding cassette protein,in alkaloid transport in Coptis japonica[J]. Proc Natl Acad Sci USA,2003,100(2):751−756. doi: 10.1073/pnas.0134257100
[38] Goodman CD,Casati P,Walbot V. A multidrug resistance-associated protein involved in anthocyanin transport in Zea mays[J]. Plant Cell,2004,16(7):1812−1826. doi: 10.1105/tpc.022574
[39] Sagharyan M,Sharifi M,Samari E. Methyl jasmonate redirects the dynamics of carbohydrates and amino acids toward the lignans accumulation in Linum album cells[J]. Plant Physiol Biochem,2023,198:107677. doi: 10.1016/j.plaphy.2023.107677




 下载:
下载: