cDNA yeast library construction of Dendrobium officinale Kimura et Migo seeds and screening and analysis of DELLA interacting proteins
-
摘要:
赤霉素(GA)广泛参与植物生命周期的各种生长过程,DELLA蛋白作为GA信号通路中的抑制子,对植物的生长发育起抑制作用。铁皮石斛(Dendrobium officinale Kimura et Migo)种子中高表达的DELLA家族基因可能与其种子自然萌发困难有关。为筛选铁皮石斛DoDELLA蛋白的互作蛋白,解析DoDELLA在种子萌发过程中的作用机制,本研究利用Gateway重组技术构建了铁皮石斛种子cDNA文库,采用同源重组的方法构建DoDELLA4重组诱饵载体,从cDNA文库中筛选DoDELLA4的互作蛋白。结果显示,铁皮石斛种子cDNA文库的库容量为1.20×107 CFU,平均插入片段大于1 000 bp,重组率100%。在SD/-Trp/-Leu/-His/-Ade培养基中添加20 mmol/L的3-AT可抑制重组诱饵载体pGBKT7-DoDELLA4的自激活。从文库中筛选获得了70个潜在的互作蛋白,通过酵母双杂交实验,验证了DoELIP1、5807、DoTZF、DoUBQ、DoGRPA3与DoDELLA4蛋白存在互作关系。研究结果为进一步探究DoDELLA基因调控铁皮石斛种子萌发的分子机制提供了基础。
Abstract:Gibberellins (GAs) regulate diverse growth processes throughout the plant life cycle. DELLA proteins function as key repressors in the GA signaling pathway, inhibiting plant growth and development. The high expression of DELLA family genes in Dendrobium officinale Kimura et Migo seeds may be related to their poor natural germination. To identify interacting proteins of DoDELLA and elucidate its role in seed germination, a cDNA library was constructed from D. officinale seeds using Gateway recombination technology. A recombinant bait vector for DoDELLA4 was generated using homologous recombination and used to screen interacting proteins from the cDNA library. The constructed library exhibited a capacity of 1.20×107 CFU, with an average insert size exceeding 1 000 bp and a recombination efficiency of 100%. The recombinant bait vector pGBKT7-DoDELLA4 effectively suppressed self-activation in SD/-Trp/-Leu/-His/-Ade medium supplemented with 20 mmol/L 3-AT. Screening identified 70 potential interacting proteins, and yeast two-hybrid assays confirmed interactions between DoDELLA4 and DoELIP1, 5807, DoTZF, DoUBQ, and DoGRPA3. These findings establish a foundation for further investigation into the molecular mechanisms by which DoDELLA regulates seed germination in D. officinale.
-
Keywords:
- Dendrobium officinale /
- Yeast two-hybrid /
- DoDELLA /
- Interacting proteins
-
DELLA蛋白是植物特异性核蛋白GRAS家族中的一个亚家族,因其N端具有高度保守的DELLA结构域而命名。不同物种中DELLA蛋白的数量及作用方式不同,目前,已经从拟南芥(Arabidopsis thaliana (L.) Heynh.)[1]、水稻(Oryza sativa L.)[2]、大白菜(Brassica rapa L. ssp. pekinensis)[3]、梨(Pyrus bretschneideri Rehder)[4]、谷子(Setaria italica (L.) Beauv)[5]等几十种植物中相继鉴定出DELLA蛋白。AtRGL2是种子萌发的主要负调节因子[6]。DELLA和ABI3、ABI5在高温下能相互作用,激活下游基因SOMNUS的表达,进而抑制种子萌发[7]。PbDELLA影响梨子房的生长发育和种子形成[4],SiDELLA在谷子干种子中的高表达会抑制种子的萌发[5]。DELLA蛋白的N端是赤霉素(Gibberellin,GA)信号的感应器,当该结构域发生突变时,其对赤霉素信号的识别能力变弱,导致DELLA蛋白的累积,增强了DELLA蛋白对植物生长发育的抑制作用[8]。
赤霉素作为一类作用广泛的植物激素,调节植物生长的各个阶段,包括打破种子休眠、促进茎和根的伸长生长、调控花的发育起始、提高抗逆性等[9-14]。DELLA蛋白是GA信号通路中的负调控因子,GA通过降解DELLA蛋白,进而缓解DELLA引起的生长抑制作用,刺激植物生长[15]。
铁皮石斛(Dendrobium officinale Kimura et Migo)又名黑节草,是中国传统的名贵中药材,也是一种重要的兰科观赏植物。铁皮石斛的种子细小,呈粉尘状,且数量庞大,因缺乏足够的营养物质储备,在自然环境中难以萌发,通常要与某些真菌共生才能萌发[16]。为了有效保护野生资源,目前国内铁皮石斛的大规模育苗均采用组织培养的方法[17]。本实验室前期从铁皮石斛中克隆出6个DELLA家族基因,其中,DoDELLA1、DoDELLA4所编码的蛋白质N端结构域发生突变,且在种子中高表达,可能与铁皮石斛种子的自然萌发困难有关。本研究通过构建铁皮石斛种子cDNA文库,并以DoDELLA4为诱饵载体进行互作蛋白筛选,以期为进一步揭示DoDELLA蛋白在铁皮石斛种子萌发过程的作用奠定基础。
1. 材料与方法
1.1 植物材料及取样
铁皮石斛材料取自上海浦东孙桥农业园区铁皮石斛种植基地,选取雁荡山青杆品系经过人工授粉后形成的成熟蒴果,于2023年11月18日采集,清洗后转移至超净台,吸干水分,用镊子夹紧果柄一端,另一端剪开一小口,轻敲镊子使种子抖入冻存管,液氮速冻后置于−80 ℃冰箱保存备用。
1.2 铁皮石斛种子RNA的提取及酵母双杂交文库的构建
采用CTAB法提取总RNA。在1.5 mL离心管中加入600 μL CTAB裂解液。种子在液氮中研磨成粉末,转移到CTAB裂解液中,涡旋震荡混匀,42 ℃水浴90 min;加入700 μL预冷的氯仿-异戊醇混合液,混匀,4 ℃,13 000 r/m,离心15 min;转移600 μL上清液到新的1.5 mL离心管,加入600 μL 4 mol/L LiCl和300 μL无水乙醇,放至−20 ℃冰箱90 min;然后离心15 min,弃上清;在沉淀中加入700 μL 预冷的2 mol/L LiCl,离心15 min,弃上清;75%乙醇洗涤沉淀;晾干,加入适量RNA-酶free H2O溶解,电泳检测后于−80 ℃保存。参考GenElute™ Direct mRNA Miniprep Kit (Sigma-Aldrich,美国)说明书,分离mRNA,1%琼脂糖凝胶电泳检测后,用于文库构建。
酵母双杂交文库的构建参照CloneMiner™ Ⅱ cDNA Library Construction Kit (Invitrogen,美国)说明书,将mRNA进行反转录,合成双链cDNA,再连接attB1重组接头,合成含有接头的双链cDNA。通过色谱柱分级法将cDNA分级分离并回收,进一步利用BP Clonase® Ⅱ enzyme mix进行BP反应并连接pDONR222载体,将反应产物转入大肠杆菌DH10B感受态细胞中,得到初级文库。随机挑取24个单克隆,进行PCR扩增,电泳检测重组率及插入片段长度。
利用EZgene™ Plasmid Midiprep Kit Ⅱ抽提初级文库质粒,将得到的质粒利用LR Clonase Ⅱ Mix进行LR反应,以及与pGADT7-DEST载体的连接,连接产物转入大肠杆菌DH10B感受态细胞中,得到次级文库。按照上述方法鉴定库容量、重组率及插入片段的长度。
1.3 诱饵载体pGBKT7-DoDELLA4的构建
根据DoDELLA4基因序列和pGBKT7载体序列,设计带酶切位点的特异性引物,上游引物pGBKT7-DoDELLA4-F为:5′-TCAGAGGAGGACCTGCATATG-GACGAGAGTTCGTACGGTCAGG-3′,下游引物pGBKT7-DoDELLA4-R为:5′-CCGCTGCAGGTCGACGGATCCCTACTCTCGCCGGTCAGAACC-3′。利用高保真酶扩增DoDELLA4基因的全长序列,胶回收PCR产物;提取pGBKT7载体质粒,在37 ℃条件下使用限制性内切酶Nde Ⅰ和BamH Ⅰ对载体进行双酶切,胶回收纯化线性化的载体,利用无缝连接酶将上述PCR产物与线性化载体在50 ℃条件下连接5 min,连接产物转入大肠杆菌感受态,挑取单菌落进行测序,提取测序正确的pGBKT7-DoDELLA4重组质粒,保存菌株。
1.4 诱饵载体pGBKT7-DoDELLA4毒性及自激活检测
参照Yeastmaker™ Yeast Transformation System 2(Takara,日本)制备和转化酵母感受态细胞。利用LiAc转化法,将诱饵载体pGBKT7-DoDELLA4和空载载体pGBKT7分别转入Y2HGold酵母感受态,进行毒性检测。转化后的酵母菌液涂布于SD/-Trp平板,30 ℃倒置培养2~3 d,对比Y2HGold(pGBKT7-DoDELLA4)和Y2HGold(pGBKT7)在SD/Trp缺陷培养基上的生长情况,判断诱饵载体对酵母是否有毒性。
分别以pGBKT7-53+pGADT7-T和pGBKT7-Lam+pGADT7-T作为阳性对照和阴性对照,pGBKT7-DoDELLA4+pGADT7作为自激活检测组,将对照组和自激活检测组共转化到Y2HGold酵母感受态,进行自激活检测。转化后的酵母菌液涂布于SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade缺陷培养基,30 ℃倒置培养3~5 d,观察酵母生长情况,判断诱饵载体是否存在自激活情况。
若诱饵载体存在自激活性,可在缺陷培养基中添加适量的HIS3竞争性抑制剂3-AT进行抑制,将含有pGBKT7-DoDELLA4+pGADT7质粒的Y2HGold酵母菌液分别涂布在含有5、10、20、30、40、60、80 mmol/L 3-AT的SD/-Trp/-Leu/-His/-Ade缺陷培养基上,30 ℃倒置培养3~5 d,观察酵母生长情况。
1.5 酵母双杂交文库筛选
取10 μg铁皮石斛种子cDNA文库质粒与5 μg诱饵质粒pGBKT7-DoDELLA4, LiAc转化法转化至Y2HGold酵母感受态。在SD/-Trp/-Leu/-His/-Ade/3-AT(20 mmol/L)平板上,30 ℃倒置培养3~5 d,单克隆长至1~2 mm大小,初筛完成。为了去除假阳性,进行二次筛选,将初筛平板上的单克隆点到SD/-Trp/-Leu/-His/-Ade/X-α-Gal/3-AT (20 mmol/L)平板上,30 ℃培养3~5 d,挑取颜色变蓝的菌落进行PCR并测序。
1.6 互作蛋白的验证
克隆候选互作蛋白基因的CDS序列,重新构建pGADT7质粒,将pGADT7-候选互作蛋白质粒与诱饵质粒pGBKT7-DoDELLA4共转化于Y2HGold酵母感受态中,涂布SD/-Trp/-Leu缺陷培养基,30 ℃培养3~5 d,挑取单克隆重悬于0.9%的 NaCl溶液中,按梯度稀释,转接到SD/-Trp/-Leu、SD/-Trp/-Leu/-His/-Ade/3-AT和SD/-Trp/-Leu/-His/-Ade/X-α-Gal/3-AT缺陷培养基。30 ℃倒置培养3~5 d,以pGBKT7-53+pGADT7-T为阳性对照,pGBKT7-Lam+pGADT7-T为阴性对照,观察酵母生长及显色情况。
2. 结果与分析
2.1 酵母文库的构建及鉴定
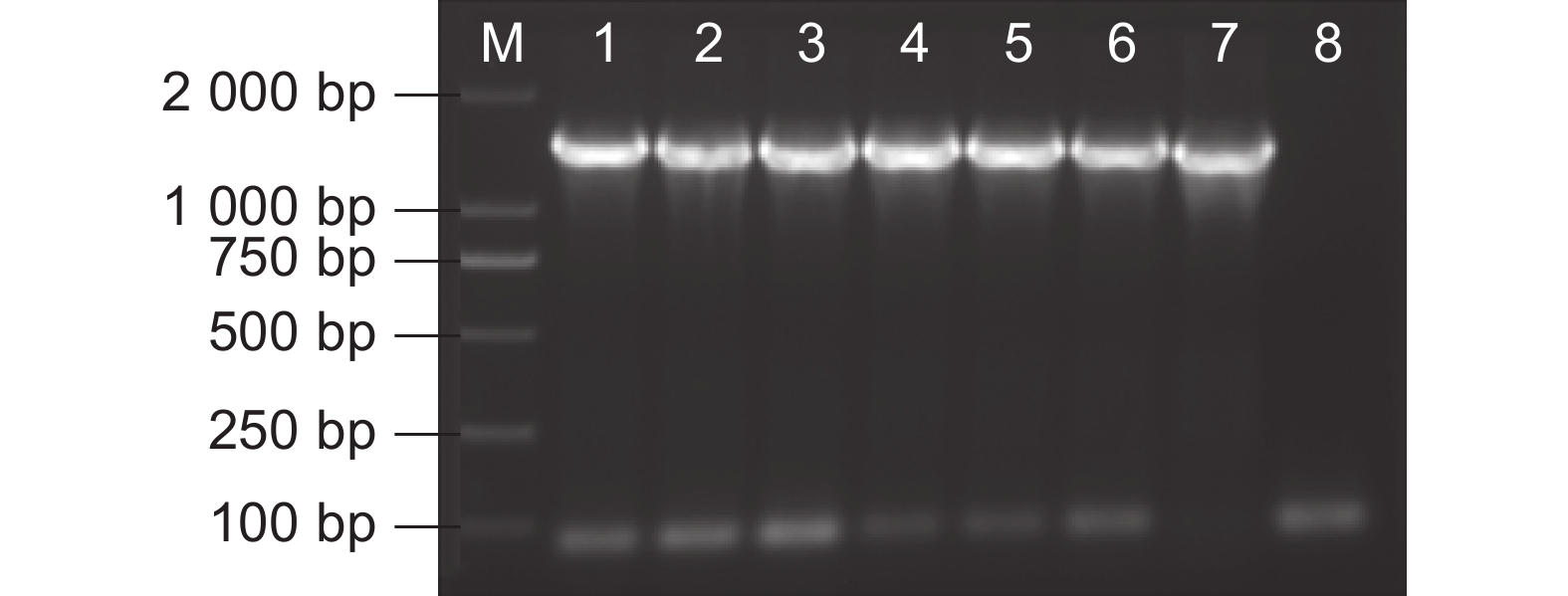
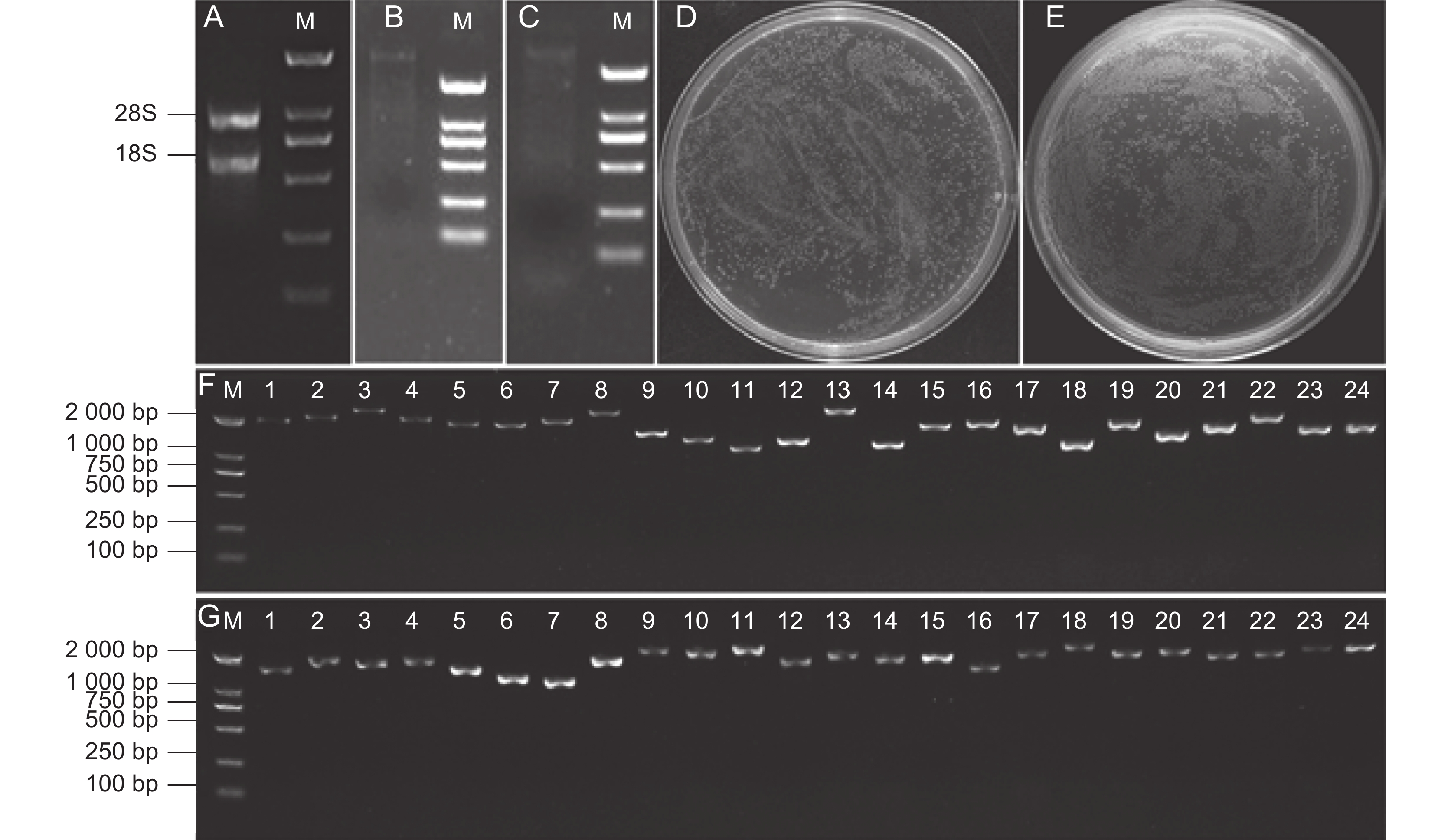
采用CTAB法提取铁皮石斛种子的总RNA,电泳显示总RNA的28S和18S两条主带完整清晰,没有弥散(图1:A)。分离纯化mRNA(图1:B),反转录合成双链cDNA,电泳检测cDNA的质量较好(图1:C)。将cDNA与attB1重组接头连接,BP重组反应连接pDONR222载体后,转化涂板,获得初级文库,共1 600个单克隆,得到的文库库容量为1.28×107 CFU(图1:D),随机挑取24个克隆进行PCR扩增,发现插入片段平均长度 大于1 000 bp(图1:F),重组率为100%,达到初级文库要求。
![]() 图 1 酵母双杂交文库构建A~C:总RNA、mRNA、cDNA;D、E:初级文库和次级文库;F、G:初级文库和次级文库的插入片段PCR检测。M:DNA分子量标准。Figure 1. Yeast two-hybrid library constructionA-C: Total RNA, mRNA, and double-stranded cDNA; D-E: Primary and secondary library capacity identification; F,G: PCR detection of primary and secondary library inserts. M: DNA molecular weight marker.
图 1 酵母双杂交文库构建A~C:总RNA、mRNA、cDNA;D、E:初级文库和次级文库;F、G:初级文库和次级文库的插入片段PCR检测。M:DNA分子量标准。Figure 1. Yeast two-hybrid library constructionA-C: Total RNA, mRNA, and double-stranded cDNA; D-E: Primary and secondary library capacity identification; F,G: PCR detection of primary and secondary library inserts. M: DNA molecular weight marker.将初级文库质粒与pGADT7-DEST载体进行LR反应,转化涂板,获得次级文库,共1 500个单克隆,计算库容量为1.20×107 CFU(图1:E),随机挑取24个克隆进行菌落PCR扩增,片段平均长度大于1 000 bp(图1:G),重组率为100%,以上结果表明所构建的cDNA文库满足酵母双杂交筛选条件。
2.2 诱饵载体pGBKT7-DoDELLA4的构建
扩增DoDELLA4基因的CDS序列,与线性化的pGBKT7载体连接后,转化大肠杆菌感受态。37 ℃倒置培养,挑取6个单克隆进行鉴定,结果显示均为阳性克隆(图2)。测序结果显示,DoDELLA4基因插入到pGBKT7载体的正确位置,且无移码突变,表明诱饵载体构建成功。
2.3 诱饵载体毒性及自激活分析
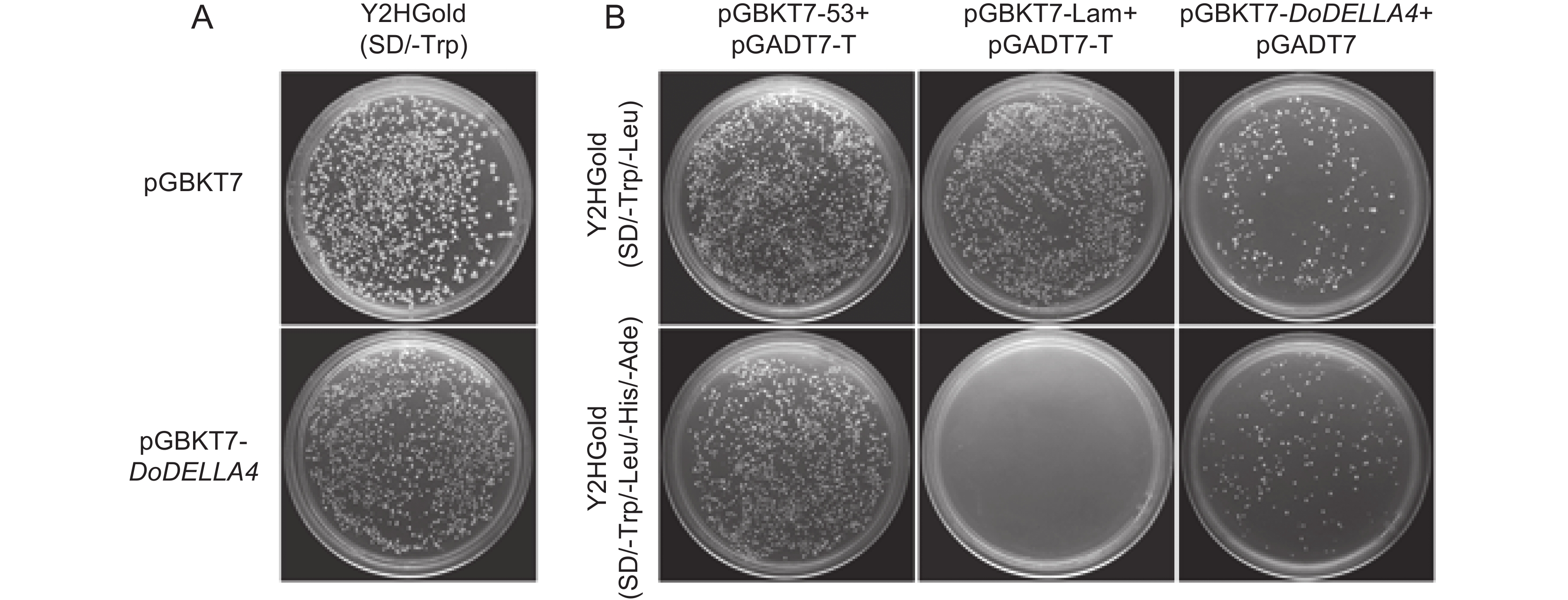
以空载质粒pGBKT7为对照,将诱饵载体转入Y2HGold酵母感受态,涂布于SD/-Trp平板上,结果显示,诱饵载体转入Y2HGold酵母后,菌落生长情况与对照一致(图3:A),表明诱饵载体对酵母细胞无毒性。
为避免假阳率过高,进一步检测诱饵载体是否存在自激活现象。将不同质粒组合转入Y2HGold酵母菌株,分别涂布于SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade平板上,结果显示(图3:B),阳性对照在两种平板上均能生长,阴性对照只在SD/-Trp/-Leu平板上生长,说明对照组正常。自激活检测组pGBKT7-DoDELLA4+pGADT7在SD/-Trp/-Leu平板上生长,说明共转化是成功的,同时也能在SD/-Trp/-Leu/-His/-Ade平板上生长,说明诱饵载体具有自激活性。
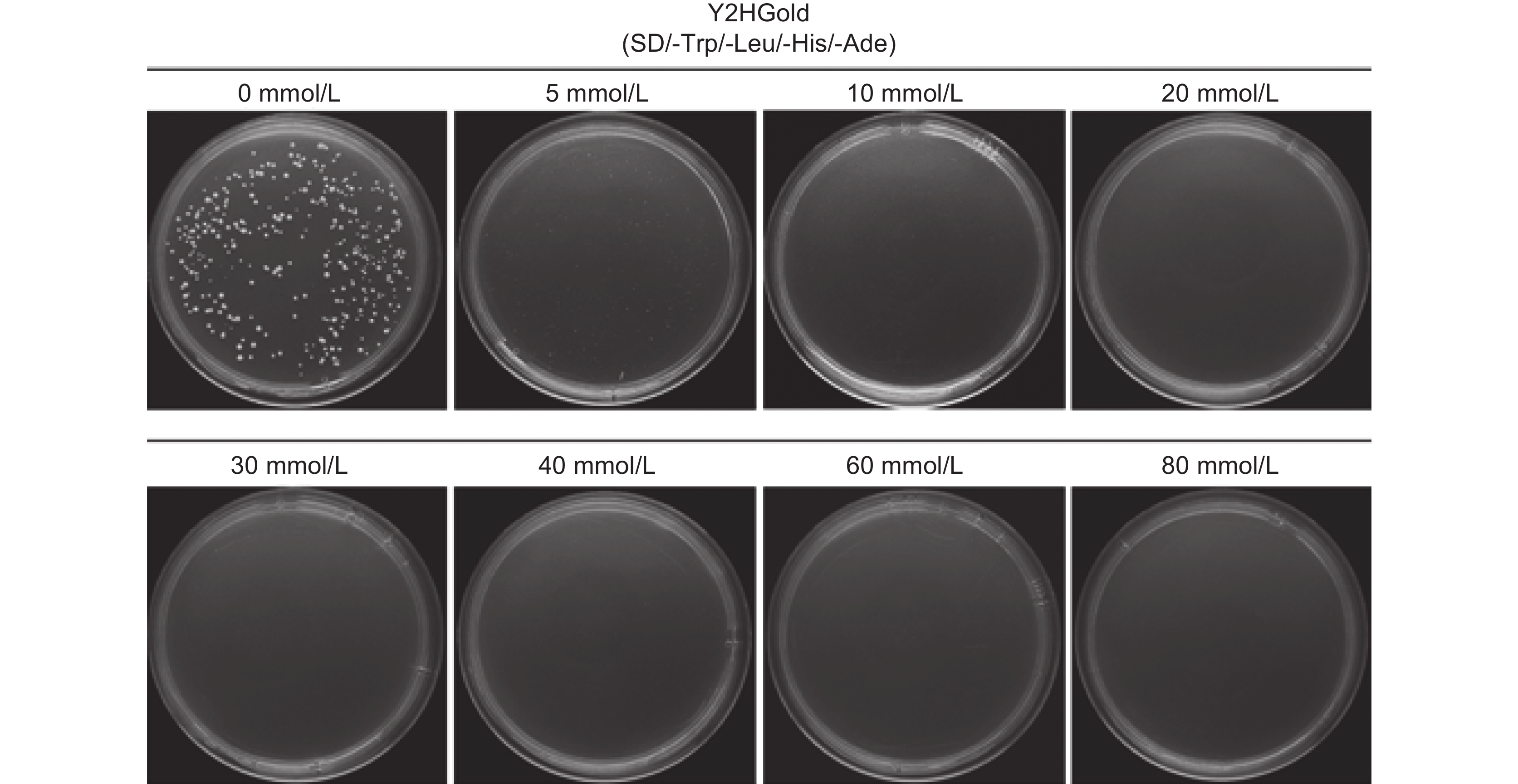
为了抑制诱饵载体的自激活性,在SD/-Trp/-Leu/-His/-Ade平板中分别加入不同浓度的3-AT。结果发现,浓度为20 mmol/L的3-AT能够抑制诱饵载体的自激活现象(图4)。
2.4 酵母双杂交筛选候选互作蛋白
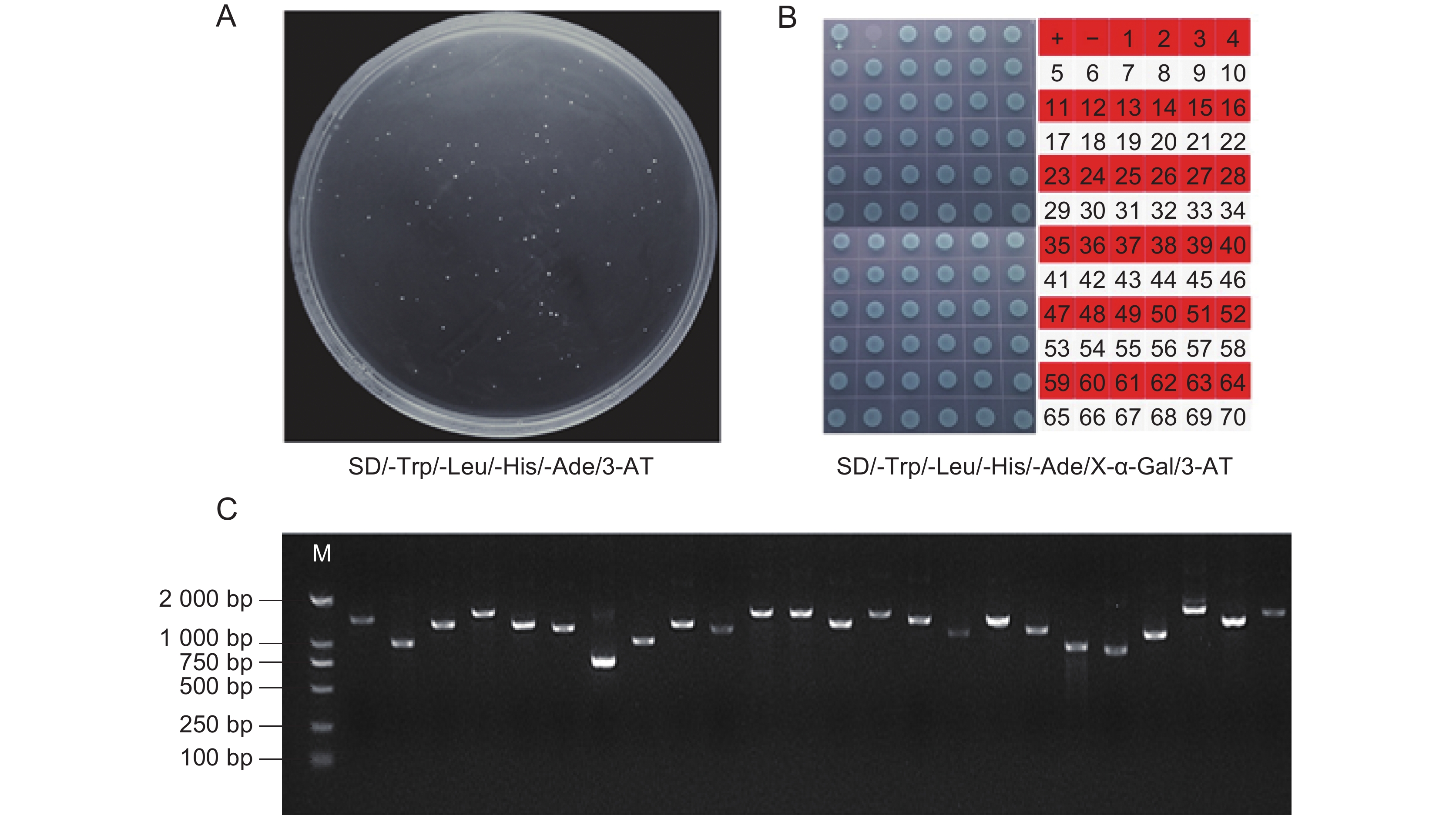
将诱饵质粒pGBKT7-DoDELLA4与铁皮石斛cDNA文库质粒共转化入Y2HGold酵母感受态,涂布于SD/-Trp/-Leu/-His/-Ade/3-AT (20 mmol/L)缺陷培养进行初筛,共获得70个克隆(图5:A),将这些克隆在SD/-Trp/-Leu/-His/-Ade/X-α-Gal/3-AT(20 mmol/L)平板上进行复筛,发现70个克隆均能生长且变蓝(图5:B)。挑取这些单克隆进行菌落PCR,部分结果见图5:C。将阳性克隆进行测序,测序结果在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中进行比对后,最终得到70个候选互作蛋白(附表1
1 ))。2.5 点对点互作验证
从候选互作蛋白中选取出现频率较高的7个蛋白进行互作验证,蛋白具体信息见表1。从NCBI数据库中下载编码这些候选互作蛋白的CDS序列,设计特异性引物,扩增目的片段,并与线性化的pGADT7载体进行连接,最终得到7个重组猎物载体。
表 1 互作蛋白的功能注释Table 1. Functional annotation of interacting proteins编号
No.GenBank 登录号
GenBank Accession Number基因注释
Gene annotation基因名
Gene4 XM_020850203.2 脱水蛋白DHN4 DoDHN4 6 XM_028692804.1 早期光诱导蛋白1,叶绿体 DoELIP1 13 XM_020828349.2 油体蛋白S2-2 DoOLES2-2 14 XM_020837109.2 多聚泛素蛋白 DoUBQ 21 XM_028698338.1 含锌指CCCH结构域蛋白2 DoTZF 27 XM_020849176.2 未表征蛋白 5807 39 XM_020825139.1 富含甘氨酸蛋白A3 DoGRPA3 将诱饵载体pGBKT7-DoDELLA4和7个猎物载体分别共转化到Y2HGold酵母感受态,挑取阳性克隆进行点对点互作验证。结果显示(图6),实验组和对照组均能在SD/-Trp/-Leu平板上正常生长,而在SD/-Trp/-Leu/-His/-Ade/3-AT (20 mmol/L)平板上,则只有阳性对照和实验组(pGADT7-DoELIP1、pGADT7-5807、pGADT7-DoTZF、pGADT7-DoUBQ、pGADT7-DoGRPA3)能够正常生长,且在SD/-Trp/-Leu/-His/-Ade/X-α-Gal/3-AT平板上颜色变蓝。这些结果说明,DoELIP1、5807、DoTZF、DoUBQ、DoGRPA3等5个蛋白分别与DoDELLA4蛋白存在互作关系。
3. 讨论
铁皮石斛是一种具有景天酸代谢途径(Crassulacean acid metabolism,CAM)的植物,能够有效抵抗低温、高盐、干旱等非生物胁迫。刘博婷等[18]利用RNA-seq技术研究了铁皮石斛DcAI基因家族在低温胁迫下的表达模式,推测DcAIs通过调控基因表达,增加细胞内可溶性多糖的含量,从而提高铁皮石斛的低温耐受性。Zhang等[19]发现,铁皮石斛可通过减缓生长、积累相容性溶质以及增加根中过量Na+的排出来适应盐胁迫。Huang等[20]则指出,轻度缺水可激活铁皮石斛的激素信号转导途径,而严重干旱胁迫则会启动类黄酮生物合成途径。本研究通过Gateway重组技术构建了铁皮石斛种子的cDNA文库,并筛选出与DoDELLA蛋白潜在互作的蛋白,为解析DoDELLA基因的功能及作用机制提供了基础。然而,酵母双杂交筛库过程中可能存在假阳性问题,需通过一对一验证以及双分子荧光互补(BiFC)、免疫共沉淀(Co-IP)、pull-down等体内外蛋白互作实验进一步鉴定。
本研究共筛选到70个可能与DoDELLA相互作用的候选蛋白,包括肽基脯氨酰顺反异构酶FKBP12、类脱水蛋白DHN4、类几丁质酶蛋白1、GATA转录因子20、叶绿体DCL蛋白、以及早期光诱导蛋白1(ELIP1)等。早期研究发现,转录因子DAG1的缺失会导致叶绿体蛋白如ELIP1和ELIP2的失调,进而影响拟南芥种子的萌发。在非生物胁迫下,单突变体elip1种子的萌发率较低,而elip2种子的萌发率较高;DAG1的缺失则提高了elip1 elip2双突变体种子的萌发率[21]。
另一个候选互作蛋白——多聚泛素蛋白,则主要参与泛素/26S蛋白酶体途径中的蛋白质水解,进而影响植物生长发育的多项生理活动[22]。脱落酸(ABA)和GA在植物生长发育的多个阶段发挥重要调控作用,尤其是在调节种子萌发过程中不可或缺。DELLA蛋白是GA信号通路的抑制子,当植物接收到GA信号时,F-box蛋白(SLY1)介导DELLA蛋白的泛素化降解,从而解除其对生长的抑制作用[23]。在种子萌发过程中,ABI5作为ABA信号传导途径的下游组分,其表达也受到泛素化的调节。RPN10通过指导特定蛋白质进入26S蛋白酶体进行降解,影响拟南芥的诸多调节过程。当RPN10亚基发生突变时,rpn10-1突变体表现出类似过表达ABI5的表型,如种子萌发率降低、生长速度减缓、雄蕊数量减少等,且对ABA超敏感。RPN10的突变影响了ABI5基因的转录水平,导致ABI5蛋白的降解受阻[24]。
本研究筛选到的候选蛋白包括XM_028698338.1编码的含锌指CCCH结构域蛋白2。研究表明,拟南芥AtTZF4、AtTZF5和AtTZF6基因通过调控对ABA和GA响应至关重要的基因,从而影响种子的萌发[25]。CpC3H3基因可能通过与其他开花基因互作或影响开花信号途径中的关键因子来调控蜡梅(Chimonanthus praecox (L.) Link)开花[26]。SOM编码位于细胞核的CCCH型锌指蛋白,其通过调节ABA和GA代谢基因的表达影响种子萌发。SOM还参与植物色素信号转导途径,调节PIL5下游的激素代谢基因[27]。SOMNUS/AGL67/EBS复合物通过表观修饰激活SOMNUS表达,抑制高温胁迫下的种子萌发[28]。水稻中SOMNUS的同源基因OsZFL1在干种子中高表达,吸胀后表达水平迅速下降,推测其与种子萌发及发育相关[29]。本研究鉴定发现,DoTZF蛋白与DoDELLA蛋白存在互作。CCCH型锌指蛋白在植物生长发育调控中具有重要作用,而DoTZF是否参与调控铁皮石斛种子的萌发尚需进一步研究。
此外,本研究筛选到了XM_020825139.1编码的富含甘氨酸蛋白A3(GRP)。GRPs(Glycine-rich proteins)是一类广泛存在于植物体内的蛋白质,富含高度重复的甘氨酸序列[30]。在冷胁迫下,AtGRP2促进拟南芥种子的萌发[31];在盐或脱水胁迫下,AtGR-RBP4则延缓拟南芥种子的萌发[32]。AtRZ-1a基因通过调控萌发相关基因的表达影响拟南芥种子的萌发,在盐或干旱胁迫下,过表达AtRZ-1a的拟南芥转基因植株种子萌发迟缓,而敲除AtRZ-1a基因的突变体则表现出更强的萌发和生长能力[33]。研究者还从中国樱桃(Prunus pseudocerasus Lindl.)的转录组数据库中筛选到3个GRP编码基因(PpcGRP4、PpcGRP6、PpcGRP7),其中,过表达PpcGRP6和PpcGRP7基因均能显著促进拟南芥种子的萌发[34]。
除了上述已注释的蛋白外,本研究还筛选到1个与DoDELLA蛋白存在互作的未表征蛋白(XM_020849176.2),该蛋白在铁皮石斛生长发育中的具体功能尚不清楚。因此,深入探究DoDELLA与互作蛋白之间的分子互作机制,对于理解DoDELLA基因的功能及其在铁皮石斛生长调控中的作用具有重要意义。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
图 1 酵母双杂交文库构建
A~C:总RNA、mRNA、cDNA;D、E:初级文库和次级文库;F、G:初级文库和次级文库的插入片段PCR检测。M:DNA分子量标准。
Figure 1. Yeast two-hybrid library construction
A-C: Total RNA, mRNA, and double-stranded cDNA; D-E: Primary and secondary library capacity identification; F,G: PCR detection of primary and secondary library inserts. M: DNA molecular weight marker.
表 1 互作蛋白的功能注释
Table 1 Functional annotation of interacting proteins
编号
No.GenBank 登录号
GenBank Accession Number基因注释
Gene annotation基因名
Gene4 XM_020850203.2 脱水蛋白DHN4 DoDHN4 6 XM_028692804.1 早期光诱导蛋白1,叶绿体 DoELIP1 13 XM_020828349.2 油体蛋白S2-2 DoOLES2-2 14 XM_020837109.2 多聚泛素蛋白 DoUBQ 21 XM_028698338.1 含锌指CCCH结构域蛋白2 DoTZF 27 XM_020849176.2 未表征蛋白 5807 39 XM_020825139.1 富含甘氨酸蛋白A3 DoGRPA3 -
[1] Wen CK,Chang C. Arabidopsis RGL1 encodes a negative regulator of gibberellin responses[J]. Plant Cell,2002,14(1):87−100. doi: 10.1105/tpc.010325
[2] Zhang YH,Bian XF,Zhang SB,Ling J,Wang YJ,et al. Identification of a novel gain-of-function mutant allele,slr1-d5,of rice DELLA protein[J]. J Integr Agr,2016,15(7):1441−1448. doi: 10.1016/S2095-3119(15)61208-4
[3] Yuan YX,Wang LX,Zhao QY,Liu CW,Fu X,et al. Genome-wide identification,expression analysis and functional study of DELLA genes in Chinese cabbage (Brassica rapa L. ssp. pekinensis)[J]. Front Biosci (Landmark Ed),2024,29(5):198. doi: 10.31083/j.fbl2905198
[4] 岳溶榕. 梨单性结实相关DELLA基因的功能分析[D]. 咸阳:西北农林科技大学,2019:32−38. [5] 李露露. 谷子DELLA基因的鉴定、克隆与功能分析[D]. 太原:山西农业大学,2022:29−46. [6] Hussain A,Peng JR. DELLA proteins and GA signalling in Arabidopsis[J]. J Plant Growth Regul,2003,22(2):134−140. doi: 10.1007/s00344-003-0028-5
[7] Lim S,Park J,Lee N,Jeong J,Toh S,et al. ABA-insensitive3,ABA-insensitive5,and DELLAs interact to activate the expression of SOMNUS and other high-temperature-inducible genes in imbibed seeds in Arabidopsis[J]. Plant Cell,2013,25(12):4863−4878.
[8] 赵春丽,王晓,陈家兰,陈何,王乐,等. 植物DELLA蛋白家族研究进展[J]. 应用与环境生物学报,2020,26(5):1299−1308. Zhao CL,Wang X,Chen JL,Chen H,Wang L,et al. Progress in research on plant DELLA family proteins[J]. Chinese Journal of Applied and Environmental Biology,2020,26(5):1299−1308.
[9] Cheng H,Qin LJ,Lee S,Fu XD,Richards DE,et al. Gibberellin regulates Arabidopsis floral development via suppression of DELLA protein function[J]. Development,2004,131(5):1055−1064. doi: 10.1242/dev.00992
[10] 于磊. 水曲柳DELLA家族基因应答低温胁迫及参与被动休眠调控研究[D]. 哈尔滨:东北林业大学,2021:51−70. [11] Eriksson S,Böhlenius H,Moritz T,Nilsson O. GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation[J]. Plant Cell,2006,18(9):2172−2181. doi: 10.1105/tpc.106.042317
[12] Yamaguchi S. Gibberellin metabolism and its regulation[J]. Annu Rev Plant Biol,2008,59:225−251. doi: 10.1146/annurev.arplant.59.032607.092804
[13] Davière JM,Achard P. Gibberellin signaling in plants[J]. Development,2013,140(6):1147−1151. doi: 10.1242/dev.087650
[14] Ito T,Okada K,Fukazawa J,Takahashi Y. DELLA-dependent and -independent gibberellin signaling[J]. Plant Signal Behav,2018,13(3):e1445933. doi: 10.1080/15592324.2018.1445933
[15] Tyler L,Thomas SG,Hu JH,Dill A,Alonso JM,et al. DELLA proteins and gibberellin-regulated seed germination and floral development in Arabidopsis[J]. Plant Physiol,2004,135(2):1008−1019. doi: 10.1104/pp.104.039578
[16] 马庆,付强,杨银,陈兰娅,陈海,等. 铁皮石斛分子生物学研究进展[J]. 山地农业生物学报,2023,42(4):45−50. Ma Q,Fu Q,Yang Y,Chen LY,Chen H,et al. A review of molecular biology of Dendrobium officinale[J]. Journal of Mountain Agriculture and Biology,2023,42(4):45−50.
[17] 王美娟,赵千里,柏冰洋,向松竹,洪承昊. 铁皮石斛的组织培养及种植技术研究进展[J]. 中南农业科技,2023,44(1):217−221. doi: 10.3969/j.issn.1007-273X.2023.01.054 [18] 刘博婷,唐演儿,李琳,林一帆,李学诗,等. 铁皮石斛酸性蔗糖转化酶基因家族鉴定及低温下表达分析[J]. 江苏农业科学,2022,50(24):33−42. [19] Zhang MZ,Liu N,da Silva JAT,Liu XC,Deng RF,et al. Physiological and transcriptomic analysis uncovers salinity stress mechanisms in a facultative crassulacean acid metabolism plant Dendrobium officinale[J]. Front Plant Sci,2022,13:1028245. doi: 10.3389/fpls.2022.1028245
[20] Huang H,Jiao YX,Tong Y,Wang YH. Comparative analysis of drought-responsive biochemical and transcriptomic mechanisms in two Dendrobium officinale genotypes[J]. Ind Crop Prod,2023,199:116766. doi: 10.1016/j.indcrop.2023.116766
[21] Rizza A,Boccaccini A,Lopez-Vidriero I,Costantino P,Vittorioso P. Inactivation of the ELIP1 and ELIP2 genes affects Arabidopsis seed germination[J]. New Phytol,2011,190(4):896−905. doi: 10.1111/j.1469-8137.2010.03637.x
[22] 强承魁,凤舞剑,王胜永,赵虎,苏新林,周保亚. 拟南芥泛素家族的全基因组分析[J]. 基因组学与应用生物学,2010,29(5):969−975. Qiang CK,Feng WJ,Wang SY,Zhao H,Su XL,Zhou BY. Genome-wide analysis of ubiquitin family in Arabidopsis thaliana[J]. Genomics and Applied Biology,2010,29(5):969−975.
[23] McGinnis KM,Thomas SG,Soule JD,Strader LC,Zale JM,et al. The Arabidopsis SLEEPY1 gene encodes a putative F-box subunit of an SCF E3 ubiquitin ligase[J]. Plant Cell,2003,15(5):1120−1130. doi: 10.1105/tpc.010827
[24] Smalle J,Kurepa J,Yang PZ,Emborg TJ,Babiychuk E,et al. The pleiotropic role of the 26S proteasome subunit RPN10 in Arabidopsis growth and development supports a substrate-specific function in abscisic acid signaling[J]. Plant Cell,2003,15(4):965−980. doi: 10.1105/tpc.009217
[25] Bogamuwa S,Jang JC. The Arabidopsis tandem CCCH zinc finger proteins AtTZF4,5 and 6 are involved in light-,abscisic acid- and gibberellic acid-mediated regulation of seed germination[J]. Plant,Cell Environ,2013,36(8):1507−1519.
[26] 肖诗琪. 蜡梅CCCH型锌指蛋白基因CpC3H3在成花诱导中的功能研究[D]. 重庆:西南大学,2022:35−45. [27] Kim DH,Yamaguchi S,Lim S,Oh E,Park J,et al. SOMNUS,a CCCH-type zinc finger protein in Arabidopsis,negatively regulates light-dependent seed germination downstream of PIL5[J]. Plant Cell,2008,20(5):1260−1277. doi: 10.1105/tpc.108.058859
[28] Li P,Zhang QL,He DN,Zhou Y,Ni HH,et al. AGAMOUS-LIKE67 cooperates with the histone mark reader EBS to modulate seed germination under high temperature[J]. Plant Physiol,2020,184(1):529−545. doi: 10.1104/pp.20.00056
[29] 闫丽华. 水稻SOMNUS同源基因在光敏色素介导的光反应中的作用初探[D]. 烟台:烟台大学,2018:17−22. [30] 张水军,曾千春,卢秀萍,李文正. 植物富含甘氨酸蛋白的研究进展[J]. 中国农学通报,2010,26(14):54−58. Zhang SJ,Zeng QC,Lu XP,Li WZ. Progress on plant glycine-rich protein[J]. Chinese Agricultural Science Bulletin,2010,26(14):54−58.
[31] Kim JY,Park SJ,Jang B,Jung CH,Ahn SJ,et al. Functional characterization of a glycine-rich RNA-binding protein 2 in Arabidopsis thaliana under abiotic stress conditions[J]. Plant J,2007,50(3):439−451. doi: 10.1111/j.1365-313X.2007.03057.x
[32] Kwak KJ,Kim YO,Kang H. Characterization of transgenic Arabidopsis plants overexpressing GR-RBP4 under high salinity,dehydration,or cold stress[J]. J Exp Bot,2005,56(421):3007−3016. doi: 10.1093/jxb/eri298
[33] Kim YO,Pan S,Jung CH,Kang H. A zinc finger-containing glycine-rich RNA-binding protein,atRZ-1a,has a negative impact on seed germination and seedling growth of Arabidopsis thaliana under salt or drought stress conditions[J]. Plant Cell Physiol,2007,48(8):1170−1181. doi: 10.1093/pcp/pcm087
[34] 徐瑞. 中国樱桃富含甘氨酸RNA结合蛋白基因克隆与功能初鉴[D]. 金华:浙江师范大学,2018:36−47. -
其他相关附件
-
PDF格式
李琳 附表 点击下载(259KB)
-



 下载:
下载: