cDNA yeast library construction of Dendrobium officinale Kimura et Migo seeds and screening and analysis of DELLA interacting proteins
-
摘要:
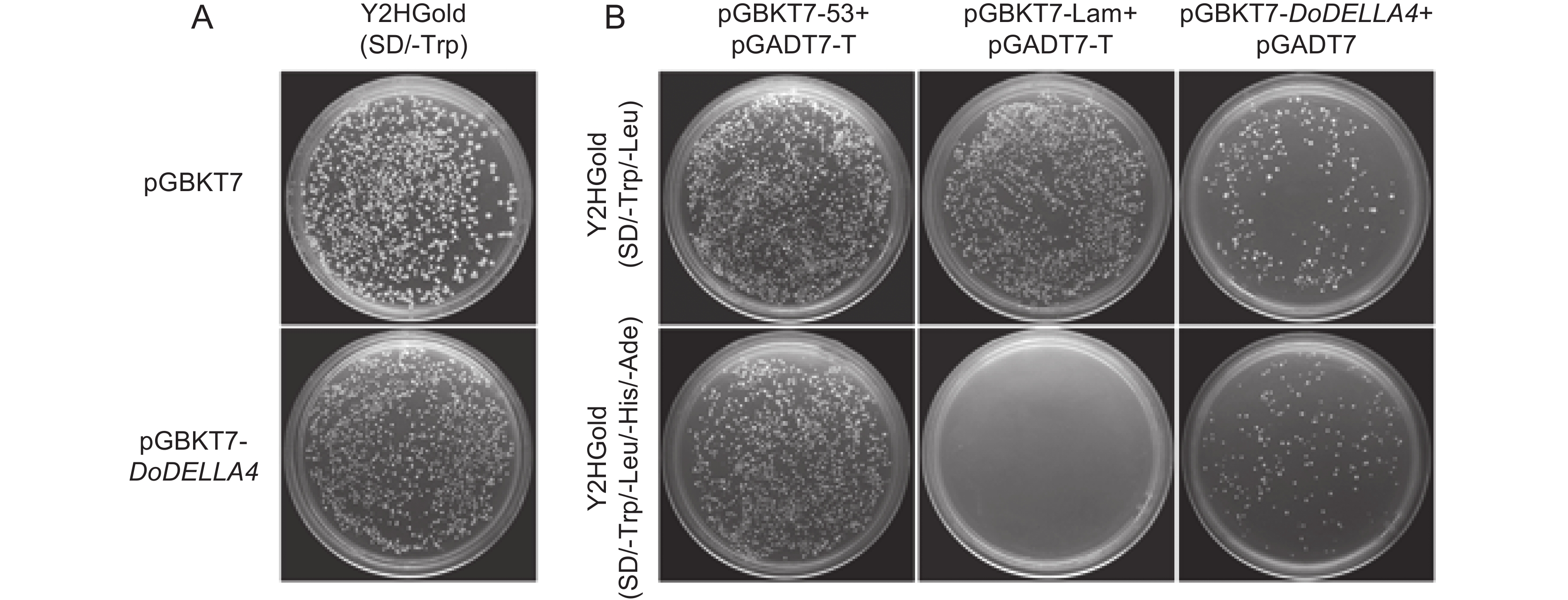
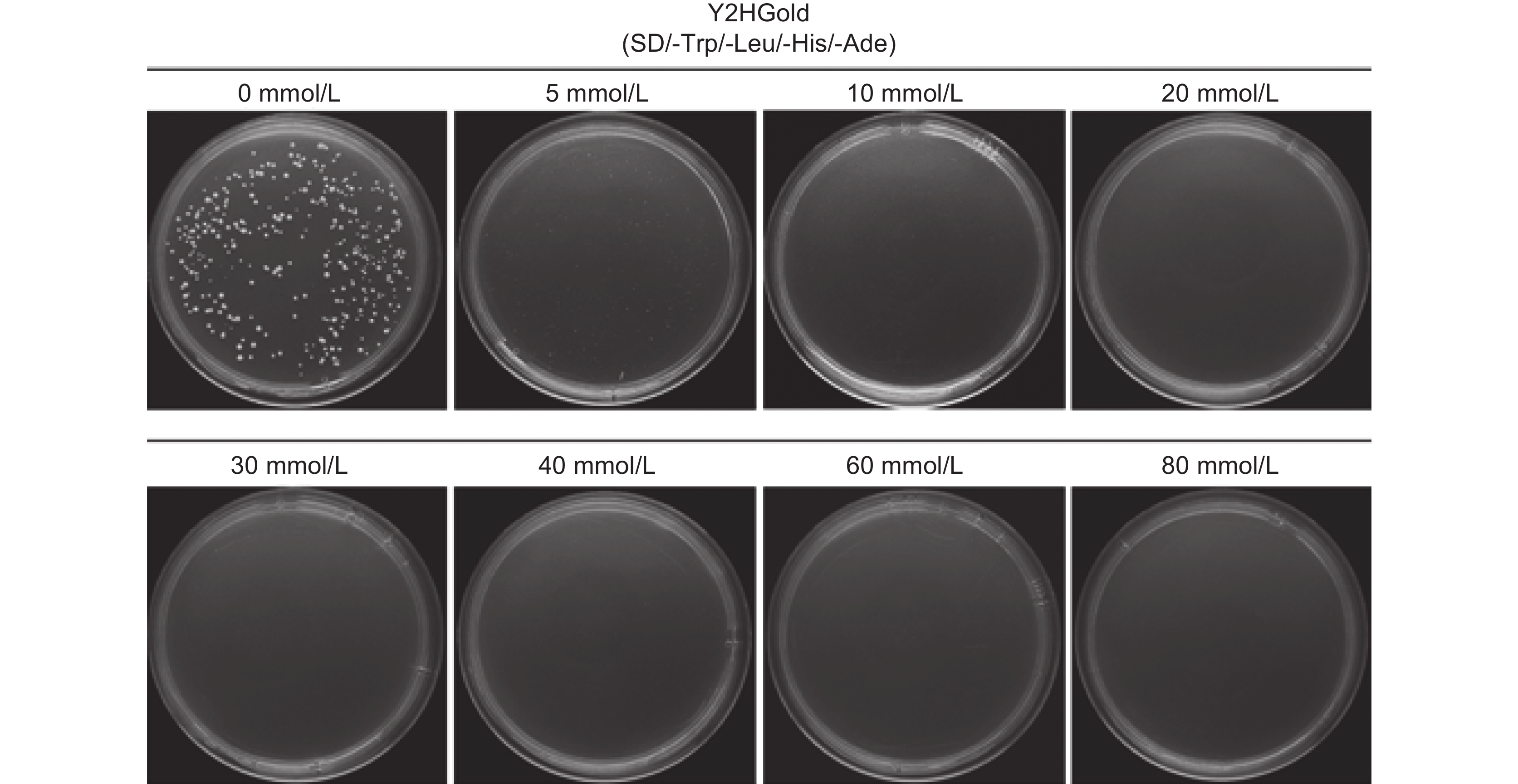
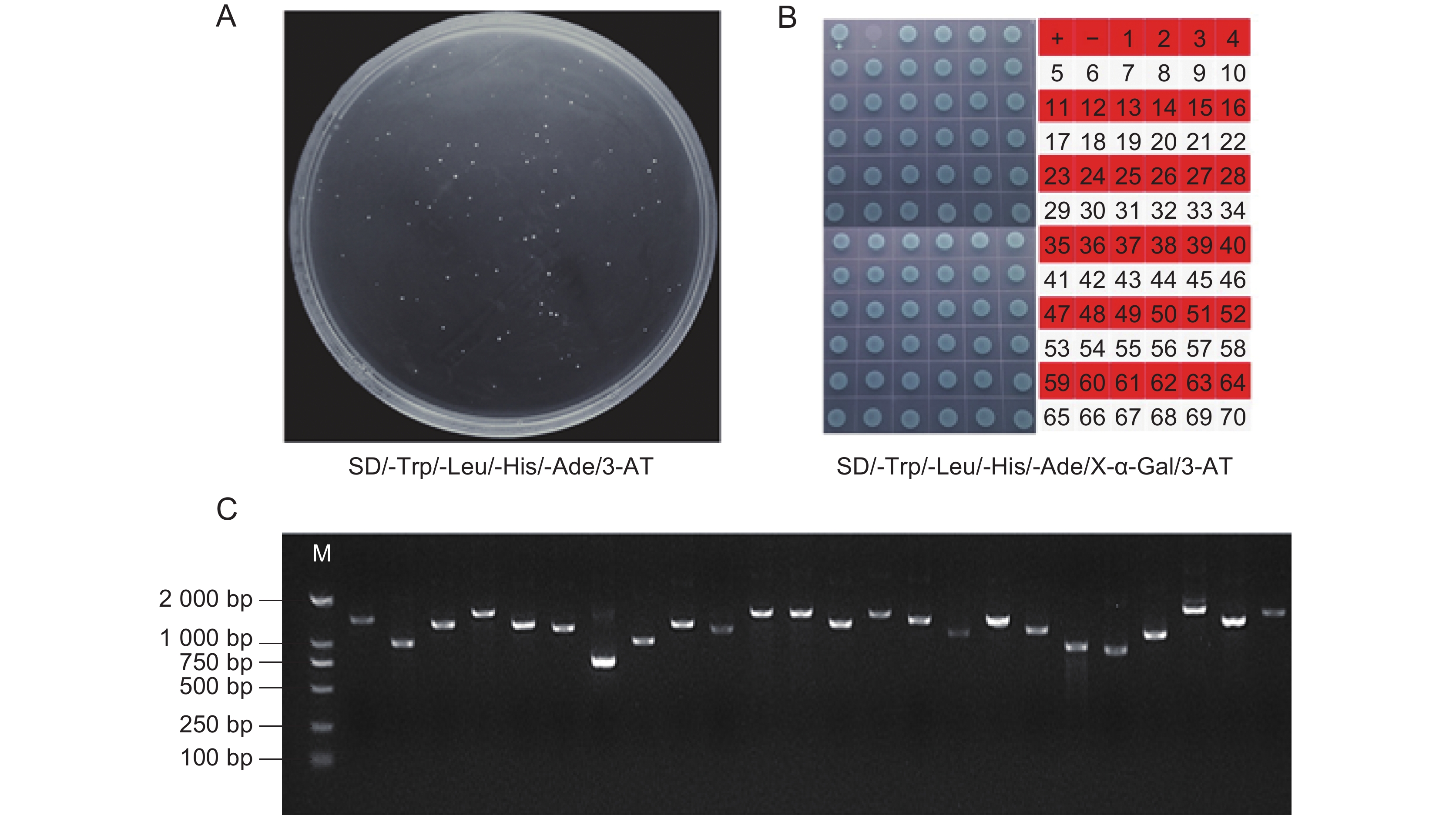
赤霉素(GA)广泛参与植物生命周期的各种生长过程,DELLA蛋白作为GA信号通路中的抑制子,对植物的生长发育起抑制作用。铁皮石斛(Dendrobium officinale Kimura et Migo)种子中高表达的DELLA家族基因可能与其种子自然萌发困难有关。为筛选铁皮石斛DoDELLA蛋白的互作蛋白,解析DoDELLA在种子萌发过程中的作用机制,本研究利用Gateway重组技术构建了铁皮石斛种子cDNA文库,采用同源重组的方法构建DoDELLA4重组诱饵载体,从cDNA文库中筛选DoDELLA4的互作蛋白。结果显示,铁皮石斛种子cDNA文库的库容量为1.20×107 CFU,平均插入片段大于1 000 bp,重组率100%。在SD/-Trp/-Leu/-His/-Ade培养基中添加20 mmol/L的3-AT可抑制重组诱饵载体pGBKT7-DoDELLA4的自激活。从文库中筛选获得了70个潜在的互作蛋白,通过酵母双杂交实验,验证了DoELIP1、5807、DoTZF、DoUBQ、DoGRPA3与DoDELLA4蛋白存在互作关系。研究结果为进一步探究DoDELLA基因调控铁皮石斛种子萌发的分子机制提供了基础。
Abstract:Gibberellins (GAs) regulate diverse growth processes throughout the plant life cycle. DELLA proteins function as key repressors in the GA signaling pathway, inhibiting plant growth and development. The high expression of DELLA family genes in Dendrobium officinale Kimura et Migo seeds may be related to their poor natural germination. To identify interacting proteins of DoDELLA and elucidate its role in seed germination, a cDNA library was constructed from D. officinale seeds using Gateway recombination technology. A recombinant bait vector for DoDELLA4 was generated using homologous recombination and used to screen interacting proteins from the cDNA library. The constructed library exhibited a capacity of 1.20×107 CFU, with an average insert size exceeding 1 000 bp and a recombination efficiency of 100%. The recombinant bait vector pGBKT7-DoDELLA4 effectively suppressed self-activation in SD/-Trp/-Leu/-His/-Ade medium supplemented with 20 mmol/L 3-AT. Screening identified 70 potential interacting proteins, and yeast two-hybrid assays confirmed interactions between DoDELLA4 and DoELIP1, 5807, DoTZF, DoUBQ, and DoGRPA3. These findings establish a foundation for further investigation into the molecular mechanisms by which DoDELLA regulates seed germination in D. officinale.
-
Keywords:
- Dendrobium officinale /
- Yeast two-hybrid /
- DoDELLA /
- Interacting proteins
-
植物组织培养是将离体器官、组织或细胞等在无菌条件下培养,使其重新分化发育成完整植株的技术,但有研究发现随着继代时间延长,继代培养物可能出现不同程度的退化现象[1]。如薛美凤等[2]研究发现,棉花(Gossypium hirsutum L.)胚性愈伤组织随着继代培养时间的延长,再生能力下降,不育率升高。王艳丽等[3]研究发现,长期继代培养下,黑松(Pinus thunbergii Parl.)愈伤组织发生和植株再生能力下降。Wang等[4]研究表明,天麻(Gastrodia elata Bl.)幼苗在长期无性繁殖下出现了形态退化和产量下降。研究表明,许多植物材料在继代培养1年以上时,培养物的形态发生能力和遗传稳定性等都可能会有较大程度的退化。
退化的发生可能与生理生化变化及遗传信息有关。都晓龙等[5]的研究表明,长期继代培养下,水稻(Oryza sativa L.)的愈伤组织再生率与分化率显著下降,与抗氧化酶活性变化有关。王胤和姚瑞玲[6]的研究发现,长期继代培养下,植物生长素与赤霉素比例失衡,造成马尾松(Pinus massoniana Lamb.)继代芽生根能力衰退。董静等[7]的研究指出,在长期继代培养后,生理生化代谢活性下降,如可溶性糖、可溶性蛋白含量上升,淀粉酶活性下降,导致楸树(Catalpa bungei C. A. Mey.)愈伤组织分化再生困难。
苍术为菊科茅苍术(Atractylodes lancea (Thunb.) DC.)或北苍术(A. chinensis (DC.) Koidz.)的干燥根茎[8],具有燥湿健脾,祛风散寒,明目等功效。现代药理学研究表明,茅苍术具有促进肠胃运动、抗缺氧、抗血糖、抗菌、抗病毒等作用[9]。江苏茅山一带是茅苍术传统道地产区,但自20世纪80年代以来,茅苍术野生资源受到掠夺性采挖,目前已难觅踪迹,无法为市场提供药材货源。栽培苍术夏季高温季节地上部分早枯,造成结实率较低,且种子育苗过程病害严重,种子苗产量低[10]。因此,生产上多采取根茎切块无性繁殖,但多代无性繁殖易出现种质退化,造成药材产量降低、品质下降。
本研究以茅苍术组培苗为材料,在无菌环境下探究长期多代培养后,其组培苗的表型特征、生理生化与基因表达的改变,以期为初步揭示茅苍术无性繁殖退化的可能机制奠定理论基础。
1. 材料与方法
1.1 实验材料
于2021年11月采集江苏茅山的野生茅苍术种子,经湖北中医药大学刘合刚教授鉴定为菊科植物茅苍术的种子。将采集的茅苍术种子冲洗消毒,剥去种皮,将消毒之后的胚接种到灭菌培养基中,培养在适宜条件的培养箱中,生长4个月后得到大小适宜的0代茅苍术组培苗。
在实验室无菌条件下,将0代组培苗取出,每株组培苗按不定芽生长方向分切,切成大小相近的多株组培苗,并接种到无菌培养基中。后续每30 d进行一次继代工作,并收集第3、10、17代苗龄30 d的茅苍术组培苗样本,液氮冷冻,于−80 ℃保存待用。
1.2 测定方法
1.2.1 形态学指标
随机选取第3、10、17代的茅苍术组培苗,在苗龄30 d时,将组培苗从瓶中取出,用吸水纸吸干表面水分,测定外观形态特征数据。利用游标卡尺直接测定组培苗的株高;利用分析天平直接测定组培苗的生物量,并计算增殖率;利用纸片比重法测定组培苗的叶面积,同时测量叶片长度与宽度,计算长宽比,每组6个重复。
1.2.2 生理生化指标
利用Flour Pen 100便携式叶绿素荧光仪测定叶绿素荧光参数,取第3、10、17代茅苍术组培苗,苗龄30 d时位于中部的完全展开叶,将叶片暗处理30 min后测定OJIP值,包括:初始荧光(Fo)、最大荧光(Fm)和最大光化学速率(Fv/Fm),每组设置6个重复。
利用蒽酮比色法[11]测定可溶性糖的含量;利用考马斯亮蓝-G250法[12]测定可溶性蛋白的含量。利用试剂盒(北京盒子生工科技有限公司)测定过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性,以及胁迫物过氧化氢(H2O2)与丙二醛(MDA)的含量。利用酶联免疫分析试剂盒(江苏酶免实业有限公司)测定植物生长素IAA、植物总细胞分裂素CTK、植物赤霉素GA3含量与端粒酶逆转录酶活性。每组设置3个重复。
1.3 转录组测序
将第3、10、17代苗龄30 d的苍术组培苗用液氮冷冻,每组设置3个重复。干冰保存运输至公司进行转录组测序。首先提取样品 RNA,RNA 样品检测合格后,构建文库,文库检测合格后,使用高通量测序平台 Illumina Nova Seq 6000 进行测序。原始数据过滤掉低质量数据后得到clean reads。利用DESeq 2软件进行差异表达分析,筛选 P-adj<0.05 且 |log2 FoldChange|>1 的差异表达基因。利用 Cluster Profiler 软件进行差异表达基因富集分析,实现差异表达基因的GO富集分析和KEGG富集分析。
1.4 数据处理
所有实验数据均采用SPSS 26 软件进行显著性差异分析与相关性分析,不同字母代表不同代数组培苗间在 P<0.05 水平下具有显著差异。利用 GraphPad Prism 8.0.1 软件进行标准曲线的拟合与作图。
2. 结果与分析
2.1 形态变化
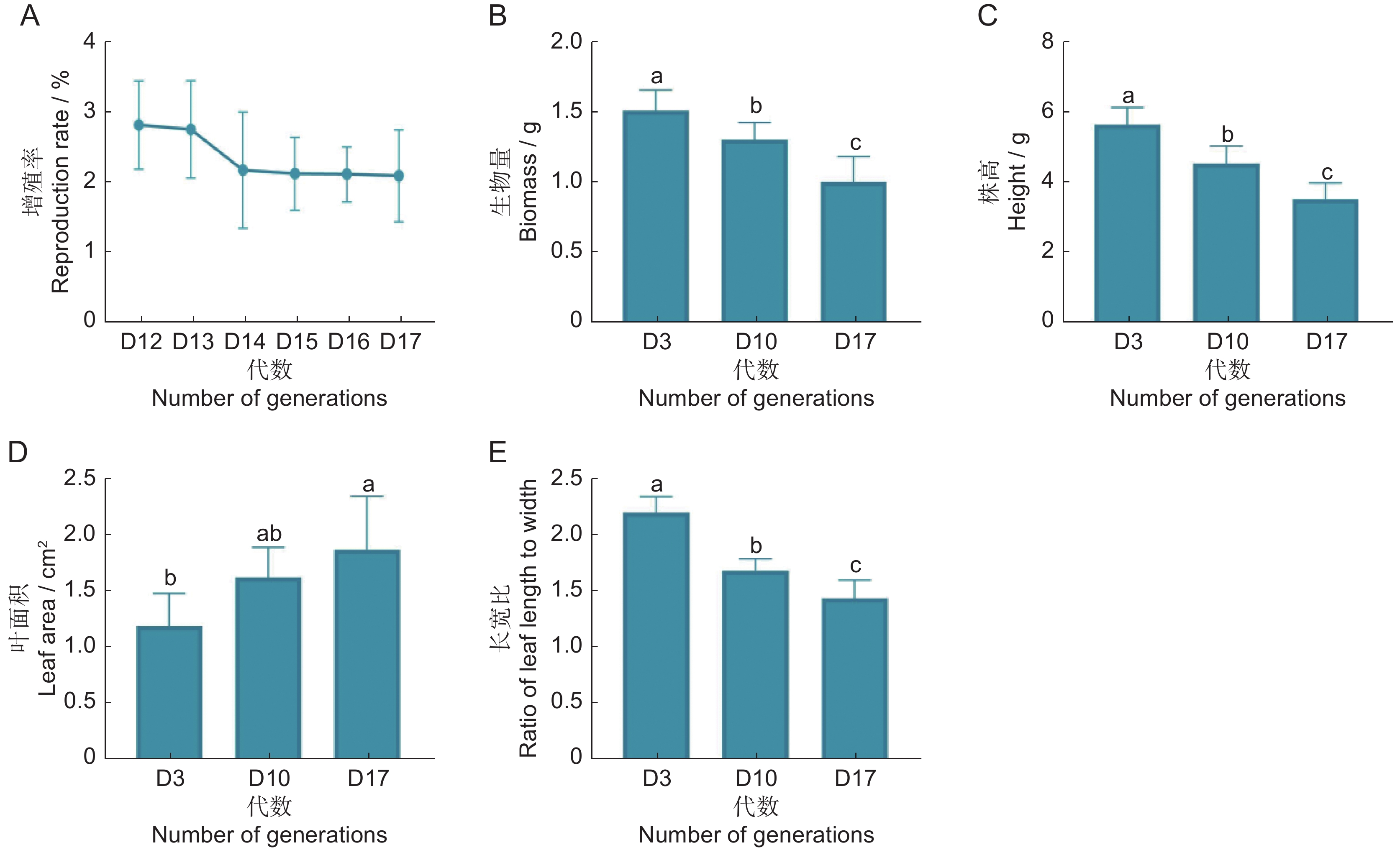
本研究发现,经过多次继代培养后,茅苍术组培苗外观发生明显变化,黄叶增多,愈伤组织减小,质地由坚韧转向酥脆易断(图1)。增殖率第14代下降较为明显,14代之后下降趋势较缓(图2:A)。生物量随着继代次数的增加出现梯度下降,株高也呈现出相同的趋势,叶面积梯度增加,叶长宽比均呈现梯度下降的趋势(图2:B~E)。
![]() 图 2 不同继代次数茅苍术组培苗表型参数数据为“平均值±标准差”;显著性分析在同一个无性系内开展,不同字母表示不同代数间差异显著(P<0.05),下同。Figure 2. Phenotypic parameters of tissue culture seedlings from different generationsData are mean±standard deviation. Significance analysis was carried out in the same clone, and different letters indicate significant differences between different generations (P<0.05), same below.
图 2 不同继代次数茅苍术组培苗表型参数数据为“平均值±标准差”;显著性分析在同一个无性系内开展,不同字母表示不同代数间差异显著(P<0.05),下同。Figure 2. Phenotypic parameters of tissue culture seedlings from different generationsData are mean±standard deviation. Significance analysis was carried out in the same clone, and different letters indicate significant differences between different generations (P<0.05), same below.2.2 生理生化指标变化
2.2.1 叶绿素荧光参数
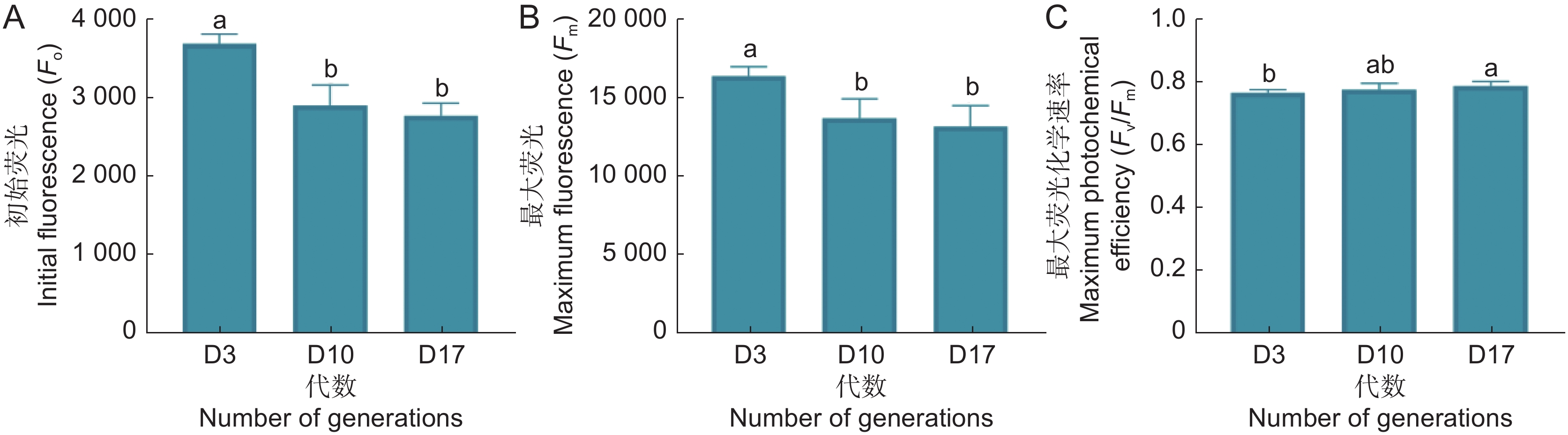
叶绿素荧光参数分析结果如图3所示,随着继代次数的增加,初始荧光Fo及最大荧光Fm呈现出相同的趋势,继代早期显著下降,后期变化不显著(图3:A、B)。随着继代次数的增加,最大光化学速率Fv/Fm值增大(图3:C)。
2.2.2 可溶性糖、可溶性蛋白含量
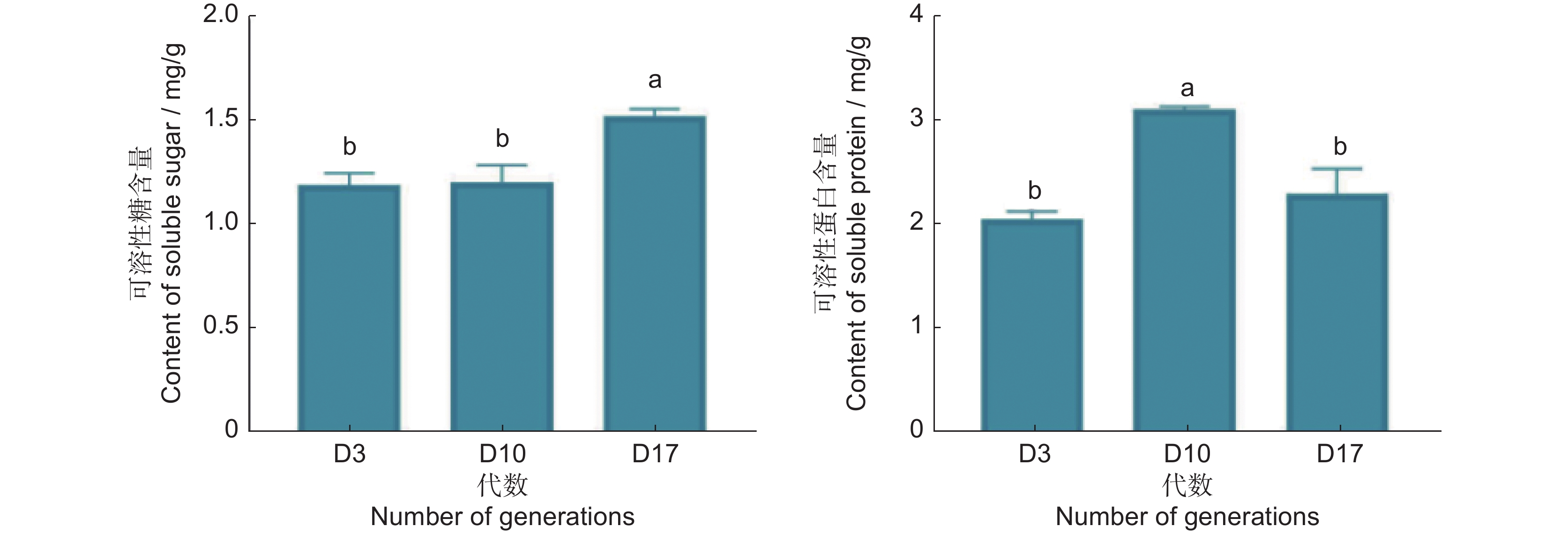
第3、10、17代的可溶性糖、可溶性蛋白含量测定结果如图4所示,在长期继代培养下,可溶性糖含量在继代后期显著上升,而可溶性蛋白含量呈现出先增加后降低的趋势。
2.2.3 抗氧化酶活性与胁迫物的含量
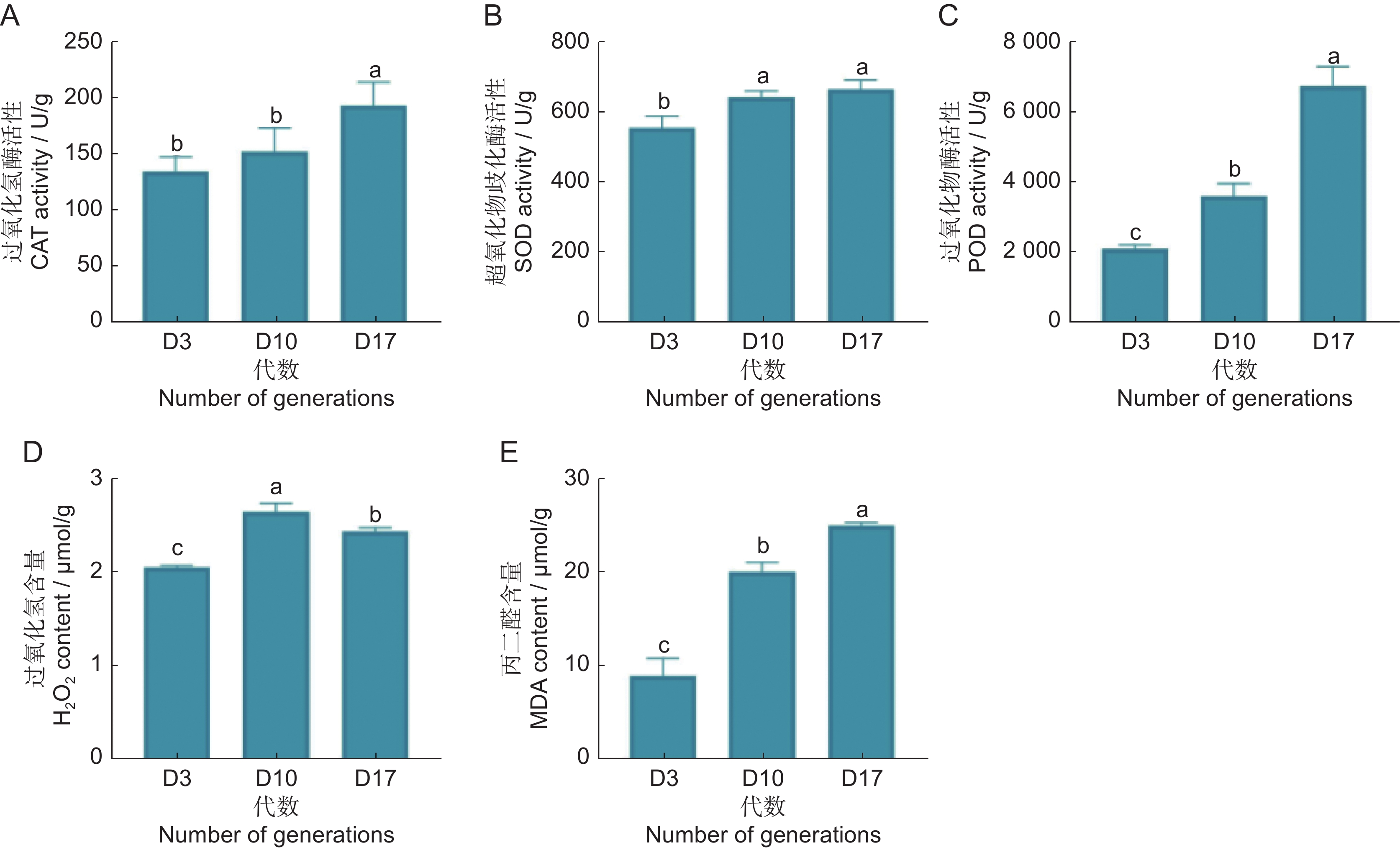
第3、10、17代的抗氧化酶活性与胁迫物的含量测定结果如图5所示。CAT、SOD与POD活性均随着继代次数的增加呈现逐渐上升的趋势,CAT活性在继代后期上升较显著,SOD活性在继代早期上升较为显著,而POD呈现梯度上升趋势(图5:A~C)。MDA含量的随着继代次数的增加而显著上升。H2O2含量的测定结果虽然呈现先上升后下降趋势,但第17代的活性显著高于第3代(图5:D、E)。
2.2.4 内源激素含量
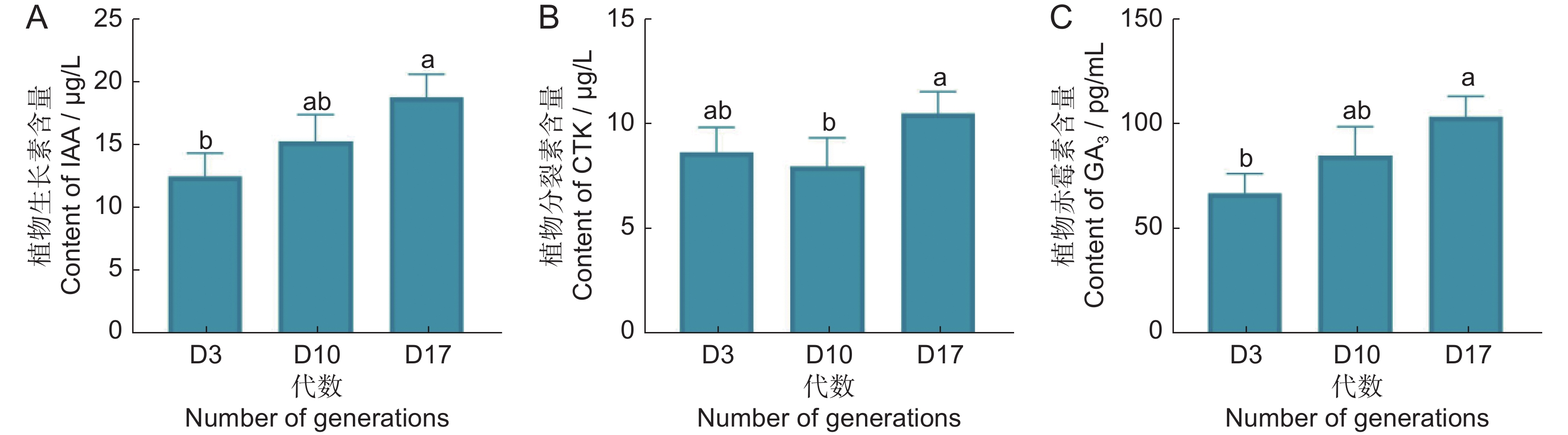
第3、10、17代茅苍术组培苗的内源激素含量如图6所示。IAA和GA3均呈现梯度上升趋势(图6:A、C),CTK呈现出前期缓慢下降后期显著上升的趋势(图6:B)。第17代时的IAA、GA3含量显著高于第3代,而CTK含量变化不显著。
2.2.5 端粒酶逆转录酶活性
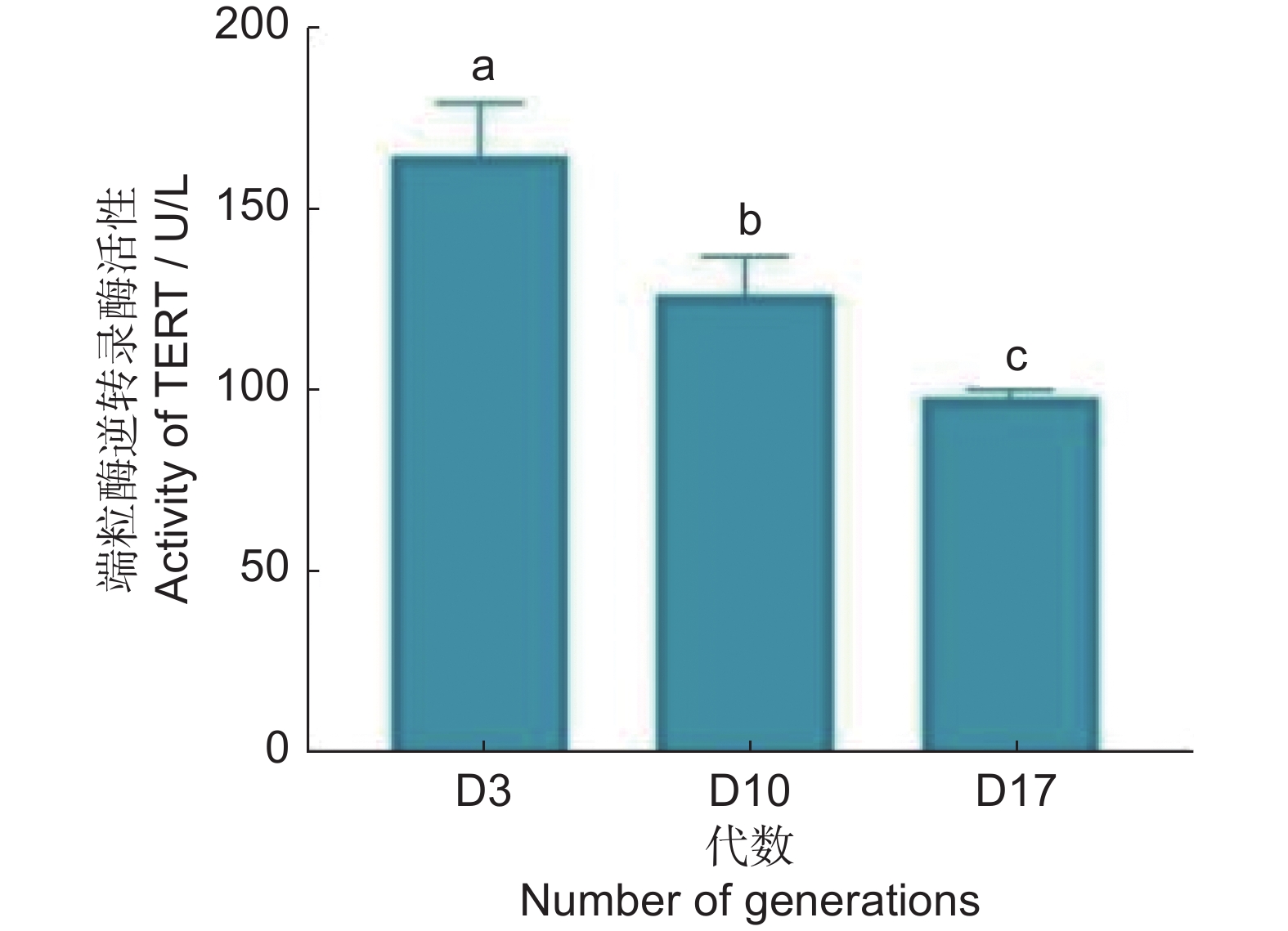
端粒酶逆转录酶(TERT)的活性如图7所示,随着继代次数的增加而显著下降,同时相关性分析发现,TERT活性与代数呈显著负相关。
2.3 转录组分析
2.3.1 差异表达基因筛选
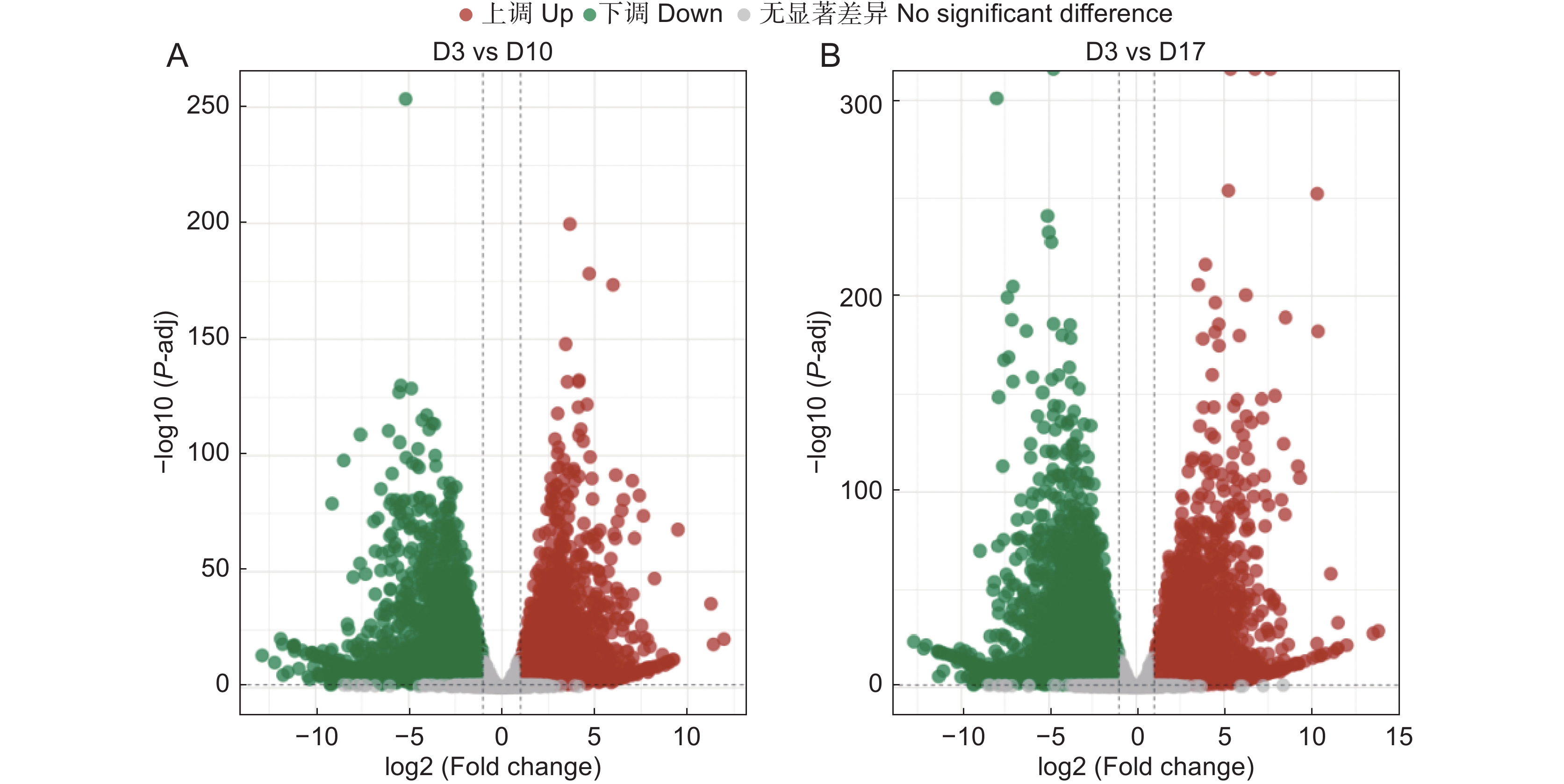
本研究筛选 FDR<0.05 且 |log2 FoldChange|>1 的基因为显著差异表达基因,并进行了火山图分析(图8)。火山图中每一个点表示一个基因,越靠近两端的基因,差异程度越大。本研究发现,随着继代次数的增加,差异基因数目增加,且分布更发散,显著差异增加,说明长期的无性繁殖,出现大量差异表达基因。
2.3.2 差异表达基因富集分析
GO富集分析结果显示(附图1
1 )),组培苗各代差异表达基因在生物过程功能区富集数目最多的 term 是“防御反应(Defense response,GO:0006952)”和“信号转导(Signal transduction,GO:0007165)”。在细胞组分功能区富集数目最多的 term 是“细胞膜(Integral component of membrane,GO:0016021)” 、“细胞核(Nucleus,GO:0005634)”和“ 细胞质(Cytoplasm,GO:0005737)”。在分子功能区下,“ ATP结合(ATP binding,GO:0005524)”、“金属离子结合(Metal ion binding,GO:0046872)”和“ DNA结合 (DNA binding,GO:0003677)”最为富集。KEGG富集通路分析发现(附图2
1 )),显著富集且数目最多的 pathway 是代谢途径(Metabolic pathways),次生代谢物的生物合成(Biosynthesis of secondary metabolites),植物激素信号转导途径(Plant hormone signal transduction),MAPK信号通路-植物(MAPK signaling pathway - plant)。2.3.3 差异基因代谢途径分析
根据KEGG 富集结果对比基因表达差异,选取P值最小的14条通路分析组培苗经历持续的继代培养后基因表达差异(表1)。在长期的组织继代培养下,茅苍术组培苗的初生代谢、次生代谢以及信号转导途径均受到影响。初生代谢途径涉及光合作用-天线蛋白、光合作用、光合生物的碳固定等,次生代谢途径涉及次生代谢物的生物合成、不饱和脂肪酸的生物合成、α-亚麻酸代谢、苯丙素生物合成、类黄酮生物合成、单萜类生物合成、鬼臼毒素生物合成等,信号转导途径涉及MAPK信号通路-植物、植物激素信号转导等。
表 1 不同代数差异基因代谢通路Table 1. Differential gene metabolic pathways路径编号
Pathway ID相关通路
Relative pathwayD3 vs D10 D3 vs D17 下调Down 上调Up 下调Down 上调Up ko04016 MAPK信号通路-植物 98 156 123 141 ko01110 次生代谢物生物合成 523 400 538 448 ko00196 光合作用-天线蛋白 1 28 0 32 ko01100 代谢通路 842 668 892 728 ko00195 光合作用 5 57 8 50 ko01040 不饱和脂肪酸生物合成 45 22 61 0 ko00592 α-亚麻酸代谢 36 29 − − ko04075 植物激素信号转导通路 120 89 132 97 ko00940 苯丙素类生物合成 80 25 − − ko00941 类黄酮的生物合成 20 25 21 22 ko04712 昼夜节律-植物 − − 18 32 ko00902 单萜类生物合成 − − 17 16 ko00999 鬼臼毒素生物合成 24 41 28 50 ko00710 光合生物的碳固定 36 38 31 37 2.3.3.1 脂肪酸代谢途径
乙酰辅酶A(Acetyl-CoA)是许多代谢途径的关键节点。柠檬酸循环是绝大多数生物体的主要分解代谢途径,是糖、脂质以及氨基酸代谢的最后共同途径,是新陈代谢的中心环节,为细胞生理活动提供能量[13]。脂肪酸降解途径(ko00071)中(附图3
2 )),酰基辅酶A氧化酶、烯酰辅酶A水合酶、3-羟酰辅酶A脱氢酶、乙酰辅酶A酰基转移酶1表达下调,可能抑制脂肪酸分解代谢,乙酰辅酶A合成降低,柠檬酸循环受阻,脂肪酸的分解代谢受到严重影响。2.3.3.2 萜类骨架合成途径
萜类骨架合成(ko00900)途径中(附图4
2 )),随着继代次数的增加,MVA途径中的羟甲基戊二酰辅酶A还原酶、磷酸甲羟戊酸激酶、二磷酸甲羟戊酸脱羧酶等多种蛋白酶表达下调,其中羟甲基戊二酰辅酶A还原酶是MVA途径第一个限速酶。MEP途径差异基因表达则较为复杂,上游与下游部分多种酶表达上调,但中游部分多种酶表达下调,如异戊烯基二磷酸δ异构酶、异戊二烯合酶等。2.3.3.3 激素信号转导途径
植物激素信号转导路径(ko04075)中(附图5
3 )),在生长素信号转导通路上,TIR1节点上有1个差异表达基因上调,TIR1是植物体内响应生长素的信号蛋白,能抑制生长素的运输能力,其对于植物抵抗胁迫作用具有重要作用[14]。在赤霉素信号转导上,GID2节点有1个差异表达基因下调,GID2是GA信号转导途径中的正向调节因子之一,在泛素化途径中帮助降解DELLA蛋白,消除其对植物生长的抑制作用,从而调节植物株高[15]。在脱落酸信号转导中,ABF节点有4个基因表达上调,ABF蛋白参与了植物生长发育的多个阶段。在乙烯信号转导中,SIMKK和EIN1节点各有1个差异基因,EIN2节点有3个差异基因表达下调,其中EIN2是乙烯信号转导过程中起正调控作用的关键因子,同时也是核心调节因子[16]。因此,长期继代培养影响了苍术多种激素信号转导途径的基因表达。3. 讨论
在植物的生长发育过程中,生物量、株高等特征都是判断植物生长状态的重要指标,而叶片的大小和形状直接影响植物对光能的吸收[17]。本研究通过茅苍术种子形成的根茎诱导出的组培苗在不断继代培养的过程中,总体表现出增殖率、生物量、株高、叶长宽比逐渐下降,证实长期的无性繁殖下出现了退化现象。
叶绿素荧光参数能快速、精准地反映植物对光能的吸收和利用状况[18]。随着继代次数的增加,Fo、Fm降低,表明在光反应中非光化学能量耗散增加,PSⅡ反应中心受到损伤,而Fv / Fm值升高预示PSⅡ反应中心原初光能转化效率提升,表明长期的继代培养影响了PSⅡ反应中心活性,但具体作用方式不明。可溶性糖可以调控植物的生长和发育;可溶性蛋白可以调控细胞内代谢活动。同时,它们还能维持植物渗透压平衡,其含量的变化也体现了植物抗逆性的强弱[8]。在本研究中,可溶性糖含量不断增加,说明在继代培养的过程中,可溶性糖不断积累,影响组培苗的渗透压平衡与生长发育。可溶性蛋白含量先增加后降低,说明在继代后期,茅苍术组培苗可能受到胁迫增加,蛋白的合成与代谢受阻,代谢紊乱,组培苗抗逆性下降。在逆境条件下,植物体内会产生大量活性氧(如O2−·和H2O2),机体通过提高抗氧化酶活性如SOD、CAT、POD等,来分解活性氧以维持自身的正常代谢,而MDA是生物体内脂质过氧化反应的终产物,其含量间接反映组织过氧化损伤程度[19-21]。茅苍术组培苗的胁迫物质MDA与H2O2含量显著上升,抗氧化酶活性均显著上升,表明虽然继代过程中抗氧化酶活性提高以清除过量的活性氧,但是胁迫物含量已经超过植物自身的清除能力,产生大量的过氧化物,形成了一定程度的氧化胁迫,损伤细胞结构。植物内源激素是植物体内调节自身生理代谢的活性物质,参与并调控植物整个生长发育过程[22]。本研究中第17代时IAA、CTK与GA3含量均显著高于第3代,说明长期的继代培养使植物内源激素积累,激素比例失衡,导致植物体内代谢受阻,生长发育减缓,形态特征发生变化。端粒酶逆转录酶作为端粒酶核心蛋白亚基之一,在体内具有维持端粒长度,延缓植物衰老退化的作用[23]。而茅苍术组培苗TERT活性随着代数增加而下降,进一步证明长期的无性繁殖引起了茅苍术细胞的退化。
转录组分析结果表明,不同代数的茅苍术组培苗基因表达差异较大。随着继代次数的增加,脂肪酸代谢途径大量蛋白酶表达下调,导致柠檬酸循环受阻,影响苍术体内代谢活性;在萜类骨架合成通路中,MVA途径多种蛋白酶表达下调,萜类骨架合成重要中间产物乙酰辅酶A的合成受阻,抑制茅苍术萜类物质的合成。在激素信号转导途径中,多种激素信号转导途径基因的差异表达,导致激素运输能力受阻,抑制植物各组织的生长分化。此外,激素信号转导途径基因差异表达可能不仅影响苍术的形态发生能力,还能调控植物的光合作用、营养物质积累与运输、抗氧化系统等各项生理生化过程。
长期继代培养将影响组培苗生理生化过程,但是至今为止尚无茅苍术组培苗的相关研究,现有研究仅探究了茅苍术试管苗在长期继代培养过程中产生的基因表达变化[10],并未进行系统全面的分析。本文首次对茅苍术组培苗的退化现象进行鉴定,揭示了长期继代培养下生理生化与分子水平的变化,并探讨了茅苍术无性繁殖退化的可能机制。本研究中,茅苍术组培苗在经历连续十余次的继代培养后,发生了形态特征上的退化,植物体胁迫水平增加,也发生生理水平上的退化。同时在长期无性繁殖下,茅苍术组培苗出现基因表达差异,初生代谢、次生代谢与激素信号转导途径等均受到影响。
本课题组前期研究初步断定苍术组培苗的退化的拐点位于10代之后,对茅苍术第3、10、17代组培苗的形态、生理、生化和转录组的变化进行了全面分析,进一步确定了退化拐点处于该区域。因此,后续应该深入拐点前后茅苍术组培苗形态特征、生理生化与分子水平指标的变化,并联系代数进行相关性分析,实现茅苍术代数鉴定,之后对次生代谢产物含量进行测定,并将其与相关基因表达变化建立关联,确定茅苍术质量等级优劣的代数范围,促进茅苍术无性繁殖培养与质量控制标准化。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
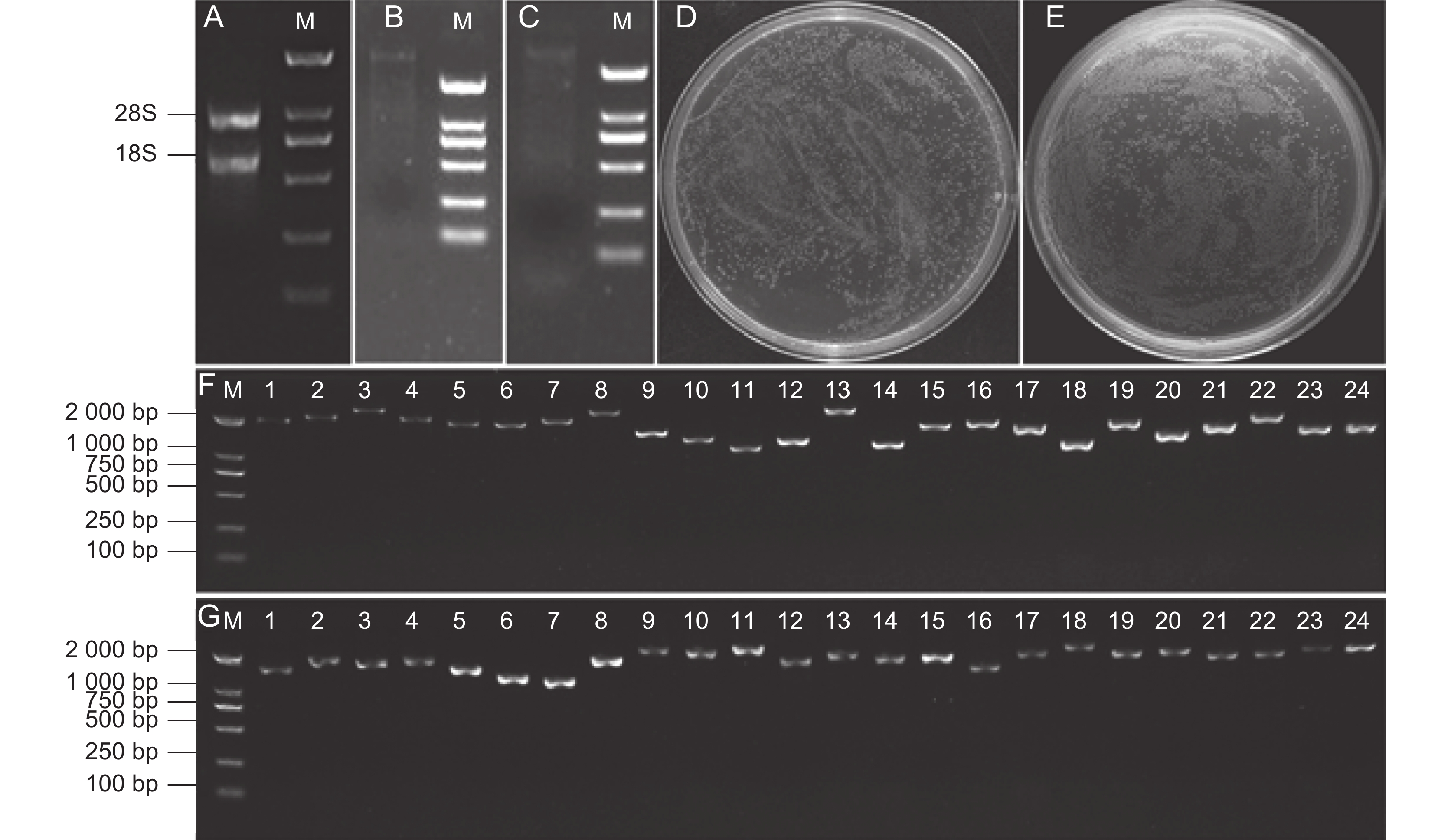
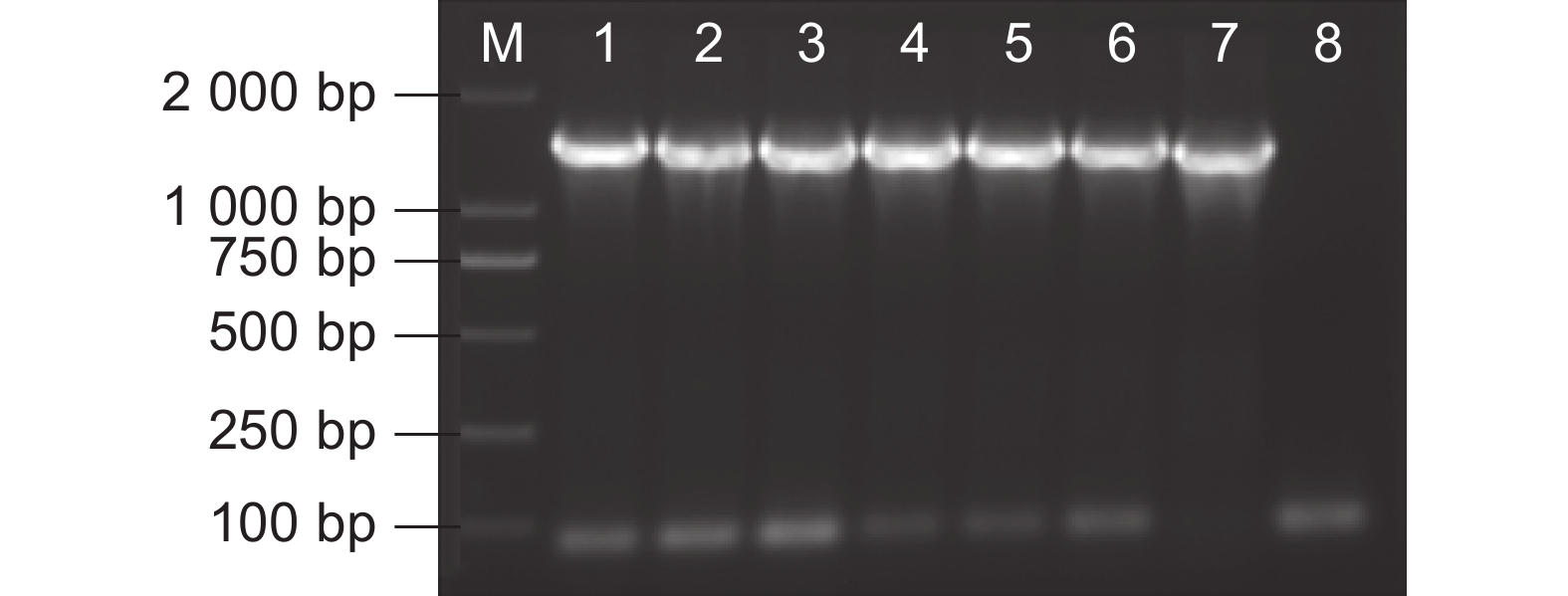
图 1 酵母双杂交文库构建
A~C:总RNA、mRNA、cDNA;D、E:初级文库和次级文库;F、G:初级文库和次级文库的插入片段PCR检测。M:DNA分子量标准。
Figure 1. Yeast two-hybrid library construction
A-C: Total RNA, mRNA, and double-stranded cDNA; D-E: Primary and secondary library capacity identification; F,G: PCR detection of primary and secondary library inserts. M: DNA molecular weight marker.
表 1 互作蛋白的功能注释
Table 1 Functional annotation of interacting proteins
编号
No.GenBank 登录号
GenBank Accession Number基因注释
Gene annotation基因名
Gene4 XM_020850203.2 脱水蛋白DHN4 DoDHN4 6 XM_028692804.1 早期光诱导蛋白1,叶绿体 DoELIP1 13 XM_020828349.2 油体蛋白S2-2 DoOLES2-2 14 XM_020837109.2 多聚泛素蛋白 DoUBQ 21 XM_028698338.1 含锌指CCCH结构域蛋白2 DoTZF 27 XM_020849176.2 未表征蛋白 5807 39 XM_020825139.1 富含甘氨酸蛋白A3 DoGRPA3 -
[1] Wen CK,Chang C. Arabidopsis RGL1 encodes a negative regulator of gibberellin responses[J]. Plant Cell,2002,14(1):87−100. doi: 10.1105/tpc.010325
[2] Zhang YH,Bian XF,Zhang SB,Ling J,Wang YJ,et al. Identification of a novel gain-of-function mutant allele,slr1-d5,of rice DELLA protein[J]. J Integr Agr,2016,15(7):1441−1448. doi: 10.1016/S2095-3119(15)61208-4
[3] Yuan YX,Wang LX,Zhao QY,Liu CW,Fu X,et al. Genome-wide identification,expression analysis and functional study of DELLA genes in Chinese cabbage (Brassica rapa L. ssp. pekinensis)[J]. Front Biosci (Landmark Ed),2024,29(5):198. doi: 10.31083/j.fbl2905198
[4] 岳溶榕. 梨单性结实相关DELLA基因的功能分析[D]. 咸阳:西北农林科技大学,2019:32−38. [5] 李露露. 谷子DELLA基因的鉴定、克隆与功能分析[D]. 太原:山西农业大学,2022:29−46. [6] Hussain A,Peng JR. DELLA proteins and GA signalling in Arabidopsis[J]. J Plant Growth Regul,2003,22(2):134−140. doi: 10.1007/s00344-003-0028-5
[7] Lim S,Park J,Lee N,Jeong J,Toh S,et al. ABA-insensitive3,ABA-insensitive5,and DELLAs interact to activate the expression of SOMNUS and other high-temperature-inducible genes in imbibed seeds in Arabidopsis[J]. Plant Cell,2013,25(12):4863−4878.
[8] 赵春丽,王晓,陈家兰,陈何,王乐,等. 植物DELLA蛋白家族研究进展[J]. 应用与环境生物学报,2020,26(5):1299−1308. Zhao CL,Wang X,Chen JL,Chen H,Wang L,et al. Progress in research on plant DELLA family proteins[J]. Chinese Journal of Applied and Environmental Biology,2020,26(5):1299−1308.
[9] Cheng H,Qin LJ,Lee S,Fu XD,Richards DE,et al. Gibberellin regulates Arabidopsis floral development via suppression of DELLA protein function[J]. Development,2004,131(5):1055−1064. doi: 10.1242/dev.00992
[10] 于磊. 水曲柳DELLA家族基因应答低温胁迫及参与被动休眠调控研究[D]. 哈尔滨:东北林业大学,2021:51−70. [11] Eriksson S,Böhlenius H,Moritz T,Nilsson O. GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation[J]. Plant Cell,2006,18(9):2172−2181. doi: 10.1105/tpc.106.042317
[12] Yamaguchi S. Gibberellin metabolism and its regulation[J]. Annu Rev Plant Biol,2008,59:225−251. doi: 10.1146/annurev.arplant.59.032607.092804
[13] Davière JM,Achard P. Gibberellin signaling in plants[J]. Development,2013,140(6):1147−1151. doi: 10.1242/dev.087650
[14] Ito T,Okada K,Fukazawa J,Takahashi Y. DELLA-dependent and -independent gibberellin signaling[J]. Plant Signal Behav,2018,13(3):e1445933. doi: 10.1080/15592324.2018.1445933
[15] Tyler L,Thomas SG,Hu JH,Dill A,Alonso JM,et al. DELLA proteins and gibberellin-regulated seed germination and floral development in Arabidopsis[J]. Plant Physiol,2004,135(2):1008−1019. doi: 10.1104/pp.104.039578
[16] 马庆,付强,杨银,陈兰娅,陈海,等. 铁皮石斛分子生物学研究进展[J]. 山地农业生物学报,2023,42(4):45−50. Ma Q,Fu Q,Yang Y,Chen LY,Chen H,et al. A review of molecular biology of Dendrobium officinale[J]. Journal of Mountain Agriculture and Biology,2023,42(4):45−50.
[17] 王美娟,赵千里,柏冰洋,向松竹,洪承昊. 铁皮石斛的组织培养及种植技术研究进展[J]. 中南农业科技,2023,44(1):217−221. doi: 10.3969/j.issn.1007-273X.2023.01.054 [18] 刘博婷,唐演儿,李琳,林一帆,李学诗,等. 铁皮石斛酸性蔗糖转化酶基因家族鉴定及低温下表达分析[J]. 江苏农业科学,2022,50(24):33−42. [19] Zhang MZ,Liu N,da Silva JAT,Liu XC,Deng RF,et al. Physiological and transcriptomic analysis uncovers salinity stress mechanisms in a facultative crassulacean acid metabolism plant Dendrobium officinale[J]. Front Plant Sci,2022,13:1028245. doi: 10.3389/fpls.2022.1028245
[20] Huang H,Jiao YX,Tong Y,Wang YH. Comparative analysis of drought-responsive biochemical and transcriptomic mechanisms in two Dendrobium officinale genotypes[J]. Ind Crop Prod,2023,199:116766. doi: 10.1016/j.indcrop.2023.116766
[21] Rizza A,Boccaccini A,Lopez-Vidriero I,Costantino P,Vittorioso P. Inactivation of the ELIP1 and ELIP2 genes affects Arabidopsis seed germination[J]. New Phytol,2011,190(4):896−905. doi: 10.1111/j.1469-8137.2010.03637.x
[22] 强承魁,凤舞剑,王胜永,赵虎,苏新林,周保亚. 拟南芥泛素家族的全基因组分析[J]. 基因组学与应用生物学,2010,29(5):969−975. Qiang CK,Feng WJ,Wang SY,Zhao H,Su XL,Zhou BY. Genome-wide analysis of ubiquitin family in Arabidopsis thaliana[J]. Genomics and Applied Biology,2010,29(5):969−975.
[23] McGinnis KM,Thomas SG,Soule JD,Strader LC,Zale JM,et al. The Arabidopsis SLEEPY1 gene encodes a putative F-box subunit of an SCF E3 ubiquitin ligase[J]. Plant Cell,2003,15(5):1120−1130. doi: 10.1105/tpc.010827
[24] Smalle J,Kurepa J,Yang PZ,Emborg TJ,Babiychuk E,et al. The pleiotropic role of the 26S proteasome subunit RPN10 in Arabidopsis growth and development supports a substrate-specific function in abscisic acid signaling[J]. Plant Cell,2003,15(4):965−980. doi: 10.1105/tpc.009217
[25] Bogamuwa S,Jang JC. The Arabidopsis tandem CCCH zinc finger proteins AtTZF4,5 and 6 are involved in light-,abscisic acid- and gibberellic acid-mediated regulation of seed germination[J]. Plant,Cell Environ,2013,36(8):1507−1519.
[26] 肖诗琪. 蜡梅CCCH型锌指蛋白基因CpC3H3在成花诱导中的功能研究[D]. 重庆:西南大学,2022:35−45. [27] Kim DH,Yamaguchi S,Lim S,Oh E,Park J,et al. SOMNUS,a CCCH-type zinc finger protein in Arabidopsis,negatively regulates light-dependent seed germination downstream of PIL5[J]. Plant Cell,2008,20(5):1260−1277. doi: 10.1105/tpc.108.058859
[28] Li P,Zhang QL,He DN,Zhou Y,Ni HH,et al. AGAMOUS-LIKE67 cooperates with the histone mark reader EBS to modulate seed germination under high temperature[J]. Plant Physiol,2020,184(1):529−545. doi: 10.1104/pp.20.00056
[29] 闫丽华. 水稻SOMNUS同源基因在光敏色素介导的光反应中的作用初探[D]. 烟台:烟台大学,2018:17−22. [30] 张水军,曾千春,卢秀萍,李文正. 植物富含甘氨酸蛋白的研究进展[J]. 中国农学通报,2010,26(14):54−58. Zhang SJ,Zeng QC,Lu XP,Li WZ. Progress on plant glycine-rich protein[J]. Chinese Agricultural Science Bulletin,2010,26(14):54−58.
[31] Kim JY,Park SJ,Jang B,Jung CH,Ahn SJ,et al. Functional characterization of a glycine-rich RNA-binding protein 2 in Arabidopsis thaliana under abiotic stress conditions[J]. Plant J,2007,50(3):439−451. doi: 10.1111/j.1365-313X.2007.03057.x
[32] Kwak KJ,Kim YO,Kang H. Characterization of transgenic Arabidopsis plants overexpressing GR-RBP4 under high salinity,dehydration,or cold stress[J]. J Exp Bot,2005,56(421):3007−3016. doi: 10.1093/jxb/eri298
[33] Kim YO,Pan S,Jung CH,Kang H. A zinc finger-containing glycine-rich RNA-binding protein,atRZ-1a,has a negative impact on seed germination and seedling growth of Arabidopsis thaliana under salt or drought stress conditions[J]. Plant Cell Physiol,2007,48(8):1170−1181. doi: 10.1093/pcp/pcm087
[34] 徐瑞. 中国樱桃富含甘氨酸RNA结合蛋白基因克隆与功能初鉴[D]. 金华:浙江师范大学,2018:36−47. -
其他相关附件
-
PDF格式
李琳 附表 点击下载(259KB)
-




 下载:
下载: