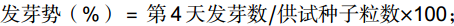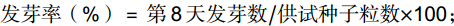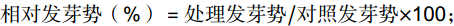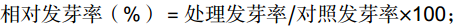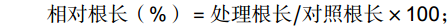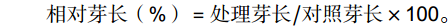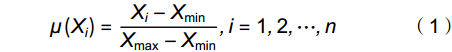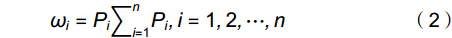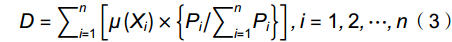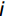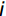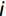Systematic analysis of TPS genes for the synthesis of floral aroma components of Gardenia jasminoides J. Ellis based on the whole genome
-
摘要:
栀子(Gardenia jasminoides J. Ellis)花色洁白且香气怡人,不仅具有极高的观赏价值,还是重要天然香料来源。萜类是栀子花独特香气的主要组成成分,但合成该类挥发性产物的关键萜类合酶(TPS)尚未鉴定。本研究基于栀子高质量基因组,通过转录组数据、系统发育树和保守结构域分析等,全面挖掘栀子萜类花香成分合成相关的TPS基因。结果显示,栀子基因组共注释到44个GjTPS基因,不均匀分布于11条染色体,其中9个GjTPS参与串联复制事件。所有GjTPS被划分为5个亚家族,其中27个属于被子植物特有的TPS-a、TPS-b和TPS-g分支。结合栀子5个器官的转录组数据及实时荧光定量PCR分析,筛选出5个候选GjTPS基因,其在盛开期的花器官中特异高表达,且含有DDXXD和NSE/DTE 活性基序。其中,GjTPS1、GjTPS2、GjTPS3和GjTPS27为TPS-b分支酶,推测为芳樟醇或罗勒烯等栀子主要花香成分合成酶,而TPS-a分支的GjTPS18可能是金合欢烯合酶。
Abstract:Gardenia jasminoides J. Ellis flowers are white in color and have a pleasant aroma. These flowers have high ornamental value and are an important source of natural spices. Terpenes are the main components of the unique aroma of G. jasminoides flowers, but the key terpene synthases (TPSs) for the biosynthesis of such volatile products have not yet been identified. Here, based on the high-quality genome of G. jasminoides, this study comprehensively explored the TPS genes related to floral scent biosynthesis through transcriptomic, phylogenetic, and conserved domain analysis. In total, 44 GjTPS genes were identified in G. jasminoides, unevenly distributed on 11 chromosomes, and nine GjTPS genes participated in tandem duplication events. All GjTPSs were clustered into five subfamilies, 27 of which belonged to the angiosperm-specific clades, including TPS-a, TPS-b, and TPS-g. Combining transcriptomic data and quantitative real-time PCR (qRT-PCR) analyses of five organs, five candidate GjTPS genes, with high expression in blooming flowers and containing the active motif DDXXD and NSE/DTE, were screened. Among them, GjTPS1, GjTPS2, GjTPS3, and GjTPS27 were grouped in the TPS-b clade, speculated to be the TPSs responsible for the biosynthesis of the main floral aroma components of G. jasminoides, such as linalool and ocimene, while GjTPS18 from the TPS-a clade may be a farnesene synthase.
-
Keywords:
- Gardenia jasminoides /
- Floral scent /
- Terpene synthase /
- Genome /
- Transcriptome
-
土壤盐渍化是植物面临的主要非生物胁迫之一,严重影响了农作物的地理分布和产量,是长期困扰全球农业发展的难题。我国盐渍化土地分布广泛,总面积位居世界第三,约3 600万hm2,耕地中盐渍化面积达到920.9万hm2,约占全国耕地面积的6.62%[1-3]。近年来,由于耕作方式落后、灌溉措施不当[4, 5],再加上全球气候变暖、极端天气增多和人口增加等原因[6],全球范围内盐碱地面积逐年增加,严重威胁到全球粮食安全。因此,加强耐盐种质资源挖掘与利用成为保障国家粮食安全、提高战略储备竞争力的重要途径之一。
耐盐种质资源的鉴定是耐盐育种中需要解决的首要问题,也是进一步开展耐盐机制研究的前提。近年来,国内外在水稻(Oryza sativa L.)、小麦(Triticum aestivum L.)、玉米(Zea mays L.)、绿豆(Vigna radiata L.)等不同作物耐盐性方面开展了大量研究,鉴定出许多耐盐种质[7-10]。谷子(Setaria italica L.)须根粗壮、根系发达、吸水能力较强、叶形狭窄、水分蒸腾量较少,其耐盐碱性高于水稻、玉米、小麦等作物[11-13]。但是,谷子耐盐种质资源鉴定方面研究还很不充分。韩飞等[14]以1.0%(约171 mmol/L)的NaCl溶液对63份谷子种质资源进行萌发期耐盐性鉴定,利用相关性分析、主成分分析、隶属函数分析和聚类分析等方法进行综合评价,发现发芽率、发芽指数、相对根长、相对芽长可以作为谷子耐盐性评价关键指标,并筛选出济谷16、汾特11号、峰红谷、晋谷57、晋汾106号等5份耐盐谷子种质。秦岭等[15]采用类似分析方法,用 1.5%(约256 mmol/L)的NaCl溶液对不同生态区的54份谷子种质进行萌发期耐盐性鉴定,筛选出4个高度耐盐种质,分别是济谷16、矮88、陇谷3号和延谷13。张笛[16]以150 mmol/L NaCl 对100份谷子种质资源进行了萌发期的盐胁迫处理,通过综合评价和等级划分,最终筛选出晋育红谷、公矮6号、红钙谷和晋谷29等4个综合耐盐能力强的种质。
本研究利用不同浓度的NaCl溶液对10份谷子种质进行盐胁迫处理,采用培养皿发芽实验,分析了谷子萌发期相对发芽势、相对发芽率、相对芽长以及相对根长等4个指标,明确了谷子萌发期耐盐性鉴定的最适盐浓度为180 mmol/L。利用该浓度NaCl溶液,对不同栽培区收集的180份种质资源进行耐盐性鉴定,通过隶属函数分析和主成分分析等综合评价谷子耐盐性,此外,对一个重组自交系(Recombinant inbred lines,RIL)群体后代进行了耐盐性评价,研究结果旨在为谷子耐盐QTL(Quantitative trait locus)或基因的挖掘与耐盐机制解析奠定基础。
1. 材料与方法
1.1 实验材料
10份谷子种质用于萌发期耐盐种质适宜浓度筛选(表1);180份核心种质用于耐盐性种质资源鉴定,包括:育成种63份、农家种115份、突变材料2份(附表1
1 );40个株系(来自黑枝谷(极端盐敏感)×长农35号(耐盐)RIL群体)用于后裔材料耐盐性分析。本实验谷子种质材料均为山西农业大学谷子研究所保存资源。表 1 10份供试种质材料及来源Table 1. Name and source of 10 germplasms编号Code 名称Name 来源Origin 1 长农35号 山西 2 六月鲜 河北 3 龙辐 黑龙江 4 毛毛谷 河北 5 小乌谷 河北 6 金棒子 甘肃 7 茶清谷 河北 8 小红谷 甘肃 9 菠菜腿 内蒙古 10 郑448 河南 1.2 耐盐性鉴定
种子处理:用分析天平称取谷子成熟种子1.5 g,自来水浸泡3 min,倒掉漂浮种子,将剩余种子置于滤纸上,室内自然晾干。用75%酒精处理自然晾干的种子30 s,采用5% NaClO浸泡20 min,再用无菌蒸馏水清洗3次,最后用无菌滤纸将种子表面水分吸干。
实验设置:在直径为9 cm的玻璃培养皿中放置双层滤纸,滤纸中间夹带4层灭菌纸巾,以确保滤纸在实验过程中始终保持湿润。在处理好的培养皿中,分别加入不同浓度的NaCl溶液,分别为0(CK,无菌蒸馏水)、50、100、120、150、160、170、180、200 mmol/L [14,17,18],每个实验设置3次重复。进一步挑选籽粒饱满、大小一致的种子各50粒分别置于上述培养皿中,保持种子高度的一半浸在NaCl溶液中。最后,将上述处理好的种子放置于植物组织培养室中,于28 ℃、黑暗条件(表面覆盖遮光性强的黑布)下,培养2 d,第3天取掉黑布,使其在28 ℃、14 h光照/10 h黑暗条件下,继续培养5 d。每隔1 d补充适量蒸馏水,以保持培养皿中的盐溶液浓度。
数据采集:以根、芽长度均超过种子直径一半为发芽标准,从第2天开始每日记录种子发芽数,第4天发芽数用于计算发芽势。第8天发芽数计算发芽率,从每个培养皿中随机选取5粒萌发的种子,用直尺分别测量其芽长、根长。以相对发芽势RGP(Relative germination potential)、相对发芽率RGR(Relative germination rate)、相对芽长RCL(Relative coleoptile length)和相对根长RRR(Relative radical root length),这4个指标作为耐盐性鉴定的性状指标,计算公式如下:
发芽势(%)=第4天发芽数/供试种子粒数×100; 发芽率(%)=第8天发芽数/供试种子粒数×100; 相对发芽势(%)=处理发芽势/对照发芽势×100; 相对发芽率(%)=处理发芽率/对照发芽率×100; 相对根长(%)=处理根长/对照根长×100; 相对芽长(%)=处理芽长/对照芽长×100。 1.3 数据处理
采用Excel 2010软件对数据进行统计,采用SPSS 22.0软件进行主成分分析、隶属函数、建立载荷矩阵等,采用 LSD 法进行显著性检验,采用隶属函数法进行耐盐性综合评价,计算各指标[19, 20]。使用GraphPad Prism 8.0软件绘制柱状图,利用R 4.2.2软件的corrplot包进行相关性分析,graphics包绘制直方图以及ggtree包做聚类分析。
隶属函数值:
μ(Xi)=Xi−XminXmax−Xmin,i=1,2,⋯,n (1) 权重:
ωi=Pi÷∑ni=1Pi,i=1,2,⋯,n (2) 综合耐盐指数:
D=∑ni=1[μ(Xi)×{Pi/∑ni=1Pi}],i=1,2,⋯,n (3) 公式(1)中,计算每一个材料各综合指标的隶属函数值,Xi 表示第
i 个综合指标的测定值;Xmin、Xmax 分别表示第i 个综合指标的最小值和最大值。公式(2)计算综合指标的权重,Pi 代表各材料第i 个综合指标的贡献率。公式(3)计算各材料的耐盐性综合评价值D。2. 结果与分析
2.1 适宜盐浓度筛选
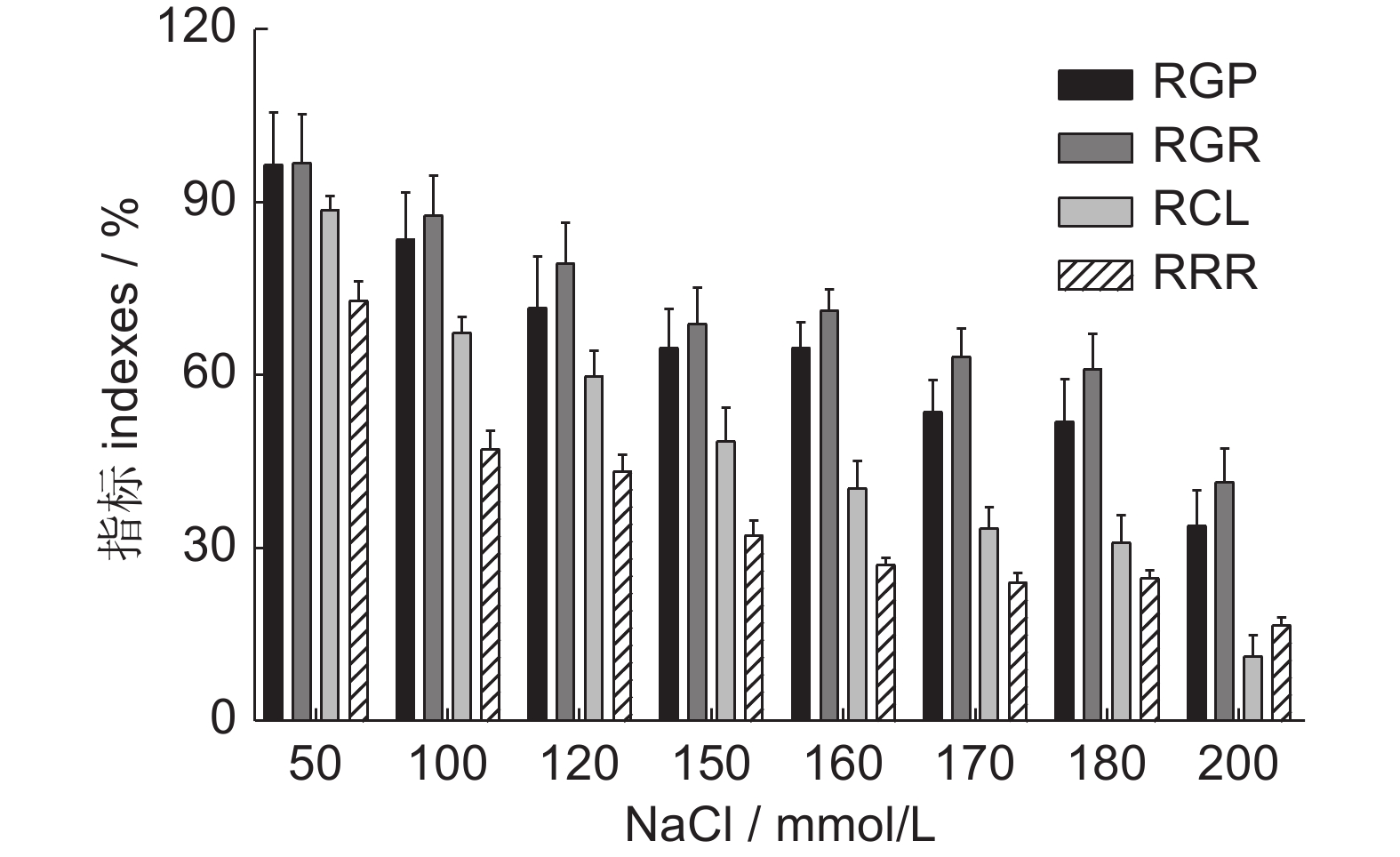
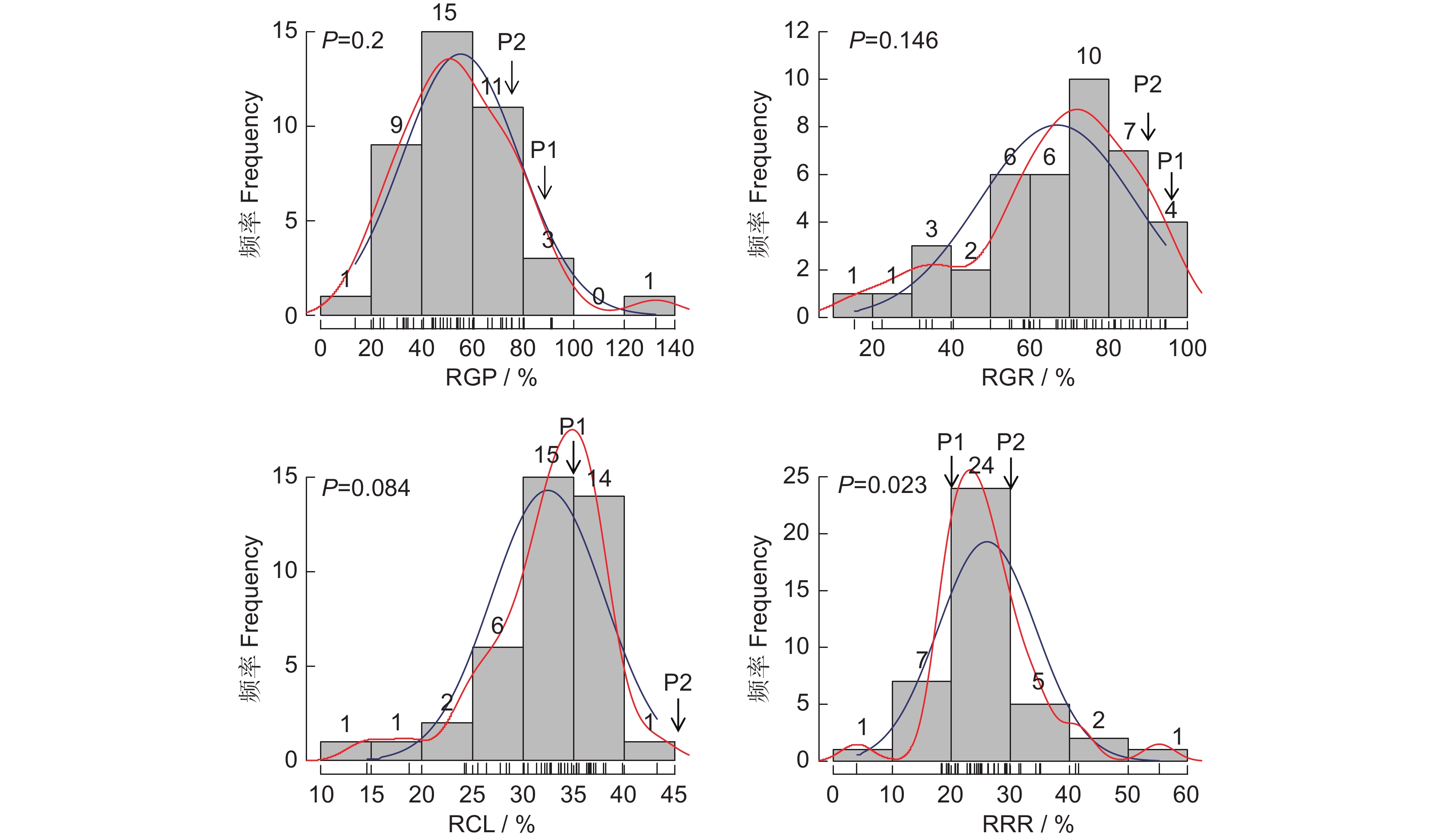
为了筛选适宜谷子萌发期耐盐性研究的NaCl处理浓度,本研究采用9个不同浓度的NaCl溶液处理种子,分析了10份谷子种质的相对发芽势、相对发芽率、相对芽长及相对根长等4个指标。结果表明,随着NaCl浓度升高,4个指标值整体均呈下降趋势(图1),所有指标性状变异系数几乎均在10%以上(表2),表明10份谷子种质在盐胁迫下存在变异。
表 2 10份谷子种质在不同盐浓度下的指标分析Table 2. Analysis of four indexes in 10 germplasms of Setaria italica under different NaCl concentrations指标
IndexesNaCl浓度
NaCl
concentration /
mmol/L性状值
Average±
SE / %变异幅度
Range of
variation / %变异系数
CV / %RGP 50 96.58±27.64a 58.70~166.67 28.62 100 83.63±23.98ab 57.50~138.10 28.67 120 71.79±26.69b 45.00~139.68 37.18 150 64.88±20.19b 37.59~96.83 31.12 160 64.88±13.16b 54.00~91.00 20.29 170 53.63±16.72bc 33.00~87.00 31.17 180 52.07±25.58b 10.00~94.00 49.12 200 34.00±18.26c 10.00~67.44 53.70 RGR 50 96.91±25.90a 66.41~155.56 26.72 100 87.70±21.10ab 54.10~127.78 24.06 120 79.42±21.00 ab 56.10~134.72 26.51 150 68.97±19.54b 39.34~101.39 28.34 160 71.22±11.21b 61.00~96.00 15.74 170 63.37±14.32b 40.00~90.00 22.60 180 61.10±24.46b 12.00~89.00 40.03 200 41.52±17.36c 6.56~63.16 41.80 RCL 50 88.61±8.69a 73.87~101.19 9.81 100 67.40±9.88b 50.70~81.92 14.66 120 59.83±13.85b 37.38~82.34 23.15 150 48.53±18.03c 16.59~68.66 37.15 160 40.42±14.27cd 14.00~62.00 35.30 170 33.49±11.18d 12.00~54.00 33.38 180 31.07±16.85d 2.00~55.00 54.23 200 11.37±10.67e 0.00~32.15 93.87 RRR 50 72.93±11.22c 59.21~94.54 15.38 100 47.25±9.43b 31.94~57.26 19.97 120 43.36±8.07b 28.44~51.31 18.62 150 32.30±9.63c 18.40~49.43 29.80 160 27.10±3.77c 23.00~33.00 13.89 170 24.18±4.41c 18.00~34.00 18.23 180 24.82±5.65c 13.00~34.00 22.74 200 16.79±4.06d 9.72~24.99 24.17 注:指标名缩写同图1。同一指标同列不同字母表示不同处理间在 P<0.05水平上差异显著。 Notes: Abbreviations are the same as those in Fig. 1. Different letters indicate significant differences between treatments (P<0.05). 随着NaCl浓度的升高,相对发芽势和相对发芽率整体表现抑制作用,并逐渐增强。NaCl浓度低于150 mmol/L时,有8份材料表现抑制作用,有2份材料表现促进作用;高于150 mmol/L时,相对发芽势和相对发芽率在10份材料中均表现出不同程度抑制作用,并随着盐浓度升高抑制作用增强;180 mmol/L时,相对发芽势和相对发芽率的变异幅度最大(10.00%~94.00%及12.00%~89.00%),变异系数相对较高(49.12%、40.03%);200 mmol/L时,变异系数达最高(53.70%、41.80%),但变异幅度明显降低(10.00%~67.44%及6.56%~63.16%)。
在所有NaCl浓度处理下,相对芽长和相对根长都表现出抑制作用,随着盐浓度升高抑制作用增强。当NaCl浓度为200 mmol/L时,相对芽长的变异系数最大(93.87%),但相对根长及其变异幅度、相对芽长的变异幅度相对其他浓度处理下较低;180 mmol/L时,相对芽长和相对根长的变异幅度和变异系数都达到较高水平(分别为2.00%~55.00%、54.23%及13.00%~34.00%、22.74%)。
综上所述,NaCl浓度为180 mmol/L时,10份谷子种质的相对发芽势、相对发芽率、相对芽长以及相对根长存在显著差异,适宜谷子种质耐盐性筛选鉴定。
2.2 180份谷子种质萌发期各项指标频数分布及相关性分析
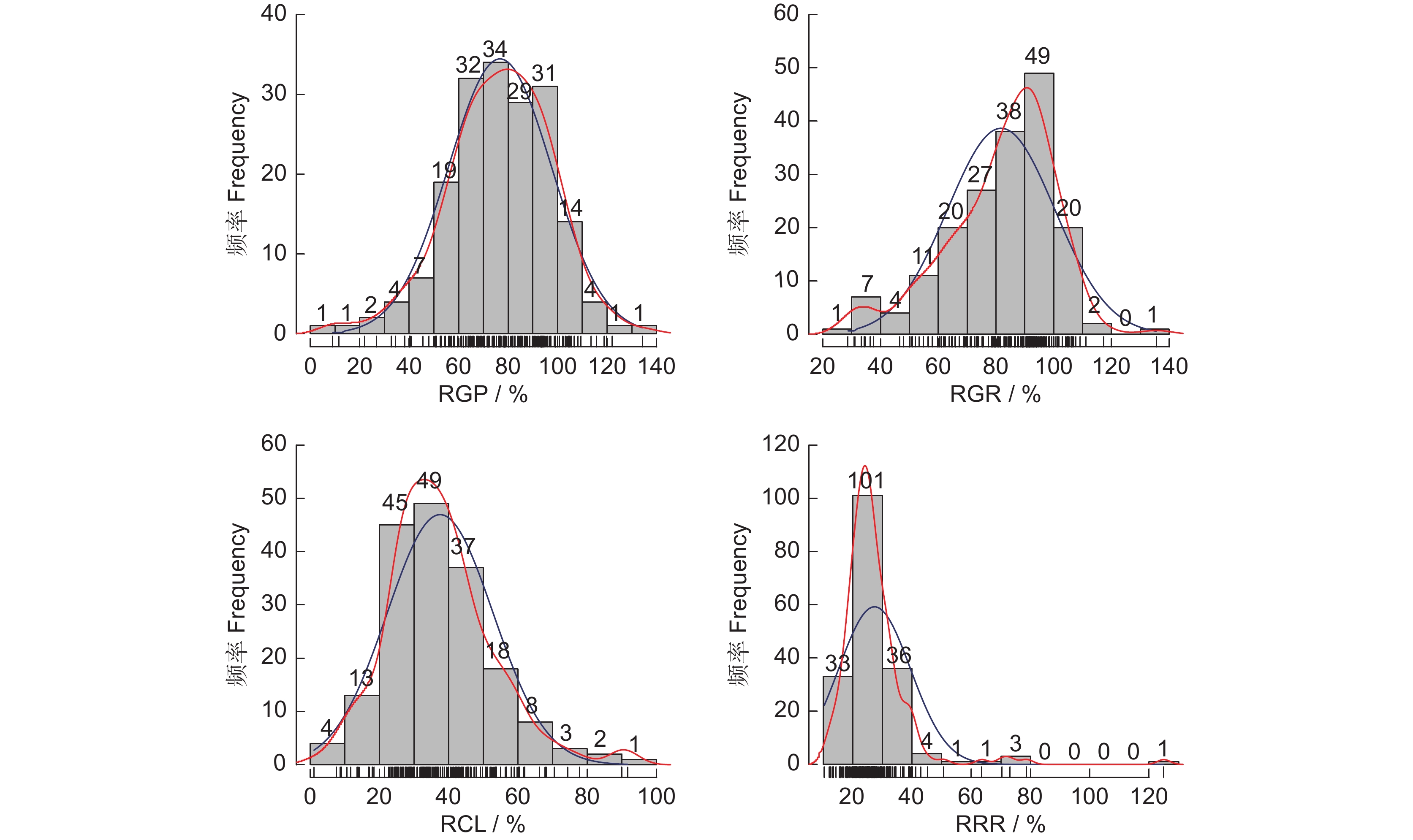
采用180 mmol/L的NaCl溶液对180份谷子种质进行处理,分析了相对发芽势、相对发芽率、相对芽长和相对根长等4个指标,采用直方图表示上述4个指标在材料间的频数分布(附表2
2 、图2)。由图2可知,4个指标均广泛分布,相对发芽势和相对发芽率的分布范围分别为0~140%和20%~140%,两个指标主要分布在60%~100%和70%~90%;相对芽长和相对根长的分布范围分别为0~100%和20%~120%,两个指标主要分布在20%~50%和20%~30%。![]() 图 2 谷子萌发期耐盐性指标频数分布直方图横坐标表示相对值大小,纵坐标表示各组所占频数,图中红线表示密度线,蓝线表示正态分布曲线。Figure 2. Frequency distribution of salt tolerance traits during thegermination stage in Setaria italicaAbscissa represents relative value; Ordinate represents frequency of each group; Red line represents density; Blue line represents normal distribution curve.
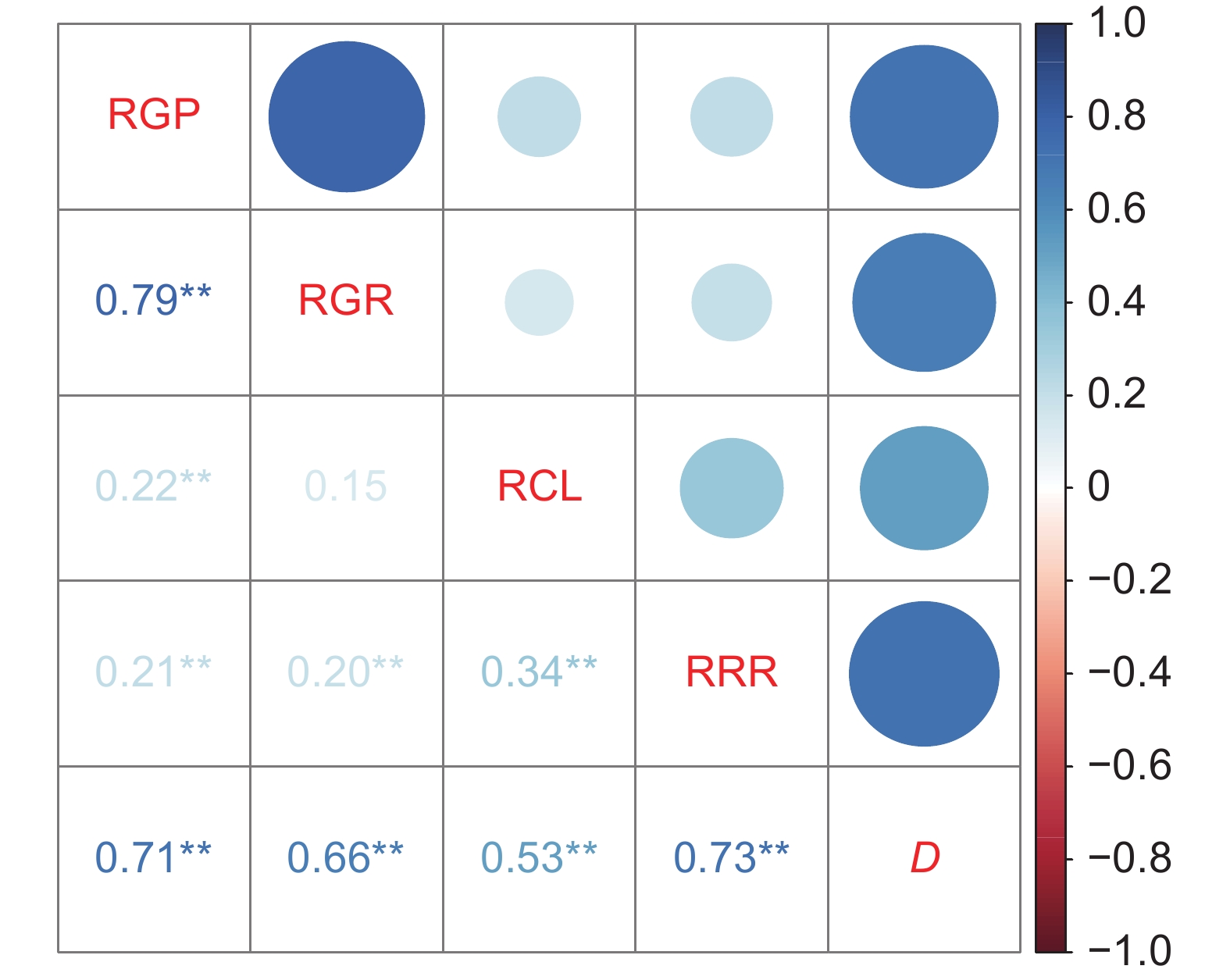
图 2 谷子萌发期耐盐性指标频数分布直方图横坐标表示相对值大小,纵坐标表示各组所占频数,图中红线表示密度线,蓝线表示正态分布曲线。Figure 2. Frequency distribution of salt tolerance traits during thegermination stage in Setaria italicaAbscissa represents relative value; Ordinate represents frequency of each group; Red line represents density; Blue line represents normal distribution curve.采用SPSS 22.0软件中双变量相关法,对盐胁迫下谷子萌发期各性状相对值进行相关分析与显著性差异分析。基于Spearman相关分析结果可知,180 mmol/L NaCl处理下,除相对发芽率和相对芽长之间相关性不显著以外,其余性状之间均呈极显著正相关,其中相对发芽势与相对发芽率的相关系数最高(r=0.79),相对芽长与相对根长的相关系数次之(r=0.34)(图3)。
2.3 180份谷子种质萌发期耐盐性综合评价
2.3.1 谷子种质萌发期耐盐性主成分分析
根据主成分提取原则,即特征值大于1及累计贡献率大于75%,选取了前两个主成分,累计贡献率为78.827%,可有效反映出绝大部分信息。第1主成分的方差贡献率为51.140%,主要特征向量为相对发芽势和相对发芽率;第2主成分方差贡献率为27.687%,载荷较高的是相对芽长和相对根长(表3、表4)。将4个耐盐相关指标,转换为2个相互独立的综合指标,用于耐盐性综合评价。
表 3 NaCl 胁迫下谷子萌发期综合指标的主成分及贡献率Table 3. Principal component and contribution rates of comprehensive indexes of Setaria italica during the germination stage under NaCl stress主成分
Principal component特征值
Eigen value贡献率
Contribution rate / %累计贡献率
Cumulative contribution rate / %1 2.046 51.140 51.140 2 1.107 27.687 78.827 表 4 NaCl胁迫条件下谷子萌发期各指标的因子载荷矩阵Table 4. Factor loading matrix of four indexes of Setaria italica during the germination stage under NaCl stress指标
Indexes成分1
Component 1成分2
Component 2RGP 0.439 −0.293 RGR 0.425 −0.353 RCL 0.260 0.540 RRR 0.218 0.633 注:指标名缩写同图1。 Note: Abbreviations are the same as those given in Fig. 1. 2.3.2 谷子种质萌发期耐盐性综合评价
运用隶属函数法,对180份谷子种质进行萌发期耐盐性综合评价。根据公式(1)计算得到贡献率μ(X),根据公式(2)计算得到两个综合指标的权重分别为0.535、0.289,运用公式(3)计算谷子的萌发期综合耐盐评价值D值(附表3
3 ),采用最大距离法,对180份种质材料耐盐性进行综合评价和聚类分析。将180份种质按7∶3的比例随机分成回归组和检验组,回归组126份材料4个性状的耐盐指标值为自变量,耐盐性综合评价值D值为因变量,进行多元逐步回归分析。建立多元回归分析方程为:y=0.067+0.005X1+0.002X2+0.001X3。方程中y代表耐盐评价值D值,X1代表相对根长,X2代表相对发芽势,X3代表芽长。方程决定系数R2=0.977,F=2524.518,P<0.01,该回归方程对观测数据的真实反映程度为99%。运用该回归方程计算检验组54份材料的耐盐预测值,与对应D值做相关性分析,显示相关性系数为0.987,呈显著正相关,表明该回归方程能够很好地预测谷子种质资源的耐盐性。
综合相关性分析结果表明,各指标隶属函数值和D值之间均存在极显著正相关,其中相对发芽势和相对根长有较大的相关系数(均大于0.7)(图3),表明相对发芽势和相对根长与D值之间存在不少于70%的重叠信息,因此可以认为这两个指标与耐盐性关系最为密切。
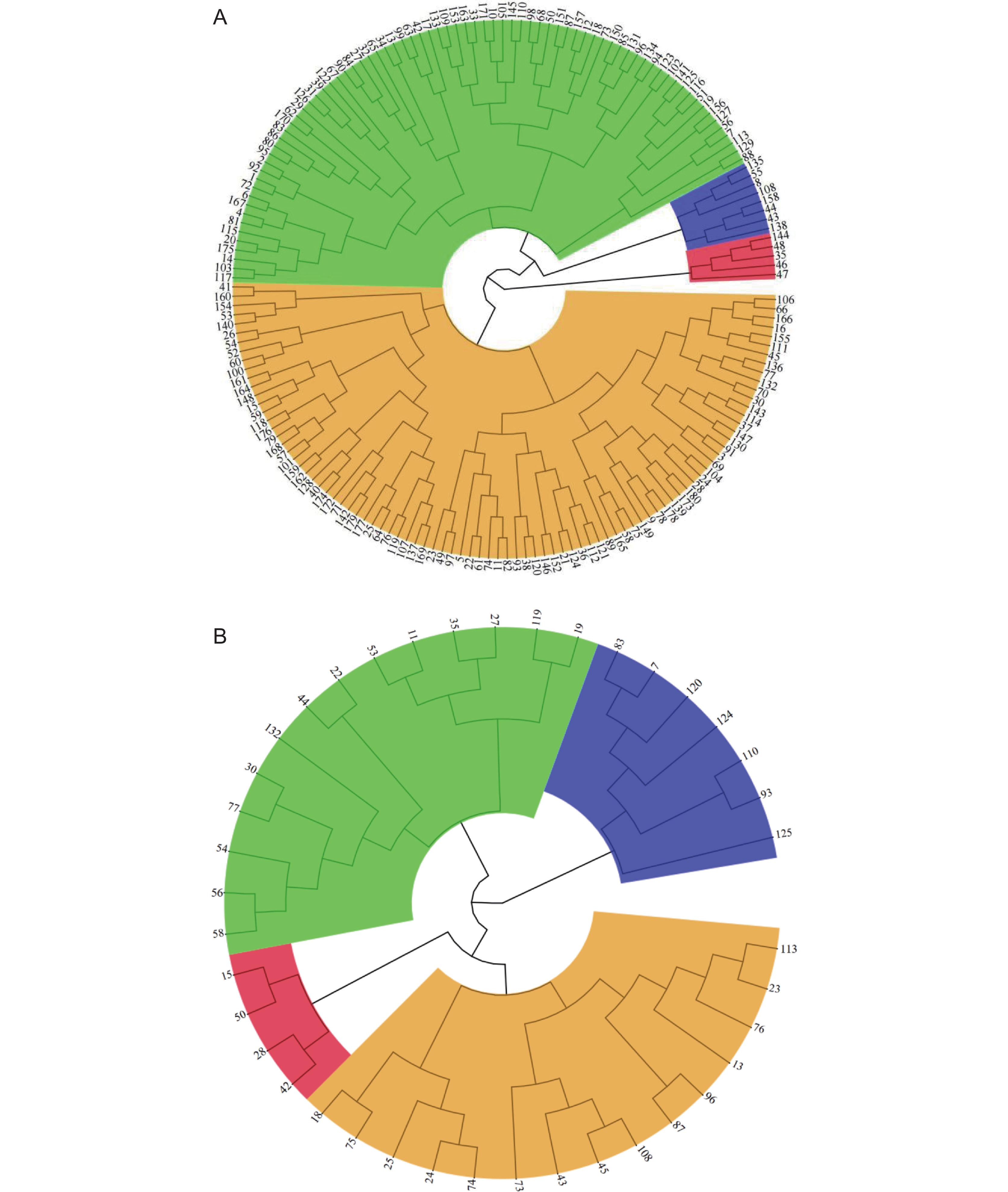
聚类分析结果显示,180份种质耐盐性可划分为4类(图4:A、表5),第1类为极端耐盐种质,共5份,占供试材料的2.78%,分别为硷谷、衡谷12、齐头白、K-3606和晋谷20,其相对发芽势和相对发芽率较高,其中晋谷20的相对发芽势和相对发芽率均最高,分别为134.29%和135.53%,表现出较强促进作用;第2类为耐盐种质,共91份,占50.56%;第3类为盐敏感种质,共76份,占42.22%;第4类为极端盐敏感种质,共8份,占4.44%,分别为小青谷、黑谷、Red manna、秃头、锤罗、蒙金谷1号、山东-4、黑枝谷,其中小青谷和锤罗相对发芽势和相对发芽率最小,分别为9.09%、30.77%和11.61%、28.70%,表现出强烈抑制作用。
![]() 图 4 180份谷子种质及40份遗传群体后代耐盐性的聚类分析A:180份谷子种质材料;数字代表180份谷子种质的编号(附表3)。B:遗传群体40份株系;数字代表RIL群体40份种质的编号;红色代表极端耐盐种质;黄色代表耐盐种质;绿色代表盐敏感种质;蓝色代表极端盐敏感种质。Figure 4. Cluster of 180 germplasms and 40 lines from one genetic population for salt toleranceA: 180 germplasms; Numbers represent codes of 180 germplasms(Attached Table 3). B: 40 lines from one genetic population; Numbers represent the code of 40 germplasms from a RIL population. Red represents extremely salt-tolerant accessions; Yellow represents salt-tolerant accessions; green represents salt-sensitive accessions; Blue represents extremely salt-sensitive accessions.表 5 180份谷子种质萌发期耐盐分类情况Table 5. Classification of 180 Setaria italica germplasms for salt tolerance during the germination stage
图 4 180份谷子种质及40份遗传群体后代耐盐性的聚类分析A:180份谷子种质材料;数字代表180份谷子种质的编号(附表3)。B:遗传群体40份株系;数字代表RIL群体40份种质的编号;红色代表极端耐盐种质;黄色代表耐盐种质;绿色代表盐敏感种质;蓝色代表极端盐敏感种质。Figure 4. Cluster of 180 germplasms and 40 lines from one genetic population for salt toleranceA: 180 germplasms; Numbers represent codes of 180 germplasms(Attached Table 3). B: 40 lines from one genetic population; Numbers represent the code of 40 germplasms from a RIL population. Red represents extremely salt-tolerant accessions; Yellow represents salt-tolerant accessions; green represents salt-sensitive accessions; Blue represents extremely salt-sensitive accessions.表 5 180份谷子种质萌发期耐盐分类情况Table 5. Classification of 180 Setaria italica germplasms for salt tolerance during the germination stage耐盐性
Salt tolerance综合评价值
D种质名称
Name极端耐盐 0.335~0.436 硷谷、衡谷12、齐头白、K-3606、晋谷20 耐盐 0.200~0.311 长治204、济矮秆6、小黄谷子、晋谷33、大青苗、小三变、小白谷、长农35号等 盐敏感 0.121~0.199 红苗金耙齿、鸭子嘴、显256B、金香玉、高粱红、黄粘谷、六棱谷、猫屎谷等 极端盐敏感 0.058~0.113 小青谷、黑谷、Red manna、秃头、锤罗、蒙金谷1号、山东-4、黑枝谷 2.4 RIL群体后代耐盐性分析
为了加强耐盐种质创制和耐盐基因挖掘,利用以上180份谷子种质萌发期耐盐性综合评价中所得到的聚类结果,结合本实验室现有的遗传群体,我们选取黑枝谷(极端盐敏感)×长农35号(耐盐)RIL群体(通过单粒传繁殖到F7代)40个株系进行了耐盐性鉴定验证。
运用R语言最大距离法进行聚类分析,可将40个株系分为4类(图4:B),第1类属于极端耐盐株系,占供试材料的10%;第2类属于耐盐株系,占35%;第3类为盐敏感株系,占37.5%;第4类为极端盐敏感株系,占17.5%。进一步株系耐盐性频率分布分析发现,40个株系相对发芽势、相对发芽率、相对芽长和相对根长表现正态分布(P>0.05)或近似正态分布(图5),表明各株系之间的耐盐性存在明显差异,该群体适宜耐盐QTL挖掘。
3. 讨论
耐盐性鉴定是筛选耐盐种质资源的重要手段。谷子不同生育阶段盐敏感性不同,耐盐性鉴定所采用的鉴选指标也有一定差异。种子萌发期作为植株生长发育的初始阶段,其耐盐性能直接决定植物的出苗率和成苗力[21, 22],发芽率、发芽势、根长和芽长的相对值及盐害率是谷子有效的耐盐性鉴定指标[14, 15, 17, 18, 23-27]。此外,也有学者对谷子苗期和全生育期的耐盐性进行了鉴定,认为株高和相对盐害率可作为苗期的鉴定指标[17, 28],穗重、单穗粒重、干物质重、地上部含水量则是全生育期的耐盐性鉴定指标[18]。综合考虑,本研究选用萌发期的相对发芽势、相对发芽率、相对根长、相对芽长等作为谷子耐盐性的鉴定指标。
合适的筛选浓度能够使各指标在材料间的变异系数和变异幅度最大。前人研究中,谷子NaCl处理浓度主要有150 mmol/L[17, 18]、200 mmol/L[17]、1.5%(约256 mmol/L )[29]、1.0% (约171 mmol/L)[14]等。此外,也有学者利用混合盐碱胁迫方法,所鉴定到的盐浓度相比单一NaCl较低[30, 31]。本实验在150~200 mmol/L设置了更为精细的浓度梯度,明确180 mmol/L NaCl是谷子萌发期耐盐筛选的最适浓度。
作物耐盐性是一个非常复杂的数量性状,单一指标无法准确评价其耐盐性。在耐盐性评价过程中,为减少各指标间代表信息的交叉或重叠,又考虑到综合指标重要性的差异,通常选用综合评价的方法来鉴定耐盐性状,在水稻、小麦、玉米、绿豆、谷子等不同作物中均有报道,并以此鉴定出大量耐盐种质[7-10, 14-16, 32]。本研究选用相对发芽势、相对发芽率、相对芽长和相对根长等4个指标,利用主成分分析、综合相关性分析、聚类分析和多元线性回归方程等进行耐盐指标筛选。主成分分析结果表明相对发芽势、相对发芽率、相对芽长和相对根长可以作为评价谷子萌发期耐盐性的重要指标,采用综合相关性分析,发现相对发芽势和相对根长可以作为耐盐评价的首选指标,通过多元回归方程分析发现相对根长、相对发芽势、相对芽长为耐盐筛选的密切指标。综上,我们认为相对发芽势和相对根长是体现谷子耐盐性的最重要指标,这与小麦中的研究结果类似[33]。
本研究选用综合评价的方法,在180 mmol/L NaCl胁迫下,从180份谷子种质中筛选到5份极端耐盐种质及8份极端盐敏感种质。结合前人研究结果,发现几乎无相同种质的重复鉴定。考虑到一方面,研究中所用材料多少以及统计指标有一定差异;另一方面所选材料中农家种、自育品种所占比重不同,也会造成一定影响。因此,本研究认为在谷子萌发期耐盐性鉴定方面,要特别重视材料选择和分析指标的代表性。
随着功能基因组学和分子生物学技术的发展,在不同作物中,学者们利用不同的遗传群体定位了很多耐盐QTL。迄今,已检测到农作物耐盐相关QTL近1 000个,其中22%的QTL表型贡献率大于20%[34],已精细定位或图位克隆耐盐相关QTL主要有水稻第1染色体上的Salto1和qSKC-1[35, 36],而谷子尚无耐盐性相关QTL的报道。本研究中,我们在180份谷子种质资源耐盐性鉴定基础上,结合本实验室现有遗传群体,对黑枝谷(极端盐敏感)×长农35号(耐盐)RIL群体部分株系进行了耐盐性分析,证实该群体后代株系间耐盐性存在显著差异且表现为近似正态分布,适宜耐盐QTL挖掘。因此,须进一步利用该群体,加快谷子萌发期耐盐QTL挖掘,同时,利用本研究鉴定出的耐盐性差异种质,进行杂交组配,构建不同类型的耐盐性QTL鉴定遗传群体(盐敏感×极端耐盐、盐敏感×耐盐、极端盐敏感×耐盐、极端盐敏感×极端耐盐),用于谷子耐盐QTL挖掘和新品种选育。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
图 1 栀子转录组测序样本基因表达相关性(A)及萜类花香成分合成途径(B)
圆的半径与相关系数成正比,蓝色和红色分别代表负相关和正相关。
Figure 1. Gene expression correlations of RNA-seq samples (A) and biosynthetic pathway of volatile terpenes in Gardenia jasminoides flowers (B)
Circle radius is proportional to correlation coefficient. Blue and red indicate negative and positive correlations of gene expression between pairs of samples, respectively.
表 1 不同物种的TPS蛋白信息
Table 1 Protein information of TPSs collected from multiple species
蛋白名称
Protein name蛋白编号
Protein ID蛋白名称
Protein name蛋白编号
Protein IDFhrTPS1[8] AtTPS02 P0CJ43.1 FhrTPS2[8] AtTPS03 A4FVP2.1 FhrTPS4[8] AtTPS06 Q84UU9.2 FhrTPS6[8] AtTPS10 Q9ZUH4.1 FhaTPS7[8] AtTPS11 Q4KSH9.2 FhaTPS8[8] AtTPS12 Q9T0J9.2 SlTPS3 G1JUH1.1 AtTPS13 Q9T0K1.2 SlTPS5 Q1XBU5.1 AtTPS14 Q84UV0.2 SlTPS9 O64961.1 AtTPS20 A0A178U9Y5.1 SlTPS12 D5KXD2.1 AtTPS21 Q84UU4.2 SlTPS14 G5CV54.1 AtTPS23 P0DI77.1 SlTPS17 G5CV52.1 AtTPS24 Q9LRZ6.1 SlTPS24 NP_001307929.1 AtTPS27 P0DI76.1 SlTPS31 G5CV46.1 LadGERDS U3LVL5.1 SlTPS40 NP_001234008.2 LadCADS U3LW50.1 AgPIN1 O24475.1 LadCARS U3LVZ7.1 AgLIM1 O22340.1 LaBERS Q2XSC4.1 CaTPS1 XP_027109762.1 LaLINS Q2XSC5.1 CaTPS2 R4YXW8.2 LaLIMS Q2XSC6.1 CaTPS3 XP_027093045.1 注:At:拟南芥;Ca:小果咖啡;Lad:薰衣草栽培品种‘Diva’;La:薰衣草;Fhr:香雪兰杂交品种‘Red River’;Fha:香雪兰杂交品种‘Ambiance’;Sl:番茄;Ag:大冷杉。下同。 Notes: At: Arabidopsis thaliana (L.) Heynh.; Ca: Coffea arabica L.; Lad: Lavandula angustifolia ‘Diva’; La: Lavandula angustifolia Mill.; Fhr: Freesia x hybrida ‘Red River’; Fha: Freesia x hybrida ‘Ambiance’; Sl: Solanum lycopersicum L.; Ag: Abies grandis (Douglas ex D. Don) Lindl.. Same below. 表 2 GjTPS基因表达定量引物
Table 2 Primers of GjTPS for qRT-PCR
基因
Gene正向引物(5 ' →3 ')
Forward primer反向引物(5 ' →3 ')
Reverse primerGjACTIN TCCTCTTCCAGCCTTCTATC GCTCATACGGTCAGCAATAC GjTPS1 CTTAGGCAACATGGGTACAA CTCCTTCTGATCCAAGATTCG GjTPS2 ACTTGGTCTGGCCAATTAC ATGCCCATGTTGCCTAAG GjTPS3 GTCTTGGTGAAGAAGGAGAAG CGTTGTACCATTCCACTCTG GjTPS18 TCAGCCTTCCAAGTTAAGCG GTAAAGTTGAATTATGTGAGGGAA GjTPS19 TTCAGTCTTGCAAGTCAAGCG GCATTAGTAAAGTTGTATTATGTGAAGA GjTPS27 GGAGTCAACATCATCCCATAC GCATGGACTAGAAATACTGGAG -
[1] Huang MS,Sanchez-Moreiras AM,Abel C,Sohrabi R,Lee S,et al. The major volatile organic compound emitted from Arabidopsis thaliana flowers,the sesquiterpene (E)-β-caryophyllene,is a defense against a bacterial pathogen[J]. New Phytol,2012,193(4):997−1008. doi: 10.1111/j.1469-8137.2011.04001.x
[2] Willmer PG,Nuttman CV,Raine NE,Stone GN,Pattrick JG,et al. Floral volatiles controlling ant behaviour[J]. Funct Ecol,2009,23(5):888−900. doi: 10.1111/j.1365-2435.2009.01632.x
[3] Mostafa S,Wang Y,Zeng W,Jin B. Floral scents and fruit aromas:functions,compositions,biosynthesis,and regulation[J]. Front Plant Sci,2022,13:860157. doi: 10.3389/fpls.2022.860157
[4] Dudareva N,Klempien A,Muhlemann JK,Kaplan I. Biosynthesis,function and metabolic engineering of plant volatile organic compounds[J]. New Phytol,2013,198(1):16−32. doi: 10.1111/nph.12145
[5] Yonekura-Sakakibara K,Saito K. Functional genomics for plant natural product biosynthesis[J]. Nat Prod Rep,2009,26(11):1466−1487. doi: 10.1039/b817077k
[6] 李海燕,李火根,杨秀莲,岳远征,徐晨,等. 植物花香物质合成与调控研究进展[J]. 分子植物育种,2018,16(1):123−129. Li HY,Li HG,Yang XL,Yue YZ,Xu C,et al. Advances studies on the synthesis and regulation of floral substances in plant[J]. Molecular Plant Breeding,2018,16(1):123−129.
[7] Li JJ,Yu XJ,Shan QR,Shi ZB,Li JH,et al. Integrated volatile metabolomic and transcriptomic analysis provides insights into the regulation of floral scents between two contrasting varieties of Lonicera japonica[J]. Front Plant Sci,2022,13:989036. doi: 10.3389/fpls.2022.989036
[8] Gao FZ,Liu BF,Li M,Gao XY,Fang Q,et al. Identification and characterization of terpene synthase genes accounting for volatile terpene emissions in flowers of Freesia x hybrida[J]. J Exp Bot,2018,69(18):4249−4265. doi: 10.1093/jxb/ery224
[9] Jullien F,Moja S,Bony A,Legrand S,Petit C,et al. Isolation and functional characterization of a τ-cadinol synthase,a new sesquiterpene synthase from Lavandula angustifolia[J]. Plant Mol Biol,2014,84(1):227−241.
[10] 张瑜,徐志超,季爱加,宋经元. bZIP转录因子调控植物次生代谢产物生物合成的研究进展[J]. 植物科学学报,2017,35(1):128−137. Zhang Y,Xu ZC,Ji AJ,Song JY. Regulation of secondary metabolite biosynthesis by bZIP transcription factors in plants[J]. Plant Science Journal,2017,35(1):128−137.
[11] Degenhardt J,Köllner TG,Gershenzon J. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants[J]. Phytochemistry,2009,70(15-16):1621−1637. doi: 10.1016/j.phytochem.2009.07.030
[12] Bohlmann J,Meyer-Gauen G,Croteau R. Plant terpenoid synthases:molecular biology and phylogenetic analysis[J]. Proc Natl Acad Sci USA,1998,95(8):4126−4133. doi: 10.1073/pnas.95.8.4126
[13] 秦政,郑永杰,张文根,张龙,黎祖尧,杨光耀. 毛竹萜类合成酶基因家族序列鉴定与表达分析[J]. 植物科学学报,2018,36(4):575−585. Qin Z,Zheng YJ,Zhang WG,Zhang L,Li ZY,Yang GY. Genome-wide identification and expression analysis of TPS genes in moso bamboo (Phyllostachys edulis)[J]. Plant Science Journal,2018,36(4):575−585.
[14] Chen F,Tholl D,Bohlmann J,Pichersky E. The family of terpene synthases in plants:a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom[J]. Plant J,2011,66(1):212−229. doi: 10.1111/j.1365-313X.2011.04520.x
[15] 李亚文. 三种中国原产精油抗衰老功效及安全性研究[D]. 上海: 上海交通大学, 2019: 3. [16] 姜冬梅,朱源,余江南,徐希明. 芳樟醇药理作用及制剂研究进展[J]. 中国中药杂志,2015,40(18):3530−3533. Jiang DM,Zhu Y,Yu JN,Xu XM. Advances in research of pharmacological effects and formulation studies of linalool[J]. China Journal of Chinese Materia Medica,2015,40(18):3530−3533.
[17] 卢路路,樊怡灵,邓珂,许光治,王艳,等. 不同品种和花期栀子花挥发性物质的主成分和聚类分析[J]. 核农学报,2021,35(7):1601−1608. Lu LL,Fan YL,Deng K,Xu GZ,Wang Y,et al. Principal component and cluster analysis of volatile components in cape jasmine flower from different cultivars at different stages of bloom[J]. Journal of Nuclear Agricultural Sciences,2021,35(7):1601−1608.
[18] 徐晓俞,李程勋,李爱萍,郑开斌. 栀子鲜花精油挥发性成分分析[J]. 福建农业科技,2020(11):12−19. Xu XY,Li CX,Li AP,Zheng KB. Analysis of volatile components in essential oil of Gardenia jasminoides fresh flower[J]. Fujian Agricultural Science and Technology,2020(11):12−19.
[19] 王文翠,毛伟芳,姚雷. 不同提取温度对栀子花香气成分的影响[J]. 上海交通大学学报(农业科学版),2017,35(2):47−53. doi: 10.3969/J.ISSN.1671-9964.2017.02.008 Wang WC,Mao WF,Yao L. Effect of different extraction temperature on Gardenia aroma[J]. Journal of Shanghai Jiaotong University (Agricultural Science)
,2017,35(2):47−53. doi: 10.3969/J.ISSN.1671-9964.2017.02.008 [20] Zhang XF,Klingeman WE,Hu J,Chen F. Emission of volatile chemicals from flowering dogwood (Cornus florida L.) flowers[J]. J Agric Food Chem,2008,56(20):9570−9574. doi: 10.1021/jf801651v
[21] Bergström G,Dobson HEM,Groth I. Spatial fragrance patterns within the flowers of Ranunculus acris (Ranunculaceae)[J]. Plant Syst Evol,1995,195(3-4):221−242. doi: 10.1007/BF00989298
[22] Verdonk JC,de Vos CHR,Verhoeven HA,Haring MA,van Tunen AJ,Schuurink RC. Regulation of floral scent production in petunia revealed by targeted metabolomics[J]. Phytochemistry,2003,62(6):997−1008. doi: 10.1016/S0031-9422(02)00707-0
[23] Du F,Fan JM,Wang T,Wu Y,Grierson D,et al. Identification of differentially expressed genes in flower,leaf and bulb scale of Lilium oriental hybrid 'Sorbonne' and putative control network for scent genes[J]. BMC Genomics,2017,18(1):899. doi: 10.1186/s12864-017-4303-4
[24] Nagegowda DA,Gutensohn M,Wilkerson CG,Dudareva N. Two nearly identical terpene synthases catalyze the formation of nerolidol and linalool in snapdragon flowers[J]. Plant J,2008,55(2):224−239. doi: 10.1111/j.1365-313X.2008.03496.x
[25] Xu ZC,Pu XD,Gao RR,Demurtas OC,Fleck SJ,et al. Tandem gene duplications drive divergent evolution of caffeine and crocin biosynthetic pathways in plants[J]. BMC Biol,2020,18(1):63. doi: 10.1186/s12915-020-00795-3
[26] Xu WJ,Lou Q,Hao LJ,Hu KZ,Cao M,et al. O-methyltransferases catalyze the last step of geniposide biosynthesis in Gardenia jasminoides[J]. Ind Crops Prod,2022,177:114438. doi: 10.1016/j.indcrop.2021.114438
[27] Ye P,Liang SC,Wang XM,Duan LX,Jiang-Yan F,et al. Transcriptome analysis and targeted metabolic profiling for pathway elucidation and identification of a geraniol synthase involved in iridoid biosynthesis from Gardenia jasminoides[J]. Ind Crops Prod,2019,132:48−58. doi: 10.1016/j.indcrop.2019.02.002
[28] Christianson DW. Structural biology and chemistry of the terpenoid cyclases[J]. Chem Rev,2006,106(8):3412−3442. doi: 10.1021/cr050286w
[29] Dudareva N,Martin D,Kish CM,Kolosova N,Gorenstein N,et al. (E)-βa-ocimene and myrcene synthase genes of floral scent biosynthesis in snapdragon:function and expression of three terpene synthase genes of a new terpene synthase subfamily[J]. Plant Cell,2003,15(5):1227−1241. doi: 10.1105/tpc.011015
[30] Van Schie CCN,Haring MA,Schuurink RC. Tomato linalool synthase is induced in trichomes by jasmonic acid[J]. Plant Mol Biol,2007,64(3):251−263. doi: 10.1007/s11103-007-9149-8
[31] Falara V,Akhtar TA,Nguyen TTH,Spyropoulou EA,Bleeker PM,et al. The tomato terpene synthase gene family[J]. Plant Physiol,2011,157(2):770−789. doi: 10.1104/pp.111.179648
[32] Del Terra L,Lonzarich V,Asquini E,Navarini L,Graziosi G,et al. Functional characterization of three Coffea arabica L. monoterpene synthases:insights into the enzymatic machinery of coffee aroma[J]. Phytochemistry,2013,89:6−14. doi: 10.1016/j.phytochem.2013.01.005
-
期刊类型引用(1)
1. 吴子龙,张晨,刘天艺,纪佳佳,刘瑶瑶,任梦莹,赵昕. 外源水杨酸对PEG胁迫下谷子发芽及幼苗生长的影响. 饲料研究. 2024(06): 115-119 .  百度学术
百度学术
其他类型引用(1)
-
其他相关附件
-
PDF格式
许文杰-附表1 点击下载(122KB)
-



 下载:
下载: