Growth and physiological response of Cinnamomum camphora (L.) Presl to copper stress and analysis of copper enrichment and transport characteristics
-
摘要:
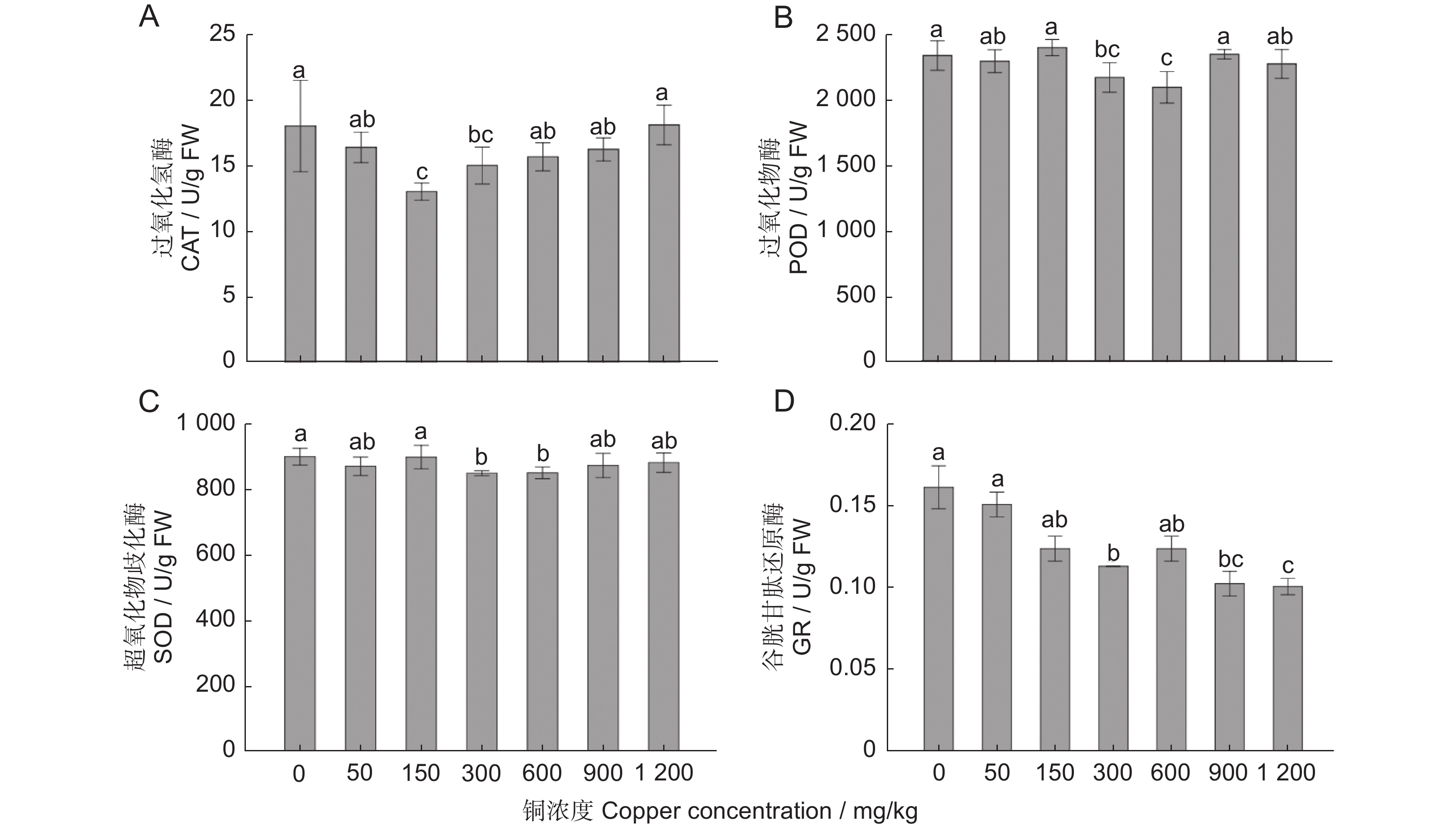
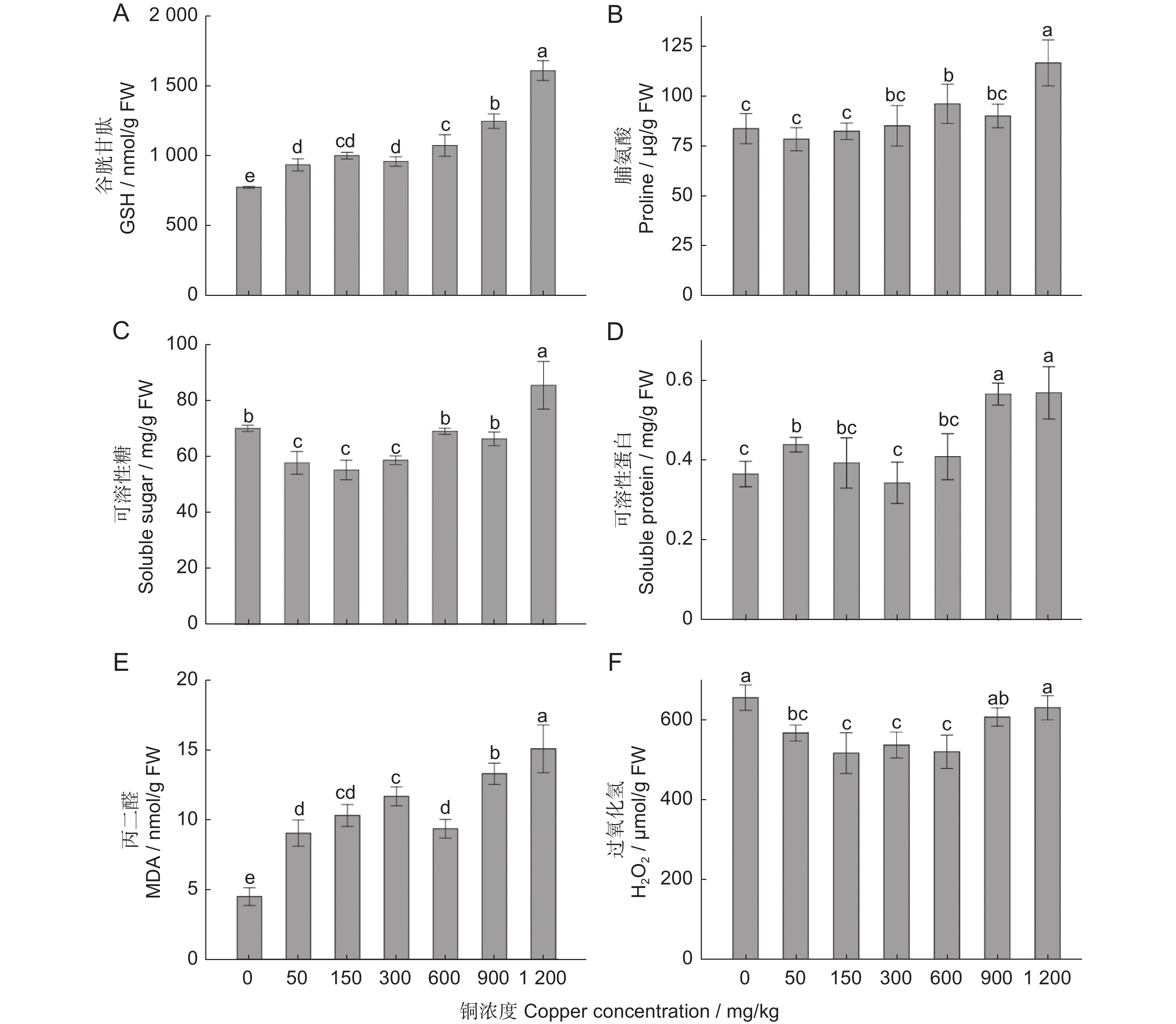
以前期在铜污染矿区修复中筛选出的耐铜樟树(Cinnamomum camphora (L.) Presl)为材料,通过盆栽模拟实验,以不添加铜为对照(CK),设置50、150、300、600、900、1 200 mg/kg 6个处理浓度,胁迫处理60 d后,测定樟树的生物量积累、叶绿素含量、生理生化指标及樟树对铜离子的富集和转移量,分析不同浓度铜处理对耐铜樟树生长、生理生化的影响,以及铜在不同组织的富集转运规律。结果显示,樟树对铜胁迫表现出低浓度(150 mg/kg)促进生长,高浓度抑制生长的趋势。超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)、过氧化氢(Hydrogen peroxide,H2O2)、游离脯氨酸和可溶性糖含量等生理指标在900 mg/kg处理时没有显著升高;谷胱甘肽还原酶(Glutathione reductase,GR)随着处理浓度的升高逐渐降低;丙二醛(Malondialdehyde,MDA)、谷胱甘肽(Glutathione,GSH)含量则随着处理浓度的升高逐渐升高。各器官铜含量的大小顺序为根>叶>茎,樟树主要将铜富集在根系,往地上茎和叶的转移率很低,极大地降低了对茎、叶的铜毒害作用,且随着处理浓度的增加,铜由根系向叶片的转移率IF(Leaf/Root)由对照处理的0.078逐降至1 200 mg/kg处理时的0.007;铜由根系向茎的转移率IF(Stem/Root)由对照处理的0.06逐降至1 200 mg/kg处理时的0.005。综合其生长、生理及铜的富集转运特性,樟树对铜具有较好的耐受性,耐受浓度可达900 mg/kg,是可用于铜污染土壤种植的理想材料。
Abstract:This study investigated copper-resistant Cinnamomum camphora (L.) Presl in the restoration of a copper-polluted mining area through pot simulation experiments. Six treatment concentrations were established (50, 150, 300, 600, 900, and 1 200 mg/kg), with no copper addition used as the control (CK). After 60 d of treatment, biomass accumulation, chlorophyll content, physiological and biochemical indexes of C. camphora, and copper ion accumulation and transfer were measured. The impact of different copper concentrations on growth, physiological, and biochemical responses in C. camphora, as well as the patterns of copper accumulation and distribution in various tissues, were explored to evaluate copper tolerance in this species. Results showed that C. camphora growth under copper stress was enhanced at low copper concentrations (150 mg/kg) and inhibited at high copper concentrations. Physiological indicators, including superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), hydrogen peroxide (H2O2), free proline, and soluble sugar, did not significantly increase under 900 mg/kg copper treatment. glutathione reductase (GR) decreased gradually with the increase of copper concentration, while malondialdehyde (MDA) and glutathione (GSH) contents increased gradually with the increase of copper concentration. Copper was predominantly accumulated in the roots, minimizing toxicity to above-ground tissues, with organ copper content in the order root > leaf > stem. The copper transfer rate (IF) from root to leaf (leaf/root) decreased from 0.078 in the control to 0.007 in the 1 200 mg/kg copper treatment group, while the copper transfer rate (IF) from root to stem (Stem/Root) decreased from 0.06 in the control to 0.005 in the 1 200 mg/kg copper treatment group. Based on growth performance, physiological responses, and copper ion accumulation and transfer, C. camphora exhibited good copper tolerance, withstanding up to 900 mg/kg, highlighting its potential for planting in copper-contaminated soils.
-
湿地与森林、海洋并称为地球三大生态系统,其在调节生物多样性和保护自然环境等方面具有不可替代的功能与效益。西藏作为地球上独特的环境地域单元,孕育了非常独特的高寒生态环境,有着丰富的湿地资源。根据全国湿地资源第二次调查结果,西藏现有河流、湖泊、沼泽等各类湿地6.53 × 104 km2,湿地率(即湿地面积占国土面积的比率)达5.31%,高居全国第二位[1]。西藏独特的自然地理环境条件,也孕育了丰富的湿地生物多样性。近几十年来,西藏高原湿地的生物多样性受气候变化和人为活动等因素的威胁越来越严重,其生态状况也引起了世界范围的高度关注[2]。
植物是湿地生态系统的重要组成部分,也是其主要的初级生产者,对维持生态系统结构和功能的稳定有重要作用[3]。植物多样性是评价湿地生态服务价值和生态系统稳定性的重要指标,与土壤、海拔、气候等环境因子密切相关。一方面,环境因子可以影响植物的生长与群落分布,如有研究表明土壤养分含量直接制约植被的生长发育[4]。海拔也被认为是决定植被群落分布的重要因素之一[5],二者的关系目前主要有两种理论。第一种是“中间高度膨胀理论”[6, 7],即植物多样性在中海拔位置达到峰值,而在高海拔和低海拔地区相对较低。第二种是“负相关理论”[8],即植物多样性随着海拔的增加而降低。另一方面,越来越多的研究表明植物的凋落物和根系分泌物可显著改变土壤质地和肥力,进而可能影响植物的多样性[9, 10]。有研究发现,西藏地区水生植物物种丰富度和系统发育多样性随海拔的增加而显著降低[11]。也有研究表明,西藏高寒沼泽湿地植物多样性的变异受到多种环境因子相互作用的影响[12]。目前对西藏湿地植物的研究大多集中在植物物种调查[13, 14]和保护[15]上,而对湿地植物与高寒环境之间关系的探究相对较少[16, 17],因此,探讨西藏湿地植物多样性与环境因子之间关系具有重要意义。
土壤微生物作为湿地生态系统的分解者,在能量流动、物质循环、生态系统演替以及生物多样性维持等方面发挥重要的生态功能。细菌是最常见和最丰富的土壤微生物类群,驱动着绝大多数生物地球化学循环过程,如土壤有机物矿化、硝化、反硝化等[2, 18]。土壤细菌多样性与生态系统稳定性及土壤肥力有关,且能在一定程度上指示土壤养分状况和土壤质量。研究表明,土壤性质[19]、气候因素[20, 21]、地理距离[22]、植物多样性[23]等因子能显著影响土壤细菌多样性。如在高山草地和森林土壤中,pH是土壤细菌多样性形成和维持的主要驱动因子[24, 25];而在石灰质沙漠土壤中,土壤营养盐含量显著改变细菌群落的组成和结构[26]。李明家等[27]对西藏横断山区怒江和澜沧江两个流域进行了研究,发现气候和环境因子是影响细菌多样性的重要因素。甄莉等[28]探究了西藏热泉沉积物中硫氧化细菌的多样性,发现溶解有机碳含量显著影响硫氧化菌群的多样性。此外,植被特征差异也能不同程度地解释土壤微生物的多样性。如在旱地生态系统中,植物丰富度、盖度以及叶片面积等功能性状可以解释土壤细菌多样性的变异[29]。近年来,土壤微生物多样性的相关研究已经引起了国内外的广泛关注,但目前对西藏高寒环境下湿地土壤细菌多样性的研究还较少。
基于此,本研究选取26个具有代表性的西藏高原湿地为对象,探讨湿地植物和土壤细菌多样性,明确影响植物多样性与土壤细菌多样性的关键因子,试图回答“高寒环境下,哪些环境因子能够解释湿地植物和土壤细菌多样性的空间变化?”这一科学问题。研究结果旨在为了解高寒湿地生态系统的植物、微生物和土壤的相互关系,保护湿地生态系统生物多样性提供理论支撑。
1. 材料与方法
1.1 研究地点
于2020年8月在西藏选取26个相互隔离的典型湿地(28.87° ~ 33.44°N,79.77° ~ 91.88°E)开展植被调查与土壤采样工作(图1)。所选湿地的海拔范围为3974 ~ 5206 m,年平均气温(Mean annual temperature, MAT)为−2.72℃ ~ 6.25℃,年平均降水量(Mean annual precipitation, MAP)为41 ~ 429 mm。所选湿地8月的平均降水量(Average precipitation)为67 mm,平均气温(Average temperature)为10.2℃。
依据典型性原则,在每个湿地内选择能够代表整个植被和土壤等特征的地段设置1个样地。记录样地位置(经度、纬度、海拔)及周围环境特点(放牧干扰程度、水源补给方式等)等信息。在样地内随机布设5 ~ 15个样方,样方面积为1 m2(1 m × 1 m),记录样方内的植物种类、个体数(株 / 丛数)和盖度。随机选取其中1个样方,样方内出现的所有植物各取10个叶片用信封保存,当天测定生物量鲜重和叶面积,并带回实验室测干重、碳氮磷含量等植物功能性状。在该样方内取10 g表层根际土放入冻存管中,带回实验室测定细菌多样性,另取150 g根际土放入自封袋中,带回实验室检测土壤理化性质。
1.2 植物多样性与功能性状测定
根据样方调查数据,计算植物的物种丰富度(Richness)、香农指数(Shannon index)等多样性参数。采样结束后,将植物地上部分与地下部分分开,吸干表面水分后测生物量鲜重。叶片在叶面积板上展开并拍照,使用Image J软件测叶面积(Leaf area, LA)。植物样品带回实验室放置于烘箱中,105℃杀青15 min后,立即降低烘箱温度至80℃,48 h后称量生物量干重,并计算干物质含量(Leaf dry matter content, LDMC)和比叶面积(Specific leaf area, SLA)。烘干后的植物样品用球磨仪粉碎,使用元素分析仪(Elementar Analysensysteme, Vario MACRO cube, 美国)测定叶片总碳(TC)和总氮(TN)含量,使用等离子体原子发射光谱仪(Perkin Elmer, Optima 8000 DV, 美国)测定叶片总磷(TP)含量。根据样方内各物种的相对多度(个体数),计算群落水平上各功能性状的群落加权平均数(Community weighted mean, CWM)。
1.3 土壤细菌多样性的测定
基于16S rRNA基因,采用扩增子高通量测序技术测定土壤的细菌多样性。DNA提取步骤如下:称取0.5 g土壤样品,分别加入PB(pH值 8.0)溶液和TNS(pH值 8.0)溶液,在样品破碎仪(Fastprep-24, 美国)下进行破碎,并离心得到上清液,然后分别用试剂PCI(苯酚∶氯仿∶异戊醇 = 25∶24∶1)、CI(氯仿∶异戊醇 = 24∶1)进行提取,离心得到的沉淀加入TE(pH值 8.0)溶液进行溶解,即DNA溶液。DNA溶液提纯后送至上海派森诺公司进行高通量测序。细菌群落DNA片段的双端(Paired-end)测序在Illumina MiSeq 300PE平台进行,对获得的序列使用DADA2方法进行去引物、质量过滤、去噪、拼接和去嵌合体等操作[30],获得的序列即为操作分类单元(Operational taxonomic units, OTUs)代表序列。使用QIIME 2软件中的“qiime feature-table rarefy”功能,抽平深度设为最低样本序列量的97%,获得抽平OTUs表。通过QIIME 2软件计算土壤细菌的Chao1和香农等多样性指数[31, 32]。
1.4 土壤理化性质的测定
新鲜土壤样品使用烘干法测量含水率(Moisture)。土样经自然风干、碾碎、去除细根等预处理后,分别过10目和100目筛备用。过10目筛的土样采用5%的H2O2去除有机质,然后使用激光粒度粒形仪(Mastersizer 3000, 英国)分析土壤黏粒含量(Clay)。过100目筛的土样用哈纳水质分析仪(HANNA HI98194, 意大利)测定pH值和电导率(Electrical conductivity, EC)。土样(过100目筛)经稀HCl酸化后,用元素分析仪测定有机碳含量(TOC)。使用元素分析仪测定土样(过100目筛)TC和TN含量。土样(过100目筛)经微波消解仪消解后采用等离子体原子发射光谱仪测定TP含量。
1.5 气候数据获取
采用WorldClim v2中的Average temperature(℃)、Precipitation(mm)和Bioclimatic variables(分辨率均为30″)栅格数据集,将其导入到ArcGIS 10.6软件中,使用Spatial Analyst Tools工具箱中的Extract Multi Values To Points工具,提取26个采样位点的月平均温度(Average temperature)、月降水量(Average precipitation),并计算年平均温度(MAT)和年降水量(MAP)等两个气候参数。
1.6 统计分析
实验数据使用R 3.6.2软件进行分析。用Shapiro-Wilk法检测数据的正态性和方差齐性,对不符合正态分布的数据进行对数转换或者平方根转换。采用Mantel分析植物功能性状与细菌多样性的关系,采用相关性分析探讨环境因子与植物多样性、细菌多样性的关系。利用多元回归分析寻找植物多样性和细菌多样性的关键影响因子,并通过变差分解得到各因子的解释率。使用基于距离的冗余分析(Distance-based redundancy analysis, db-RDA)对细菌群落的组成情况进行可视化分析,并通过与排序轴的多元回归置换检验得出影响细菌群落组成的关键环境因子和植物因子。
2. 结果与分析
2.1 植物与土壤细菌的多样性
本研究对26个样地的调查结果表明,植物丰富度为1 ~ 6,平均值为3.04;植物香农指数在0 ~ 1.80,平均为1.06(表1)。土壤细菌的Chao1指数在3654 ~ 6509,平均值为4859;土壤细菌的香农指数最小值为8.72,最大值为11.30。
表 1 植物与土壤细菌多样性Table 1. Plant and soil bacterial diversity指标
Index最小值
Minimum最大值
Maximum平均值
Mean植物丰富度 Plant Richness 1 6 3.04 植物香农指数 Plant Shannon 0 1.80 1.06 细菌Chao1指数 Bacteria Chao1 3654 6509 4859 细菌香农指数 Bacteria Shannon 8.72 11.30 10.41 2.2 环境因子与植物多样性的关系
相关性分析结果表明(图2),植物丰富度仅与土壤电导率显著相关,而与其他环境因子没有明显的相关性;植物香农指数与所有环境因子的相关性均不显著。回归分析结果显示(表2),海拔、年平均温度和土壤电导率仅能解释植物丰富度26.71%的变异,但能解释植物香农指数31.92%的变异,其中,土壤电导率是解释植物丰富度和香农指数变异的首要因子,解释量分别为18.41%和16.79%。
表 2 土壤细菌多样性、植物多样性与环境因子的回归分析解释率Table 2. Multiple linear regression analysis of plant and soil bacterial diversity and environmental factors指标
Index细菌Chao1指数
Bacterial Chao1 / %细菌香农指数
Bacterial Shannon / %植物丰富度指数
Plant Richness / %植物香农指数
Plant Shannon / %纬度 Latitude 8.50 6.00 − − 海拔 Altitude 8.57 21.69 8.30 6.82 年降水 MAP 16.30 − − − pH 值 22.57 16.52 − − 年均温 MAT − − − 8.31 电导率 EC − − 18.41 16.79 总解释率 R2 56.25 44.21 26.71 31.92 2.3 环境因子、植物与土壤细菌多样性的关系
相关性分析结果表明(图2),土壤细菌Chao1指数与土壤电导率呈负相关,土壤细菌Chao1、香农指数均与海拔及年降水量呈正相关,而与土壤pH呈负相关。同时,土壤细菌香农指数还与年均温、土壤总有机碳含量显著相关。进一步进行回归分析,结果显示,纬度、海拔、年降水量和土壤pH值能够解释土壤细菌Chao1指数56.25%的变异;同时,纬度、海拔和土壤pH能够解释土壤细菌香农指数44.21%的变异(表2)。
Mantel分析结果表明,土壤细菌Chao1多样性指数与群落水平的植物叶片总氮含量(CWM.TN)呈显著正相关关系(图3)。回归分析表明,植物叶片干物质含量(CWM.LDMC)与植物丰富度是解释土壤细菌Chao1指数变化的主要因子,分别贡献了18.21%和12.14%的解释度,且细菌Chao1指数随CWM.LDMC与植物丰富度的增加而增加。植物叶片总碳含量(CWM.TC)是影响土壤细菌香农指数变异的关键因子,贡献了14.01%的解释度(表3),且CWM.TC与土壤细菌香农指数呈正相关。
表 3 植物多样性、功能性状和土壤细菌多样性的回归分析解释率Table 3. Regression analysis of plant diversity, functional traits, and soil bacterial diversity指标
Index细菌Chao1指数
Bacterial Chao1 / %细菌香农指数
Bacterial Shannon / %群落加权平均叶干物质含量 CWM.LDMC 18.21 − 植物丰富度指数Richness 12.14 − 群落加权平均叶总碳含量CWM.TC − 14.01 总解释率 R2 30.35 14.01 冗余分析结果显示(图4:A),群落水平的植物功能性状(叶片总氮含量CWM.TN和总碳含量CWM.TC)和土壤理化性质(总碳和pH值)对细菌群落组成影响最大,共解释了12.48%的变异,其中前两轴分别解释了5.58%和2.90%。土壤总碳和pH值与第1轴呈正相关,而叶片总氮和总碳含量与第1轴呈负相关。韦恩图分析结果表明(图4:B),叶片总氮和总碳、土壤总碳和pH值分别解释了细菌群落3.15%、1.73%、2.11%和7.12%的差异,而它们的共同解释率很低,仅为0.08%。此外,与植物因子相比,环境因子对细菌群落组成的影响更大(图4:B)。
3. 讨论
植物多样性的变化受多种环境因素的影响,包括气候、海拔和土壤理化性质等。本研究结果表明,西藏高原湿地土壤电导率与植物丰富度呈显著负相关,且是植物多样性变异的首要驱动因子。土壤电导率直接反映土壤的盐度,过高的土壤电导率会改变植物根区的渗透压,影响植物的代谢路径,进而影响其生长速率[33]。崔乔等[34]对盐沼湿地的研究表明,植物群落组成的模式取决于土壤电导率。气候因子(年平均温度和年降水量)也是影响植物多样性的关键因素,一方面可直接制约植物的生长、分布和繁衍,另一方面决定了土壤的水热条件,从而间接影响植物的多样性[35, 36]。本研究结果表明,年平均温度是影响植物多样性的重要因子之一,而年降水量与植物多样性并没有显著的相关性,这可能是因为青藏高原高寒湿地的植物多样性更易受温度的影响[37]。Hong等[38]在河岸带湿地的研究也发现温度而非降水是影响植物物种多样性的关键因子。海拔的变化通常伴随着气候条件的改变(如温度随海拔上升而下降),进而影响植物的多样性。在西藏高原湿地中,我们发现海拔也是影响植物多样性的一个重要因子,随海拔的升高植物多样性显著降低。
细菌多样性的变化往往与环境因子密切相关。本研究发现,环境因子能够解释土壤细菌Chao1指数56.25%的变异和香农指数44.21%的变异,是影响西藏高原湿地土壤细菌多样性变化的关键因素。此外,土壤pH是湿地细菌多样性变化的关键驱动因子,细菌多样性随土壤pH值的增加而显著降低,这与Kang等[39]的研究结果一致。土壤pH会通过影响土壤基质组成、化学性质和养分利用效率来改变细菌群落的活性和多样性[40]。同时,海拔和纬度也是细菌多样性变化的关键驱动因子,细菌的Chao1指数和香农指数均随海拔的增加而显著增加。Wang等[41]对不同海拔梯度细菌群落的生物多样性模式进行了研究,结果发现细菌多样性与海拔呈显著正相关。虽然纬度也是影响细菌多样性变化的关键因子,但本研究发现二者之间不存在显著相关。这可能是因为纬度的变化主要是通过影响气候条件和土壤理化性质,进而改变细菌的多样性。细菌Chao1指数还与年均降水量呈显著正相关,与杨阳等[42]的研究结果一致。
西藏高原湿地植物的功能性状和物种丰富度也是驱动土壤细菌多样性变化的关键因子。很多研究发现土壤细菌多样性随植物多样性的增加而增加[43, 44],但也有研究指出两者并无显著相关性[45]。植物多样性很可能是通过增加凋落物和根系分泌物等的营养资源,从而促进了土壤细菌多样性的增加[46 - 48]。此外,植物多样性的变化也会引起土壤理化特征的改变(如电导率、有机碳含量等),进而影响土壤细菌多样性。Cao等[49]研究发现植物可以通过影响土壤有机碳、总氮等理化因子间接影响土壤细菌多样性。本研究结果表明,与环境因子相比,植物因子对土壤细菌多样性变化的贡献较小,这也说明西藏高原湿地土壤的细菌多样性主要由环境因子(气候、土壤理化性质)决定。
-
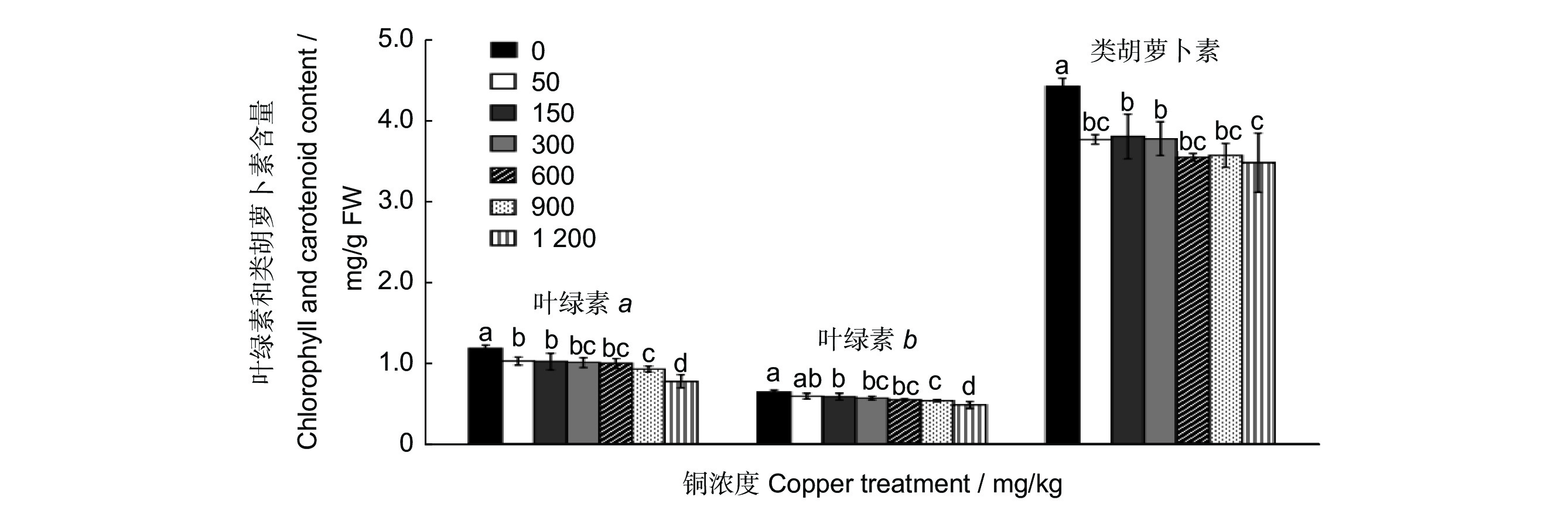
图 2 不同浓度铜处理60 d叶片中叶绿素a、b及类胡萝卜素含量的测定
不同小写字母表示处理间在 P<0.05水平差异显著。下同。
Figure 2. Determination of chlorophyll a, chlorophyll b, and carotenoid in Cinnamomum camphora leaves treated with different concentrations of copper for 60 d
Different lowercase letters indicate significant differences between different treatments at P<0.05 level. Same below.
表 1 不同浓度铜处理下樟树地上和根系生物量(干质量)的测定
Table 1 Determination of aboveground and root biomass (dry mass) of Cinnamomum camphora treated with different concentrations of copper
处理
Treatments / mg/kg地上质量
Dry mass of shoot / g根质量
Dry mass of root / g0 7.98±2.87bc 3.81±1.18ab 50 7.85±2.54bc 3.59±0.67ab 150 9.59±3.08a 4.53±1.35a 300 9.18±1.57ab 3.62±0.53ab 600 7.61±1.14bc 3.49±0.50ab 900 8.33±0.91bc 3.11±0.60b 1200 6.82±1.44c 2.97±0.90b 注:数据均为平均值±标准差,小写字母表示不同处理间在P<0.05水平上差异显著(n=4)。下同。 Notes: All data in the table are average values±standard deviation (SD). Lowercase letters after data in the same row indicate significant differences between different treatments at P<0.05 level (n=4). Same below. 表 2 不同铜浓度处理下樟树不同部位铜含量及铜转移率的测定
Table 2 Effects of different concentrations of copper on copper content and transfer rate in different parts of Cinnamomum camphora
处理
Treatments /
mg/kg叶铜含量
Leaf Cu /
mg/kg茎铜含量
Stem Cu /
mg/kg根铜含量
Root Cu /
mg/kg铜转运
(叶/根)
IF (Leaf/Root)铜转运
(茎/根)
IF (Stem/Root)0 1.91±0.13c 1.46±0.29c 24.46±1.34d 0.078±0.005a 0.060±0.011a 50 1.72±0.01c 1.09±0.13c 25.20±1.28d 0.068±0.004b 0.044±0.007b 150 1.96±0.45c 1.40±0.23c 28.80±3.16d 0.067±0.009b 0.049±0.011ab 300 3.32±0.43b 2.08±0.24b 108.95±13.01c 0.031±0.002c 0.019±0.003c 600 3.44±0.37b 2.12±0.41b 96.67±11.71c 0.036±0.008c 0.022±0.006c 900 3.33±0.66b 1.97±0.36b 384.44±34.11b 0.009±0.002d 0.005±0.001d 1 200 4.06±0.53a 2.95±0.01a 542.27±51.01a 0.007±0.001d 0.005±0.001d -
[1] Zhou JH,Cheng K,Zheng JY,Liu ZQ,Shen WB,et al. Physiological and biochemical characteristics of Cinnamomum camphora in response to Cu-and Cd-contaminated soil[J]. Water Air Soil Pollut,2019,230(1):15. doi: 10.1007/s11270-018-4048-y
[2] 朱志军,聂逢君,胡青华. 江西省德兴矿区土壤重金属污染的综合评价分析[J]. 东华理工学院学报,2007,30(4):332−336. Zhu ZJ,Nie FJ,Hu QH. Analysis of soil pollution by heavy metals in Dexing mining area,Jiangxi province[J]. Journal of East China Institute of Technology,2007,30(4):332−336.
[3] 陈翠华,倪师军,何彬彬,张成江. 江西德兴矿集区土壤重金属污染分析[J]. 地球与环境,2007,35(2):134−141. doi: 10.3969/j.issn.1672-9250.2007.02.007 Chen CH,Ni SJ,He BB,Zhang CJ. Heavy metals contamination of soils of in Dexing Mine,Jiangxi Province,China[J]. Earth and Environment,2007,35(2):134−141. doi: 10.3969/j.issn.1672-9250.2007.02.007
[4] Dhaliwal SS,Singh J,Taneja PK,Mandal A. Remediation techniques for removal of heavy metals from the soil contaminated through different sources:a review[J]. Environ Sci Pollut Res,2020,27(2):1319−1333. doi: 10.1007/s11356-019-06967-1
[5] Chandrasekhar C,Ray JG. Lead accumulation,growth responses and biochemical changes of three plant species exposed to soil amended with different concentrations of lead nitrate[J]. Ecotoxicol Environ Saf,2019,171:26−36. doi: 10.1016/j.ecoenv.2018.12.058
[6] Jaffré T,Pillon Y,Thomine S,Merlot S. The metal hyperaccumulators from New Caledonia can broaden our understanding of nickel accumulation in plants[J]. Front Plant Sci,2013,4:279.
[7] 段亚萍,赵冰,付丽童,李雨倩,张瑛. 铅、锌污染下蜀葵的生长生理响应和富集转运特性研究[J]. 草地学报,2022,30(2):418−425. Duan YP,Zhao B,Fu LT,Li YQ,Zhang Y. Study on growth,physiological response and accumulation,transport characteristics of Alcea rosea (L. ) Cavan. under lead and zinc pollution[J]. Acta Agrestia Sinica,2022,30(2):418−425.
[8] Yu G,Ullah H,Wang XS,Liu J,Chen BL,et al. Integrated transcriptome and metabolome analysis reveals the mechanism of tolerance to manganese and cadmium toxicity in the Mn/Cd hyperaccumulator Celosia argentea L.[J]. J Hazard Mater,2023,443:130206. doi: 10.1016/j.jhazmat.2022.130206
[9] 孙小艳,辛在军,刘淑娟,李晓晖,刘建平. 不同中国鹅掌楸种源对镉吸收分配特性研究[J]. 江西农业大学学报,2020,42(6):1285−1291. Sun XY,Xin ZJ,Liu SJ,Li XH,Liu JP. Characteristics of cadmium absorption and distribution in different provenances of Liriodendron chinense[J]. Acta Agriculturae Universitatis Jiangxiensis,2020,42(6):1285−1291.
[10] 李彩霞,朱国强,彭坤. 绿化带土壤重金属污染特征及植物富集研究——以长沙市为例[J]. 中南林业科技大学学报,2016,36(10):101−107. Li CX,Zhu GQ,Peng K. Study on soil pollution characteristics by heavy metals and the plant concentration in green belts[J]. Journal of Central South University of Forestry & Technology,2016,36(10):101−107.
[11] 施海涛. 植物逆境生理学实验指导[M]. 北京: 科学出版社, 2016: 57-74. [12] 于静波. Cd、Pb及其复合胁迫对樟树生理特性的影响[D]. 福州: 福建农林大学, 2012: 1-53. [13] 施浩威. 铜、锌胁迫对芳樟幼苗生长的影响[D]. 南昌: 南昌工程学院, 2018: 1-35. [14] 王利宝,朱宁华,鄂建华. Pb、Zn等重金属对樟树、栾树幼苗生长的影响[J]. 中南林业科技大学学报,2010,30(2):44−47. doi: 10.3969/j.issn.1673-923X.2010.02.008 Wang LB,Zhu NH,E JH. Effects of heavy matels lead,zinc and copper on young seedling growth of Cinnamomum camphora and Koelreuteria paniculata[J]. Journal of Central South University of Forestry & Technology,2010,30(2):44−47. doi: 10.3969/j.issn.1673-923X.2010.02.008
[15] 王丽红,陈惠茹,周青. 铜与锌对香樟、广玉兰及榉树生理生化特性的复合影响[J]. 生态环境学报,2013,22(11):1819−1824. doi: 10.3969/j.issn.1674-5906.2013.11.013 Wang LH,Chen HR,Zhou Q. Combined effects of copper,zinc on physiological and biochemical characteristics of Magnolia grandiflora,Cinnamomum camphora and Zelkova schneideriana[J]. Ecology and Environmental Sciences,2013,22(11):1819−1824. doi: 10.3969/j.issn.1674-5906.2013.11.013
[16] 李红. 铜对芥菜与小白菜萌发和生长的影响研究[D]. 杨凌: 西北农林科技大学, 2009: 22-58. [17] 黄强,司菲斐,符桢华,刘伟涛,薛长雷. Cu胁迫对小白菜生理生化特性的影响[J]. 现代食品科技,2008,24(11):1111−1114. Huang Q,Si FF,Fu ZH,Liu WT,Xue CL. The effects of Cu treatment on the physiological and biochemical characters of Brassica campestris ssp. Chinensis[J]. Modern Food Science and Technology,2008,24(11):1111−1114.
[18] 胡筑兵,陈亚华,王桂萍,沈振国. 铜胁迫对玉米幼苗生长、叶绿素荧光参数和抗氧化酶活性的影响[J]. 植物学通报,2006,23(2):129−137. Hu ZB,Chen YH,Wang GP,Shen ZG. Effects of copper stress on growth,chlorophyll fluorescence parameters and antioxidant enzyme activities of Zea mays seedlings[J]. Chinese Bulletin of Botany,2006,23(2):129−137.
[19] Appenroth KJ,Krech K,Keresztes Á,Fischer W,Koloczek H. Effects of nickel on the chloroplasts of the duckweeds Spirodela polyrhiza and Lemna minor and their possible use in biomonitoring and phytoremediation[J]. Chemosphere,2010,78(3):216−223. doi: 10.1016/j.chemosphere.2009.11.007
[20] 袁霞,李艳梅,张兴昌. 铜对小青菜生长和叶片保护酶活性的影响[J]. 农业环境科学学报,2008,27(2):467−471. doi: 10.3321/j.issn:1672-2043.2008.02.012 Yuan X,Li YM,Zhang XC. Effect of copper addition on the growth and the activities of protective enzymes in leaves of Brassica chinensis[J]. Journal of Agro-Environment Science,2008,27(2):467−471. doi: 10.3321/j.issn:1672-2043.2008.02.012
[21] 李炎林,唐前瑞,张宏志,李达,熊兴耀,于晓英. Cu2+浓度对红檵木生理生化特性的影响[J]. 经济林研究,2009,27(1):65−68. doi: 10.3969/j.issn.1003-8981.2009.01.014 Li YL,Tang QR,Zhang HZ,Li D,Xiong XY,Yu XY. Effect of copper ion concentration on physiological and biochemical characteristics of Loropetalum chinense var. rubrum[J]. Nonwood Forest Research,2009,27(1):65−68. doi: 10.3969/j.issn.1003-8981.2009.01.014
[22] 朱成豪,唐健民,高丽梅,邹蓉,史艳财,等. 重金属铜、锌、镉复合胁迫对麻疯树幼苗生理生化的影响[J]. 广西植物,2019,39(6):752−760. doi: 10.11931/guihaia.gxzw201803009 Zhu CH,Tang JM,Gao LM,Zou R,Shi YC,et al. Effects of combined stress of heavy metals Cu,Zn and Cd on physiology and biochemistry of Jatropha curcas seedlings[J]. Guihaia,2019,39(6):752−760. doi: 10.11931/guihaia.gxzw201803009
[23] 金进,叶亚新,李丹,韩乐. 重金属铜对玉米的影响[J]. 玉米科学,2006,14(3):83−86. doi: 10.3969/j.issn.1005-0906.2006.03.024 Jin J,Ye YX,Li D,Han L. Effect of heavy metal (copper) coercion on maize[J]. Journal of Maize Sciences,2006,14(3):83−86. doi: 10.3969/j.issn.1005-0906.2006.03.024
[24] 张国军,邱栋梁,刘星辉. Cu对植物毒害研究进展[J]. 福建农林大学学报(自然科学版),2004,33(3):289−294. doi: 10.3321/j.issn:1671-5470.2004.03.005 Zhang GJ,Qiu DL,Liu XH. Advances in copper toxicity to plants[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition)
,2004,33(3):289−294. doi: 10.3321/j.issn:1671-5470.2004.03.005 [25] 张莉,徐彦红,张淑炜,刘宇宇,席溢. 两种草坪草单种与混种对铅-锌-镉复合污染的生理响应[J]. 草地学报,2022,30(10):2635−2644. Zhang L,Xu YH,Zhang SW,Liu YY,Xi Y. Physiological response to Pb-Zn-Cd compound pollution under single- and mixed-sowing of two turfgrass species[J]. Acta Agrestia Sinica,2022,30(10):2635−2644.
[26] Tewari RK,Kumar P,Sharma PN,Bisht SS. Modulation of oxidative stress responsive enzymes by excess cobalt[J]. Plant Sci,2002,162(3):381−388. doi: 10.1016/S0168-9452(01)00578-7
[27] 凌宇,龙江宇,项远航,范吉标. 镉胁迫对高羊茅和匍匐翦股颖抗逆生理特性的影响[J]. 植物科学学报,2022,40(5):705−713. Ling Y,Long JY,Xiang YH,Fan JB. Effects of cadmium stress on physiological characteristics of resilience in Festuca arundinacea L. and Agrostis stolonifera L.[J]. Plant Science Journal,2022,40(5):705−713.
[28] Kaur G,Singh HP,Batish DR,Kohli RK. A time course assessment of changes in reactive oxygen species generation and antioxidant defense in hydroponically grown wheat in response to lead ions(Pb2+)[J]. Protoplasma,2012,249(4):1091−1100. doi: 10.1007/s00709-011-0353-7
[29] 刘周莉,何兴元,陈玮. 镉胁迫对金银花生理生态特征的影响[J]. 应用生态学报,2009,20(1):40−44. Liu ZL,He XY,Chen W. Effects of cadmium stress on the growth and physiological characteristics of Lonicera japonica[J]. Chinese Journal of Applied Ecology,2009,20(1):40−44.
[30] 冯世座,刘合芹. 极端温度对籼粳稻苗期光合特性及生理生化特性的影响[J]. 浙江师范大学学报(自然科学版),2012,35(3):330−337. doi: 10.3969/j.issn.1001-5051.2012.03.019 Feng SZ,Liu HQ. Effects of extreme temperature on photosynthetic and physio-biochemical characteristics of indica and japonica rice seedlings[J]. Journal of Zhejiang Normal University(Natural Sciences)
,2012,35(3):330−337. doi: 10.3969/j.issn.1001-5051.2012.03.019 [31] 蔡雄伟. 铅胁迫对狗牙根叶片中游离脯氨酸及丙二醛含量的影响[J]. 四川农业科技,2018(5):44−46. doi: 10.3969/j.issn.1004-1028.2018.05.016 [32] 吴静,袁平成. 高温处理对3种香草植物生理生化特性的影响[J]. 江汉大学学报(自然科学版),2021,49(6):42−47. Wu J,Yuan PC. Effects of high temperature treatment on the physiological and biochemical characteristics of three aromatic plants[J]. Journal of Jianghan University (Natural Science Edition)
,2021,49(6):42−47. [33] 刘家尧,衣艳君,张其德. 盐胁迫对不同抗盐性小麦叶片荧光诱导动力学的影响[J]. 植物学通报,1998,15(2):46−49. Liu JY,Yi YJ,Zhang QD. Effects of salt stress on chlorophyll a fluorescence induction kinetics in wheat leaves with different salt tolerance[J]. Chinese Bulletin of Botany,1998,15(2):46−49.
[34] 袁俊,盛莎莎,刘荣鹏,王晓云. 镉胁迫对丹参生理特性和代谢特征的影响[J]. 植物科学学报,2022,40(3):408−417. doi: 10.11913/PSJ.2095-0837.2022.30408 Yuan J,Sheng SS,Liu RP,Wang XY. Effects of cadmium on physiological characteristics and metabolic profiles of Salvia miltiorrhiza Bunge[J]. Plant Science Journal,2022,40(3):408−417. doi: 10.11913/PSJ.2095-0837.2022.30408
[35] Blokhina O,Virolainen E,Fagerstedt KV. Antioxidants,oxidative damage and oxygen deprivation stress:a review[J]. Ann Bot,2003,91(2):179−194. doi: 10.1093/aob/mcf118
[36] Song JJC,Li YY,Tang H,Qiu CS,Lei L,et al. Application potential of Vaccinium ashei R. for cadmium migration retention in the mining area soil[J]. Chemosphere,2023,324:138346. doi: 10.1016/j.chemosphere.2023.138346
[37] 吴照祥,孙小艳,刘腾云,余发新,李晓晖,周静. 中、轻度污染农田杂交水稻对Cd的吸收和累积分布[J]. 江西农业大学学报,2019,41(3):423−430. Wu ZX,Sun XY,Liu TY,Yu FX,Li XH,Zhou J. Cd accumulation,distribution and transport in varieties of hybrid rice grown in medium to low Cd-polluted farmland[J]. Acta Agriculturae Universitatis Jiangxiensis,2019,41(3):423−430.
[38] 朱宇恩,赵烨,徐东昱,闫冬,呼红霞,李永良. 旱柳(Salix matsudana Koidz)体内Cu迁移特征的水培模拟研究[J]. 环境科学学报,2011,31(12):2740−2747. Zhu YE,Zhao Y,Xu DY,Yan D,Hu HX,Li YL. Investigation on the characteristics of copper migration in different tissues of Salix matsudana Koidz based on hydroponic experiment[J]. Acta Scientiae Circumstantiae,2011,31(12):2740−2747.
[39] Yu M,Zhuo RY,Lu ZC,Li SC,Chen JJ,et al. Molecular insights into lignin biosynthesis on cadmium tolerance:morphology,transcriptome and proteome profiling in Salix matsudana[J]. J Hazard Mater,2023,441:129909. doi: 10.1016/j.jhazmat.2022.129909
[40] Hall JL. Cellular mechanisms for heavy metal detoxification and tolerance[J]. J Exp Bot,2002,53(366):1−11.
[41] Grill E,Winnacker EL,Zenk MH. Phytochelatins:the principal heavy-metal complexing peptides of higher plants[J]. Science,1985,230(4726):674−676. doi: 10.1126/science.230.4726.674
-
期刊类型引用(1)
1. 张曼华,谢元贵,田秀,张蓝月,廖小锋,王军才. 土壤微生物对4种森林类型植物多样性形成的影响. 中南林业科技大学学报. 2025(01): 26-38 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载: