Comparative proteomics analysis of developing buds in Brassica napus L.
-
摘要:
甘蓝型油菜(Brassica napus L.)是我国目前的主栽油菜类型,其花蕾发育包含一系列复杂的代谢和调控过程,尤其是小孢子成熟前的早期发育过程对油菜育性影响较大。本研究首先通过组织形态学观察,确定甘蓝型油菜花蕾大小在1~3 mm时期,对应于雄蕊发育的5~9期。利用高通量的HPLC-MS/MS质谱测序技术,对该发育时段的花蕾进行蛋白质组学分析,共鉴定到13 444 个蛋白,比较各时期鉴定到的蛋白筛选出613 个差异表达蛋白。对差异蛋白的功能进行分析,发现细胞壁建成、脂质代谢、细胞转运相关蛋白大量上调,这将有利于花蕾发育过程中的细胞建成和花粉发育;核酸相关蛋白表达与含量变化迅速,这与该时段细胞的急剧分裂与生长的代谢过程一致;而ABCDE发育模型相关蛋白的表达未发生显著变化,可能具有除诱导花蕾分化外的其他功能。研究结果说明油菜花蕾发育早期细胞代谢旺盛,大量代谢相关蛋白发生了显著变化,这将为进一步分析花蕾发育过程中的代谢及调控过程提供基础。
Abstract:Brassica napus L., the predominant variant of rapeseed cultivated in China, undergoes a series of complex metabolic and regulatory processes during flower bud development, especially the early developmental stages preceding microspore maturation, which significantly impacts fertility. Based on phenotypic and histological observations, flower bud sizes ranging from 1 mm to 3 mm in B. napus were found to correspond to the 5th–9th stages of angiosperm stamen development. Using high-throughput high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) sequencing technology, proteomics analysis was conducted on these flower buds. In total, 13 444 proteins were identified, including 613 differentially expressed proteins (DEPs). Functional analysis of the DEPs revealed a significant up-regulation in cell wall building, lipid metabolism, and cell transport-related proteins, crucial for cell development and pollen formation during the early stage of flower bud development. The expression of nucleic acid-related proteins markedly changed, consistent with rapid cell division and growth during this period. However, no significant changes were found in the expression of proteins related to the ABCDE development model, suggesting these proteins may have other functions beyond inducing flower bud differentiation. This study systematically studied the differences in tissue morphology and protein expression during the early stages of bud development in B. napus, paving the way for further research on the metabolism and regulation of flower bud development.
-
Keywords:
- Brassica napus /
- Bud /
- Comparative Proteomics /
- Development
-
油菜作为我国第一大油料作物,承担着国产油料作物至少50%的产油量,是我国国产食用植物油的重要来源。目前,我国种植的主要油菜类型为甘蓝型油菜(Brassica napus L.)[1]。油菜花的发育直接影响着种子的产量和油菜油的品质,对花器官发育进程的研究将有利于改良油菜品质与育种方式。油菜属于十字花科,具有4 枚花萼和花瓣,四长二短共6 枚雄蕊,1 枚雌蕊,四强雄蕊外侧有4 个蜜腺。油菜在茎尖分生组织由营养生长向生殖生长过渡之后开始诱导花蕾发育。花蕾由4种轮生的器官类型组成,第1轮是4个萼片原基,第2轮是4个花瓣原基,第3轮是6个雄蕊,最内侧的第4轮是两个融合的心皮。花雄蕊的发育直接决定了花的育性。Sanders等[2]根据连续的雄蕊发育组织切片观察结果将拟南芥(Arabidopsis thaliana (L.) Heynh.)花蕾发育过程划分为15 个阶段,1~2:雄蕊原基和孢原细胞出现;3:有丝分裂开始,萼片原基可见;4~5:形成蝴蝶型花药和4个清晰的药室,产生小孢子母细胞,出现花瓣原基;6:小孢子母细胞进入减数分裂,中间层被压缩,绒毡层空泡化;7:小孢子四分体出现,各器官增大并开始分化,大孢子亦已出现;8:四分体的胼胝壁退化释放出单个小孢子;9:小孢子产生外壁空泡化;10:绒毡层开始退化;第11期后花粉粒开始成熟、花药开裂、花粉释放,雄蕊开始衰老。其中,在植物体中具有维持细胞形状、保护原生质体等作用的细胞壁,它的重建就发生于有丝分裂末期,约在花蕾发育的第3~5期。同时,脂质作为细胞膜的重要组成部分,不仅提供支撑作用,还对维持植物生理状态至关重要[3],当花蕾发育处于第6期时,绒毡层内开始分泌大量油脂等物质,随着花蕾的发育,油腺逐渐发育膨大,脂质代谢也在不停地进行中。花蕾的发育是不断进行的,涉及一系列的生理生化过程,各种必需物质的产生与代谢,共同调节着花蕾的生长发育。
基于花蕾发育开展了多种基因突变体的研究。Weigel和Meyerowitz[4]在1991年提出被子植物花蕾发育的ABC模型,此模型将花器官决定基因分成3类,即A类基因、B类基因和C类基因,3种基因共同表达决定器官的形成。拟南芥中的A类基因有APETALA1(AP1)和APETALA2(AP2),B类基因有APETALA3(AP3)和PISTILLATA(PI),迄今为止发现的唯一C型基因是AGAMOUS(AG)[5]。AP1可与AP3的启动子结合[6],共同调控B类基因表达,诱导花瓣发育[7]。后来研究又发现了与C类基因功能部分重叠的D类基因以及一类SEPALLATA(SEP)基因。D类基因的突变将影响胚珠的形成和发育,部分胚珠转化为心皮结构和叶结构[8]。SEP基因被命名为E类基因,能与ABC类基因联合表达使叶片转化为完整的花器官。花器官发育模型进一步扩展为“ABCDE”模型[9]。ABCDE模型认为花器官的决定基因被MADS蛋白组合为四聚体复合体来发挥作用[10-13],即2AP1+2SEP共同调控萼片的形成和发育[14],AP1+PI+AP3+SEP共同决定花瓣的形成和发育,AP3+PI+AG+SEP共同调控雄蕊的形成和发育,2AG+2SEP共同决定心皮的形成和发育[15]。四聚体复合物模型的发现有效地解释了花器官的变化,极大地促进了对花器官发育的研究。
蛋白质组学作为后基因组时代在整体水平上研究生命活动的一种高通量方法,为研究花蕾发育过程中的蛋白变化提供了有效的平台。Zhu等[16]利用基于凝胶和非标定量的方法研究了金银花(Lonicera japonica Thunb.)未成熟花蕾中的蛋白表达情况,发现磷酸戊糖氧化途径、信号传导、激素代谢和转运相关蛋白在此阶段大量表达。拟南芥ASK1(Arabidopsis Skp1-Like1)蛋白在花的发育及雄蕊的减数分裂中发挥重要功能,Lu等[17]利用多维蛋白质鉴定技术(MudPIT)比较了野生型和ASK1突变体的花蕾蛋白表达谱,发现一系列转录调节因子、激酶、肽酶和核糖体蛋白可能对ASK1-E3在花发育中的功能产生影响。Heng等[18]通过iTRAQ标记的比较蛋白质组学技术分析了油菜Hau细胞质雄性不育系(CMS)及保持系的幼嫩花蕾,发现一些与能量代谢有关的蛋白,如氧化磷酸化、糖酵解/糖异生和丙酮酸代谢相关蛋白,在hau CMS系中显著减少,说明Hau雄性不育可能与花蕾发育期能量供应不足有关。
花蕾发育的各阶段也同时受到多种环境因子的深刻影响,致使发育进程发生差异,甚至直接影响花粉的育性。在杂交育种实践中应用的不育系多在发育早期即小孢子形成之前败育,如波里马温敏型细胞质雄性不育(pol TCMS)。目前为止,还没有针对花蕾发育进行系统蛋白质组学研究的文献。本研究选用了pol TCMS的稳定保持系597的花蕾,利用比较蛋白质组学的方法,系统研究了花蕾发育早期各阶段的蛋白表达差异,以期为深入解析油菜花蕾发育过程中的代谢及调控过程,并为进一步研究pol TCMS的败育机制提供基础。
1. 材料与方法
1.1 实验材料
本研究所用材料为甘蓝型油菜pol CMS保持系597,是一种稳定可育的材料,种植于华中农业大学油菜试验田。在开花季即3-4月对发育中的花蕾进行观察和取样分析。
1.2 实验方法
1.2.1 花蕾表型的观察
于开花季,选取不同发育阶段的花蕾,使用镊子轻轻分离保持系花瓣及雌雄蕊,使用体视显微镜观察整朵花的形态、花瓣形态、雌雄蕊形态,用电脑进行拍照记录,对比保持系597在不同发育阶段的形态变化。
取油菜不同发育阶段的花药,用解剖针分离花粉粒,置于滴有1%醋酸洋红染色液的载玻片上,盖上盖玻片,在显微镜下观察染色程度、花粉粒数目和形态的变化。
1.2.2 花蕾石蜡切片观察
石蜡切片制作参考文献[19]进行。分别取1、1.5、2和3 mm油菜花蕾放入FAA固定液中,进行抽真空固定。固定好的材料依次经各级乙醇溶液脱水,逐级浸蜡3次(各1 h)使固定材料透明。再将液体蜡和样品放入包埋框中包埋,石蜡冷却凝固后修块,于切片机上切为4 μm切片。石蜡切片在40 ℃水面上展平后,转移到载玻片上,于60 ℃烘箱烤片,再依次将载玻片放入二甲苯(40 min)、无水乙醇(20 min)、95%、90%、80%、70%乙醇(各5 min),再用蒸馏水洗净脱蜡。滴加苏木精染色液染色3~8 min,自来水洗净,1%盐酸酒精分色2~10 s,自来水冲洗,0.6%氨水返蓝,流水冲洗,伊红染液染色1~3 min。再将石蜡切片依次放入95%乙醇两次(各5 min)、无水乙醇两次(各5 min)、二甲苯两次(各5 min),使其脱水至透明,晾干后用树胶封片。最后将石蜡切片放入37 ℃培养箱中干燥,完全干透后用于显微镜观察。
1.2.3 花蕾蛋白提取与定量
分别取1、1.5、2、3 mm油菜花蕾,按照丙酮法提取总蛋白。液氮研磨样品后,加入蛋白提取液继续研磨成匀浆,离心后取上清,加入冷丙酮−20 ℃沉淀过夜。沉淀完成后离心,按上清∶丙酮 = 1∶3体积比加冷丙酮洗蛋白,−20 ℃沉淀,重复3 次。最后干燥并于−80 ℃保存。用8 mol/L 尿素溶解刚提取到的蛋白干粉后,用BCA(Bicinchoninic acid assay)法进行蛋白定量,方法参考BCA蛋白浓度测定试剂盒说明书。首先取适量牛血清白蛋白标准品制成1 mg/mL的标准蛋白溶液,并配制一系列蛋白浓度梯度以获得标准曲线,待测蛋白用磷酸缓冲盐溶液补足体积后,加入BCA溶液室温反应30 min,通过全波长酶标仪SpectraMax 190测定562 nm处的吸光度,绘制标准曲线计算所提取总蛋白的浓度。
1.2.4 蛋白的酶解及质谱鉴定
取总蛋白50 μg,加入等体积DTT使最终浓度为5 mmol/L ,56 ℃水浴30 min,再加入11 mmol/L 的碘代乙酸,室温避光15 min,进行酰基化;而后用尿素稀释7倍,胰酶∶蛋白 = 1∶50 μg,37 ℃进行第1次酶解;胰酶∶蛋白 = 0.5∶50 μg,37 ℃进行第2次酶解后旋转干燥,用100 μL 0.1%甲酸(FA)复溶。酶解后的肽段进行分级脱盐处理,具体操作方法参考试剂盒说明书进行(Thermo,84868),脱盐的蛋白肽段进行干燥。
干燥肽段样品用0.1% FA溶液复溶,振荡混匀后,15 000 r/min离心1 min,取上清液利用EASY-nLC1200 UHPLC-MS/MS(Thermo Scientific)进行肽段液相色谱分离和质谱鉴定。液相层析系统选用C18 Tip柱(内径75 µm,长度120 mm,Nikkyo Technos),200 nl/min流速,乙腈梯度8%~30%分离和洗脱120 min。经过1.5 kV的电喷雾极化后,肽段样品进入Orbitrap质谱进行400~1 500 m/z谱扫描,产生分辨率为30 000的一级质谱数据。选取前10 个高强度的离子前体在线性离子阱以35%的能量进行碰撞,诱导产生二级质谱数据。统计每个肽段产生的不同二级碎片的强度,分析得到其相对丰度。
1.2.5 质谱数据分析
将获得的质谱信息与已发表的油菜数据库(http://cbi.hzau.edu.cn/bnapus/index.php)进行比对鉴定,利用Proteome Discoverer 2.4软件进行蛋白表达分析。韦恩图分析利用TBtools软件,通过韦恩图对比各样品中特有的蛋白数量进行主成分分析。根据P-value<0.05,Folds change≥2,CV<20%条件筛选出花蕾早期发育的差异表达蛋白,对比统计不同样品间上调蛋白和下调蛋白。差异表达蛋白的聚类(HCL)分析利用MultiExperiment Viewer软件,使用MapMan分析方法进行蛋白的功能分类。
2. 结果与分析
2.1 甘蓝型597花蕾发育表型观察
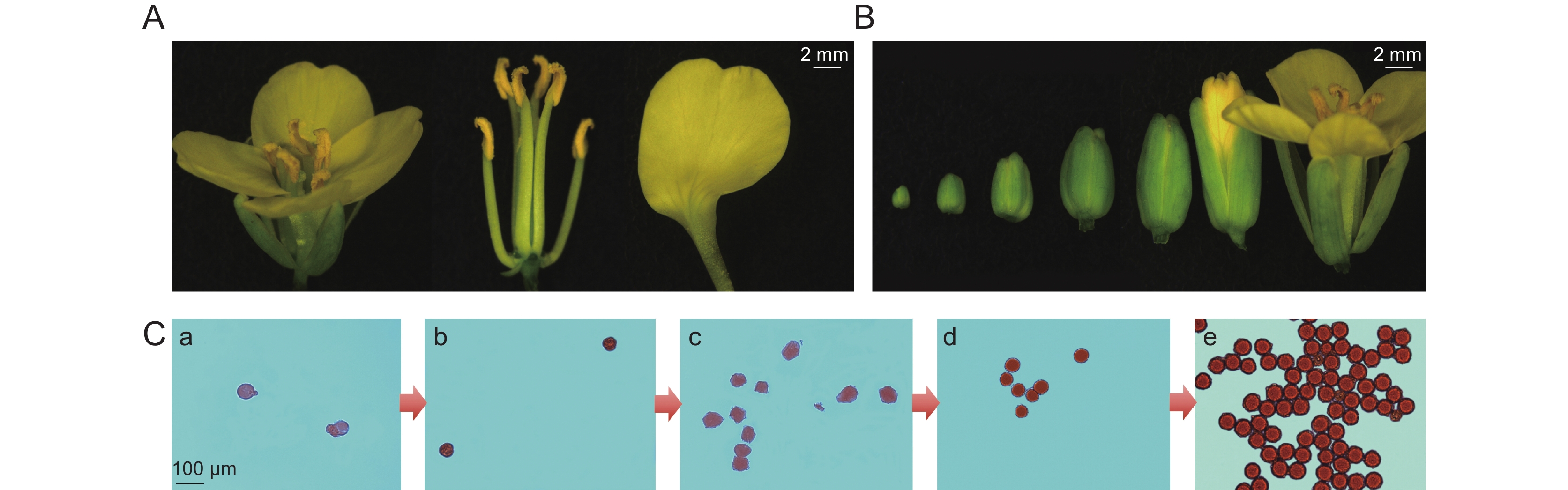
本研究发现,油菜597在16~25 ℃的生长条件下均可正常开花授粉(图1:A)。花蕾诱导分化后,随着发育时间的延长,逐渐由小到大,分化出雄蕊、雌蕊、花萼、花瓣,4个绿色花萼和花瓣依次张开,4片鲜黄色花瓣平展,雌蕊柱头饱满;6个雄蕊生长正常,四强两弱表现明显,花丝细长且呈浅绿色,花药肥大饱满呈菊黄色,为微微卷曲的三角状,能进行正常的开裂,释放花粉;雄蕊略高于雌蕊,有利于进行常异花授粉(图1:B)。
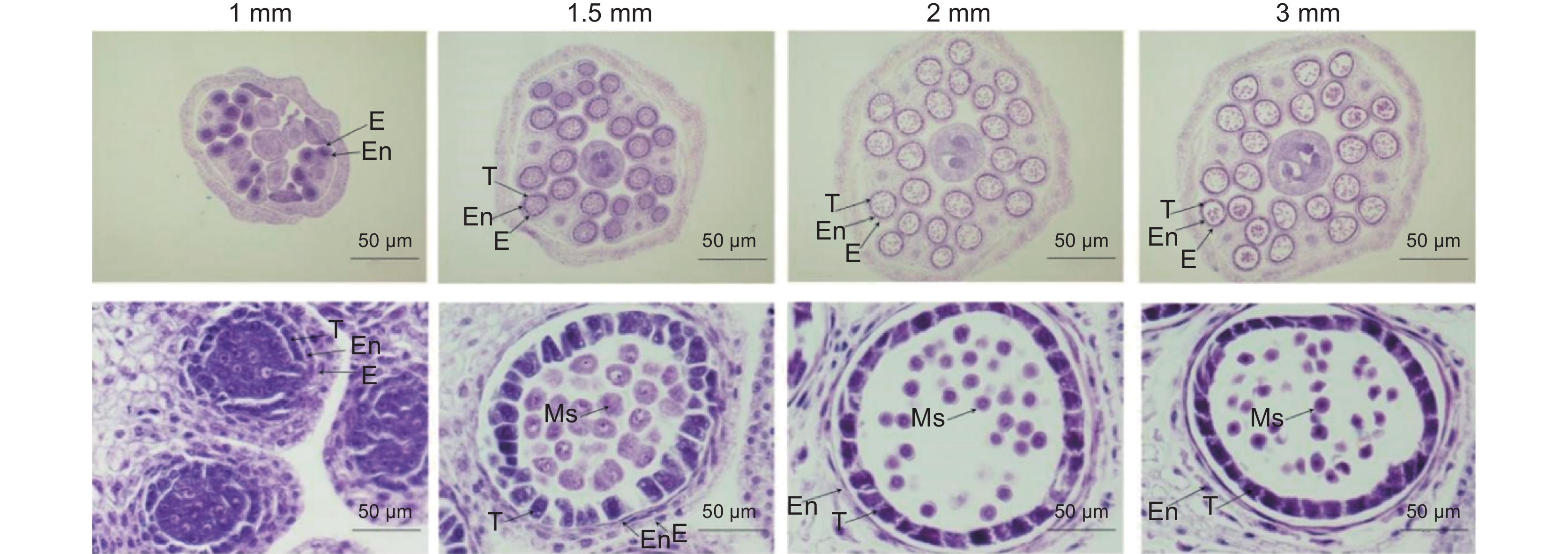
![]() 图 1 甘蓝型油菜597花蕾发育形态观察A:成熟花蕾的各组织;B:不同发育阶段的花蕾;C:不同发育阶段的花粉粒醋酸洋红染色检测。a~e:分别来自1~5 mm大小花蕾的花粉粒。Figure 1. Morphology of rapeseed line 597A: Tissues of mature flower buds; B: Buds at different developmental stages; C: Acetic acid magenta staining of pollen grains at different developmental stages. a–e: Pollen grains from 1–5 mm buds, respectively.
图 1 甘蓝型油菜597花蕾发育形态观察A:成熟花蕾的各组织;B:不同发育阶段的花蕾;C:不同发育阶段的花粉粒醋酸洋红染色检测。a~e:分别来自1~5 mm大小花蕾的花粉粒。Figure 1. Morphology of rapeseed line 597A: Tissues of mature flower buds; B: Buds at different developmental stages; C: Acetic acid magenta staining of pollen grains at different developmental stages. a–e: Pollen grains from 1–5 mm buds, respectively.为了分析597花粉发育状态变化,取不同发育时期的花蕾分离花粉粒进行显微观察(图1:C)。在花蕾1 mm大小时,处于花粉母细胞发育期,可以分离的颗粒非常少,醋酸洋红染色很浅;2 mm花蕾中花粉发育处于四分体时期,可以看到分离的花粉粒呈现典型的覆瓦状;3 mm花蕾中四分体进一步分裂产生小孢子,外观膨胀呈现不规则形状;4 mm花蕾,小孢子从四分体中释放,呈现规则的圆形,5~6 mm花蕾中小孢子可以大量释放,细胞壁增厚变圆,形成成熟花粉粒,能被醋酸洋红染为深红色。
油菜波里马不育系的花粉败育时间出现在花药发育的早期,因此选取其保持系1、1.5、2和3 mm的花蕾,通过组织切片进一步观察花粉发育状态变化(图2)。花蕾1 mm时,花药的横切面呈规则的蝶形,在四角隅形成了4个清晰的药室,药室由内到外的小孢子母细胞层、绒毡层、中层、内皮层和外皮层清晰可见,花粉发育处于第5期;1.5 mm花蕾中,小孢子母细胞发育进入减数分裂期,绒毡层饱满充盈,中层和内层细胞被压缩,处于第6期;2 mm时,小孢子母细胞分裂产生四分体,外覆盖一层胼胝质,中层和内层细胞进一步被压缩,处于第7期;3 mm的花蕾,四分体进一步发育,胼胝质退化,部分四分体分离释放出单个的小孢子,此时的花粉形态极不规则,绒毡层开始变薄,中层细胞已经退化,处于第9期。
2.2 油菜597早期花蕾发育的蛋白质组学分析
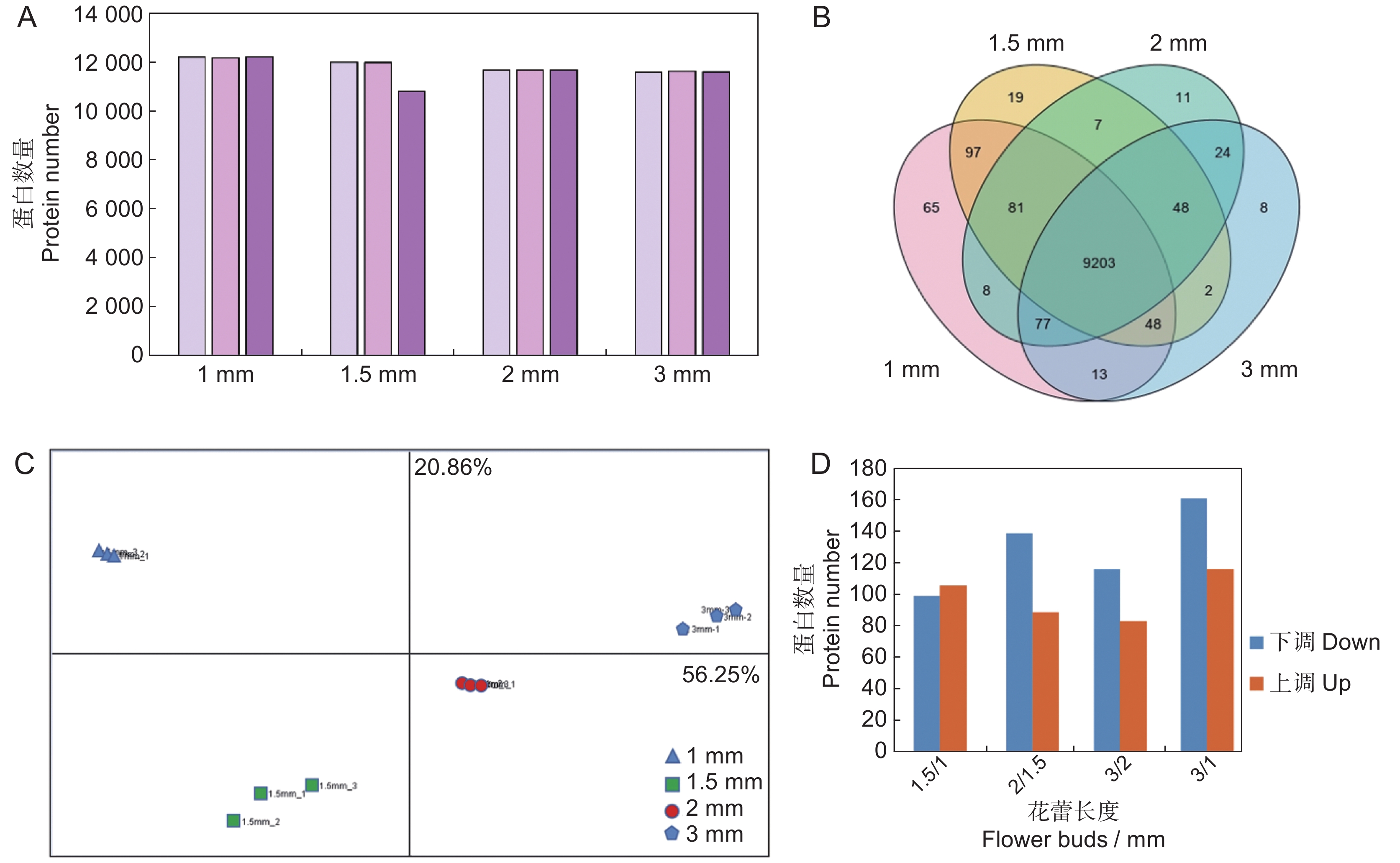
为分析597花蕾发育早期组织细胞内的蛋白谱表达变化,本研究提取了大小为1、1.5、2和3 mm的花蕾总蛋白,利用HPLC-MS/MS进行质谱非标记定性和定量分析,每个样品设置3次重复。获得的高质量质谱信息与油菜数据库比对后共鉴定到13 444 个蛋白。各重复中鉴定的蛋白数量统计结果显示,除1.5 mm中的一个重复数量稍少外,同一样品不同重复之间鉴定到的蛋白数量相似(图3:A)。剔除同一样品3次重复中出现1~2次丰度为0的不合理数据,剩余共9 711 个蛋白,韦恩图分析发现其中9 203 个蛋白为4组数据共有,而各样品中特有蛋白的数量分别为65、19、11和8 个(图3:B)。主成分分析结果显示,1、1.5、2和3 mm大小的花蕾蛋白表达有显著差异,特别是1 mm花蕾的蛋白,和其他花蕾表达都有显著差异,而各样品的3 个重复之间无明显差异(图3:C),以上分析结果表明此次实验数据高度可靠,此外,花蕾发育在早期即发生了巨大的变化。
![]() 图 3 不同发育时期597花蕾的蛋白质组学分析A:597花蕾不同发育阶段各3次技术重复鉴定到的蛋白数量;B:鉴定蛋白的韦恩图分析;C:597花蕾不同发育阶段各3次技术重复鉴定到的蛋白主成分分析,X轴差异度为56.25%,Y轴差异度为20.86%;D:不同发育时期花蕾蛋白的差异数量分布。Figure 3. Proteomics analysis of 597 buds at different developmental stagesA: Number of proteins identified in 597 buds with three technical replicates; B: Venn analysis of identified proteins; C: Principal component analysis of identified proteins; the Y and X axises present 56.25% and 20.86% difference, respectively; D: Distribution of DEPs at different developmental stages.
图 3 不同发育时期597花蕾的蛋白质组学分析A:597花蕾不同发育阶段各3次技术重复鉴定到的蛋白数量;B:鉴定蛋白的韦恩图分析;C:597花蕾不同发育阶段各3次技术重复鉴定到的蛋白主成分分析,X轴差异度为56.25%,Y轴差异度为20.86%;D:不同发育时期花蕾蛋白的差异数量分布。Figure 3. Proteomics analysis of 597 buds at different developmental stagesA: Number of proteins identified in 597 buds with three technical replicates; B: Venn analysis of identified proteins; C: Principal component analysis of identified proteins; the Y and X axises present 56.25% and 20.86% difference, respectively; D: Distribution of DEPs at different developmental stages.比较各组蛋白数据,本研究共筛选出613 个花蕾发育早期不同阶段的差异表达蛋白(DEPs)(附表1
1 )。统计不同样品间的差异蛋白数量,结果显示:从1~3 mm大量蛋白发生下调(161下调,116上调),在发育早期对比组1.5 mm/1 mm中,上调蛋白与下调蛋白数量近乎一致(106上调,99下调);进一步发育至2 mm,下调蛋白数量增加,2 mm/1.5 mm对比中,下调蛋白有139 个;3 mm/2 mm对比中,下调蛋白有116 个(图3:D)。2.3 不同发育阶段差异表达蛋白功能分析
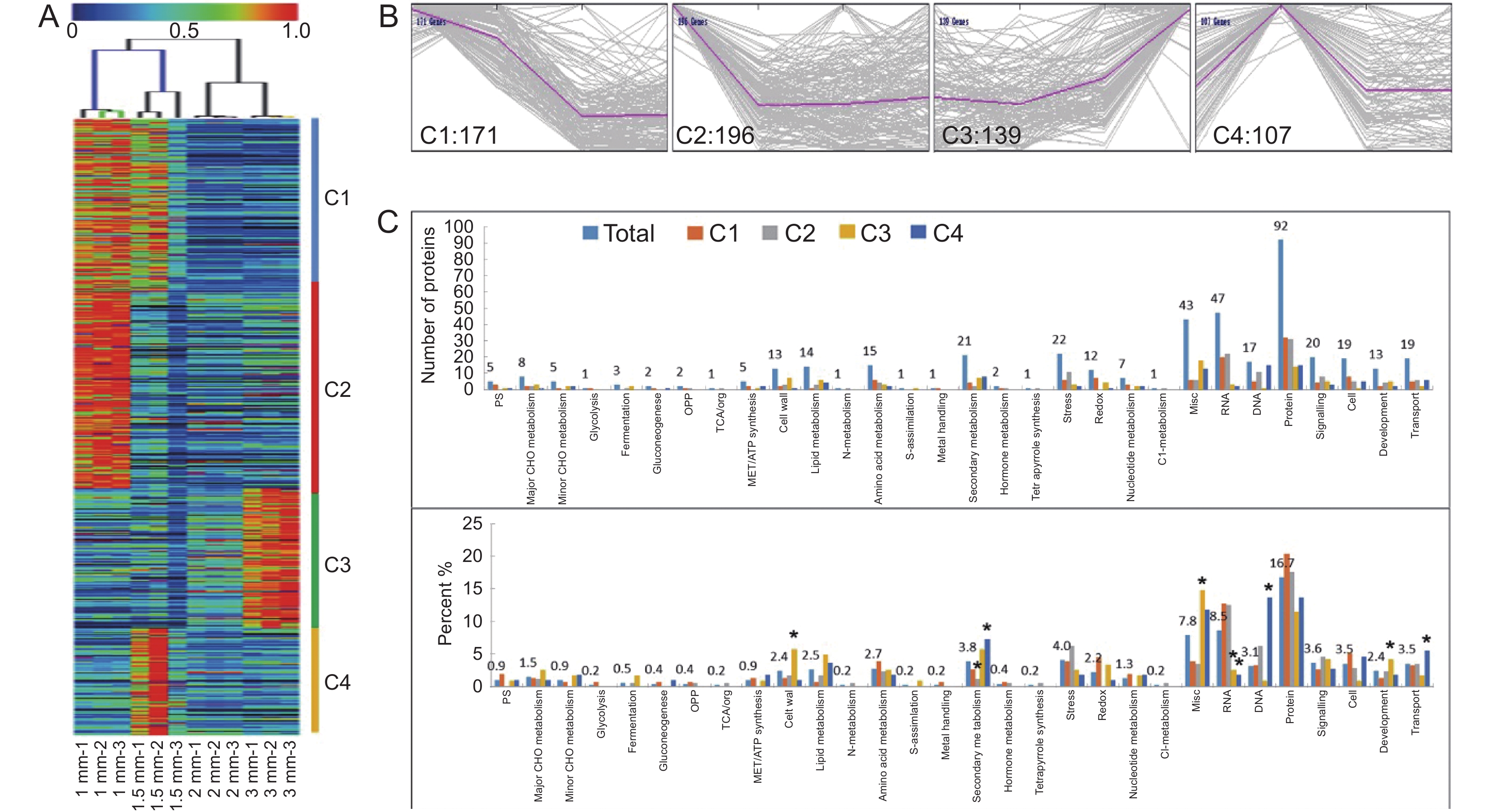
对筛选出来的613 个差异蛋白,将其表达量标准化到0~1区间后,使用MeV软件进行HCL分析(图4:A),结果表明,1和1.5 mm的蛋白表达模式相似,而2和3 mm的蛋白聚为一类。进一步采用K-mean变化趋势聚类分析,可将差异表达蛋白分为4组(C1~C4),其中C1含有171 个差异蛋白,表达趋势为前中期随着发育进程而下调,后期持平不变;C2有196 个差异蛋白,表达趋势为早期下调,后维持稳定;C3 139 个蛋白的表达随着发育进程而上调;C4 107 个差异蛋白,其表达先快速上调并在1.5 mm花蕾中达到峰值,后下调在2 mm时维持稳定(图4:B)。根据MapMan的蛋白功能分类,这些差异蛋白的功能涉及细胞生理代谢的各个过程(图4:C),主要为与蛋白代谢、RNA转录及调控、信号传递、细胞、转运、胁迫、次生代谢、多功能(Misc)等过程相关的蛋白,极少部分参与N-代谢、四吡咯合成、C1-代谢、TCA循环、微量CHO代谢、糖酵解、激素代谢等过程。
![]() 图 4 油菜597不同大小花蕾的蛋白质组分析A:差异蛋白的表达热图和HCL聚类分析;B:差异蛋白的K-mean分类,共分为4类(C1~C4);C:差异蛋白的MapMan功能注释,上:每个MapMan功能分类中差异蛋白的数量,下:每个MapMan功能分类中的差异蛋白占C1~C4各类蛋白的比例。Figure 4. Proteomics analysis of developing flower buds in rapeseed line 597A: Heatmap and HCL clustering of all DEPs; B: K-mean clusters of all DEPs; C: MapMan annotation of all DEPs in four clusters, Up: number of DEPs in each cluster, Down: percentage of DEPs in each cluster.
图 4 油菜597不同大小花蕾的蛋白质组分析A:差异蛋白的表达热图和HCL聚类分析;B:差异蛋白的K-mean分类,共分为4类(C1~C4);C:差异蛋白的MapMan功能注释,上:每个MapMan功能分类中差异蛋白的数量,下:每个MapMan功能分类中的差异蛋白占C1~C4各类蛋白的比例。Figure 4. Proteomics analysis of developing flower buds in rapeseed line 597A: Heatmap and HCL clustering of all DEPs; B: K-mean clusters of all DEPs; C: MapMan annotation of all DEPs in four clusters, Up: number of DEPs in each cluster, Down: percentage of DEPs in each cluster.通过分析不同MapMan分类下的C1~C4 4组差异蛋白占总差异蛋白的百分比(图4:C),发现在C1组中,RNA、蛋白、细胞、氧化还原相关的蛋白比例较高,而脂质代谢、发育、次生代谢和Misc类的蛋白比例显著减少;C2组中蛋白广泛出现在各类代谢过程,尤其在胁迫、RNA、DNA、信号相关的蛋白中比例较高,而在核酸代谢和Misc类的蛋白比例显著降低;C3组蛋白主要在细胞壁、脂质代谢、次生代谢、Misc、发育代谢过程相关蛋白比例较高,而在RNA、DNA、细胞和转运代谢过程中比例较低;C4组蛋白在脂质代谢、次生代谢、Misc、蛋白加工、细胞以及转运相关蛋白中比例较高,而在细胞壁、胁迫、氧化还原、RNA、DNA类的蛋白显著减少。此外,在一些重要代谢过程,如氨基酸代谢、信号通路相关蛋白出现多种表达趋势,另外还有多种代谢过程因鉴定出的总差异蛋白较少,如糖酵解、硫吸收等代谢途径相关蛋白比例未发现显著差异。
3. 讨论
本研究所用的材料为波里马温敏型细胞质雄性不育(pol TCMS)的保持系597,与不育系具有相同的细胞核和不同的细胞质遗传背景。目前对pol TCMS的不育机制的研究还处于起步阶段,相关温敏恢复基因还未确定,已经明确的是pol TCMS在花粉发育极早期(小孢子母细胞分化期)就开始出现败育表现,是一种稳定的具有高实用价值的不育类型。对pol TCMS保持系597的不同发育阶段的花蕾形态及组织学观察发现,保持系597花蕾发育稳定,不受外界环境条件的干扰。根据表型和组织结构分析,大小为1、1.5、2和3 mm的597花蕾分别对应于花蕾发育的第5、6、7和9期。选取这4种早期不同发育阶段的花蕾进行比较蛋白质组学分析,共鉴定到613 个差异表达蛋白。大多数差异蛋白显示在发育过程中下调,特别是和RNA代谢相关的蛋白,这意味着这两类基础代谢在此阶段之前,即小于1 mm的花蕾中可能更为突出,而在此后的发育过程中转向特有物质的合成、转运以及一些多种功能的蛋白为主,有助于花蕾的器官发育和功能分化。
3.1 细胞壁建成是花蕾发育期的重要代谢事件
油菜花蕾发育早期细胞分裂旺盛,新细胞壁的松弛与重构是该阶段的重要生理过程。植物细胞壁的主要成分为果胶质、纤维素和半纤维素,这些成分有助于相邻细胞的连接,缓冲细胞间的压力,对细胞起支撑和保护作用。木葡聚糖是植物细胞壁中半纤维素的主要成分,约占初生细胞壁的25%,可与纤维素微纤丝构成网状结构,提供初生壁所需的弹性与强度。木葡聚糖内转糖苷酶(Xyloglucan endotransglucosylase,XTH)可以催化木葡聚糖分子的水解与再次连接,从而引导细胞壁的松弛与重构[20]。本研究鉴定到3 个XTHs,其中包括2 个XTH3和1 个XTH9,且均属于C3组,在花蕾发育中显著上调,这将促进花蕾发育过程中的细胞壁重建和新细胞的生长。拟南芥中亦发现XTH-3和XTH-9主要在花蕾中表达[21]。
植物初生细胞壁是由多糖组成的高度交联的动态结构,果胶是其重要的结构多糖,占其干物质的1/3。这些多糖富含半乳糖醛酸(GalA),GalA残基可以在C-2或C-3位置乙酰化。果胶的乙酰化程度可以通过果胶乙酰酯酶(E.C.3.1.1.6;PAE)切割出乙酰酯键进行调节,从而影响细胞壁的疏水性和硬度等性状。不同组织中含有的GalA残基不同,对应的PAE也不同[22]。本研究发现2 个PAEs显著下调,另有1 个PAE(BnaA02G0292400ZS)显著上调,该上调PAE在细胞中的丰度远高于下调的PAEs,该PAE可能在果胶的去乙酰化中起主要作用。果胶裂解酶(PL)可消除裂解果胶,从其非还原端断裂产生具有4-脱氧-α-D-甘露糖-4-烯醇糖基的低聚糖,果胶的适当裂解有助于发育中细胞的松弛与扩张。本研究中鉴定到的2 个PLs分别属于C3和C4组,在花蕾发育中特别是早期表达上调,可以维持果胶的比例。紫色酸性磷酸酶(PAPs)是一类广泛存在于植物细胞内的金属磷酸酯酶,可参与木糖苷酶磷酸化和去磷酸化以及葡糖苷酶去磷酸化,从而增加细胞壁上木聚糖、纤维素和胼胝质的合成[23]。本研究发现两个PAP25在发育过程中持续上调。PAP25曾被报道定位于拟南芥的细胞壁,对细胞的磷吸收利用至关重要[24]。
细胞壁并不是一个刚性结构,一些蛋白如富含亮氨酸重复序列的伸展蛋白(LRXs)在其C端含有一个延伸结构域序列,可以增加细胞壁的柔性,同时参与细胞壁扩张、细胞生长调节以及感知和传递细胞外信号[25]。本研究检测到两个LRX蛋白出现在C3组,在油菜花蕾发育中持续上调表达。
3.2 脂质代谢增强有利于油菜花蕾发育
脂质代谢物质在花蕾发育过程中具有重要作用。花蕾的雄蕊发育时绒毡层会积累造油体和脂质体,并分泌大量油脂、糖、蛋白等物质给小孢子发育,形成花粉外壁的孢粉素等;同时细胞生长繁殖过程中细胞质膜及内部的具膜细胞器的形成均需要大量的脂类物质合成[26]。本研究共鉴定到14 个与脂类代谢相关的DEPs,其中5 个与脂肪酸合成、延长及去饱和相关的蛋白被发现在C3组中,特别是1个酰基辅酶A结合蛋白(BnaA05G0330000ZS)丰度尤其高,其可保护脂肪合成过程中酰基辅酶A免遭受水解;2 个与脂肪酸延长相关的DEPs出现在C4组,说明脂肪合成在花蕾发育的极早期亦较为活跃,但其丰度相对较低;1 个与脂质降解相关的脂肪酶蛋白出现在C2组中,表达量显著下降,这有利于花蕾发育后期脂质的累积。
脂转移蛋白(LTP)是一种小分子碱性蛋白,具有结合脂质,并分泌到细胞外的能力,可参与蜡质合成、细胞壁延伸、花药发育、花粉外壁的模式建成花等生物学过程[27]。本研究共鉴定到5 个LTP蛋白,其中3 个在C3组,1 个在C4组,特别是C3组中的BnaC02G0206800ZS表达量显著高于其他LTP蛋白,且在后期大量累积。这表明LTPs在花蕾发育从1.5 mm即第6期开始发挥功能,辅助脂质转运,促进花粉发育。
3.3 早期花蕾中发育及转运相关蛋白表达旺盛
花蕾的发育受ABCDE模型调控,本研究也鉴定到了76 个相关蛋白,如A类基因AP1(BnaC02G0233300ZS)、B类基因AP3(BnaA09G0503200ZS)和PI(BnaA03G0087600ZS)、E类功能基因SEP(BnaC05G0570600ZS 和BnaA07G0100900ZS),以及多个含有MADs-box的相关基因等。但是由于这些基因多为转录因子,表达量相对较低,在比较分析中未筛选到差异表达蛋白。另外,成花素FT(BnaA02G0156900ZS)及其抑制因子TFL(BnaA10G0192800ZS)也在花蕾发育中持续表达[28]。这些基因在花蕾发育早期协调调控了各组织的分化,其持续表达表明这些蛋白同时具有除决定器官分化外的其他功能,如FT还参与半纤维素和纤维素的合成调控,有助于花蕾后期的发育[29]。
花粉外壳蛋白胞外脂肪酶(EXL)在授粉过程中促进花粉在柱头上的水合作用,辅助花粉与柱头识别。两个EXLs(即EXL3和EXL6)蛋白出现在C3组中,特别是在约3 mm(花粉发育第9期)的较大花蕾中显著上调。本研究还鉴定到3 个富甘氨酸的油体蛋白GRP17蛋白,虽然其表达上无显著差异,但是GRP17可以与EXL蛋白互作,共同执行水合作用[30]。
花蕾发育是一个连续的分化生长过程,涉及到细胞壁的分裂合成、囊泡的运输、胞外分泌、细胞骨架的形成、离子梯度的产生、营养物质转运等一系列生理生化过程。ABC转运蛋白又称ATP结合盒转运蛋白(ATP-binding cassette transporter),具有核苷酸结合域和跨膜结构域两种特征结构域,可以利用水解ATP的能量进行甾醇、激素、生长物质等的跨膜转运。在花蕾发育过程中,ABC转运蛋白对花瓣形态、花色、花药花粉的发育等方面具有调控功能[31]。本研究共鉴定到43 个ABC蛋白,包含3 个差异表达蛋白,其中2 个属于C3组,1 个在C1组,表明在油菜花蕾发育特别是早期(5~6期)利用ABC转运蛋白进行物质转运的方式较为活跃。有的物质特别是一些大分子的蛋白在体内转运、识别和定位是通过囊泡运输的形式进行的。囊泡是自发形成一类封闭的磷脂双分子层结构,可通过其膜上的可溶性v-SNARE(供体膜受体蛋白)识别目标位置的t-SNARE(靶膜受体蛋白),实现物质的特异性定位转运。本研究中,3 个囊泡转运相关蛋白(SYP71、VAMP7C和VAMP7B)出现在C4组,另有一个囊泡的包被网格蛋白出现在C3组。这与早期花蕾发育时细胞分裂迅速,物质运输频繁的需求一致。4次跨膜蛋白(TET)作为细胞外小泡(EV)的必需成分,常以同源二聚体或异源二聚体的功能形式存在,在细胞间蛋白、RNA、信号分子和脂质转移中发挥重要作用,有利于植物抵抗胁迫[32]。TET8与细胞衰老相关蛋白5同源,C3组中检测到一个TET8蛋白,表达上调,尤其是3 mm花蕾中表达量高,此时花粉绒毡层开始解体,TET8可能在此过程中发挥功能。
3.4 油菜花蕾发育早期核酸相关蛋白表达变化剧烈
在油菜花蕾发育早期,伴随着DNA复制和RNA的转录表达,花蕾组织分化发育相关的蛋白被诱导合成,细胞快速分裂增殖。无论是DNA的复制和RNA的转录,首先要释放核酸结合蛋白。一系列与核酸稳定性及染色体结构维持相关蛋白被检测到下调,出现在C1和C2组中,如NAP1、NAP7、snRNP、SRT1、HD2B;与此同时,个别与DNA修复和RNA编辑相关的蛋白呈现上调,出现在C3组中,如BnaA02G0369000ZS、MADS 上调。而大量特殊的转录因子和一些通用转录调控蛋白,如C2H2、MYB结构域蛋白以及NAC、KIWI结构域蛋白出现在C1或者C2组中,表现下调,说明RNA转录事件在大于1 mm的花蕾中变弱。
4. 结论
综合以上分析,甘蓝型油菜花蕾发育涉及多个组织的形成、分化、生长及功能特化,包含一系列复杂的代谢和调控过程。本研究结合组织形态学观察及比较蛋白质组学分析,确定甘蓝型油菜花蕾在1、1.5、2、3 mm大小时,对应于雄蕊发育的第5、6、7和9期,即花粉母细胞分化、减数分裂、四分体到单核小孢子形成阶段;通过蛋白质组学分析,共鉴定到13 444 个蛋白,包含613 个差异表达蛋白。对差异蛋白的功能进行分析发现,细胞壁建成(如XTH、PAE、LRX等)、脂质代谢(如脂肪酸合成、延长及去饱和、酰基辅酶A结合蛋白、LTP等)、细胞转运(ABC转运蛋白、囊泡转运相关蛋白等)相关蛋白大量上调,这将有利于花蕾发育过程中的细胞建成和花粉发育;油菜花蕾发育相关的ABCDE蛋白表达未发现显著变化,这些蛋白可能具有除诱导花蕾分化外的其他功能;在油菜花蕾发育早期核酸相关蛋白表达变化剧烈,这与该时段细胞的急剧分裂与生长的代谢过程一致。
1 如需查阅附表内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
图 1 甘蓝型油菜597花蕾发育形态观察
A:成熟花蕾的各组织;B:不同发育阶段的花蕾;C:不同发育阶段的花粉粒醋酸洋红染色检测。a~e:分别来自1~5 mm大小花蕾的花粉粒。
Figure 1. Morphology of rapeseed line 597
A: Tissues of mature flower buds; B: Buds at different developmental stages; C: Acetic acid magenta staining of pollen grains at different developmental stages. a–e: Pollen grains from 1–5 mm buds, respectively.
图 3 不同发育时期597花蕾的蛋白质组学分析
A:597花蕾不同发育阶段各3次技术重复鉴定到的蛋白数量;B:鉴定蛋白的韦恩图分析;C:597花蕾不同发育阶段各3次技术重复鉴定到的蛋白主成分分析,X轴差异度为56.25%,Y轴差异度为20.86%;D:不同发育时期花蕾蛋白的差异数量分布。
Figure 3. Proteomics analysis of 597 buds at different developmental stages
A: Number of proteins identified in 597 buds with three technical replicates; B: Venn analysis of identified proteins; C: Principal component analysis of identified proteins; the Y and X axises present 56.25% and 20.86% difference, respectively; D: Distribution of DEPs at different developmental stages.
图 4 油菜597不同大小花蕾的蛋白质组分析
A:差异蛋白的表达热图和HCL聚类分析;B:差异蛋白的K-mean分类,共分为4类(C1~C4);C:差异蛋白的MapMan功能注释,上:每个MapMan功能分类中差异蛋白的数量,下:每个MapMan功能分类中的差异蛋白占C1~C4各类蛋白的比例。
Figure 4. Proteomics analysis of developing flower buds in rapeseed line 597
A: Heatmap and HCL clustering of all DEPs; B: K-mean clusters of all DEPs; C: MapMan annotation of all DEPs in four clusters, Up: number of DEPs in each cluster, Down: percentage of DEPs in each cluster.
-
[1] 殷艳,尹亮,张学昆,郭静利,王积军. 我国油菜产业高质量发展现状和对策[J]. 中国农业科技导报,2021,23(8):1−7. Yin Y,Yin L,Zhang XK,Guo JL,Wang JJ. Status and countermeasure of the high-quality development of rapeseed industry in China[J]. Journal of Agricultural Science and Technology,2021,23(8):1−7.
[2] Sanders PM,Bui AQ,Weterings K,McIntire KN,Hsu YC,et al. Anther developmental defects in Arabidopsis thaliana male-sterile mutants[J]. Sex. Plant Reprod,1999,11:297−322. doi: 10.1007/s004970050158
[3] 姚楠. 植物脂质生物学进展[J]. 植物生理学报,2018,54(12):1747. Yao N. Advances in plant lipid biology[J]. Plant Physiology Journal,2018,54(12):1747.
[4] Weigel D,Meyerowitz EM. The ABCs of floral homeotic genes[J]. Cell,1994,78(2):203−209. doi: 10.1016/0092-8674(94)90291-7
[5] Theissen G,Becker A,Di Rosa A,Kanno A,Kim JT,et al. A short history of MADS-box genes in plants[J]. Plant Mol Biol,2000,42(1):115−149. doi: 10.1023/A:1006332105728
[6] Hill TA,Day CD,Zondlo SC,Thackeray AG,Irish VF. Discrete spatial and temporal cis-acting elements regulate transcription of the Arabidopsis floral homeotic gene APETALA3[J]. Development,1998,125(9):1711−1721. doi: 10.1242/dev.125.9.1711
[7] Ng M,Yanofsky MF. Activation of the Arabidopsis B class homeotic genes by APETALA1[J]. Plant Cell,2001,13(4):739−753.
[8] Savidge B,Rounsley SD,Yanofsky MF. Temporal relationship between the transcription of two Arabidopsis MADS box genes and the floral organ identity genes[J]. Plant Cell,1995,7(6):721−733.
[9] Liu C,Xi WY,Shen LS,Tan CP,Yu H. Regulation of floral patterning by flowering time genes[J]. Dev Cell,2009,16(5):711−722. doi: 10.1016/j.devcel.2009.03.011
[10] Theißen G. Genetics of identity[J]. Nature,2001,414(6863):491. doi: 10.1038/35107163
[11] Theißen G,Saedler H. Plant biology. Floral quartets[J]. Nature,2001,409(6819):469−471. doi: 10.1038/35054172
[12] Becker A,Theißen G. The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J]. Mol Phylogenet Evol,2003,29(3):464−489. doi: 10.1016/S1055-7903(03)00207-0
[13] Jack T. Molecular and genetic mechanisms of floral control[J]. Plant Cell,2004,16:S1−S17. doi: 10.1105/tpc.017038
[14] Pelaz S,Gustafson-Brown C,Kohalmi SE,Crosby WL,Yanofsky MF. APETALA1 and SEPALLATA3 interact to promote flower development[J]. Plant J,2001,26(4):385−394. doi: 10.1046/j.1365-313X.2001.2641042.x
[15] Fan HY,Hu Y,Tudor M,Ma H. Specific interactions between the K domains of AG and AGLs,members of the MADS domain family of DNA binding proteins[J]. Plant J,1997,12(5):999−1010. doi: 10.1046/j.1365-313X.1997.12050999.x
[16] Zhu W,Xu XB,Tian JK,Zhang L,Komatsu S. Proteomic analysis of Lonicera japonica Thunb. immature flower buds using combinatorial peptide ligand libraries and polyethylene glycol fractionation[J]. J Proteome Res,2016,15(1):166−181. doi: 10.1021/acs.jproteome.5b00910
[17] Lu DH,Ni WM,Stanley BA,Ma H. Proteomics and transcriptomics analyses of Arabidopsis floral buds uncover important functions of ARABIDOPSIS SKP1-LIKE1[J]. BMC Plant Biol,2016,16:61. doi: 10.1186/s12870-015-0571-9
[18] Heng SP,Chen FY,Wei C,et al. Cytological and iTRAQ-based quantitative proteomic analyses of hau CMS in Brassica napus L.[J]. J Proteomics,2019,193:230−238. doi: 10.1016/j.jprot.2018.10.014
[19] 崔以璨. 长距彗星兰花蜜距石蜡切片的制备和显微结构的观察[J]. 安徽冶金科技职业学院学报,2022,32(4):45−47. doi: 10.3969/j.issn.1672-9994.2022.04.017 Cui YC. Preparation of paraffin section and observation of microstructure of nectar spur in Darwin orchid[J]. Journal of Anhui Vocational College of Metallurgy and Technology,2022,32(4):45−47. doi: 10.3969/j.issn.1672-9994.2022.04.017
[20] Oogawara R,Satoh S,Yoshioka T,Ishizawa K. Expression of α-expansin and xyloglucan endotransglucosylase/hydrolase genes associated with shoot elongation enhanced by anoxia,ethylene and carbon dioxide in arrowhead (Sagittaria pygmaea Miq.) tubers[J]. Ann Bot,2005,96(4):693−702. doi: 10.1093/aob/mci221
[21] Yokoyama R,Nishitani K. A comprehensive expression analysis of all members of a gene family encoding cell-wall enzymes allowed us to predict cis-regulatory regions involved in cell-wall construction in specific organs of Arabidopsis[J]. Plant Cell Physiol,2001,42(10):1025−1033. doi: 10.1093/pcp/pce154
[22] Philippe F,Pelloux J,Rayon C. Plant pectin acetylesterase structure and function:new insights from bioinformatic analysis[J]. BMC Genomics,2017,18(1):456. doi: 10.1186/s12864-017-3833-0
[23] 魏铭,王鑫伟,陈博,宋程威,杜亮,等. 植物紫色酸性磷酸酶基因家族功能研究进展[J]. 植物学报,2019,54(1):93−101. doi: 10.11983/CBB18044 Wei M,Wang XW,Chen B,Song CW,Du L,et al. Research progress into the function of purple acid phosphatase gene family in plants[J]. Chinese Bulletin of Botany,2019,54(1):93−101. doi: 10.11983/CBB18044
[24] Del Vecchio HA,Ying S,Park J,Knowles VL,Kanno S,et al. The cell wall-targeted purple acid phosphatase AtPAP25 is critical for acclimation of Arabidopsis thaliana to nutritional phosphorus deprivation[J]. Plant J,2014,80(4):569−581. doi: 10.1111/tpj.12663
[25] Herger A,Dünser K,Kleine-Vehn J,Ringli C. Leucine-rich repeat extensin proteins and their role in cell wall sensing[J]. Curr Biol,2019,29(17):R851−R858. doi: 10.1016/j.cub.2019.07.039
[26] Wan XY,Wu SW,Li ZW,An XL,Tian YH. Lipid metabolism:critical roles in male fertility and other aspects of reproductive development in plants[J]. Mol Plant,2020,13(7):955−983. doi: 10.1016/j.molp.2020.05.009
[27] Zhao J,Wang SS,Qin JJ,Sun CQ,Liu FX. The lipid transfer protein OsLTPL159 is involved in cold tolerance at the early seedling stage in rice[J]. Plant Biotechnol J,2020,18(3):756−769. doi: 10.1111/pbi.13243
[28] Freytes SN, Canelo M, Cerdán PD. Regulation of flowering time: when and where?[J] Curr Opin Plant Biol, 2021, 63: 102049.
[29] Wu J,Wu QH,Bo ZJ,Zhu XL,Zhang JH,et al. Comprehensive effects of Flowering locus T-mediated stem growth in tobacco[J]. Front Plant Sci,2022,13:922919. doi: 10.3389/fpls.2022.922919
[30] Updegraff EP,Zhao F,Preuss D. The extracellular lipase EXL4 is required for efficient hydration of Arabidopsis pollen[J]. Sex Plant Reprod,2009,22(3):197−204. doi: 10.1007/s00497-009-0104-5
[31] 申慧敏,史俐莎,田清尹,刘家伟,王良桂,岳远征. ABC转运蛋白在植物花器官生长发育中的研究进展[J]. 西北植物学报,2021,41(11):1975−1982. doi: 10.7606/j.issn.1000-4025.2021.11.1975 Shen HM,Shi LS,Tian QY,Liu JW,Wang LG,Yue YZ. Recent progress of ABC transporters in floral organ development of plants[J]. Acta Botanica Boreali-Occidentalia Sinica,2021,41(11):1975−1982. doi: 10.7606/j.issn.1000-4025.2021.11.1975
[32] Cai Q,Qiao LL,Wang M,He BY,Lin FM,et al. Plants send small RNAs in extracellular vesicles to fungal pathogen to silence virulence genes[J]. Science,2018,360(6393):1126−1129. doi: 10.1126/science.aar4142



 下载:
下载: