Photosynthetic limitation in soybean in response to soil water-nitrogen interactions and its relationship with leaf water use efficiency
-
摘要:
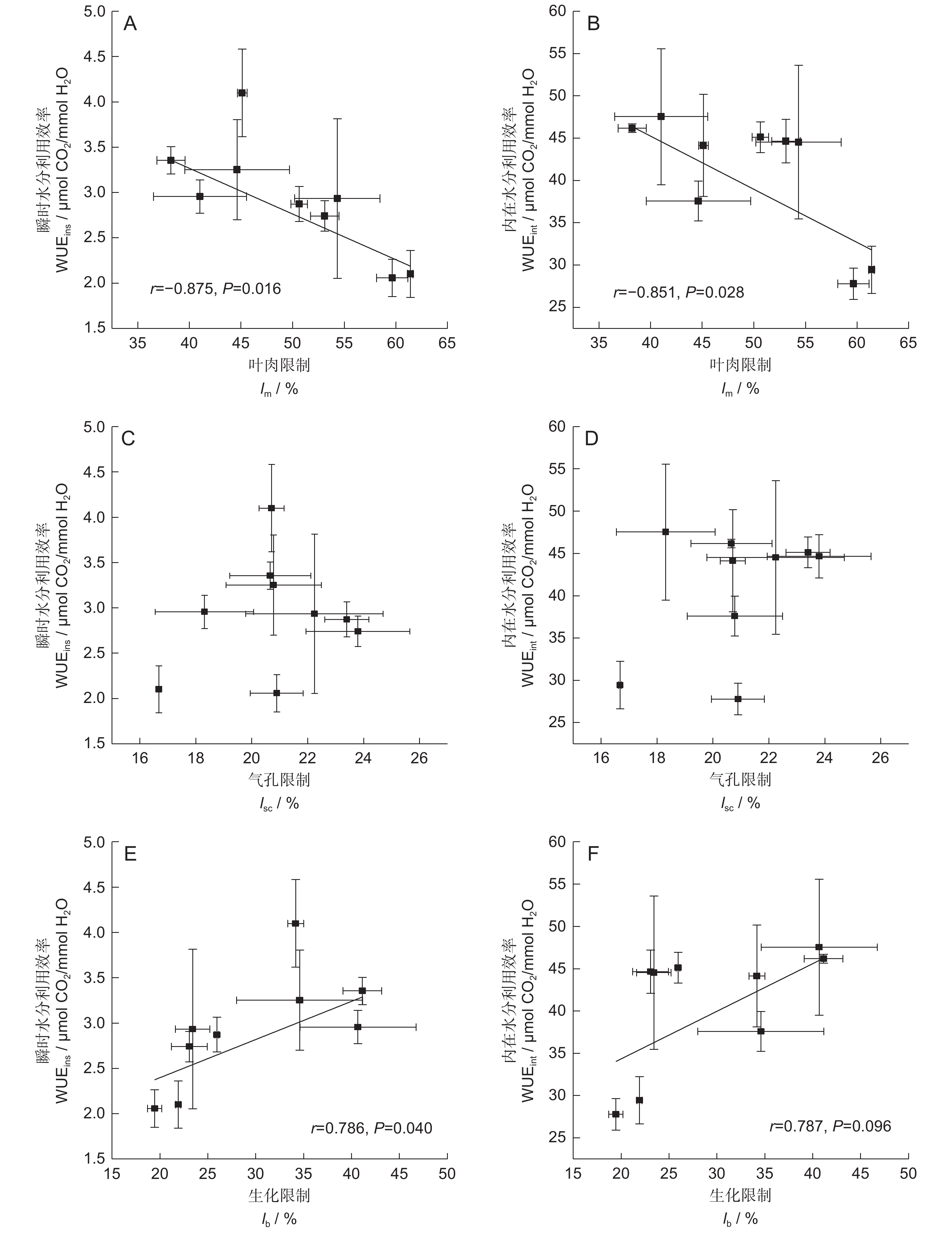
本文以我国北方旱地大豆(Glycine max (L.) Merr.)为材料,以光合限制作用为研究对象,设计土壤水-氮交互实验,探究其光合限制作用的水-氮交互响应及其与叶片瞬时水分利用效率(WUEins)和内在水分利用效率(WUEint)的相关性。结果显示:(1)大豆叶内CO2扩散性限制作用(叶肉限制,lm;气孔限制,lsc)随水分胁迫逐渐增大,生化限制(lb)逐渐减小;(2)土壤水-氮交互后,植株lm和lsc均减小,而lb显著增大;(3)lm和lb分别与WUEins及WUEint呈显著的负、正相关(P<0.05),而lsc与二者的相关性不显著;(4)相较lsc和lb,lm对植株光合碳同化与叶片水分利用效率的贡献率最大,为大豆光合与水分利用能力变化的主导限制因子。研究结果旨在揭示土壤干旱与大气氮沉降双因子交互调控作物光合碳同化的生态效应,并分析该效应与作物水分利用能力的内在关系。
Abstract:Glycine max (L.) Merr. in northern China were selected as the experimental materials, with photosynthetic limitation as the primary focus of this study. A soil water-nitrogen interaction experiment was designed to explore the relationship between photosynthetic limitation and leaf instantaneous (WUEins) and intrinsic water use efficiency (WUEint). Results showed that: (1) CO2 diffusion limitations, including mesophyll limitation (lm) and stomatal limitation (lsc), gradually increased with water stress, while biochemical limitation (lb) gradually decreased. (2) The interaction between water and nitrogen reduced lm and lsc, while lb significantly increased. (3) lm and lb were negatively and positively correlated with WUEins and WUEint, respectively (P<0.05), while lsc showed no significant correlation with either. (4) Among the limiting factors, lm contributed most to soybean photosynthetic carbon assimilation and leaf water use efficiency, making it the dominant constraint on photosynthetic and water use capacity. These findings reveal the ecological effects of soil drought and atmospheric nitrogen deposition on crop photosynthetic carbon assimilation and their intrinsic relationship with water use capacity.
-
叶片是植物与大气进行水汽交换的器官,对环境变化敏感。叶性状可以表征植物对资源的获取和利用能力以及对逆境的抗性[1, 2]。不同叶性状之间的协同或权衡关系还能够反映植物的生态策略[3, 4]。叶片厚度、比叶面积等形态结构类性状是叶经济谱的重要指标[5, 6]。倾向于快速获取资源和生长代谢的植物减少了对叶片建成的资源分配,因而具有较高的比叶面积、较薄的叶片及较低的干物质含量[7]。干旱是影响叶片正常生理活动的重要环境因子[8]。膨压丧失点水势指叶片细胞完全失去膨压时的水势,反映植物固持水分和耐失水的能力[9]。该指标还与气孔调节和栓塞脆弱性显著相关[10]。最近的研究尝将叶片饱和含水量与叶片经济谱联系起来,被认为与细胞大小和氮碳含量有关[11]。系统分析叶片形态结构和水力学特征的关联性,有助于拓展叶经济谱的概念,能全面地分析植物的生理生态策略[12]。
苏铁类植物(Cycads)属于裸子植物,最早起源可追溯至晚二叠纪[13, 14],是现存最古老、最原始的种子植物[15]。参考世界苏铁名录(https://cycadlist.org),现存苏铁类植物分为苏铁科和泽米铁科,苏铁科仅含苏铁属(Cycas)1属,泽米铁科包括非洲铁属(Encephalartos)、角状铁属(Ceratozamia)、双子铁属(Dioon)等9个属。随着被子植物的兴起、分化并逐渐取代裸子植物在陆地生态系统中占据主导地位,现存的野生苏铁类植物基本处于濒危状态,其多样性保护受到广泛关注[16]。对比分析裸子植物和被子植物功能性状的差异有助于了解这两种类群对环境变化的响应与适应机制,是植物生理生态学领域的经典问题[17]。但是目前大部分研究主要集中在针叶树种[18, 19],而对苏铁属植物的相关研究较少。苏铁类植物主要分布在热带亚热带地区,普遍认为其耐旱性较强,在水分利用策略上和其他植物类群存在显著差异[13, 15]。与同气候区的木本被子植物相比,苏铁类植物的叶(羽片)革质化、质地坚韧,导致碳投资成本高,光合收益少[20]。大部分苏铁生长在湿润的林下,也有少数苏铁类植物分布在干性森林(如Cycas bifida (Dyer) K. D. Hill)和喀斯特生境(如C. debaoensis Y. C. Zhong & C. J. Chen)。了解苏铁类植物的水分关系特征有助于了解其空间分布以及对气候变化的响应,但是相关研究较少,对比苏铁类植物和同区域木本被子植物的水力结构对于揭示不同植物类群对干旱的适应策略具有重要意义。
综上,本研究以广西南宁青秀山苏铁园28种典型的苏铁类植物为研究对象,测定它们的叶片形态解剖和水分生理性状指标。同时,搜集前期已发表的热带亚热带森林79种典型木本被子植物的相关数据。拟解决以下科学问题:(1)比较苏铁类植物与被子植物叶性状的差异性(假设与被子植物相比,苏铁类植物具有较低的比叶面积和气孔密度,具有较高的叶片厚度,以及较低的膨压丧失点水势)。(2)比较两个类群叶性状相关性网络的差异性(假设被子植物性状之间的关联性比苏铁类植物低)。研究结果旨在揭示苏铁类植物与被子植物生态策略的差异,并为其多样性保护提供理论依据。
1. 材料与方法
1.1 研究区概况
本研究所测定的苏铁类植物均来自于广西南宁植物园苏铁类植物专类园(22.78°N,108.38°E; 海拔175~210 m)。苏铁园建于1998年,目前共收集有2科9属78种苏铁类植物。受南亚热带季风气候影响,该园区年均温为21.6 ℃,年均降水量为1 304 mm。园区土壤以赤红壤为主,pH值为3.91~4.78,有机质含量约为1.5%~2.2%[21]。木本被子植物数据均来源于热带亚热带森林固定监测样地:(1)十万大山国家级自然保护区固定监测样地(21.67°N,107.48°E;海拔380~560 m)。受亚热带季风气候影响,该保护区年均气温21.6 ℃,年均降水量2 200 mm。土壤以砖红壤为主,pH值为3.38~5.05,森林群落为热带季风常绿阔叶林[22]。(2)鼎湖山国家级自然保护区季风林监测样地(23.15°N,112.5°E;海拔210~300 m)。受南亚热带季风气候影响,样地年平均温21.4℃,年均降水量1 955 mm。土壤类型主要为砖红壤,pH值为4.0~4.9,森林群落为亚热带季风常绿阔叶林[23]。
1.2 植物材料
由于大部分苏铁类植物数量稀少且个体较小,本研究共选择28种苏铁类植物进行测定(表1、附表1
1 ))。每种苏铁类植物中选择3~5株长势良好的个体,于凌晨从每株个体随机采集20~40片健康成熟的叶片,用密封袋封装。样品采集后低温冷藏。所有测定均在2022年7-9月完成。表 1 物种信息Table 1. Species information物种名
Species拉丁名
Latin Name缩写
Code科
Family生境
Distribution and Habitats伊里安苏铁 Cycas apoa K. D. Hill Cap Cycadaceae Indonesia, Papua New Guinea.* 叉叶苏铁 Cycas bifida (Dyer) K. D. Hill Cbi Cycadaceae China (Guangxi), Vietnam (Cao Bang). Limestone area. OD 德保苏铁 Cycas debaoensis Y. C. Zhong & C. J. Chen Cd Cycadaceae China (Guangxi). Limestone, sand shale area; NA 长叶苏铁 Cycas dolichophylla K. D. Hill Cdo Cycadaceae China (Guangxi, Yunnan), Laos. Limestone area; NA 越南篦齿苏铁 Cycas elongata (Leandri) D. Y. Wang Ce Cycadaceae Vietnam (Binh Dinh, Ninh Thuan, Phu Yen); M 锈毛苏铁 Cycas ferruginea F. N. Wei Cf Cycadaceae China (Guangxi), Vietnam (Lang Son). Limestone area; OD 海南苏铁 Cycas hainanensis C. J. Chen Cha Cycadaceae China (Hainan). CM 粗柄苏铁 Cycas pachypoda K. D. Hill Cp Cycadaceae Vietnam (Binh Thuan, Ninh Thuan). M 苏铁 Cycas revoluta Thunb. Cr Cycadaceae China (Fujian), Japan (Ryukyu Islands). OD 叉孢苏铁 Cycas segmentifida D. Yue Wang & C. Y. Deng Cs Cycadaceae China (Guangxi, Guizhou, Yunnan). Limestone area; CM 闽粤苏铁 Cycas taiwaniana Carruth Ct Cycadaceae China (Taiwan,Guangdong, Hainan). OD 簇羽角果泽米 Ceratozamia hildae G. P. Landry & M. C. Wilson Ch Zamiaceae Mexico (Querétaro, San Luis Potosí).* 库氏角果泽米 Ceratozamia kuesteriana Regel Ck Zamiaceae Mexico (Tamaulipas).* 宽叶角状铁 Ceratozamia latifolia Miq. Cla Zamiaceae Mexico (Hidalgo, Veracruz), Belize and Guatemala.* 双子苏铁 Dioon edule Lindl. De Zamiaceae Mexico (Hidalgo, Querétaro).* 瓦哈卡双子铁 Dioon rzedowskii De Luca, A. Moretti, Sabato & Vázq.Torres Dr Zamiaceae Mexico (Oaxaca).* 沙生非洲铁 Encephalartos arenarius R. A. Dyer. Ea Zamiaceae South Africa (E Cape). OD 野牛非洲铁 Encephalartos bubalinus Melville Eb Zamiaceae Kenya, Tanzania (Arusha).* 蜡色非洲铁 Encephalartos cerinus Lavranos & D. L. Goode Ec Zamiaceae South Africa (KwaZulu-Natal).* 奇马尼马尼非洲铁 Encephalartos chimanimaniensis R. A. Dyer & I. Verd. Ech Zamiaceae Mozambique (Manica), Zimbabwe.* 优雅非洲铁 Encephalartos concinnus R. A. Dyer & I. Verd. Eco Zamiaceae Zimbabwe (Matabeleland South).* 锐刺非洲铁 Encephalartos ferox G. Bertol. Ef Zamiaceae Mozambique (Gaza, Inhambane).* 合意非洲铁 Encephalartos gratus Prain Eg Zamiaceae Malawi (Mulanje), Mozambique.* 劳氏非洲铁 Encephalartos laurentianus De Wild. Ei Zamiaceae Angola, Democratic Republic of Congo.* 那塔尔大苏铁 Encephalartos natalensis R. A. Dyer et Verdoorn En Zamiaceae South Africa (KwaZulu-Natal).* 斯克氏非州苏铁 Encephalartos sclavoi De Luca, D. W. Stev. & A. Moretti Es Zamiaceae Tanzania (Tanga).* 摩瑞大泽米 Macrozamia moorei F. Muell. Mm Zamiaceae Australia (Qld).* 鳞秕泽米 Zamia furfuracea Ait. Zf Zamiaceae Australia (WA).* 注:植物命名参照网站The World List of Cycads(http://cycadlist.org)、中国植物志(https://www.iplant.cn/)。生境信息中:OD代表开阔干旱的原生境;NA代表狭窄瘠薄的原生境;M代表中生生境;CM代表荫蔽湿润的原生境。*表示该物种暂无生境记录。 Notes: Plant names according to The World List of Cycads (http://www.cycadlist.org), The Flora Reipublicae Popularis Sinicae (https://www.iplant.cn/). In habitat information, OD represents open and dry habitat; NA represents narrow and arid habitat; M represents mesophytic habitat; CM represents r closed and moist habitat. Asterisk “*” indicates that no habitat has been recorded for this species. 1.3 测定方法
1.3.1 膨压丧失点水势
用渗透压法进行膨压丧失点水势(Ψtlp)的测定。在早晨6:00-7:00时采集健康成熟的植物叶片,用湿试纸包裹叶片末端切口处,装入黑色遮光塑料袋中,立即将其转移到实验室中。在叶片中脉和边缘处使用8 mm直径打孔器获得一枚圆形叶片(避开叶脉),用镊子将其包入铝箔中,置于液氮内冷冻3 min,取出后去除铝箔,立即用1 mm针孔在圆片上间隔穿刺10~15个孔隙,放入渗透压仪(Vapor pressure osmometer 5600,Wescor,USA)样本室内采用自动重复模式进行测定。在连续3 min测量值之间的差异低于5 mmol/kg时记录渗透势C0并取出样品,计算渗透压(单位换算为MPa):πosm=2.5×C0/1 000。利用Bartlett拟合公式估算膨压为零时的水势(Ψtlp,MPa),其计算公式如下:Ψtlp=0.832×πosm−0.631。
1.3.2 形态和解剖结构
选取若干健康成熟的植物叶片,用试纸擦净表面,使用叶面积仪(Li-3000A,LI-COR,USA)测定叶片面积(LA,cm2),用牛皮纸信封包裹叶片,置于70 ℃烘箱干燥72 h,取出后利用分析天平称量叶片干重(DM,g)。计算单位质量的叶面积即为比叶面积(SLA,cm2/g),该指标是反映植物生存策略的关键性指标。其计算公式如下:SLA=LA/DM。
从每个个体中选取健康新鲜的3~5枚叶片,放入蒸馏水中浸泡24 h,取出叶片,用清洁试纸擦干叶表水分。利用分析天平间隔称重(每1 h称重一次),待叶片重量稳定不变时,得到叶片饱和鲜重(SW,g)。根据以下公式计算叶片饱和水含水量(SWC,%):SWC=(SW-DM)/DM×100%。
根据离析法进行气孔性状的测定。从每个个体剪取面积约2 cm2的3~5枚叶片,放入过氧化氢与冰乙酸的混合溶液(1 : 1),70 ℃水浴加热3~9 h。待出现明显脉肉分离和叶肉沉淀现象即停止水浴,用清水漂洗后放置于载玻片上,滴加1~2滴丙三醇溶液,封片。利用光学显微镜(Leica DM 3000,Leica,Wetzlar,Germany)在10倍镜下随机选取5个清晰视野进行拍摄。使用Image J软件测量并计算照片中的气孔数,气孔密度(SD,ind/mm2)为气孔数量与视野面积的比值。
每个物种选择5株长势良好的植株,各选取新鲜健康的3~5枚叶片作形态解剖。利用双面不锈钢刀片徒手制作叶片横切临时切片(中上部分,避开主脉和叶片边缘),用漂白水中漂至无色。在漂白后用镊子将切片移至装有酒精溶液(75%的酒精 : 水=1 : 2)的培养皿中,静置2 min,此步可避免气泡产生,同时洗去浮色。随后用镊子将切片夹取至载玻片上,加入一滴丙三醇溶液,盖上盖玻片,即可完成叶片横切临时切片。利用光学显微镜(Leica DM3000,Wetzlar,Germany)在10倍镜下随机选择清晰的5~10个视野进行拍照,利用Image J软件分析并计算,最终得到叶片厚度(LT,μm)和叶肉组织厚度(MT,μm)。
1.4 数据收集和分析
本研究收集热带亚热带森林79种典型木本植物(附表1)相关叶片性状的未发表数据,与苏铁类植物进行对比分析,这些被子植物与所选苏铁类植物的野外生境广泛重合。用独立样本t检验阐明苏铁类植物和被子植物叶形态结构和水力学性状的差异(检验水平为P=0.05)。利用Origin 2023b软件进行主成分排序分析(PCA),将研究中的若干指标降解为主要成分指标。分析苏铁和被子植物叶性状网络(PTNs),首先在 SPSS 26.0 软件中采用皮尔逊相关性(Pearson)分析叶性状间的相关关系[10, 24]。应用R 4.1.2软件对性状网络的网络参数的总体特征进行分析,包括边缘密度(Edge density)、直径、平均路径长度(Average path length)[24]。
2. 结果与分析
2.1 苏铁类植物和木本被子植物的主成分分析
研究结果显示,苏铁类植物SWC(平均值1.86%)显著高于被子植物(平均值1.61%,P<0.05,表2);前者的Ψtlp (平均值−1.82 MPa)显著低于后者(平均值−1.70 MPa,P<0.05)。主成分分析结果显示(图1),第1主轴和第2主轴共解释总变异的71.02%。其中,第1主轴解释总变异的45.02%,主要与LT、MT、SLA、SD相关。第2主轴解释总变异的26.00%,主要与SWC、Ψtlp相关。被子植物和苏铁类植物沿第1主轴具有显著区分(图1),被子植物样品在第1主轴的负值部分有很好的表现,苏铁类植物样品主要集中在第1主轴的正值部分。
表 2 叶性状比较分析Table 2. Comparative analysis of leaf traits性状Trait 被子植物Angiosperms 苏铁类植物Cycads P 膨压丧失点水势Leaf water potential at turgor loss point (Ψtlp / MPa) −1.70±0.03 −1.82±0.03 * 比叶面积Specific leaf area (SLA / cm2/g) 113.93±3.07 63.35±4.94 *** 气孔密度Stomatal density (SD / ind/mm2) 286.79±12.49 58.00±4.65 *** 饱和含水量Leaf saturated water content (SWC / %) 1.61±0.05 1.86±0.08 * 叶片厚度Leaf thickness (LT / μm) 231.94±7.34 480.14±31.69 *** 叶肉组织厚度Mesophyll thickness (MT / μm) 192.28±6.64 247.66±31.05 ns 注:利用独立样本t检验比较被子植物和苏铁类植物叶片性状的差异,数据为平均值±标准误。*,P<0.05;***,P<0.001;ns,P>0.05。 Notes: Differences in leaf traits between angiosperms and cycads were analyzed by independent t−tests. Data are Means±SE. ![]() 图 1 79种被子植物和28种苏铁类植物叶性状的主成分分析上方的箱线图为第1主轴上两个类群之间的独立样本 t 检验(双侧);右方的箱线图为第2主轴上两个类群植物之间的独立样本 t 检验(双侧);右上方的文字为基于两个植物类群性状之间欧式距离的ANOSIM检验结果。不同小写字母代表显著差异(P<0.05)。性状缩写同表2。下同。Figure 1. Principal component analysis of leaf traits in 79 angiosperms and 28 cycadsBox chart is independent sample t-test between two groups on first principal axis (both sides), box diagram on right is independent sample t-test between two groups on second principal axis (both sides), and text on upper right is ANOSIM results based on Euclidean distance between traits of two groups. Different letters represent significant differences (P<0.05). Abbreviations of characters are shown in Table 2. Same below.
图 1 79种被子植物和28种苏铁类植物叶性状的主成分分析上方的箱线图为第1主轴上两个类群之间的独立样本 t 检验(双侧);右方的箱线图为第2主轴上两个类群植物之间的独立样本 t 检验(双侧);右上方的文字为基于两个植物类群性状之间欧式距离的ANOSIM检验结果。不同小写字母代表显著差异(P<0.05)。性状缩写同表2。下同。Figure 1. Principal component analysis of leaf traits in 79 angiosperms and 28 cycadsBox chart is independent sample t-test between two groups on first principal axis (both sides), box diagram on right is independent sample t-test between two groups on second principal axis (both sides), and text on upper right is ANOSIM results based on Euclidean distance between traits of two groups. Different letters represent significant differences (P<0.05). Abbreviations of characters are shown in Table 2. Same below.2.2 苏铁类植物和木本被子植物的相关性分析
苏铁类植物和被子植物叶功能性状之间的相关关系具有显著差异(图2、附表2
2 ))。对于被子植物(图2:A),SLA与水力学性状(SWC、Ψtlp)显著正相关,与碳构建性状(LT、MT)显著负相关,与SD相关性不显著;Ψtlp与SLA、SWC显著正相关,与其他生理特征均无显著相关性;LT与光合性状(SLA、SD)显著负相关,与水力学性状(Ψtlp、SWC)相关性不显著;SD仅与碳构建性状(LT、MT)显著负相关,与其他生理特征相关性均不显著。对于苏铁类植物(图2:B),LT、MT与SD彼此间显著正相关,且均与SLA显著负相关;Ψtlp与SLA显著负相关,与LT显著正相关;SWC与其他性状相关性均不显著。![]() 图 2 苏铁类植物与被子植物的叶性状网络图与整体特征A、B分别为被子植物、苏铁类植物的叶性状网络图;C、D、E分别代表边缘密度、直径和平均路径长度。其中蓝色代表负相关;红色代表正相关。线的粗细表示二者之间相关性的强弱。***,P<0.001。Figure 2. Leaf trait networks and differences in overall traits of leaf trait networks between cycads and angiospermsA and B are leaf trait networks of angiosperms and cycads, respectively. C, D, and E represent edge density, diameter, and average path length, respectively. Blue lines represent negative correlations and red lines represent positive correlations. Thickness of lines indicates correlation between the two, thicker lines indicate stronger correlations.
图 2 苏铁类植物与被子植物的叶性状网络图与整体特征A、B分别为被子植物、苏铁类植物的叶性状网络图;C、D、E分别代表边缘密度、直径和平均路径长度。其中蓝色代表负相关;红色代表正相关。线的粗细表示二者之间相关性的强弱。***,P<0.001。Figure 2. Leaf trait networks and differences in overall traits of leaf trait networks between cycads and angiospermsA and B are leaf trait networks of angiosperms and cycads, respectively. C, D, and E represent edge density, diameter, and average path length, respectively. Blue lines represent negative correlations and red lines represent positive correlations. Thickness of lines indicates correlation between the two, thicker lines indicate stronger correlations.苏铁类植物与被子植物的叶功能性状的整体特征参数存在显著差异(图2:C~E)。被子植物叶性状网络的边缘密度显著高于苏铁类植物,而直径、平均路径长度显著低于苏铁类植物。
2.3 叶结构、生理性状之间的相关性比较
对被子植物与苏铁类植物性状间的相关性进行比较(图3),SLA与SWC在被子植物中存在显著的正相关,在苏铁类植物中相关性不显著(图3:A)。Ψtlp与SWC在被子植物中显著正相关,在苏铁类植物中相关性不显著(图3:B)。
3. 讨论
3.1 木本被子植物与苏铁类植物叶性状的比较
与本研究假设一致,木本被子植物和苏铁类植物在叶形态结构和水力学性状方面存在显著差异。与被子植物相比,苏铁类植物具有较低的Ψtlp、SLA、和SD(表2)。较低的SLA在减少蒸腾面积的同时降低了叶片对光资源竞争的能力,使叶肉更倾向于向提高光合效能的方向发展[25]。苏铁类植物的Ψtlp更低(表2;−1.82 MPa),与王乐乐等[19]在森林沟谷区域测定的裸子植物膨压丧失点水势结果相近(−1.83 MPa)。可能是其中喀斯特石山特有种的影响,例如,叉叶苏铁(C. bifida (Dyer) K. D. Hill;−2.08 MPa)、德保苏铁(C. debaoensis Y. C. Zhong & C. J. Chen;−2.01 MPa)和叉孢苏铁(C. segmentifida D. Yue Wang & C. Y. Deng;−1.99 MPa)等,这类苏铁原生境具有明显的垂直梯度:从山谷到山顶岩石裸露程度增加,基质储水能力下降,植物可利用的水分逐渐减少[26],植物通过维持气孔开放以获取碳收益,但面临高水力风险。与前人研究结果一致[27],部分苏铁类植物生长在干旱或半干旱环境中,叶片往往比较厚实,表皮层较发达,气孔密度较小,有助于减少水分的蒸腾损失。在水分稀缺的环境中,这种特征是对生存压力的一种适应[28]。说明对于本研究中分布在石灰岩山地的苏铁类植物而言,部分种可能通过增强木质部抗空化能力以及积累更多的干物质来增强渗透调节的能力,从而维持叶片的水分平衡。而被子植物可能主要通过提高光合作用以维持碳收益,通过增加气孔的数量来减少气孔张开的大小,以减少水分的蒸腾,进而增加其在资源获取上的竞争能力[29]。在全球变暖背景下,下一步需要对热带亚热带苏铁类植物的最低水势进行长期监测(尤其在极端干热时期),这对指导石灰岩退化生境中的濒危苏铁类植物的植被恢复具有重要意义。
与被子植物相比,苏铁类植物具有更厚的叶片以及更高的饱和含水量(表2)。苏铁类植物作为林下植被,受光率较被子植物更低,在同一环境条件下遭受食草动物啃食的风险更高[24]。苏铁类植物在构成防御方面进行大量的碳投资,使叶片更坚韧,可以有效限制食草动物的啃食。另外,以往的研究结果表明,苏铁类植物的叶片往往具有较厚的角质层和紧密的细胞结构,有助于减少水分蒸发并在叶内部存储更多的水分[30]。部分苏铁类植物茎或叶表皮具平伏短柔毛,能降低强光灼伤及水分蒸腾[31]。这种结构特点是苏铁类植物适应干旱环境的一种方式,使得它们能够在水分不足的条件下维持生命活动。
3.2 苏铁类植物和木本被子植物叶性状相关性的差异
苏铁类植物与木本被子植物的叶性状网络的整体特征存在显著差异。与研究假设相反,被子植物叶性状网络的边缘密度显著高于苏铁类植物,而直径、平均路径长度显著低于苏铁类植物。说明被子植物叶性状之间的关联性更高,这种协同作用提高了收益成本比率,反映了被子植物在进化过程中对环境的适应[32]。
苏铁类植物与被子植物的叶性状网络的相关关系存在显著差异。木本被子植物的SLA与水力学性状(SWC、Ψtlp)显著正相关,苏铁类植物则相反,但二者的SLA均与MT显著负相关。说明它们在环境适宜时均倾向于通过调节光合效率以增加碳构建成本,从而能较大程度地避免未来应对干旱胁迫时由于叶水势下降引起的叶片组织形变[9],同时,二者应对干旱胁迫所采取的水力学策略可能存在显著差异。苏铁类植物的SLA显著低于木本被子植物,LT显著高于被子植物,说明苏铁类植物在拥有相对较低的光合面积的同时,相对增加了对叶片建成的资源分配,其耐失水能力也有所提高,与它们在叶片韧性和食草防御方面的高投资一致[33],这种方式有利于苏铁类植物更好地适应热带亚热带森林高温、低辐照的林下环境。叶肉组织增厚和硬化是植物在强光、干旱条件下降低水分利用的重要策略[34],苏铁类植物气孔密度与叶片厚度显著正相关,与前人研究结果一致[28],说明苏铁类植物在利用较厚的叶片保持水分的同时,也能在环境中进行有效的呼吸作用,从而导致叶片净光合速率降低。这些机制促使苏铁类植物的资源利用策略向叶经济谱中保守的一端倾斜。因此,苏铁类植物的叶寿命也可能更长[35]。
SWC在被子植物中与SLA、Ψtlp显著正相关,而在苏铁植物中与其他性状解耦,说明苏铁类植物可能拥有与被子植物不同的水分调节机制。例如,它们可能更依赖于根系的水分吸收和存储,而不是通过叶片的物理特性进行精细调节[36]。苏铁通过其特殊的根结构(称为珊瑚根)与某些细菌建立了独特的关系。这些根是能固氮的内生细菌的宿主,对植物的营养和生长至关重要。苏铁与其珊瑚状根菌之间的共生关系,特别是蓝藻菌和其他重氮营养(固氮)细菌,突出了植物对根系养分获取和水分吸收的依赖[37],在植物适应环境中发挥重要作用。这种差异可能导致叶片饱和含水量与比叶面积以及叶片膨压丧失点之间的关系不明显。此外,苏铁类植物叶片SWC与其他性状解耦也可能是受到茎结构的影响,苏铁类植物茎木质化程度较高[26],能增强对导管的支持作用并保护其输导组织,部分苏铁类植物肉质的茎中存在特化的储水组织和粘液细胞,具有缓冲细胞水分变化等功能[38]。综上,这些机制可能使苏铁类植物独立于叶片结构进行整株植物的水分调节。
4. 结论
本研究发现木本被子植物和苏铁类植物叶性状存在差异,苏铁类植物具有较小的比叶面积、气孔密度和更低的膨压丧失点水势,具有更大的叶片厚度和饱和含水量。在相对干旱的热带亚热带森林,被子植物叶性状的关联性更强,光合能力和耐旱能力之间显著协同,说明被子植物可能主要通过提高光合作用以维持碳收益,通过增加气孔的数量来减少气孔张开的大小,以减少水分的蒸腾,进而增加其在资源获取上的竞争能力。而苏铁类植物叶片对于防御结构的高投资可能会促进叶片的能量投资策略向资源保守型转变,苏铁类植物叶片饱和含水量与其他性状解耦,说明苏铁类植物在输水过程中发生栓塞的程度可能更低。
1 如需查阅附图内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
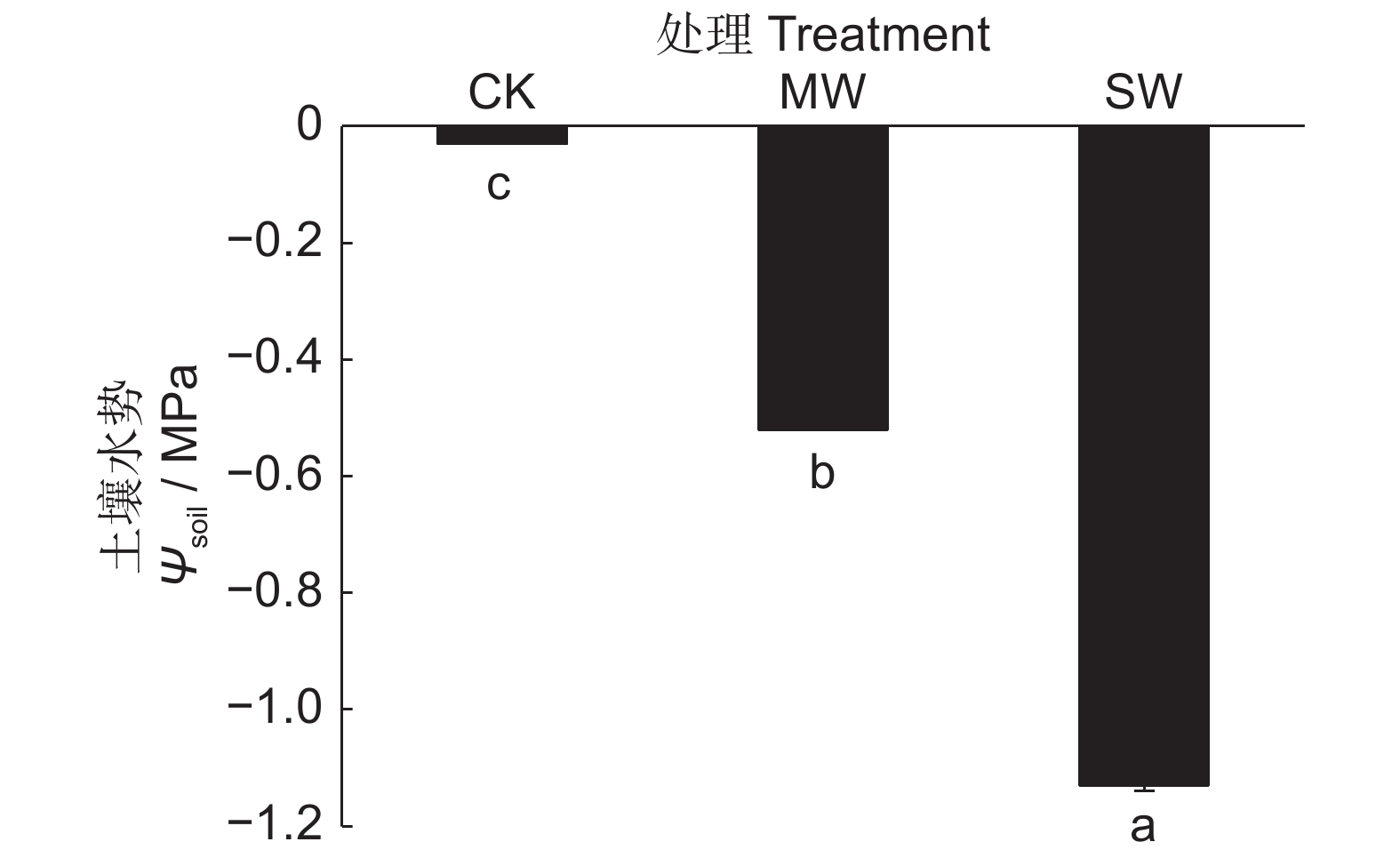
图 1 不同控水处理土壤水势(Ψsoil)变化
CK为对照,MW为轻度水分胁迫,SW为重度水分胁迫。下同。不同小写字母表示不同处理间差异显著(n=3,P<0.05)。
Figure 1. Changes in soil water potential (Ψsoil) under different water control treatments
CK: Control; MW: Moderate water stress; SW: Severe water stress. Same below. Lowercase letters indicate significant differences (n=3, P<0.05).
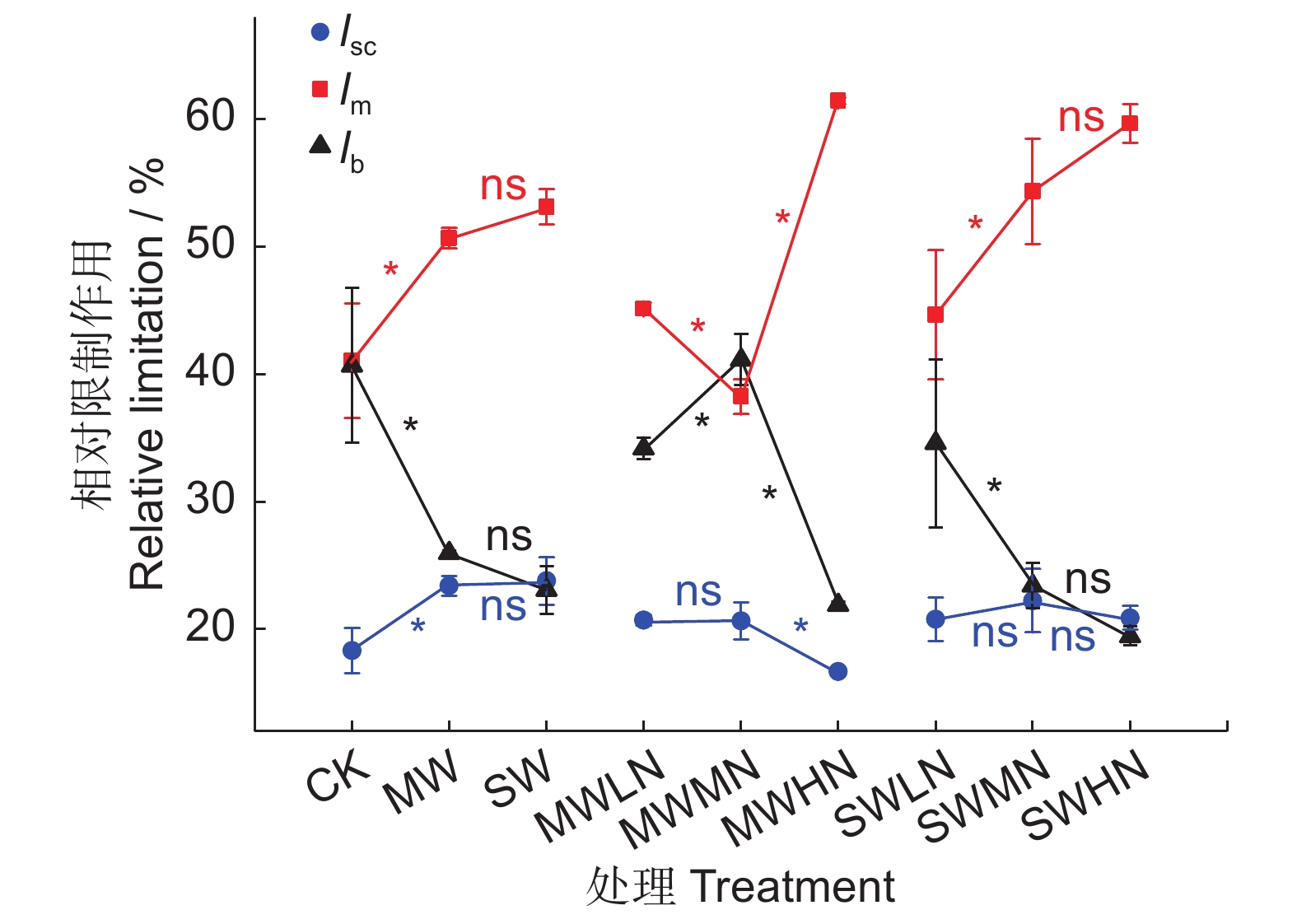
图 2 大豆光合相对限制作用随土壤水、氮含量的变化
MWLN为轻度水分胁迫,低氮添加;MWMN为轻度水分胁迫,中氮添加;MWHN为轻度水分胁迫,高氮添加;SWLN为重度水分胁迫,低氮添加;SWMN为重度水分胁迫,中氮添加;SWHN为重度水分胁迫,高氮添加。下同。*表示不同处理间在P<0.05水平上(n=3)差异显著,ns表示在该水平下差异不显著。
Figure 2. Changes in relative limitations of gsc, gm, and biochemical capacity with soil water and nitrogen in Glycine max seedlings
MWLN: Moderate water stress×low N addition; MWMN: Moderate water stress×medium N addition; MWHN: Moderate water stress×high N addition; SWLN: Severe water stress×low N addition; SWMN: Severe water stress×medium N addition; SWHN: Severe water stress×high N addition. Same below. * indicates significant difference between treatments at P<0.05 (n=3), ns indicates no significant difference at this level.
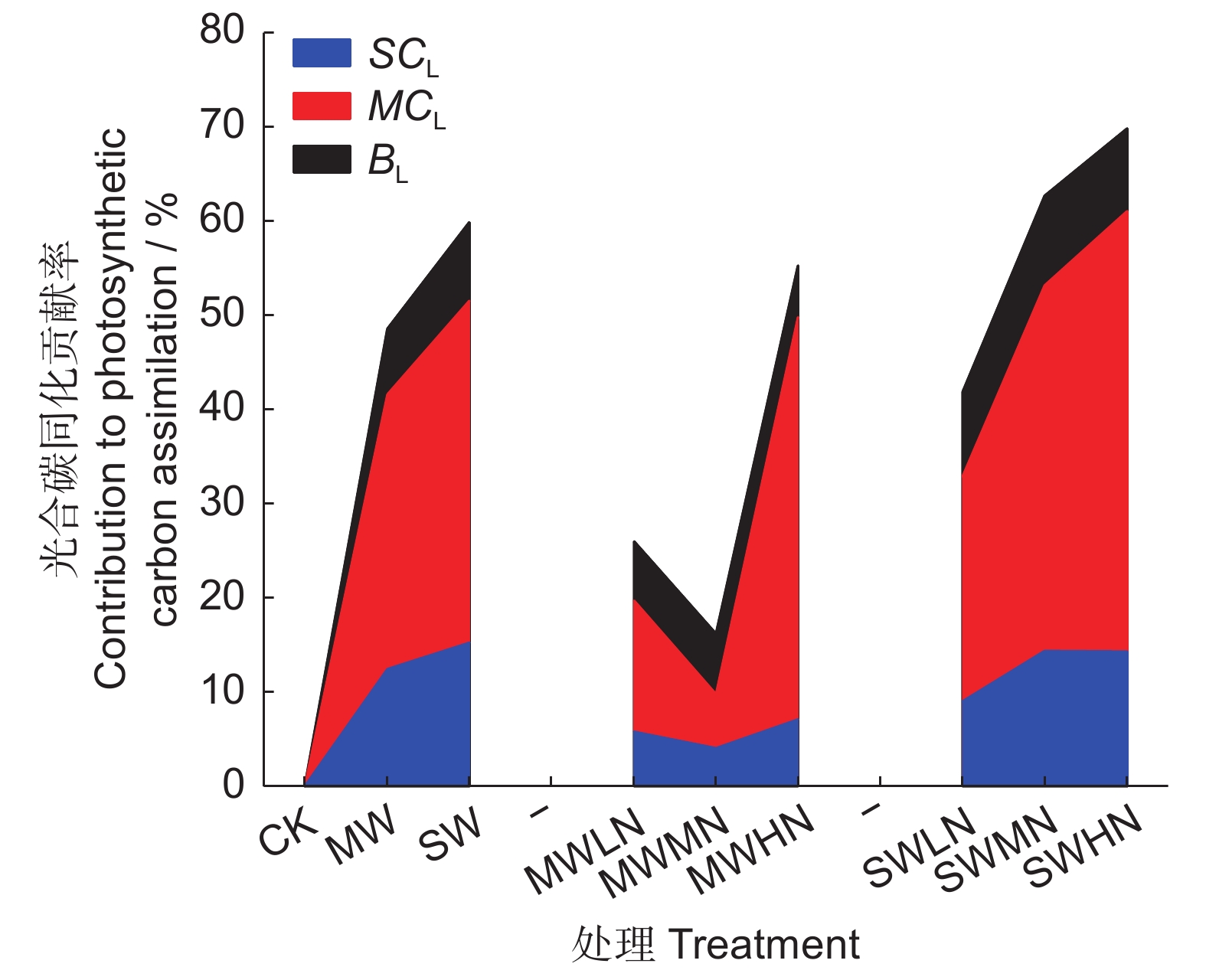
图 3 gsc、gm及生化能力对植株饱和光碳同化贡献率随土壤水、氮含量的变化
SCL、MCL和BL分别为gsc、gm和生化能力对叶片dAn/An的贡献率。
Figure 3. Changes in contributions of gsc, gm, and biochemical capacity to light-saturated assimilation with soil water and nitrogen in Glycine max seedlings
SCL, MCL, and BL are contributions of gsc, gm, and biochemical capacity to dAn/An, respectively.
表 1 叶片气孔形态特征值
Table 1 Anatomical morphological features of leaf stomata
处理
Treatment气孔密度
Ds / ind./mm2气孔大小
Ssize / μm2气孔开度
SS / μm2叶片厚度
Tleaf / μmCK 291.7±87.4a 141.2±34.4a 17.8±3.6a 192.7±24.1a MW 266.7±37.3a 141.4±42.2a 14.0±5.3ab 158.6±26.1b SW 250.0±96.2a 129.7±9.7a 8.6±1.5b 160.6±12.1b MWLN 208.3±45.0a 139.0±5.7a 11.3±2.2b 187.3±20.9ab MWMN 215.3±42.9a 147.6±37.5a 7.8±2.0bc 182.6±9.7ab MWHN 233.8±34.2a 103.7±10.8a 4.3±1.2d 192.2±18.8a SWLN 277.8±43.0a 130.4±15.8a 4.6±1.6cd 171.9±16.0ab SWMN 263.9±34.0a 145.3±16.4a 6.1±0.9cd 196.4±12.8a SWHN 222.2±96.2a 114.1±32.6a 2.2±0.1e 170.6±16.1ab 注:MWLN为轻度水分胁迫,低氮添加;MWMN为轻度水分胁迫,中氮添加;MWHN为轻度水分胁迫,高氮添加;SWLN为重度水分胁迫,低氮添加;SWMN为重度水分胁迫,中氮添加;SWHN为重度水分胁迫,高氮添加。同列不同小写字母表示处理间在P<0.05水平上差异显著。下同。 Notes: MWLN: Moderate water stress×low N addition; MWMN: Moderate water stress×medium N addition; MWHN: Moderate water stress×high N addition; SWLN: Severe water stress×low N addition; SWMN: Severe water stress×medium N addition; SWHN: Severe water stress×high N addition.Different lowercase letters in same column indicate significant differences at P<0.05 level. Same below. 表 2 不同水氮条件下土壤全氮、硝态氮、全磷、全钾、速效钾含量
Table 2 Key soil nutrient content of nitrate N, total P, total K, and available K under different water and nitrogen conditions
处理
Treatment全氮
Total nitrogen / g/kg硝态氮
Nitrate nitrogen / mg/kg全磷
Total P / g/kg全钾
Total K / g/kg速效钾
Available K / mg/kgCK 1.12±0.00a 12.4±0.3d 2.49±0.18b 30.3±1.9c 157.4±5.3d MW 1.06±0.15a 11.2±0.5d 2.37±0.15bc 29.5±1.2c 150.4±2.1d SW 1.02±0.14ab 11.0±0.4d 2.22±0.08c 29.0±1.8c 147.4±4.0d MWLN 1.26±0.14a 33.2±0.4c 2.92±0.06a 33.3±0.1b 200.7±30.9c MWMN 0.84±0.00bc 49.1±13.6b 2.91±0.02a 32.7±0.4b 163.3±3.8d MWHN 1.12±0.28a 58.6±4.6a 2.87±0.12a 35.3±0.7a 289.7±5.9a SWLN 1.12±0.00a 44.8±1.9b 2.79±0.29a 32.8±0.5b 239.9±13.2b SWMN 0.70±0.14c 55.3±2.4ab 2.91±0.16a 32.8±0.8b 222.9±6.3bc SWHN 1.12±0.00a 51.1±3.8ab 2.83±0.03a 33.6±0.2ab 240.3±20.0b -
[1] 刘平,刘学军,刘恩科,韩彦龙,李丽君,等. 山西省太原市旱作农区大气活性氮干湿沉降年度变化特征[J]. 中国生态农业学报,2017,25(5):625−633. Liu P,Liu XJ,Liu EK,Han YL,Li LJ,et al. Temporal variation of atmospheric wet/dry reactive nitrogen deposition in Taiyuan rainfed farming area of Shanxi Province[J]. Chinese Journal of Eco-Agriculture,2017,25(5):625−633.
[2] Flexas J,Ribas-Carbó M,Diaz-Espejo A,Galmés J,Medrano H. Mesophyll conductance to CO2:current knowledge and future prospects[J]. Plant Cell Environ,2008,31(5):602−621. doi: 10.1111/j.1365-3040.2007.01757.x
[3] Grassi G,Magnani F. Stomatal,mesophyll conductance and biochemical limitations to photosynthesis as affected by drought and leaf ontogeny in ash and oak trees[J]. Plant Cell Environ,2005,28(7):834−849. doi: 10.1111/j.1365-3040.2005.01333.x
[4] Galmés J,Medrano H,Flexas J. Photosynthetic limitations in response to water stress and recovery in Mediterranean plants with different growth forms[J]. New Phytol,2007,175(1):81−93. doi: 10.1111/j.1469-8137.2007.02087.x
[5] Cai YF,Wang JH,Li SF,Zhang L,Peng LC,et al. Photosynthetic response of an alpine plant,Rhododendron delavayi Franch,to water stress and recovery:the role of mesophyll conductance[J]. Front Plant Sci,2015,6:1089.
[6] Flexas J,Barón M,Bota J,Ducruet JM,Gallé A,et al. Photosynthesis limitations during water stress acclimation and recovery in the drought-adapted Vitis hybrid richter-110 (V. berlandieri × V. rupestris)[J]. J Exp Bot,2009,60(8):2361−2377. doi: 10.1093/jxb/erp069
[7] Perez-Martin A,Michelazzo C,Torres-Ruiz JM,Flexas J,Fernández JE,et al. Regulation of photosynthesis and stomatal and mesophyll conductance under water stress and recovery in olive trees:correlation with gene expression of carbonic anhydrase and aquaporins[J]. J Exp Bot,2014,65(12):3143−3156. doi: 10.1093/jxb/eru160
[8] Zhu K,Yuan FH,Wang AZ,Wu JB,Guan DX,et al. Stomatal,mesophyll and biochemical limitations to soil drought and rewatering in relation to intrinsic water-use efficiency in Manchurian ash and Mongolian oak[J]. Photosynthetica,2021,59(1):49−60. doi: 10.32615/ps.2020.084
[9] Warren CR. The photosynthetic limitation posed by internal conductance to CO2 movement is increased by nutrient supply[J]. J Exp Bot,2004,55(406):2313−2321. doi: 10.1093/jxb/erh239
[10] Bown HE,Watt MS,Mason EG,Clinton PW,Whitehead D. The influence of nitrogen and phosphorus supply and genotype on mesophyll conductance limitations to photosynthesis in Pinus radiata[J]. Tree Physiol,2009,29(9):1143−1151. doi: 10.1093/treephys/tpp051
[11] 朱凯,左齐慧,袁凤辉,关德新,吴家兵,等. 土壤氮添加对水曲柳和蒙古栎光合限制作用的影响[J]. 植物科学学报,2023,41(4):502−512. Zhu K,Zuo QH,Yuan FH,Guan DX,Wu JB,et al. Effects of soil nitrogen addition on photosynthetic limitations in Fraxinus mandshurica Rupr. and Quercus mongolica Fish. ex Ledeb[J]. Plant Science Journal,2023,41(4):502−512.
[12] Barbour MM,Kaiser BN. The response of mesophyll conductance to nitrogen and water availability differs between wheat genotypes[J]. Plant Sci,2016,251:119−127. doi: 10.1016/j.plantsci.2016.03.012
[13] Flexas J,Niinemets Ü,Gallé A,Barbour MM,Centritto M,et al. Diffusional conductances to CO2 as a target for increasing photosynthesis and photosynthetic water-use efficiency[J]. Photosynth Res,2013,117(1-3):45−59. doi: 10.1007/s11120-013-9844-z
[14] Linderson ML,Mikkelsen TN,Ibrom A,Lindroth A,Ro-Poulsen H,Pilegaard K. Up-scaling of water use efficiency from leaf to canopy as based on leaf gas exchange relationships and the modeled in-canopy light distribution[J]. Agr Forest Meteorol,2012,152:201−211. doi: 10.1016/j.agrformet.2011.09.019
[15] 赵福年,杨红燕,王润元,张凯,齐月,等. 作物内禀水分利用效率变化[J]. 核农学报,2019,33(9):1873−1881. Zhao FN,Yang HY,Wang RY,Zhang K,Qi Y,et al. Variation of intrinsic water use efficiency for crop[J]. Journal of Nuclear Agricultural Sciences,2019,33(9):1873−1881.
[16] Li YY,Liu NN,Fan H,Su JX,Fei C,et al. Effects of deficit irrigation on photosynthesis,photosynthate allocation,and water use efficiency of sugar beet[J]. Agr Water Manag,2019,223:105701. doi: 10.1016/j.agwat.2019.105701
[17] 杨建伟,梁宗锁,韩蕊莲,孙群,崔浪军. 不同干旱土壤条件下杨树的耗水规律及水分利用效率研究[J]. 植物生态学报,2004,28(5):630−636. Yang JW,Liang ZS,Han RL,Sun Q,Cui LJ. Water use efficiency and water consumption characteristics of poplar under soil drought conditions[J]. Acta Phytoecologica Sinica,2004,28(5):630−636.
[18] 王湛,李银坤,郭文忠,韩雪. 不同灌水量对温室茄子蒸腾规律及水分利用的影响[J]. 中国农村水利水电,2019(7):6−10. Wang Z,Li YK,Guo WZ,Han X. The effect of different irrigation amount on the transpiration rate and water use efficiency of autumn eggplant in greenhouses[J]. China Rural Water and Hydropower,2019(7):6−10.
[19] 胡晓创,高婉婷,孙守家,张劲松,孟平,蔡金峰. 刺槐生长和内在水分利用效率对气候因子的响应[J]. 应用生态学报,2023,34(10):2610−2618. Hu XC,Gao WT,Sun SJ,Zhang JS,Meng P,Cai JF. Responses of tree growth and intrinsic water-use efficiency of Robinia pseudoacacia to climate factors[J]. Chinese Journal of Applied Ecology,2023,34(10):2610−2618.
[20] 朱林,许兴. 植物水分利用效率的影响因子研究综述[J]. 干旱地区农业研究,2005,23(6):204−209. Zhu L,Xu X. Review on influential factors of plant water use efficiency[J]. Agricultural Research in the Arid Areas,2005,23(6):204−209.
[21] 山仑,徐萌. 节水农业及其生理生态基础[J]. 应用生态学报,1991,2(1):70−76. Shan L,Xu M. Water-saving agriculture and its physio-ecological bases[J]. Chinese Journal of Applied Ecology,1991,2(1):70−76.
[22] Han JM,Meng HF,Wang SY,Jiang CD,Liu F,et al. Variability of mesophyll conductance and its relationship with water use efficiency in cotton leaves under drought pretreatment[J]. J Plant Physiol,2016,194:61−71. doi: 10.1016/j.jplph.2016.03.014
[23] Von Caemmerer S,Farquhar GD. Some relationships between the biochemistry of photosynthesis and the gas exchange of leaves[J]. Planta,1981,153(4):376−387. doi: 10.1007/BF00384257
[24] Zhu K,Zuo QH,Liu FW,Qin JM,Wang AZ,et al. Divergences in leaf CO2 diffusion conductance and water use efficiency of soybean coping with water stress and its interaction with N addition[J]. Environ Exp Bot,2024,217:105572. doi: 10.1016/j.envexpbot.2023.105572
[25] Cano FJ,López R,Warren CR. Implications of the mesophyll conductance to CO2 for photosynthesis and water-use efficiency during long-term water stress and recovery in two contrasting Eucalyptus species[J]. Plant Cell Environ,2014,37(11):2470−2490. doi: 10.1111/pce.12325
[26] Von Caemmerer S,Evans JR,Hudson GS,Andrews TJ. The kinetics of ribulose-1,5-bisphosphate carboxylase/oxygenase in vivo inferred from measurements of photosynthesis in leaves of transgenic tobacco[J]. Planta,1994,195(1):88−97. doi: 10.1007/BF00206296
[27] 崔兴国. 植物蒸腾作用与光合作用的关系[J]. 衡水师专学报,2002,4(3):55−56. Cui XG. Relation between the transpiration and the photosynthesis of plants[J]. Journal of Hengshui Normal College,2002,4(3):55−56.
[28] Zhu K,Yuan FH,Wang AZ,Yang H,Guan DX,et al. Effects of soil rewatering on mesophyll and stomatal conductance and the associated mechanisms involving leaf anatomy and some physiological activities in Manchurian ash and Mongolian oak in the Changbai Mountains[J]. Plant Physiol Biochem,2019,144:22−34. doi: 10.1016/j.plaphy.2019.09.025
[29] 张岁岐,李秧秧. 施肥促进作物水分利用机理及对产量影响的研究[J]. 水土保持研究,1996,3(1):185−191. Zhang SQ,Li YY. Study on effects of fertilizing on crop yield and its mechanism to raise water use efficiency[J]. Research of Soil and Water Conservation,1996,3(1):185−191.
[30] Lumactud RA,Dollete D,Liyanage DK,Szczyglowski K,Hill B,Thilakarathna MS. The effect of drought stress on nodulation,plant growth,and nitrogen fixation in soybean during early plant growth[J]. J Agron Crop Sci,2023,209(3):345−354. doi: 10.1111/jac.12627
-
其他相关附件
-
PDF格式
朱凯-附图 点击下载(178KB)
-



 下载:
下载: