Identification and analysis of the GDP-mannose pyrophosphorylase gene (GMP) family in Gossypium hirsutum L.
-
摘要:
GDP-甘露糖焦磷酸化酶(GDP-mannose pyrophosphorylase,GMP)是植物多糖合成途径中的关键酶。本文对陆地棉(Gossypium hirsutum L.)GMP基因家族成员进行了鉴定,分析了其在不同组织及非生物胁迫下的表达模式,并与其他模式植物进行了物种间的进化分析。结果显示,陆地棉和海岛棉(G. barbadense L.)均包含38个GMP家族成员,雷蒙德氏棉(G. raimondii Ulbrich)包含19个成员,亚洲棉(G. arboreum L.)包含18个成员。系统发育分析将不同植物的141个GMP 分成了6个亚组,同一亚族GhGMP成员具有相似的基因结构和保守基序,且启动子区含有大量的激素应答、植物生长发育以及胁迫响应相关的顺式作用元件。转录组数据分析结果表明,GhGMPs基因在叶片中的表达量最高,非生物胁迫后,部分基因的表达显著上调。
Abstract:GDP-mannose pyrophosphorylase (GMP) is a key enzyme in the plant polysaccharide synthesis pathway. In this paper, members of the GMP gene family in Gossypium hirsutum L. were identified, their expression patterns in different tissues and under different abiotic stresses were analyzed, and evolutionary analysis between species and GMP gene families of other model plants was carried out. Results showed that G. hirsutum L. and G. barbadense L. both contained 38 GMP family members, G. raimondii Ulbrich contained 19 members, and G. arboreum L. contained 18 members. Based on phylogenetic analysis, 141 GMPs from different plants were divided into six subgroups. GhGMP members of the same subfamily exhibited similar gene structures and conserved motifs, and the promoter region contained many cis-acting element related to hormone response, plant growth and development, and stress response. Transcriptomic analysis showed that the expression of GhGMP genes was highest in the leaves, and some genes were significantly up-regulated after abiotic stress.
-
Keywords:
- Gossypium hirsutum /
- GMP gene family /
- Abiotic stress /
- Expression analysis
-
GDP-甘露糖焦磷酸化酶(GMP)是植物合成GDP-甘露糖的关键酶,可以催化鸟苷三磷酸和甘露糖-1-磷酸反应生成GDP-甘露糖。作为多糖合成中的重要前体物质,GDP-甘露糖影响原核生物和真核生物的生长[1],有助于植物细胞壁中结构性碳水化合物的合成,是碳水化合物合成的关键基质,并参与蛋白质的糖基化[2]。GMP也是植物抗坏血酸(AsA)生物合成途径的第一个关键酶,AsA对于细胞的生长、分裂以及一些次生代谢物和激素的合成具有重要功能,同时在应对非生物胁迫[3]等方面也扮演着重要角色。
目前,已在多种植物中展开了关于GMP基因的研究。在灵芝(Ganoderma lucidum (Curtis) P. Karst.)中,增加GMP的活性不仅可提高灵芝多糖的合成,也可提高甘露糖磷酸变位酶1和变位酶2的表达量[4]。在水稻(Oryza sativa L.)中,该基因可调控植株AsA含量,参与盐胁迫和干旱胁迫应答,并影响植株的根系生长[5]。在拟南芥(Arabidopsis thaliana (L.) Heynh)中,过表达水稻OsVTC1-1基因能够恢复其AsA的合成[6]。在芹菜(Apium graveolens L.)中,非生物胁迫下的AgGMP基因表达量显著升高,且转AgGMP基因拟南芥的AsA含量高于野生型植株,AgGMP基因调节芹菜AsA积累,并参与干旱胁迫响应[7]。烟草(Nicotiana tabacum L.)转入西印度樱桃(Malpighia glabra L.)MgGMP基因后,其AsA含量显著提高[8]。尽管GMP基因参与多种植物的生长并能抵御植物非生物胁迫,但关于棉花(Gossypium)GMP基因家族成员的生物信息及功能特性还鲜有报道。
棉花是重要的经济作物和战略物资,为中国第二大农作物,在国民经济中占有重要地位[9]。中国棉花主要产区包括新疆、黄河流域、长江流域等。新疆作为我国最大的棉花生产基地,2021年种植面积和总产量的全国占比分别达82.7%和89.5%[10]。但近年来受极端气候和降水量变化的影响,棉花的品质逐年下降[11],虽然采用科学滴灌方式可减轻棉花遭受干旱及盐胁迫的危害,但还是不可避免地对其产量及纤维品质造成影响[12]。对可能参与植物生长发育、非生物逆境胁迫响应的GMP基因家族进行生物信息学分析,可为挖掘棉花中优异的抗胁迫基因提供基础,并为育种提供新的候选基因,有助于今后采用分子技术手段提高棉花的抗逆境胁迫能力,促进其产量及品质的提高。
1. 材料及方法
1.1 植物材料
本研究选用新疆推广的陆地棉(G. hirsutum L.)‘石远321’(抗旱)和‘奎85-174’(敏旱),均由新疆农业大学作物遗传改良与种质创新重点实验室提供。采用盆栽土培的方式,种植前称取盆栽整体重量。放置在光周期为12 h光照/12 h黑暗、 温度为25 ℃的温室培养。棉花幼苗培养至三叶期时进行干旱胁迫。用整体称重法逐日测量土壤含水量,在土壤含水量分别为50%、40%、30%、20%、10%时,选取长势一致的3株棉苗,对叶片进行取样,放置液氮中冻存。
1.2 全基因组鉴定及理化性质分析
从CottonFGD数据库[13]下载棉花基因序列。拟南芥和水稻的相关基因组和蛋白质组文件均从Ensembl Plants数据库[14]中下载。借助GMP蛋白保守结构域的HMM隐马可夫模型(PF00483),在本地蛋白质组数据库中进行Blast比对,得到具有GMP蛋白特有结构域的序列。将得到的推测为GMP蛋白的序列在NCBI-CDD数据库[15]中进行GMP家族特异性结构域验证,去除不包含GMP蛋白结构域的序列。最后,利用ExPASy[16]网站中的ProtParam在线工具对GhGMPs蛋白序列的分子量(MW)、等电点(pI)等理化性质进行分析,利用WoLF PSORT(https://wolfpsort.hgc.jp/)在线工具进行亚细胞定位预测。
1.3 进化树、同源性分析
利用MEGA-X软件[17]中的Clustal W功能对棉花、拟南芥的GMP蛋白和水稻的MPG蛋白进行多序列比对。基于比对的果,采用邻近法(Neighbor-joining,NJ)构建系统进化树,重复次数为1000。利用在线网站Evolview v3[18]对其进行美化。根据棉花的基因组和染色体数据库CottonFGD[13],利用TBtools软件[19]展示GMP蛋白家族成员在棉花染色体上的同源性。通过CottonGen数据库[20]、Blast[21]、TBtools软件[19]和MCScanX[22]对GMP蛋白家族在陆地棉AD基因亚组之间以及陆地棉与水稻、拟南芥之间的同源性进行比对和共线性分析,通过TBtools可视化后用Adobe Illustrator CS6软件进行美化调整。
1.4 陆地棉GMP基因结构分析及顺式作用元件预测
通过MEME程序[23]对陆地棉GMP家族成员进行保守基序(Motif)分析。使用CottonGen网站[16]下载基因组注释文件,利用TBtools软件[19]进行数据可视化处理,并提取基因CDS区上游2 000 bp的序列,利用Plant CARE软件[24]对启动子区的顺式作用元件进行预测。
1.5 陆地棉GMP基因转录组表达模式分析
从NCBI SAR(Sequence read archive)数据库下载陆地棉器官(根、茎、叶、雌蕊、雄蕊、花萼、花瓣和花托)和非生物胁迫处理后的转录组数据(PRJNA248163)。参考基因组文件TM-1_genome_ZJU_v2.1[25],对原始数据进行转录组标准分析,得到表达量数据,并对表达量数据进行log10(TPM + 1)标准化。利用TBtools软件[19]绘制表达量热图、基因结构图、顺式作用元件图,使用Adobe Illustrator CS6软件进行美化调整。
1.6 RNA提取及qRT-PCR分析
利用CottonFGD数据库[13]下载陆地棉GMP基因CDS序列信息,使用DNAMan软件设计荧光定量PCR引物(表1)。利用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根,北京)从幼苗中提取总RNA,反转录 合成第一链cDNA。选择棉花Ubiquitin7(UBQ7)作为内参基因,利用罗氏Light Cycler荧光定量PCR仪进行qRT-PCR扩增(3次技术重复),采用2-ΔΔCt法[26]计算基因相对表达量。利用GraphPad Prism v 9.0.0对数据进行可视化处理,并用Adobe Illustrator CS6软件进行美化调整。
表 1 引物序列Table 1. Primer sequences引物 Primer 序列 Sequence(5'→3') 引物 Primer 序列 Sequence(5'→3') GhGMP08qt-F GAGTTTGGGGAGTTGGTAGCAGATC GhGMP27qt-F GAGTTTGGGGAGTTGGTAGCAGATC GhGMP08qt-R ACCACAGTTGATTCGGTCACTTACG GhGMP27qt-R ACCACAGTTGATTCGGTCACTTACG GhGMP11qt-F TGATGGCTACTGGGAGGACATTGG GhGMP30qt-F TGCTTCTCTCAATCGTCACCTTTCC GhGMP11qt-R TCTGGCACTGGCTTCTTGGTAATTC GhGMP30qt-R GCCTCACCGCATCTGCTGTC GhGMP15qt-F GTGCCTCGGACTTCGGTCTAATG GhGMP34qt-F CGTGCCTCGGATTTCGGTCTAATG GhGMP15qt-R TGCTTTCAATTCTGCTCCCTTGGG GhGMP34qt-R TGCTTTCAATTCTGCTCCCTTGGG GhGMP16qt-F GGCTCTCAAGGCTGTTGGTGTAAG GhGMP35qt-F AATTGGTCCAGGCTGCGTTGTC GhGMP16qt-R CAGTGCCAAGCGGCTCAGTC GhGMP35qt-R GGTGGAATGCCATCCGATGATACTG GhGMP17qt-F GCTTGTCGTTCTCGGCGTCTG GhGMP36qt-F GCTTGTCGTTCTCGGCGTCTG GhGMP17qt-R ATTGAAGCAGTCCGTTCCGTTCG GhGMP36qt-R ATTGAAGCAGTCCGTTCCGTTCG GhGMP25qt-F CCTTCTCCCTCAATCGTCACTTAGC GhUBQ7qt-F GACCTACACCAAGCCCAAGAAG GhGMP25qt-R GCCTCACAGCATCAGCAGTTCC GhUBQ7qt-R TGAGCCCACACTTACCACAATAGT 2. 结果与分析
2.1 棉花GMP基因家族的全基因组鉴定及理化性质分析
通过本地Blast数据库和NCBI-CDD数据库[15]对棉花GMP蛋白家族进行筛选,共鉴定出113个GMPs基因,其中陆地棉和海岛棉(G. barbadense L.)均包含38个,雷蒙德氏棉(G. raimondii Ulbrich)和亚洲棉(G. arboreum L.)分别有19和18个(附表1
1 )。分析结果表明,陆地棉GMP基因编码区长度为225~2 181 bp,编码氨基酸在74~726 aa,编码蛋白分子量为8.14~81.54 kD,等电点介于4.65~9.15;海岛棉GMP基因编码区长度为183~2 181 bp,编码氨基酸长度在60~726 aa,编码蛋白质分子量为6.57~81.51 kD,等电点在4.65~9.4;雷蒙德氏棉GMP基因编码区在1 002~2 178 bp,编码氨基酸333~725 aa,编码蛋白分子量为36.54~81.44 kD,等电点介于4.68~9.13;亚洲棉GMP基因编码区长度为1 080~2 181 bp,编码氨基酸长度在359~726 aa,编码蛋白分子量为39.24~81.53 kD,等电点在4.64~9.11。亚细胞定位结果显示,棉花GMP蛋白大多数位于叶绿体、细胞质或细胞核中,少数成员存在于不止一个细胞器内。GMP家族成员的理化性质和亚细胞定位存在较大差异,预示着该基因家族在棉花生长发育过程中可能扮演着不同的角色。2.2 棉花GMP基因染色体定位与命名
将棉花GMP基因进行染色体定位,结果如附图1
2 所示,陆地棉、海岛棉、雷蒙德氏棉、亚洲棉的GMP基因在染色体上呈不均匀分布。陆地棉和海岛棉的A02、A12、D03、D12染色体均无GMP基因分布,A03、A04、A06、A08、A10、A11、D01、D02、D05、D06、D08、D10和D11染色体各有1个基因,其他染色体GMP基因分布数目2~5个不等,陆地棉和海岛棉的A01与A05染色体上的基因分布数量存在差异。雷蒙德氏棉中08染色体无基因分布,Chr02、Chr05、Chr07、Chr09、Chr10和Chr11染色体各有1个,GrGMP19分布于14号染色体大片段,其他染色体上基因分布数目在2~4个。亚洲棉Chr01、Chr02、Chr12染色体无基因分布,Chr03、Chr05、Chr06、Chr08、Chr10、Chr11各1个,其他染色体上2~4个不等,GaGMP17和GaGMP18基因分布在14号染色体大片段上。陆地棉GMP基因不均匀地分布于22条染色体上,其中A亚组和D亚组均有19个,海岛棉同上。但在各自的AD亚组染色体中也存在差异,如A04染色体中有1个GMP基因,而D04染色体中有3个;陆地棉A05染色体有3个基因,海岛棉A05染色体有2个,而各自的D05染色体只有1个GMP基因。雷蒙德氏棉19个GMPs基因不均匀地分布于11条染色体上,1个分布于14号染色体大片段上。亚洲棉18个GMPs基因有16个分布于11条染色体上,2个分布于染色体大片段上。根据基因在不同棉种染色体上的位置,陆地棉命名为GhGMP01~GhGMP38,海岛棉命名为GbGMP01~GbGMP38,雷蒙德氏棉命名为GrGMP01~GrGMP19,亚洲棉命名为GaGMP01~GaGMP18。2.3 棉花GMP基因家族系统进化分析
为了解GMP基因家族的进化关系,对棉花、拟南芥以及水稻中的GMPs基因编码蛋白进行聚类分析,构建系统进化树。结果如图1所示,141个GMPs可分为6个亚组,即Group 1 ~ Group 6。Group 4成员最少,为6个,其中陆地棉和海岛棉均有2个,雷蒙德氏棉和亚洲棉各1个。Group 1和Group 3成员均为17个,Group 1中陆地棉和海岛棉均有4个,雷蒙德氏棉和亚洲棉均有2个,拟南芥有1个,而水稻有4个。Group 3中陆地棉有5个,海岛棉有4个,雷蒙德氏棉、亚洲棉、拟南芥及水稻均有2个。Group 5成员有23个,其中陆地棉和海岛棉均有5个,雷蒙德氏棉有4个,亚洲棉、拟南芥及水稻均有3个。Group 2成员共31个,其中陆地棉有9个,海岛棉有8个,雷蒙德氏棉和亚洲棉各4个,拟南芥和水稻各有3个。Group 6成员最多,为47个,其中陆地棉13个,海岛棉15个,雷蒙德氏棉、亚洲棉及拟南芥分别为6个,水稻有1个。陆地棉和海岛棉在染色体相同位置上的GMPs基因均紧密聚集在同一个亚组中,且每个亚组中陆地棉和海岛棉的基因数量是雷蒙德式棉和亚洲棉的2倍左右,符合棉花物种的进化关系(图2)。
2.4 陆地棉GMP基因同源性分析
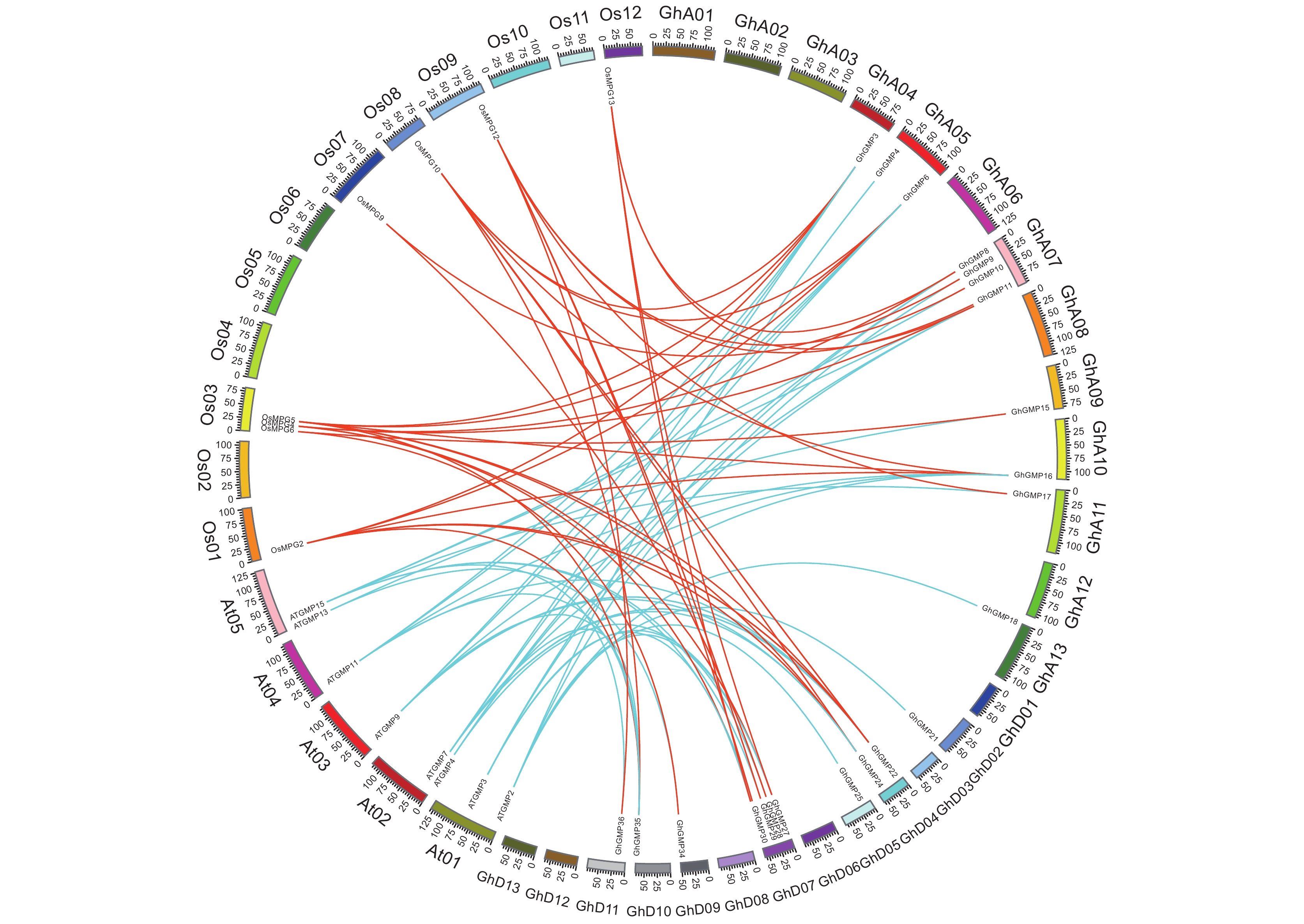
以拟南芥、水稻作为参考物种,分析陆地棉GMP家族基因的进化关系。由图2可知,陆地棉与拟南芥有22对直系同源基因,与水稻有18对直系同源基因。由此推断,陆地棉与拟南芥和水稻中的GMP基因可能由共同祖先基因组的进化产生,GMP基因家族进化演变可能不受被子植物分化传递至单子叶和双子叶植物过程的影响。
2.5 陆地棉GMP蛋白保守基序及基因结构分析
陆地棉中38个GMPs蛋白的序列保守程度较高,7个保守基序(Motif1~Motif7)中,包含Motif2(92.1%)、Motif4(94.7%)、Motif5(97.3%)和Motif6(89.5%)的基因最多。第1组12个陆地棉成员中有11个均只含有Motif2、Motif4、Motif5、Motif6,而GhGMP20缺少Motif6。第2组9个陆地棉成员中有8个均包含Motif1~Motif7,而GhGMP05只含有Motif4、Motif5。第3组17个成员中有10个均包含Motif1~Motif7,GhGMP01缺少Motif6,其余4个成员均包含Motif2、Motif4、Motif5、Motif6,而GhGMP22基因只含有Motif6,GhGMP23基因只含有Motif5(图3:A)。
基因结构分析结果表明(图3:B),GMPs含有2~15个外显子,GhGMP23和GhGMP05数目最少,分别为2和3个,大多数基因具有14个外显子。同组成员中个别基因的保守基序数量差异较大,且长度相似的基因其外显子的数量和长度也不相同。
2.6 陆地棉GMP基因家族的启动子分析
对陆地棉启动子的顺式元件进行分析,发现38个GMPs基因启动子主要包含与激素相关的顺式元件,如赤霉素响应元件(GARE-motif、TATC-box、P-box)、水杨酸响应元件(TCA-element、SARE)、脱落酸响应元件(ABRE)、茉莉酸甲酯响应元件(TGACG-motif、CGTCA-motif)、生长素响应元件(TGA-element、AuxRR-core)等;以及与胁迫相关的顺式元件,如防御和应激响应元件(TC-rich repeats)、低温反应响应元件(LTR)和干旱胁迫响应元件(MBS),此外还有类黄酮生物合成基因的调控元件(MBSI)。各GMP基因所含顺式作用元件在2~8个不等,脱落酸、茉莉酸甲酯相关的顺式作用元件数目最多。其中,GhGMP13、GhGMP17、GhGMP29、GhGMP32、GhGMP36、GhGMP37等6个基因所含脱落酸、茉莉酸甲酯顺势作用元件数量最多(附图2
3 )。这说明陆地棉GMP基因家族可能在植物生长发育及抵御非生物逆境胁迫中发挥作用。2.7 陆地棉GMP基因家族的表达分析
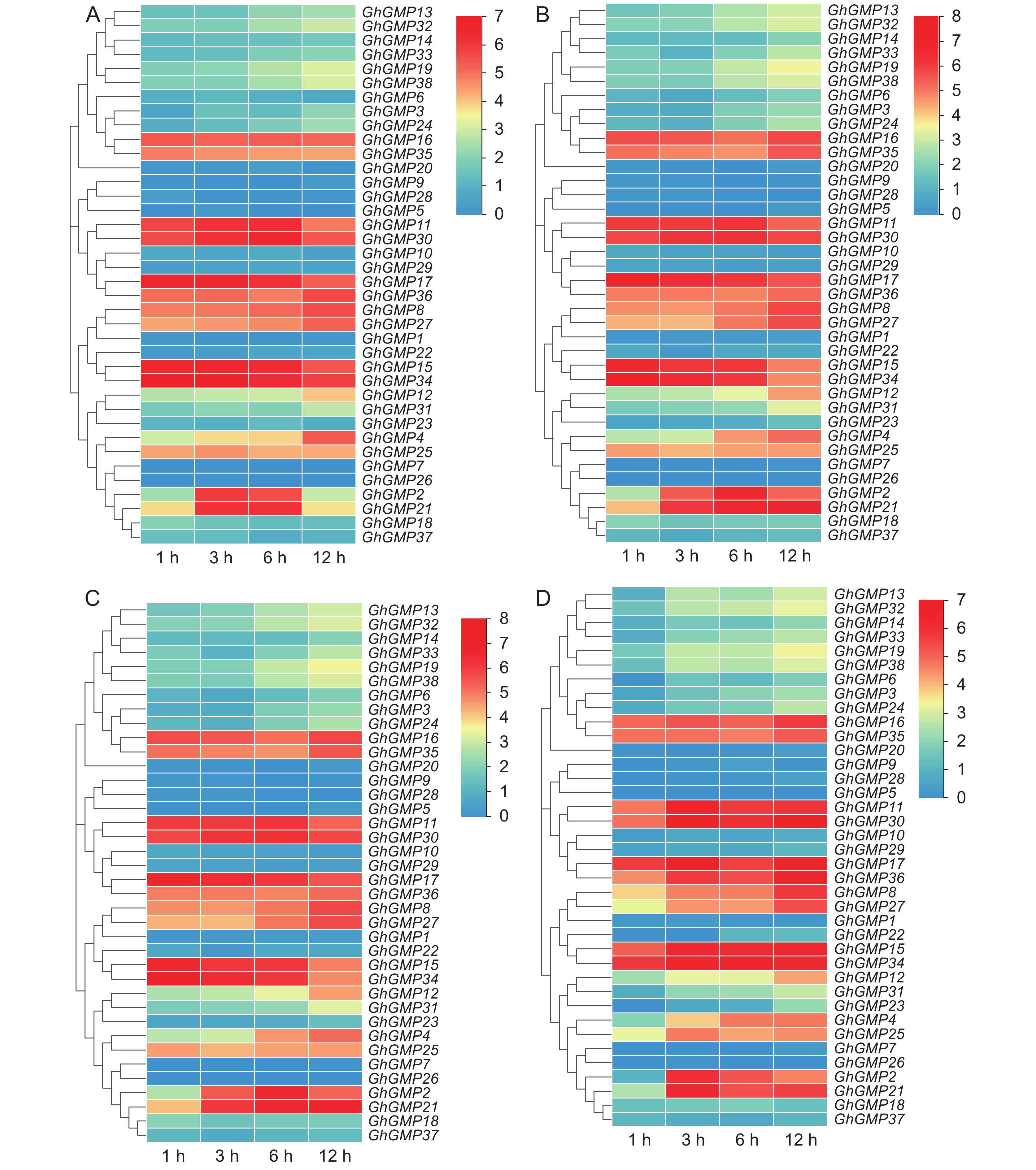
对38个GhGMPs基因的组织特异性表达进行分析,结果显示,正常生长条件下,不同基因在不同组织呈现不同的表达模式。GhGMP02、GhGMP08、GhGMP16、GhGMP17、GhGMP21、GhGMP27、GhGMP35和GhGMP36在不同组织中差异较大,且表达量较高,其中GhGMP02、GhGMP17、GhGMP21和GhGMP36在根、茎、叶、花托中均有表达,且在叶中表达量最高,其余基因则低表达,甚至不表达(附图3
4 )。不同非生物胁迫下的GMP家族基因表达情况分析结果表明, GhGMP08、GhGMP16、GhGMP25、GhGMP27、GhGMP35和GhGMP36的表达在干旱、冷、热胁迫不同时间后多呈升高趋势,冷胁迫后基因的表达趋势相反,但基因表达量较高。GhGMP11、GhGMP15、GhGMP17、GhGMP30和GhGMP34在不同非生物胁迫下持续高表达,且在花托和花萼等器官中的表达量高于其他组织。GhGMP02、GhGMP21呈先上升后下降的趋势,在干旱和热胁迫3 h、盐胁迫6 h后的表达量最高,且在叶片中的表达量最高。其余基因在非生物胁迫后表达量较低甚至不表达(图4)。
2.8 qRT-PCR分析
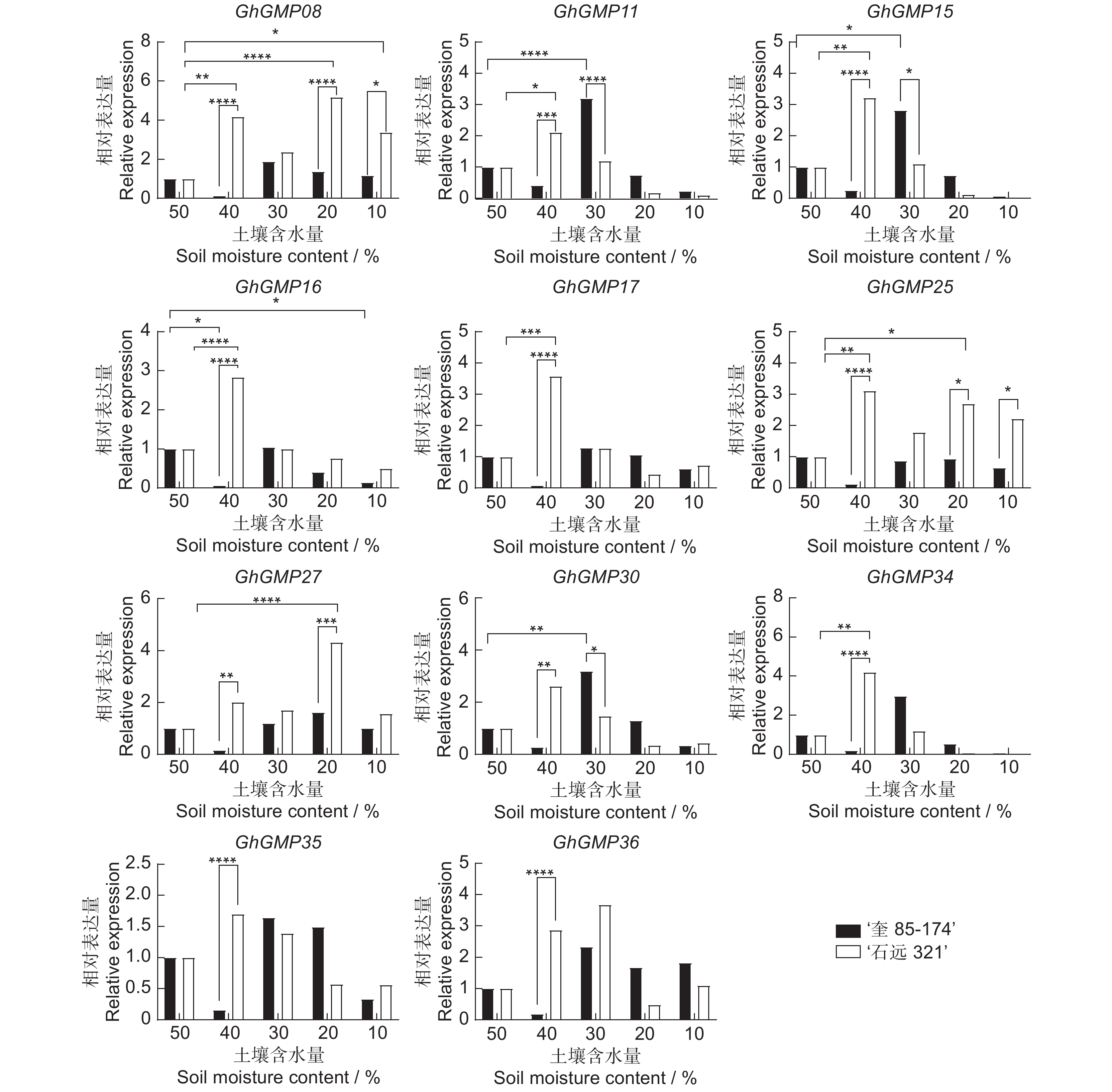
为了验证RNA-seq分析的准确性,选取干旱胁迫下表达变化明显且含干旱相关顺式作用元件最多的11个GhGMPs基因,对其在相同叶片部位的表达水平进行qRT-PCR分析。结果显示,干旱胁迫处理下,11个GhGMPs基因随着土壤含水量的递减,在干旱敏感材料‘奎85-174’叶片中的表达水平呈下降-上升-下降的变化趋势。在耐旱材料‘石远321’叶片中呈现先上升后下降的变化趋势。GhGMP08、GhGMP25、GhGMP27基因呈上升-下降-上升-下降的变化趋势,并在土壤含水量为40%和20%时显著高表达。相较于土壤含水量为50%(对照)时,‘奎85-174’中各基因在40%时的表达均显著降低,而‘石远321’与之相反。总体上,GMP基因在耐旱材料中的表达量高于干旱敏感材料(图5)。
3. 讨论
GMP基因的功能在多种植物中已有报道,但GMP基因家族相关研究却较少,在棉花中还未见报道。番茄(Solanum lycopersicum L.)[27]中发现了4个GMP基因家族成员,拟南芥和水稻中各有15和13个成员,而本研究从陆地棉、海岛棉、雷蒙德氏棉和亚洲棉中分别鉴定到38、38、19和18个GMP家族成员,共113个。各物种GMP家族成员数量差异较大,说明棉花同其他物种相比有较为明显的扩增。水稻[6]、芹菜[8]、白及(Bletilla striata (Thunb. ex Murray) Rchb. F)[28]等植物的GMP蛋白位于细胞质或线粒体中,本研究发现棉花GMP家族成员多位于叶绿体、细胞质或细胞核中,少数位于多个细胞器中,与前人的研究结果较为一致。拟南芥为双子叶植物,水稻为单子叶植物,本研究分析了水稻、拟南芥、棉花GMP家族成员的进化关系,并将其分为6个亚组。每个亚组中陆地棉和海岛棉在染色体相同位置的GMPs基因都紧密地聚集在一起,且每个亚组中陆地棉和海岛棉的基因数量基本上是雷蒙德式棉和亚洲棉的2倍左右,符合棉花物种的进化关系。对陆地棉GMP家族成员进行结构域分析,可将其分为3组,同一组中大部分成员具有相似的保守结构基序。第1组的GhGMP20仅缺少Motif6,第2组中GhGMP05则只含有Motif4、Motif5,第3组的GhGMP22只含有Motif6,而GhGMP23只含有Motif5。这说明该基因家族在棉花生长发育过程中可能发挥不同的功能。
研究表明,缺乏GDP-甘露糖焦磷酸化酶的拟南芥突变体其细胞壁生物合成存在严重缺陷,胚胎会停止发育[29]。在番茄[30]、马铃薯(Solanum tuberosum L.)[31]中增加GMP酶活性均可提高植物AsA含量,且番茄叶片中的AsA含量上升较多,此外,马铃薯叶片的色素含量及净光合速率显著增加,延缓了植株衰老。本研究发现陆地棉GMP基因启动子区含有生长发育及激素相关、逆境响应调控相关等顺式作用元件,其中GhGMP13、GhGMP17、GhGMP29、GhGMP32、GhGMP36和GhGMP37等6个基因所含脱落酸、茉莉酸甲酯相关顺式元件数量最多。这表明GMP基因家族可能参与棉花的生长发育调控,以及逆境胁迫响应。
茶(Camellia sinensis O. Ktze)[32]、番茄[33]、苹果(Malus domestica L.)[34]的GMP基因在不同组织中表达量具有差异,叶片中高于其他组织。水稻GMP同源蛋白在AsA合成中的不同作用可能与其转录水平和酶活性的差异有关[35]。这与本研究结果较为一致,GMP家族不同基因在陆地棉不同组织和不同非生物胁迫下的表达模式不同。qRT-PCR分析结果表明,11个陆地棉GhGMPs基因的表达随着土壤含水量的递减发生了明显变化,说明GhGMP蛋白家族可能与转录因子或者激酶互作,对干旱胁迫具有一定的响应或调控作用。我们推测GhGMP08、GhGMP11、GhGMP15、GhGMP16、GhGMP17、GhGMP25、GhGMP27、GhGMP30、GhGMP34、GhGMP35和GhGMP36可能是棉花响应非生物胁迫的关键基因,可进一步研究其功能特性。
1 如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。2 如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。3 如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。4 如需查阅附件内容请登录《植物科学学报》网站(http://www.plantscience.cn)查看本期文章。 -
表 1 引物序列
Table 1 Primer sequences
引物 Primer 序列 Sequence(5'→3') 引物 Primer 序列 Sequence(5'→3') GhGMP08qt-F GAGTTTGGGGAGTTGGTAGCAGATC GhGMP27qt-F GAGTTTGGGGAGTTGGTAGCAGATC GhGMP08qt-R ACCACAGTTGATTCGGTCACTTACG GhGMP27qt-R ACCACAGTTGATTCGGTCACTTACG GhGMP11qt-F TGATGGCTACTGGGAGGACATTGG GhGMP30qt-F TGCTTCTCTCAATCGTCACCTTTCC GhGMP11qt-R TCTGGCACTGGCTTCTTGGTAATTC GhGMP30qt-R GCCTCACCGCATCTGCTGTC GhGMP15qt-F GTGCCTCGGACTTCGGTCTAATG GhGMP34qt-F CGTGCCTCGGATTTCGGTCTAATG GhGMP15qt-R TGCTTTCAATTCTGCTCCCTTGGG GhGMP34qt-R TGCTTTCAATTCTGCTCCCTTGGG GhGMP16qt-F GGCTCTCAAGGCTGTTGGTGTAAG GhGMP35qt-F AATTGGTCCAGGCTGCGTTGTC GhGMP16qt-R CAGTGCCAAGCGGCTCAGTC GhGMP35qt-R GGTGGAATGCCATCCGATGATACTG GhGMP17qt-F GCTTGTCGTTCTCGGCGTCTG GhGMP36qt-F GCTTGTCGTTCTCGGCGTCTG GhGMP17qt-R ATTGAAGCAGTCCGTTCCGTTCG GhGMP36qt-R ATTGAAGCAGTCCGTTCCGTTCG GhGMP25qt-F CCTTCTCCCTCAATCGTCACTTAGC GhUBQ7qt-F GACCTACACCAAGCCCAAGAAG GhGMP25qt-R GCCTCACAGCATCAGCAGTTCC GhUBQ7qt-R TGAGCCCACACTTACCACAATAGT -
[1] 刘项. GDP-甘露糖焦磷酸化酶(GMPP)的原核表达与性质的表征[D]. 济南: 山东大学, 2008: 14-25. [2] Zakrzewska A,Palamarczyk G,Krotkiewski H,Zdebska E,Saloheimo M,et al. Overexpression of the gene encoding GTP:mannose-1-phosphate guanyltransferase,mpg1,increases cellular GDP-mannose levels and protein mannosylation in Trichoderma reesei[J]. Appl Environ Microbiol,2003,69 (8):4383−4389. doi: 10.1128/AEM.69.8.4383-4389.2003
[3] 俞乐,刘拥海,袁伟超,周丽萍,彭长连. 植物抗坏血酸积累及其分子机制的研究进展[J]. 植物学报,2016,51(3):396−410. doi: 10.11983/CBB15093 Yu L,Liu YH,Yuan WC,Zhou LP,Peng CL. Recent advances in the study of accumulation of ascorbic acid and its molecular mechanism in plants[J]. Chinese Bulletin of Botany,2016,51 (3):396−410. doi: 10.11983/CBB15093
[4] Zhao LN,Cao YB,Luo Q,Xu YL,Li N,et al. Overexpression of phosphomannomutase increases the production and bioactivities of Ganoderma exopolysaccharides[J]. Carbohydr Polym,2022,294:119828. doi: 10.1016/j.carbpol.2022.119828
[5] 王亚云. GDP-甘露糖焦磷酸化酶基因OsVTC1-1和OsVTC1-3在水稻抗坏血酸合成与胁迫应答中的功能研究[D]. 北京: 中国农业科学院, 2016: 26-37. [6] Kumar R,Mustafiz A,Sahoo KK,Sharma V,Samanta S,et al. Functional screening of cDNA library from a salt tolerant rice genotype Pokkali identifies mannose-1-phosphate guanyl transferase gene (OsMPG1) as a key member of salinity stress response[J]. Plant Mol Biol,2012,79 (6):555−568. doi: 10.1007/s11103-012-9928-8
[7] Liu YH,Wang H,Liu JX,Shu S,Tan GF,et al. AgGMP encoding GDP-D-mannose pyrophosphorylase from celery enhanced the accumulation of ascorbic acid and resistance to drought stress in Arabidopsis[J]. PeerJ,2022,10:e12976. doi: 10.7717/peerj.12976
[8] Badejo AA,Tanaka N,Esaka M. Analysis of GDP-D-mannose pyrophosphorylase gene promoter from acerola (Malpighia glabra) and increase in ascorbate content of transgenic tobacco expressing the acerola gene[J]. Plant Cell Physiol,2008,49 (1):126−132. doi: 10.1093/pcp/pcm164
[9] 张钊,田迎春. 棉花精量播种高产技术要点[J]. 现代农村科技,2019(9):15−16. [10] 国家统计局. 国家统计局关于2021年棉花产量的公告[EB/OL]. (2021-12-14)[2022-09-05]. https://www.gov.cn/xinwen/2021-12/14/content_5660705.htm. [11] 黄静,张运,汪明秀,王芳,汤志,何好. 近17年新疆干旱时空分布特征及影响因素[J]. 生态学报,2020,40(3):1077−1088. Huang J,Zhang Y,Wang MX,Wang F,Tang Z,He H. Spatial and temporal distribution characteristics of drought and its relationship with meteorological factors in Xinjiang in last 17 years[J]. Acta Ecologica Sinica,2020,40 (3):1077−1088.
[12] 蔡焕杰,邵光成,张振华. 荒漠气候区膜下滴灌棉花需水量和灌溉制度的试验研究[J]. 水利学报,2002(11):119−123. doi: 10.13243/j.cnki.slxb.2002.11.022 Cai HJ,Shao GC,Zhang ZH. Water demand and irrigation scheduling of drip irrigation for cotton under plastic mulch[J]. Journal of Hydraulic Engineering,2002 (11):119−123. doi: 10.13243/j.cnki.slxb.2002.11.022
[13] Zhu T,Liang CZ,Meng ZG,Sun GQ,Meng Z,et al. CottonFGD:an integrated functional genomics database for cotton[J]. BMC Plant Biol,2017,17 (1):101. doi: 10.1186/s12870-017-1039-x
[14] Howe KL,Contreras-Moreira B,de Silva N,Maslen G,Akanni W,et al. Ensembl Genomes 2020-enabling non-vertebrate genomic research[J]. Nucleic Acids Res,2020,48 (D1):D689−D695. doi: 10.1093/nar/gkz890
[15] Lu SN,Wang JY,Chitsaz F,Derbyshire MK,Geer RC,et al. CDD/SPARCLE:the conserved domain database in 2020[J]. Nucleic Acids Res,2020,48 (D1):D265−D268. doi: 10.1093/nar/gkz991
[16] Wilkins MR, Gasteiger E, Bairoch A, Sanchez JC, Williams KL, et al. Protein identification and analysis tools in the ExPASy server[M]//Link AJ, ed. 2-D Proteome Analysis Protocols. Totowa: Humana, 1999, 112: 531-552.
[17] Kumar S,Stecher G,Li M,Knyaz C,Tamura K. MEGA X:molecular evolutionary genetics analysis across computing platforms[J]. Mol Biol Evolut,2018,35 (6):1547−1549. doi: 10.1093/molbev/msy096
[18] Subramanian B,Gao SH,Lercher MJ,Hu SN,Chen WH. Evolview v3:a webserver for visualization,annotation,and management of phylogenetic trees[J]. Nucleic Acids Res,2019,47 (W1):W270−W275. doi: 10.1093/nar/gkz357
[19] Chen CJ,Chen H,Zhang Y,Thomas HR,Frank MH,et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Mol Plant,2020,13 (8):1194−1202. doi: 10.1016/j.molp.2020.06.009
[20] Yu J,Jung S,Cheng CH,Ficklin SP,Lee T,et al. CottonGen:a genomics,genetics and breeding database for cotton research[J]. Nucleic Acids Res,2014,42 (D1):D1229−D1236. doi: 10.1093/nar/gkt1064
[21] Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ. Basic local alignment search tool[J]. J Mol Biol,1990,215 (3):403−410. doi: 10.1016/S0022-2836(05)80360-2
[22] Wang Y,Tang H,Debarry JD,Tan X,Li J,et al. MCScanX:a toolkit for detection and evolutionary analysis of gene synteny and collinearity[J]. Nucleic Acids Res,2012,40 (7):e49. doi: 10.1093/nar/gkr1293
[23] Bailey TL,Boden M,Buske FA,Frith M,Grant CE,et al. MEME SUITE:tools for motif discovery and searching[J]. Nucleic Acids Res,2009,37 (S2):W202−W208.
[24] Lescot M,Déhais P,Thijs G,Marchal K,Moreau Y,et al. PlantCARE,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Res,2002,30 (1):325−327. doi: 10.1093/nar/30.1.325
[25] Zhang TZ,Hu Y,Jiang WK,Fang L,Guan XY,et al. Sequencing of allotetraploid cotton (Gossypium hirsutum L. acc. TM-1) provides a resource for fiber improvement[J]. Nat Biotechnol,2015,33 (5):531−537. doi: 10.1038/nbt.3207
[26] Livak KJ,Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the
2−ΔΔCT method[J]. Methods,2001,25 (4):402−408. doi: 10.1006/meth.2001.1262[27] Zhang CJ,Ouyang B,Yang CX,Zhang XH,Liu H,et al. Reducing AsA leads to leaf lesion and defence response in knock-down of the AsA biosynthetic enzyme GDP-D-mannose pyrophosphorylase gene in tomato plant[J]. PLoS One,2013,8 (4):e61987. doi: 10.1371/journal.pone.0061987
[28] 许娟,石云平,韦绍龙,苏祖祥,林茜,等. 白及GMP基因cDNA全长克隆及生物信息学分析[J]. 西南农业学报,2018,31(6):1104−1110. Xu J,Shi YP,Wei SL,Su ZX,Lin Q,et al. Cloning and bioinformatics analysis of GMP gene in Bletilla striata[J]. Southwest China Journal of Agricultural Sciences,2018,31 (6):1104−1110.
[29] Lukowitz W,Nickle TC,Meinke DW,Last RL,Conklin PL,Somerville CR. Arabidopsis cyt1 mutants are deficient in a mannose-1-phosphate guanylyltransferase and point to a requirement of N-linked glycosylation for cellulose biosynthesis[J]. Proc Natl Acad Sci USA,2001,98 (5):2262−2267. doi: 10.1073/pnas.051625798
[30] Cronje C,George GM,Fernie AR,Bekker J,Kossmann J,Bauer R. Manipulation of L-ascorbic acid biosynthesis pathways in Solanum lycopersicum:elevated GDP-mannose pyrophosphorylase activity enhances L-ascorbate levels in red fruit[J]. Planta,2012,235 (3):553−564. doi: 10.1007/s00425-011-1525-6
[31] 林玲玲. GDP-D-甘露糖焦磷酸化酶基因(GMPase)在马铃薯中的功能分析[D]. 泰安: 山东农业大学, 2009: 29-42. [32] 肖瑶,周天山,李佼,张佳欣,余有本. 茶树GDP-D-甘露糖焦磷酸化酶基因cDNA全长的克隆与表达分析[J]. 茶叶科学,2015,35(1):55−63. doi: 10.13305/j.cnki.jts.2015.01.010 Xiao Y,Zhou TS,Li J,Zhang JX,Yu YB. Cloning and expression analysis of GDP-D-mannose pyrophosphorylase cDNA in Camellia sinensis[J]. Journal of Tea Science,2015,35 (1):55−63. doi: 10.13305/j.cnki.jts.2015.01.010
[33] 王华森. 番茄叶片GDP-甘露糖焦磷酸化酶基因(GMPase)的cDNA克隆及功能分析[D]. 泰安: 山东农业大学, 2007: 61-62. [34] 夏惠,张敏,马锋旺. 苹果GMP、GME和GGP基因的克隆与表达分析[J]. 西北农林科技大学学报(自然科学版),2014,42(3):191−196. Xia H,Zhang M,Ma FW. Cloning and expression analysis of GMP,GME and GGP genes in apple[J]. Journal of Northwest A& F University (Natural Science Edition)
,2014,42 (3):191−196. [35] Qin H,Deng ZA,Zhang CY,Wang YY,Wang J,et al. Rice GDP-mannose pyrophosphorylase OsVTC1-1 and OsVTC1-3 play different roles in ascorbic acid synthesis[J]. Plant Mol Biol,2016,90 (3):317−327. doi: 10.1007/s11103-015-0420-0
-
其他相关附件
-
PDF格式
2023年 5期 付锦程 附件 点击下载(1609KB)
-



 下载:
下载: