Research progress in plant Trehalose-6-phosphate synthase genes
-
摘要:
海藻糖-6-磷酸代谢通路是植物响应非生物胁迫生理调控网络中的重要组成部分,海藻糖-6-磷酸合成酶基因TPS(Trehalose-6-phosphate synthase)是植物合成海藻糖的关键基因。为了更加充分地理解TPS基因在植物应答非生物胁迫、调节开花时间等方面的作用,本文首先对植物TPS基因家族成员的系统进化关系及序列结构信息进行了研究,重点论述了TPS基因在植物响应干旱、盐害、高温、低温胁迫中的调控功能及分子作用机制,最后对TPS基因参与植物开花调控的研究进展进行了综述。本文深入总结了目前植物TPS基因响应非生物胁迫及开花调控的研究进展,并对今后TPS同源基因的研究方向和应用价值进行了展望。
-
关键词:
- 海藻糖-6-磷酸合成酶基因 /
- 非生物胁迫 /
- 开花调控
Abstract:The trehalose-6-phosphate metabolic pathway is an important component of the plant physiological regulation network in response to abiotic stress. Trehalose-6-phosphate synthase (TPS) is a key gene for trehalose synthesis in plants. To better understand the role of the TPS gene in plant response to abiotic stress and regulation of flowering time, this study presents an overview of current information on the phylogenetics and sequence structure of plant TPS gene family members, as well as the regulatory function and molecular mechanism of TPS in plant responses to drought, salt damage, high temperature, and low temperature stress, and research progress regarding its effects on plant flowering regulation. This study presents a comprehensive summary of research progress on the TPS gene in response to abiotic stress and flowering regulation, while also providing future research directions and potential applications of TPS homologs.
-
海藻糖是由两个吡喃型葡萄糖单体通过α、α-1、1-糖苷键连接而成的非还原性双糖,存在于细菌、酵母、真菌、植物、无脊椎动物、藻类等多种生物体内[1, 2]。海藻糖最早在一些细菌和耐旱的低等维管植物中被发现,如卷柏(Selaginella lepidophylla Hook. & Grev.),在干旱的条件下,卷柏会积累大量的海藻糖,并能保持数年的代谢休眠的假死状态,直到环境湿度增加,它们又可复活[3]。
海藻糖是一种典型的应激代谢物。当一种生物在适宜的条件下生长时,它不会积累海藻糖,但当处于胁迫状态(饥饿、干旱、高温和盐碱)时,海藻糖会迅速积累[4, 5]。海藻糖化学性质非常稳定,即使在高温和酸性条件下也不容易发生分解反应;同时海藻糖缺乏与形成糖苷键有关的还原性末端,使其不易发生美拉德反应;它还能够形成一种玻璃状结构,可以在缺水或低温条件下稳定蛋白质和膜中的脂质,这说明海藻糖具有很强的抗脱水作用,能够保护生物结构免受高温、干旱以及高盐碱等非生物胁迫损伤[2, 6]。
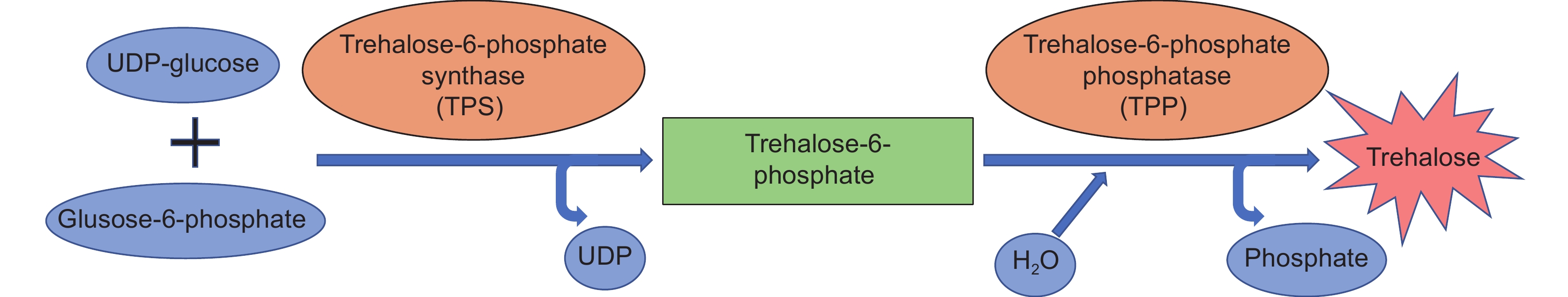
目前已知的海藻糖体内生物合成途径有5种,在植物中存在的途径为TPS-TPP途径(图1),包括两步反应:首先由海藻糖-6-磷酸合成酶(Trehalose-6-phosphate synthase, TPS)催化UDP-葡萄糖和葡萄糖-6-磷酸合成海藻糖-6-磷酸(Trehalose-6-phosphate,T6P),然后再由海藻糖-6-磷酸磷酸酶(Trehalose-6-phosphate phosphatase,TPP)催化T6P脱磷酸生成海藻糖[3, 7]。早期研究者认为更高等的维管植物失去了合成海藻糖的能力,直到基因测序等更精准的实验技术的使用,发现高等植物能够合成少量的海藻糖,并且存在大量同源的功能性海藻糖合成酶基因[7]。
海藻糖的生物合成途径存在于所有植物中,TPS基因已在主要植物类群中被鉴定[1,8]。目前已经在水稻(Oryza sativa L.)、小麦(Triticum aestivum L.)、玉米(Zea mays L.)、陆地棉(Gossypium hirsutum L.)、木薯(Manihot esculenta Crantz)等多种作物中通过转基因实验证明TPS基因能够响应高温、干旱、盐碱等多种非生物胁迫,提高植物的耐逆性[3]。还有研究表明TPS基因在植物开花调控中发挥着重要作用[9, 10]。本文综述了近年来发现的植物TPS基因家族序列的进化和结构信息,以及TPS同源基因在植物非生物胁迫和开花调控中的作用,并对将来如何利用分子生物学方法改良经济作物的抗逆性和生育期进行了展望。
1. 植物TPS基因家族系统进化及序列结构
1993年,De Virgilio等[11]在酿酒酵母中发现了编码TPS和TPP这两种酶的基因TPS1和TPS2。此前,Kassen等[12]克隆出了在大肠杆菌中编码海藻糖-6-磷酸合成酶(OtsA)和海藻糖-6-磷酸磷酸酶(OtsB)的两个基因otsA和otsB。后经研究发现,大肠杆菌中的OtsA和OtsB与酿酒酵母中的TPS和TPP具有同源性,大肠杆菌中的otsA和otsB基因分别对应酵母中的TPS1和TPS2基因[13]。植物中的TPS基因最先在拟南芥(Arabidopsis thaliana (L.) Heynh.)中被鉴定。1998年Blázquez等[14]利用拟南芥的cDNA文库克隆了AtTPS1基因,该基因编码拟南芥中的TPS酶,其表达可恢复酵母tps1突变体合成海藻糖的能力。
植物中的TPS基因常以基因家族的形式出现,根据基因家族成员氨基酸序列的保守结构域不同,被分为两个亚类。Ⅰ类TPS基因和Ⅱ类TPS基因分别与酵母TPS1基因和TPS2基因同源[14, 15]。虽然酵母TPS2基因在酵母中具有TPP酶催化活性,但植物中的Ⅱ类TPS基因大多没有编码TPS催化酶或TPP催化酶的能力。推测植物Ⅱ类TPS基因曾经有编码TPP酶的能力,但随着植物原生TPP基因的出现,植物的Ⅱ类TPS基因开始进化出了新的功能,植物也进化出了单独的TPP基因家族来编码TPP酶[7]。拟南芥的TPS基因家族有11个TPS基因成员(AtTPS1 ~ AtTPS11),Ⅰ类TPS蛋白(AtTPS1 ~ AtTPS4)具有一个保守度较高的N端TPS-like结构域和一个保守度低的C端TPP结构域。其中3个基因AtTPS1、AtTPS2和AtTPS4已经被证明可以和酵母tps1突变体互补,编码具有催化活性的TPS酶[16]。但AtTPS3很可能是一个假基因[17]。更引人注目的是,AtTPS1是唯一具有N端延伸结构域的Ⅰ类蛋白,其N端延伸域可能作为一个自抑制域发挥作用。Ⅱ类TPS蛋白(AtTPS5 ~ AtTPS11)也是一个双结构域蛋白,具有一个N端TPS-like结构域和一个C端保守性较高的TPP结构域。在Delorge等[16]和Ramon等[18]的研究中,没有一个Ⅱ类AtTPS蛋白被证明可以与酵母tps1突变体互补或在体外具有TPS或TPP催化活性。不过研究表明Ⅱ类AtTPS基因与拟南芥响应生物和非生物胁迫以及生长发育等相关,如AtTPS5参与拟南芥的耐热反应,AtTPS6可以控制细胞的形态发生[18-20]。在辣木(Moringa oleifera Lam.)的8个TPS基因(MoTPS1 ~ MoTPS8)中,只有MoTPS1表现出TPS活性,属于Ⅰ类的MoTPS1和 MoTPS2与生殖发育密切相关,而Ⅱ类MoTPS基因与根、茎、叶的耐热性相关[21]。水稻中有11个TPS基因(OsTPS1 ~ OsTPS11),其中属于Ⅰ类TPS基因只有OsTPS1,能够编码具有催化活性的TPS蛋白[22]。
近年来,越来越多的植物基因组数据库的建立为分析和研究植物基因家族提供了有利条件,多种植物的TPS基因陆续被鉴定出来。单子叶植物玉米TPS基因家族有12个成员(ZmTPS1 ~ ZmTPS12),ZmTPS1属于Ⅰ类,ZmTPS2 ~ ZmTPS12属于Ⅱ类,在这些基因中,ZmTPS1和ZmTPS3编码的蛋白具TPS活性,ZmTPS3和ZmTPS4编码的蛋白具TPP活性[23]。大豆(Glycine max (L.) Merr.)中有20个TPS基因(GmTPS1 ~ GmTPS20),其中属于Ⅰ类基因的有GmTPS1 ~ GmTPS4和GmTPS20,属于Ⅱ类基因的有GmTPS5 ~ GmTPS19[24]。在双子叶植物白杨(Populus tomentosa Carr.)中共有13个TPS基因(PtTPS1 ~ PtTPS13),其中PtTPS1 、PtTPS4和PtTPS10属于Ⅰ类,其他属于Ⅱ类[25]。此外,在小麦[26]、荷花(Nelumbo nucifera Gaertn.)[27]、马铃薯(Solanum tuberosum L.)[28]、甘蔗(Saccharum officinarum L.)[29]、黄瓜(Cucumis sativus L.)[30]、新铁炮百合(Lilium × formolongi I.)[31] 和大麻(Cannabis sativa L.)[32]中分别有12、9、8、9、7、9和10个TPS基因。可见,不同植物的TPS基因的家族成员数具有差异,TPS基因成员的数量在单子叶和双子叶植物中存在分化的现象。
2. TPS基因响应植物非生物胁迫的调控作用
2.1 干旱胁迫
干旱影响植物的正常生长,导致植物减产。海藻糖是植物响应外界环境变化的代谢产物之一,对植物有很好的抗逆保护作用。植物体内海藻糖的代谢过程受逆境调节,逆境条件下,TPS基因的表达受到诱导,可促进海藻糖的合成,提高植物的抗逆性。干旱可以诱导陆地棉和葡萄(Vitis vinifera L.)部分TPS基因的表达,使海藻糖积累增加,表明TPS基因参与了植物抗旱[33, 34]。Yang等[35]分析了梅花(Prunus mume Siebold & Zucc.)PmTPS基因家族成员在干旱条件下的表达模式,发现PmTPS基因家族在梅花响应干旱胁迫中发挥了重要调控作用。Yeo等[36]将酿酒酵母的TPS1基因转入马铃薯中,获得了更加抗旱的转基因马铃薯。Li等[37]培育了过表达OsTPS1的转基因水稻株系,发现转基因水稻的耐旱性获得了增加。还有研究在烟草(Nicotiana tabacum L.)中过表达了木薯MeTPS1基因,植株的海藻糖积累显著增加,烟草的抗旱性得到了提高[38]。
TPS基因的过表达,不仅可以增加植物体内海藻糖的积累,还会引起植物体内其他生理代谢的变化。Stiller等[39]将酵母TPS1基因导入马铃薯,在干旱胁迫条件下,转基因植株的气孔密度比野生型植株减少30% ~ 40%。Liu等[40]在干旱条件下统计分析出转酵母TPS1基因玉米的存活率比野生型玉米(WT)高70%,其气孔密度比WT要减少20%。
2.2 盐碱胁迫
海藻糖是一种重要的渗透调节物质,植物可以利用海藻糖来维持渗透势以抵抗盐碱胁迫。盐处理时,小麦的TPS活性增强,海藻糖含量增加[41]。盐胁迫能促进蒺藜苜蓿(Medicago truncatula L.)中5个MtTPS家族基因的上调表达,这5个MtTPS基因可能在蒺藜苜蓿抵御盐胁迫上具有重要调控作用[42]。将拟南芥的AtTPS1基因转入烟草,获得的转基因烟草种子在盐胁迫下的发芽率显著高于野生型烟草种子(表1)[43]。在水稻中,OsTPS1的过表达可提高植株的耐盐碱性,OsTPS8基因的过表达也可使转基因水稻植株的耐盐性提高[37, 44]。Jiang等[45]从番薯(Ipomoea batatas (L.) Lam.)中分离出一个IbTPS基因,并将其导入了烟草,在盐胁迫下,转基因烟草体内的海藻糖和脯氨酸含量的积累明显高于野生型烟草,相关耐逆基因的表达上调,转基因烟草的耐盐性显著高于对照(表1)。在过表达了西瓜(Citrullus lanatus (Thunb.) Matsum. & Nakai)ClTPS3基因的拟南芥植株中,海藻糖含量及超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性显著提高,该转基因植株的耐盐性提高(表1)[46]。
表 1 植物TPS基因家族的鉴定和功能验证情况Table 1. Identification and functional verification of TPS gene family in plants植物种类
Plant speciesTPS基因成员数
No. of TPS family members转入基因
Transferred genes启动子
Promoter转化植物
Transformed plant主要效应
Main effects文献
Reference苹果 Malus pumila Mill. 13 无 无 无 无 [10] 白杨 Populus tomentosa Carr. 13 无 无 无 无 [25] 荷花 Nelumbo nucifera Gaertn. 9 无 无 无 无 [27] 马铃薯 Solanum tuberosum L. 8 无 无 无 无 [28] 甘蔗 Saccharum officinarum L. 9 无 无 无 无 [29] 黄瓜 Cucumis sativus L. 7 无 无 无 无 [30] 大麻 Cannabis sativa L. 10 无 无 无 无 [32] 葡萄 Vitis vinifera L. 11 无 无 无 无 [34] 梅 Prunus mume Siebold & Zucc. 9 无 无 无 无 [35] 水稻 Oryza sativa L. 11 OsTPS1 Actin 1 水稻 提高了植株对低温、高盐、干旱等胁迫的耐受性 [37] 木薯 Manihot esculenta Crantz 12 MeTPS1 Ca MV35S 烟草 根茎叶中海藻糖积累增加,对干旱的耐受性增强 [38] 蒺藜苜蓿 Medicago truncatula L. 11 无 无 无 无 [42] 拟南芥 Arabidopsis thaliana (L.) Heynh. 11 AtTPS1 Ca MV35S 烟草 对干旱和高、低温的耐受性增强 [43] AtTPS1 35S 拟南芥 更耐脱水,抗性提高,对葡萄糖和脱落酸不敏感 [54] 番薯 Ipomoea batatas (L.) Lam. 1 IbTPS1 Ca MV35S 烟草 海藻糖和脯氨酸含量增加,耐盐性增强 [45] 西瓜 Citrullus lanatus (Thunb.) Matsum. & Nakai 7 ClTPS3 Ca MV35S 拟南芥 耐盐性显著增强 [46] 番茄 Solanum lycopersicum L. 11 无 无 无 无 [49] 大白菜 Brassica campestris L. 15 无 无 无 无 [50] 小麦 Triticum aestivum L. 12 TaTPS11 Ca MV35S 拟南芥 抗寒性增强 [53] 月季 Rosa chinensis Jacq. 9 无 无 无 无 [55] 新铁炮百合 Lilium × formolongi I. 9 LfTPS1/3/5 Ca MV35S 拟南芥 开花提前 [56] 辣木 Moringa oleifera Lam. 8 MoTPS1/2 无 拟南芥 开花提前 [57] 小桐子 Jatropha curcas L. 1 JcTPS1 Ca MV35S 拟南芥 开花提前 [58] 2.3 高温胁迫
高温胁迫容易对植物生长发育造成不可逆转的伤害。高温处理使拟南芥中AtTPS5基因的表达上调,植株耐热性增强,tps5突变体则耐热性降低[20]。Miranda等[47]将来自酵母的具有TPS和TPP酶活性的融合基因TPS1-TPS2转入拟南芥,提高了拟南芥的耐热性。大肠杆菌海藻糖-6-磷酸合成酶/磷酸酶融合基因(TPSP)在番茄(Solanum lycopersicum L.)中过表达,提高了番茄种子的海藻糖含量。在高温处理下,相较于野生型种子,转TPSP基因的番茄种子的发芽率显著增高、各种热胁迫应答基因的表达增强,种子耐热性提高[48]。研究表明,番茄自身的SlTPS基因也受高温的诱导,SlTPS基因在番茄适应热胁迫上发挥重要的作用[49]。庞强强等[50]从大白菜(Brassica campestris L.)基因组中鉴定出了15个TPS基因(BrTPS1 ~ BrTPS15),分析了这些基因在连续高温处理时不同组织部位的表达情况,发现BrTPS基因的表达存在时空差异性,并证实BrTPS1、BrTPS2、BrTPS8和BrTPS11这4个基因能够响应高温胁迫。
2.4 低温胁迫
低温寒害是植物中最常见的灾害之一。低温胁迫下,植物的细胞膜最先受到破坏,然后引起一系列生理和生化变化[51-58]。海藻糖具有很大的水合体积能够保护细胞中蛋白质免受低温造成的变性和不稳定性,是细胞膜质和蛋白质的有效的保护剂。冬小麦越冬的主要部位是其根茎,在冷冻条件下,外源施加海藻糖可以促进‘东农冬麦1号’的根、茎中TaTPS1、TaTPS3、TaTPS7 ~ TaTPS9这几个基因上调表达,说明这几个基因对‘东农冬麦1号’的抗寒性起到重要的作用[51]。低温诱导促使茶(Camellia sinensis (L.) O. Ktze.)老叶和嫩叶中的CsTPS基因上调程度明显大于根系,表明CsTPS基因可能参与了茶抗寒调控过程[52]。Lin等[53]将小麦TaTPS11基因转入拟南芥,得到的转基因植株耐寒性提高(表1)。研究表明,水稻中OsTPS1基因的过表达有利于提高植株对低温的抵御能力。低温条件下,纯合T3代转基因水稻高表达系(25-3-9、51-6-3)和低表达系(39-5-1)的存活率分别为79.17%、89.58%和12.5%,均高于野生型植株的存活率(4.17%)(表1)[37]。
3. TPS基因参与植物逆境胁迫的分子机制
研究表明,糖信号通路在植物抵御非生物胁迫过程中发挥着重要作用。海藻糖-6-磷酸通路是糖信号通路的重要组成部分,也参与了植物逆境胁迫信号转导及次生代谢产物调控过程[59]。海藻糖是植物重要的应激代谢物,可以保护细胞膜和大分子物质的稳定性。通过TPS基因的表达来调控海藻糖代谢通路,增加植物体内海藻糖含量,可以提高植物对多种非生物胁迫的抵抗能力。在部分研究中,TPS基因的表达只引起海藻糖的少量积累,还不足以作为渗透胁迫物质来提高植物抗性,推测海藻糖的少量增加可能作为信号物质响应逆境胁迫。植物合成海藻糖的中间产物T6P在调节植物体内蔗糖的含量和运输方面具有重要作用[60]。有研究指出,在海藻糖代谢通路中,不是海藻糖,而是T6P含量的变化,提高了植物的抗逆性。T6P能够和蔗糖非发酵相关激酶1(Sucrose non-fermenting related kinase-1,SnRK1)相互作用,调节植物碳的分配和利用,促使植物能在逆境下存活[61]。
此外,TPS基因对非生物胁迫的响应与其启动子中含有受逆境诱导的元件相关。水稻中大多数OsTPS基因,特别是OsTPS1基因启动子中含有被非生物胁迫调控的顺式调控元件,这些顺式调控元件使OsTPS基因在环境胁迫条件下的表达量增加,从而提高植物在胁迫条件下的生存能力[62]。高温胁迫下月季(Rosa chinensis Jacq.)RcTPS7b的表达显著提高,研究者在RcTPS7b基因启动子中发现多个脱落酸(ABA)响应元件,认为RcTPS7b基因可能参与了抗热应激ABA信号转导途径[55]。过表达TPS基因的植物会诱导逆境胁迫相关通路的基因,包括参与ABA和葡萄糖合成信号通路的基因高表达,促使防御系统响应非生物胁迫,从而提高植物的抗性[54]。
花青素可以降低细胞渗透势和冰点,帮助植物适应逆境。研究表明,TPS1基因的表达可以影响花青素合成调控基因的表达来提高花青素的含量。干旱胁迫条件下,转酵母TPS1基因促进了玉米中花青素积累,提高了植株的抗旱性[63]。此外,研究发现,TPS基因还可以调控气孔密度、调节影响气孔发生的基因SDD1(Stomata density and distribution 1)的表达,TPS1基因通过降低气孔密度和降低转基因玉米植株的蒸腾速率提高了玉米的抗旱性[39, 40]。
植物体内存在多种渗透调节物质,如甜菜碱、脯氨酸和可溶性蛋白等。研究表明,TPS基因的过表达可以增加脯氨酸、可溶性蛋白的含量,提高植物的耐盐性[37, 45]。木质素的沉积可以作疏水屏障阻止离子进入植物木质部,减少盐胁迫对植物组织的破坏[64]。Vishal等[44]研究认为过表达OsTPS8的转基因水稻株系的耐盐性得到显著提高主要是由于OsTPS8通过ABA信号促进了水稻木质素沉积。
拟南芥中AtTPS5缺乏的突变体具有热敏性,AtTPS5基因的表达受耐热调节基因MBF1c (Multiprotein bridging factor 1c)的调控,并且二者相互作用,但二者互作激发的下游耐热机制还有待研究[20]。蔗糖代谢与植物抵抗低温胁迫密切相关。小麦TaTPS11基因的超量表达可以正向调控与蔗糖合成和分解代谢相关的基因SPS(Sucrose phosphate synthase)、SuSy(Sucrose synthase)和INV(Invertase)的表达,影响植物的蔗糖代谢,提高植物的耐寒性[53]。
4. TPS基因在植物开花调控中的研究进展及作用机制
许多高等植物的TPS基因通过年龄效应途径调控开花时间。研究发现,即使在其他因素的诱导下,AtTPS1基因的缺失还是会导致拟南芥开花延迟,表明AtTPS1基因具有正向调控拟南芥开花的作用[9]。AtTPS1基因可以通过促进叶片和茎尖中的几个关键成花整合子的表达来调控开花时间。在叶片中,TPS1能够诱导开花调控途径中的成花素基因FT(Flowering locus T)表达,使植物提前启动开花;在茎尖中,TPS1则可通过调节年龄效应途径中SPL(Squamosa promoter binding protein-like)基因的表达,参与植物的开花启动[9]。植物miR156(microRNA156)可以抑制SPL基因的表达,通过年龄途径参与调控植物开花。研究发现,新铁炮百合中LfTPS1/3/5基因在拟南芥中过表达,促进拟南芥早花且miR156含量下降,这表明LfTPS基因可能通过抑制miR156来促进开花(表1)[56]。
碳水化合物是调控植物成花转变的重要物质,T6P的含量是反映植物体内碳水化合物含量水平的重要指标,是参与开花调控的重要信号分子。Gabriel等[65]的研究结果表明,可以通过调控海藻糖-6-磷酸代谢通路影响甘蔗中可溶性糖的分布。T6P可以作为信号分子参与调节蔗糖的供应,影响植物开花[8]。研究证明,在成花诱导开始前外源施加蔗糖可显著提高苹果(Malus pumila Mill.)花的产量。在蔗糖处理后,苹果中MdTPS1、MdTPS2、MdTPS4、MdTPS10和MdTPS11的表达迅速显著上调,开花相关基因SPL、FT1和AP1(Apetala1)的表达水平也随之增加,因此苹果MdTPS家族成员可能通过糖代谢通路影响花芽诱导和开花时间[10]。Lin等[57]研究发现在拟南芥中过表达辣木MoTPS1和MoTPS2基因,能够促进拟南芥在短日照条件下提前开花,说明MoTPS1和MoTPS2基因具有促进开花的功能(表1)。此外,赵美丽等[58]克隆了小桐子(Jatropha curcas L.)中的JcTPS1基因,其在拟南芥中超表达可促使拟南芥提前开花(表1)。
5. 展望
综上所述,TPS基因家族在植物响应逆境胁迫方面有重要作用,并且某些TPS基因成员还参与了植物开花时间调控过程。目前至少有24种高等植物已经开展了TPS基因家族的研究,为利用TPS基因进行植物耐逆分子育种提供了一定的理论基础。但目前植物TPS基因家族研究还存在以下尚未解决的问题。
首先,转基因植物中TPS基因的过表达能明显地提高植物的抗逆能力,但过表达某些微生物的TPS基因对植物的生长发育有一定的影响[66, 67]。大肠杆菌otsA和otsB基因在水稻中过表达使转基因植株生长受阻[67]。非胁迫条件下,转酵母TPS基因的T1代转基因小麦出现植株矮化、叶片增厚、叶色加深等现象[68]。Yeo等[36]报道发现,用酵母TPS1基因转化的马铃薯植株生长迟缓,出现植株矮化、叶片发黄、叶呈柳叶形、根发育异常、畸形等现象,在移栽土壤后,植株恢复正常。但是,当研究者们在拟南芥和水稻中过表达自身的TPS1基因时,植株却没有出现显著的表型变化,同时抗逆性也有所增强[37, 54]。程庚[69]将垫状卷柏(Selaginella pulvinata (Hook. & Grev.) Maxim.)SpTPS1基因转入玉米,获得的转基因植株也未出现生长畸形的情况。这些现象说明,植物来源的TPS基因可能比大肠杆菌和酵母菌中的TPS 基因对植物的负面影响更小,对植物更安全,植物内源TPS基因在基因工程育种中具有更为广阔的运用前景。因此,今后植物的TPS同源基因鉴定与功能分析研究势必会越来越多。
其次,目前的研究多集中于Ⅰ类TPS基因上,对Ⅱ类TPS基因家族成员的研究还很欠缺。在大部分植物中,Ⅰ类TPS同源基因具有TPS酶催化活性,在植物逆境胁迫或开花调控中发挥重要作用。Ⅱ类TPS同源基因一般不具有TPS酶催化活性,但是研究表明许多植物的Ⅱ类TPS基因也在植物抵抗逆境胁迫中发挥重要作用[15]。但是目前大部分种类的植物只对个别Ⅰ类TPS同源基因成员进行了功能分析,对Ⅱ类TPS基因的功能研究较少,而且对于TPS基因家族成员调控植物非生物胁迫及开花转变的分子机制尚不完全清楚。如目前对模式植物拟南芥和粮食作物水稻TPS基因家族的研究都集中于TPS1基因上,对其他Ⅱ类TPS基因家族成员的研究很少;拟南芥的AtTPS1基因与成花诱导相关,而AtTPS5基因能响应高温胁迫,这两个基因在功能上的差异是由什么造成的还未可知。
随着分子生物学技术的发展,对Ⅱ类TPS同源基因功能进化差异分析及其响应逆境胁迫的分子机制的解析将会是未来的研究热点。今后研究者们将利用多组学联合分析手段挖掘鉴定更多植物的TPS同源基因,并使用基因编辑、染色质免疫沉淀技术、双荧光素酶互补等技术解析TPS基因在植物非生物胁迫及开花诱导中的分子作用机制,为今后利用分子生物学方法改良经济作物的抗逆性和生育期提供坚实的理论基础。
-
表 1 植物TPS基因家族的鉴定和功能验证情况
Table 1 Identification and functional verification of TPS gene family in plants
植物种类
Plant speciesTPS基因成员数
No. of TPS family members转入基因
Transferred genes启动子
Promoter转化植物
Transformed plant主要效应
Main effects文献
Reference苹果 Malus pumila Mill. 13 无 无 无 无 [10] 白杨 Populus tomentosa Carr. 13 无 无 无 无 [25] 荷花 Nelumbo nucifera Gaertn. 9 无 无 无 无 [27] 马铃薯 Solanum tuberosum L. 8 无 无 无 无 [28] 甘蔗 Saccharum officinarum L. 9 无 无 无 无 [29] 黄瓜 Cucumis sativus L. 7 无 无 无 无 [30] 大麻 Cannabis sativa L. 10 无 无 无 无 [32] 葡萄 Vitis vinifera L. 11 无 无 无 无 [34] 梅 Prunus mume Siebold & Zucc. 9 无 无 无 无 [35] 水稻 Oryza sativa L. 11 OsTPS1 Actin 1 水稻 提高了植株对低温、高盐、干旱等胁迫的耐受性 [37] 木薯 Manihot esculenta Crantz 12 MeTPS1 Ca MV35S 烟草 根茎叶中海藻糖积累增加,对干旱的耐受性增强 [38] 蒺藜苜蓿 Medicago truncatula L. 11 无 无 无 无 [42] 拟南芥 Arabidopsis thaliana (L.) Heynh. 11 AtTPS1 Ca MV35S 烟草 对干旱和高、低温的耐受性增强 [43] AtTPS1 35S 拟南芥 更耐脱水,抗性提高,对葡萄糖和脱落酸不敏感 [54] 番薯 Ipomoea batatas (L.) Lam. 1 IbTPS1 Ca MV35S 烟草 海藻糖和脯氨酸含量增加,耐盐性增强 [45] 西瓜 Citrullus lanatus (Thunb.) Matsum. & Nakai 7 ClTPS3 Ca MV35S 拟南芥 耐盐性显著增强 [46] 番茄 Solanum lycopersicum L. 11 无 无 无 无 [49] 大白菜 Brassica campestris L. 15 无 无 无 无 [50] 小麦 Triticum aestivum L. 12 TaTPS11 Ca MV35S 拟南芥 抗寒性增强 [53] 月季 Rosa chinensis Jacq. 9 无 无 无 无 [55] 新铁炮百合 Lilium × formolongi I. 9 LfTPS1/3/5 Ca MV35S 拟南芥 开花提前 [56] 辣木 Moringa oleifera Lam. 8 MoTPS1/2 无 拟南芥 开花提前 [57] 小桐子 Jatropha curcas L. 1 JcTPS1 Ca MV35S 拟南芥 开花提前 [58] -
[1] Lunn JE,Delorge I,Figueroa CM,Van Dijck P,Stitt M. Trehalose metabolism in plants[J]. Plant J,2014,79 (4):544−567. doi: 10.1111/tpj.12509
[2] Acosta-Pérez P,Camacho-Zamora BD,Espinoza-Sánchez EA,Gutiérrez-Soto G,Zavala-García F,et al. Characterization of trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase genes and analysis of its differential expression in maize (Zea mays) seedlings under drought stress[J]. Plants,2020,9 (3):315. doi: 10.3390/plants9030315
[3] Yatsyshyn VY,Kvasko AY,Yemets AI. Genetic approaches in research on the role of trehalose in plants[J]. Cytol Genet,2017,51 (5):371−383. doi: 10.3103/S0095452717050127
[4] Tang B,Wang S,Wang SG,Wang HJ,Zhang JY,Cui SY. Invertebrate trehalose-6-phosphate synthase gene:genetic architecture,biochemistry,physiological function,and potential applications[J]. Front Physiol,2018,9:30. doi: 10.3389/fphys.2018.00030
[5] Wang PL,Lei XJ,Lü JX,Gao CQ. Overexpression of the ThTPS gene enhanced salt and osmotic stress tolerance in Tamarix hispida[J]. J For Res,2022,33 (1):299−308. doi: 10.1007/s11676-020-01224-5
[6] Ma C,Wang ZQ,Kong BB,Lin TB. Exogenous trehalose differentially modulate antioxidant defense system in wheat callus during water deficit and subsequent recovery[J]. Plant Growth Regul,2013,70 (3):275−285. doi: 10.1007/s10725-013-9799-2
[7] Vandesteene L,López-Galvis L,Vanneste K,Feil R,Maere S,et al. Expansive evolution of the TREHALOSE-6-PHOSPHATE PHOSPHATASE gene family in Arabidopsis[J]. Plant Physiol,2012,160 (2):884−896. doi: 10.1104/pp.112.201400
[8] Fichtner F,Lunn JE. The role of trehalose 6-phosphate (Tre6P) in plant metabolism and development[J]. Annu Rev Plant Biol,2021,72:737−760. doi: 10.1146/annurev-arplant-050718-095929
[9] Wahl V,Ponnu J,Schlereth A,Arrivault S,Langenecker T,et al. Regulation of flowering by trehalose-6-phosphate signaling in Arabidopsis thaliana[J]. Science,2013,339 (6120):704−707. doi: 10.1126/science.1230406
[10] Du LS,Qi SY,Ma JJ,Xing LB,Fan S,et al. Identification of TPS family members in apple (Malus x domestica Borkh.) and the effect of sucrose sprays on TPS expression and floral induction[J]. Plant Physiol Biochem,2017,120:10−23. doi: 10.1016/j.plaphy.2017.09.015
[11] De Virgilio C,Bürckert N,Bell W,Jeno P,Boller T,Wiemken A. Disruption of TPS2,the gene encoding the 100-kDa subunit of the trehalose-6-phosphate synthase/phosphatase complex in Saccharomyces cerevisiae,causes accumulation of trehalose-6-phosphate and loss of trehalose-6-phosphate phosphatase activity[J]. Eur J Biochem,1993,212 (2):315−323. doi: 10.1111/j.1432-1033.1993.tb17664.x
[12] Kaasen I,Falkenberg P,Styrvold OB,Strøm AR. Molecular cloning and physical mapping of the otsBA genes,which encode the osmoregulatory trehalose pathway of Escherichia coli:evidence that transcription is activated by katF (AppR)[J]. J Bacteriol,1992,174 (3):889−898. doi: 10.1128/jb.174.3.889-898.1992
[13] Kaasen I,McDougall J,Strøm AR. Analysis of the otsBA operon for osmoregulatory trehalose synthesis in Escherichia coli and homology of the OtsA and OtsB proteins to the yeast trehalose-6-phosphate synthase/phosphatase complex[J]. Gene,1994,145 (1):9−15. doi: 10.1016/0378-1119(94)90316-6
[14] Blázquez MA,Santos E,Flores CL,Martinez-Zapater JM,Salinas J,Gancedo C. Isolation and molecular characterization of the Arabidopsis TPS1 gene,encoding trehalose-6-phosphate synthase[J]. Plant J,1998,13 (5):685−689. doi: 10.1046/j.1365-313X.1998.00063.x
[15] Delorge I,Janiak M,Carpentier S,van Dijck P. Fine tuning of trehalose biosynthesis and hydrolysis as novel tools for the generation of abiotic stress tolerant plants[J]. Front Plant Sci,2014,5:147.
[16] Delorge I,Figueroa CM,Feil R,Lunn JE,van Dijick P. Trehalose-6-phosphate synthase 1 is not the only active TPS in Arabidopsis thaliana[J]. Biochem J,2015,466 (2):283−290. doi: 10.1042/BJ20141322
[17] Lunn JE. Gene families and evolution of trehalose metabolism in plants[J]. Funct Plant Biol,2007,34 (6):550−563. doi: 10.1071/FP06315
[18] Ramon M,De Smet I,Vandesteene L,Naudts M,Leyman B,et al. Extensive expression regulation and lack of heterologous enzymatic activity of the Class Ⅱ trehalose metabolism proteins from Arabidopsis thaliana[J]. Plant Cell Environ,2009,32 (8):1015−1032. doi: 10.1111/j.1365-3040.2009.01985.x
[19] Chary SN,Hicks GR,Choi YG,Carter D,Raikhel NV. Trehalose-6-phosphate synthase/phosphatase regulates cell shape and plant architecture in Arabidopsis[J]. Plant Physiol,2008,146 (1):97−107. doi: 10.1104/pp.107.107441
[20] Suzuki N,Bajad S,Shuman J,Shulaev V,Mittler R. The transcriptional co-activator MBF1c is a key regulator of thermotolerance in Arabidopsis thaliana[J]. J Biol Chem,2008,283 (14):9269−9275. doi: 10.1074/jbc.M709187200
[21] Lin MF,Jia RH,Li JC,Zhang MJ,Chen HB,et al. Evolution and expression patterns of the trehalose-6-phosphate synthase gene family in drumstick tree (Moringa oleifera Lam.)[J]. Planta,2018,248 (4):999−1015. doi: 10.1007/s00425-018-2945-3
[22] Zang BS,Li HW,Li WJ,Deng XW,Wang XP. Analysis of trehalose-6-phosphate synthase (TPS) gene family suggests the formation of TPS complexes in rice[J]. Plant Mol Biol,2011,76 (6):507−522. doi: 10.1007/s11103-011-9781-1
[23] 蒋伟. 玉米海藻糖-6-磷酸合成酶基因家族的功能验证和差异表达分析[D]. 雅安: 四川农业大学, 2010: 32−34. [24] 谢翎,汪章勋,黄勃. 大豆TPS基因家族全基因组鉴定、分类与表达分析[J]. 中国油料作物学报,2014,36(2):160−167. doi: 10.7505/j.issn.1007-9084.2014.02.004 Xie L,Wang ZX,Huang B. Genome-wide identification classification and expression of TPS family genes in soybean[J]. Chinese Journal of Oil Crop Sciences,2014,36 (2):160−167. doi: 10.7505/j.issn.1007-9084.2014.02.004
[25] Gao YH,Yang XY,Yang X,Zhao TY,An XM,Chen Z. Characterization and expression pattern of the trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase gene families in Populus[J]. Int J Biol Macromol,2021,187:9−23. doi: 10.1016/j.ijbiomac.2021.07.096
[26] Xie DW,Wang XN,Fu LS,Sun J,Zheng W,Li ZF. Identification of the trehalose-6-phosphate synthase gene family in winter wheat and expression analysis under conditions of freezing stress[J]. J Genet,2015,94 (1):55−65. doi: 10.1007/s12041-015-0495-z
[27] Jin QJ,Hu X,Li X,Wang B,Wang YJ,et al. Genome-wide identification and evolution analysis of trehalose-6-phosphate synthase gene family in Nelumbo nucifera[J]. Front Plant Sci,2016,7:1445.
[28] Xu YC,Wang YJ,Mattson N,Yang L,Jin QJ. Genome-wide analysis of the Solanum tuberosum (potato) trehalose-6-phosphate synthase (TPS) gene family:evolution and differential expression during development and stress[J]. BMC Genomics,2017,18 (1):926. doi: 10.1186/s12864-017-4298-x
[29] Hu X,Wu ZD,Luo ZY,Burner DM,Pan YB,Wu CW. Genome-wide analysis of the trehalose-6-phosphate synthase (TPS) gene family and expression profiling of ScTPS genes in sugarcane[J]. Agronomy,2020,10 (7):969. doi: 10.3390/agronomy10070969
[30] Dan YY,Niu Y,Wang CL,Yan M,Liao WB. Genome-wide identification and expression analysis of the trehalose-6-phosphate synthase (TPS) gene family in cucumber (Cucumis sativus L.)[J]. PeerJ,2021,9:e11398. doi: 10.7717/peerj.11398
[31] Li YF,Zhang MF,Zhang M,Jia GX. Analysis of global gene expression profiles during the flowering initiation process of Lilium × formolongi[J]. Plant Mol Biol,2017,94 (4-5):361−379. doi: 10.1007/s11103-017-0612-x
[32] Sun J,Dai ZG,Zhang XY,Tang Q,Cheng CH,et al. Identification of TPS and TPP gene families in Cannabis sativa and their expression under abiotic stresses[J]. Biol Plant,2022,66:14−23. doi: 10.32615/bp.2021.051
[33] Kosmas SA,Argyrokastritis A,Loukas MG,Eliopoulos E,Tsakas S,Kaltsikes PJ. Isolation and characterization of drought-related trehalose 6-phosphate-synthase gene from cultivated cotton (Gossypium hirsutum L.)[J]. Planta,2006,223 (2):329−339. doi: 10.1007/s00425-005-0071-5
[34] Morabito C,Secchi F,Schubert A. Grapevine TPS (trehalose-6-phosphate synthase) family genes are differentially regulated during development,upon sugar treatment and drought stress[J]. Plant Physiol Biochem,2021,164:54−62. doi: 10.1016/j.plaphy.2021.04.032
[35] Yang YJ,Ma KF,Zhang TX,Li LL,Wang J,et al. Characteristics and expression analyses of trehalose-6-phosphate synthase family in Prunus mume reveal genes involved in trehalose biosynthesis and drought response[J]. Biomolecules,2020,10 (10):1358. doi: 10.3390/biom10101358
[36] Yeo ET,Kwon HB,Han SE,Lee JT,Ryu JC,Byu MO. Genetic engineering of drought resistant potato plants by introduction of the trehalose-6-phosphate synthase (TPS1) gene from Saccharomyces cerevisiae[J]. Mol Cells,2000,10 (3):263−268.
[37] Li HW,Zang BS,Deng XW,Wang XP. Overexpression of the trehalose-6-phosphate synthase gene OsTPS1 enhances abiotic stress tolerance in rice[J]. Planta,2011,234 (5):1007−1018. doi: 10.1007/s00425-011-1458-0
[38] Han BY,Fu LL,Zhang D,He XQ,Chen Q,et al. Interspecies and intraspecies analysis of trehalose contents and the biosynthesis pathway gene family reveals crucial roles of trehalose in osmotic-stress tolerance in cassava[J]. Int J Mol Sci,2016,17 (7):1077. doi: 10.3390/ijms17071077
[39] Stiller I,Dulai S,Kondrák M,Tarnai R,Szabó L,et al. Effects of drought on water content and photosynthetic parameters in potato plants expressing the trehalose-6-phosphate synthase gene of Saccharomyces cerevisiae[J]. Planta,2008,227 (2):299−308.
[40] Liu YB,Han LZ,Qin LJ,Zhao DG. Saccharomyces cerevisiae gene TPS1 improves drought tolerance in Zea mays L. by increasing the expression of SDD1 and reducing stomatal density[J]. Plant Cell Tissue Organ Cult,2015,120 (2):779−789. doi: 10.1007/s11240-014-0647-5
[41] El-Bashiti T,Hamamcı H,Öktem HA,Yücel M. Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions[J]. Plant Sci,2005,169 (1):47−54. doi: 10.1016/j.plantsci.2005.02.024
[42] Song JB,Mao HY,Cheng J,Zhou Y,Chen RR,et al. Identification of the trehalose-6-phosphate synthase gene family in Medicago truncatula and expression analysis under abiotic stresses[J]. Gene,2021,787:145641. doi: 10.1016/j.gene.2021.145641
[43] Almeida AM,Villalobos E,Araújo SS,Leyman B,van Dijck P,et al. Transformation of tobacco with an Arabidopsis thaliana gene involved in trehalose biosynthesis increases tolerance to several abiotic stresses[J]. Euphytica,2005,146 (1-2):165−176. doi: 10.1007/s10681-005-7080-0
[44] Vishal B,Krishnamurthy P,Ramamoorthy R,Kumar PP. OsTPS8 controls yield-related traits and confers salt stress tolerance in rice by enhancing suberin deposition[J]. New Phytol,2019,221 (3):1369−1386. doi: 10.1111/nph.15464
[45] Jiang T,Zhai H,Wang FB,Zhou HN,Si ZZ,et al. Cloning and characterization of a salt tolerance-associated gene encoding trehalose-6-phosphate synthase in sweetpotato[J]. J Integr Agric,2014,13 (8):1651−1661. doi: 10.1016/S2095-3119(13)60534-1
[46] Yuan GP,Liu JP,An GL,Li WH,Si WJ,et al. Genome-wide identification and characterization of the trehalose-6-phosphate synthetase (TPS) gene family in watermelon (Citrullus lanatus) and their transcriptional responses to salt stress[J]. Int J Mol Sci,2021,23 (1):276. doi: 10.3390/ijms23010276
[47] Miranda JA,Avonce N,Suárez R,Thevelein JM,van Dijck P,Iturriaga G. A bifunctional TPS-TPP enzyme from yeast confers tolerance to multiple and extreme abiotic-stress conditions in transgenic Arabidopsis[J]. Planta,2007,226 (6):1411−1421. doi: 10.1007/s00425-007-0579-y
[48] Lyu JI,Park JH,Kim JK,Bae CH,Jeong WJ,et al. Enhanced tolerance to heat stress in transgenic tomato seeds and seedlings overexpressing a trehalose-6-phosphate synthase/phosphatase fusion gene[J]. Plant Biotechnol Rep,2018,12 (6):399−408. doi: 10.1007/s11816-018-0505-8
[49] Mollavali M,Börnke F. Characterization of trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase genes of tomato (Solanum lycopersicum L.) and analysis of their differential expression in response to temperature[J]. Int J Mol Sci,2022,23 (19):11436. doi: 10.3390/ijms231911436
[50] 庞强强,蔡兴来,孙晓东,张文,周曼. 大白菜TPS基因家族鉴定及其在高温胁迫下的表达分析[J]. 分子植物育种,2020,18(8):2452−2459. Pang QQ,Cai XL,Sun XD,Zhang W,Zhou M. Identification of TPS gene family in Chinese cabbage (Brassica campestris L.) and its expression under heat stress[J]. Molecular Plant Breeding,2020,18 (8):2452−2459.
[51] 谢冬微. 冬小麦低温下基因表达谱分析及海藻糖基因家族研究[D]. 哈尔滨: 东北农业大学, 2014: 77−83. [52] 丁菲,庞磊,李叶云,葛菁,江昌俊. 茶树海藻糖-6-磷酸合成酶基因(CsTPS)的克隆及表达分析[J]. 农业生物技术学报,2012,20(11):1253−1261. Ding F,Pang L,Li YY,Ge J,Jiang CJ. Cloning and expression analysis of trehalose-6-phosphate synthase gene(CsTPS) from tea plant (Camellia sinensis (L. ) O. Kuntz)[J]. Journal of Agricultural Biotechnology,2012,20 (11):1253−1261.
[53] Liu X,Fu LS,Qin P,Sun YL,Liu J,Wang XN. Overexpression of the wheat trehalose 6-phosphate synthase 11 gene enhances cold tolerance in Arabidopsis thaliana[J]. Gene,2019,710:210−217. doi: 10.1016/j.gene.2019.06.006
[54] Avonce N,Leyman B,Mascorro-Gallardo JO,van Dijck P,Thevelein JM,Iturriaga G. The Arabidopsis trehalose-6-P synthase AtTPS1 gene is a regulator of glucose,abscisic acid,and stress signaling[J]. Plant Physiol,2004,136 (3):3649−3659. doi: 10.1104/pp.104.052084
[55] Wei XR,Ling W,Ma YW,Du JL,Cao FX,et al. Genome-wide analysis of the trehalose-6-phosphate synthase gene family in rose (Rosa chinensis) and differential expression under heat stress[J]. Horticulturae,2022,8 (5):429. doi: 10.3390/horticulturae8050429
[56] Zhang Q,Zhang M,Zhao YQ,Hu H,Huang YX,Jia GX. Identification of trehalose-6-phosphate synthase (TPS)-coding genes involved in flowering induction of Lilium × formolongi[J]. Plant Physiol Biochem,2022,171:84−94. doi: 10.1016/j.plaphy.2021.12.025
[57] Lin MF,Ma SY,Quan KH,Yang ED,Hu L,Chen XY. Comparative transcriptome analysis provides insight into the molecular mechanisms of long-day photoperiod in Moringa oleifera[J]. Physiol Mol Biol Plants,2022,28 (5):935−946. doi: 10.1007/s12298-022-01186-4
[58] 赵美丽,倪军,陈茂盛,徐增富. 超量表达小桐子JcTPS1促进拟南芥开花并增加叶片花青素含量[J]. 分子植物育种,2018,16(1):255−261. Zhao ML,Ni J,Chen MS,Xu ZF. Over-expression of JcTPS1 from Jatropha curcas induces early flowering of Arabidopsis and improves anthocyanin accumulation in leaves[J]. Molecular Plant Breeding,2018,16 (1):255−261.
[59] 陈宏艳,李小二,李忠光. 糖信号及其在植物响应逆境胁迫中的作用[J]. 生物技术通报,2022,38(7):80−89. Chen HY,Li XE,Li ZG. Sugar signaling and its role in plant response to environmental stress[J]. Biotechnology Bulletin,2022,38 (7):80−89.
[60] Bischof S. Life is sweeter with trehalose 6-phosphate[J]. Plant Cell,2020,32 (6):1784−1785. doi: 10.1105/tpc.20.00276
[61] Paul MJ,Gonzalez-Uriarte A,Griffiths CA,Hassani-Pak K. The role of trehalose 6-phosphate in crop yield and resilience[J]. Plant Physiol,2018,177 (1):12−23. doi: 10.1104/pp.17.01634
[62] Saidi A,Hajibarat Z. Computational analysis and expression study of trehalose 6-phosphate synthase (TPS) in rice (Oryza sativa)[J]. Sci Study Res:Chem Chem Eng,Biotechnol,Food Ind,2021,22 (1):13−25.
[63] 项阳,刘延波,赵德刚,Yi Li. 转TPS1基因促进干旱胁迫条件下的花青素积累提高玉米植株抗旱性[J]. 植物生理学报,2015,51(11):2054−2062. Xiang Y,Liu YB,Zhao DG,Yi L. Improve drought tolerance via accumulating anthocyanidin under drought stress in TPS1 transgenic maize[J]. Plant Physiology Journal,2015,51 (11):2054−2062.
[64] Krishnamurthy P,Jyothi-Prakash PA,Qin L,He J,Lin QS,et al. Role of root hydrophobic barriers in salt exclusion of a mangrove plant Avicennia officinalis[J]. Plant Cell Environ,2014,37 (7):1656−1671. doi: 10.1111/pce.12272
[65] Gabriel C,Fernhout JJ,Fichtner F,Feil R,Lunn JE,et al. Genetic manipulation of trehalose-6-phosphate synthase results in changes in the soluble sugar profile in transgenic sugarcane stems[J]. Plant Direct,2021,5 (11):e358.
[66] Romero C,Bellés JM,Vayá JL,Serrano R,Culiáñez-Macià FA. Expression of the yeast trehalose-6-phosphate synthase gene in transgenic tobacco plants:pleiotropic phenotypes include drought tolerance[J]. Planta,1997,201 (3):293−297. doi: 10.1007/s004250050069
[67] Garg AK,Kim JK,Owens TG,Ranwala AP,Choi YD,et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J]. Proc Natl Acad Sci USA,2002,99 (25):15898−15903. doi: 10.1073/pnas.252637799
[68] 杜丽璞,徐惠君,叶兴国,林忠平. 小麦转TPS基因植株的获得及其初步功能鉴定[J]. 麦类作物学报,2007,27(3):369−373. doi: 10.3969/j.issn.1009-1041.2007.03.001 Du LP,Xu HJ,Ye XG,Lin ZP. Transgenic wheat plants with trehalose-6-phosphate synthase (TPS) gene and identification of their function[J]. Journal of Triticeae Crops,2007,27 (3):369−373. doi: 10.3969/j.issn.1009-1041.2007.03.001
[69] 程庚. 垫状卷柏海藻糖-6-磷酸合成酶基因转化玉米[D]. 雅安: 四川农业大学, 2012: 31−37. -
期刊类型引用(4)
1. 张桂华,岳春雷,李贺鹏,张晓勉,俞振明. 木麻黄海藻糖-6-磷酸合酶家族鉴定及表达分析. 农业生物技术学报. 2025(03): 581-593 .  百度学术
百度学术
2. 康舒淇,朱田田,晋玲,刘天乐,张菁,张明惠,徐丽,张帅. 两品种当归转录组分析及抗旱关键基因挖掘. 中国药学杂志. 2024(12): 1100-1109 .  百度学术
百度学术
3. 朱思奕,曾周婷,冯雨欣,何昊强,岑欣颖,邹小维,俞振明,李效贤. 魔芋海藻糖-6-磷酸合酶基因家族鉴定及表达分析. 核农学报. 2024(10): 1847-1856 .  百度学术
百度学术
4. 徐鹏,刘梦雪,黄亚茹,尤翠翠,王冠军. 外源海藻糖对大穗型粳稻稻米品质的影响. 安徽农学通报. 2023(20): 1-6 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载:
