Niche and interspecific associations of main species in the Acacia confusa Merr. community shrub layer in Fuying Island, Xiapu County
-
摘要:
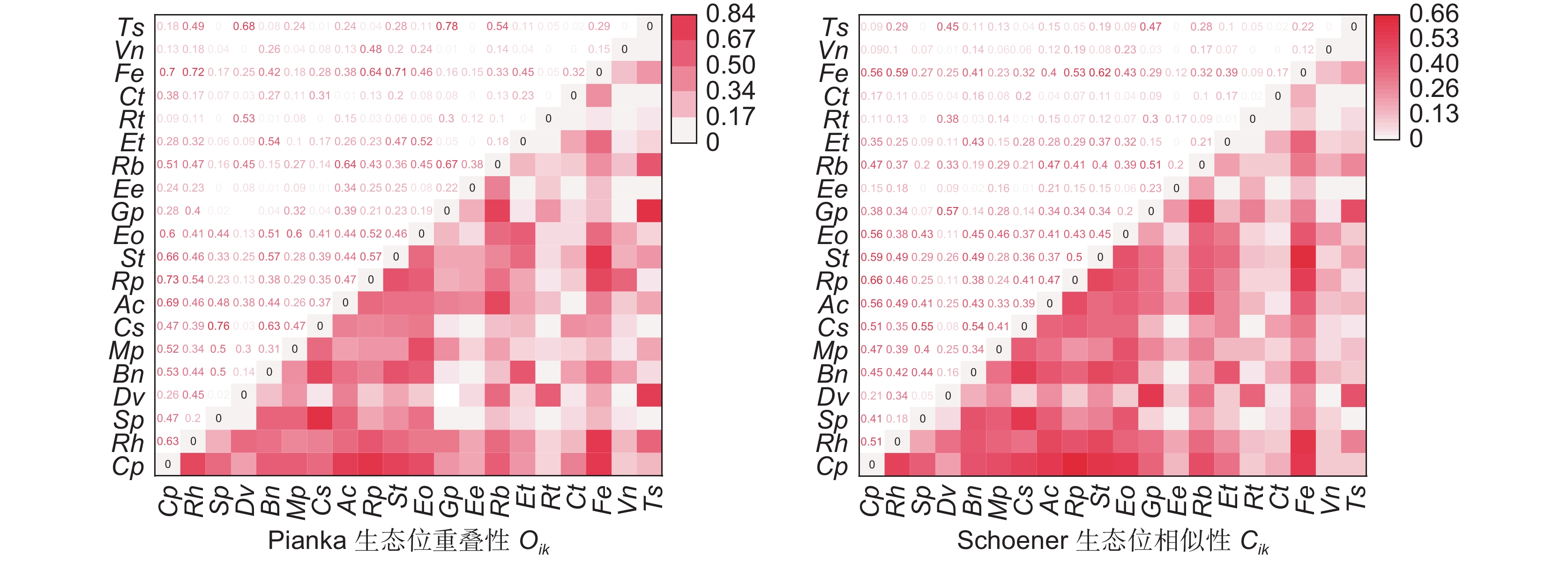
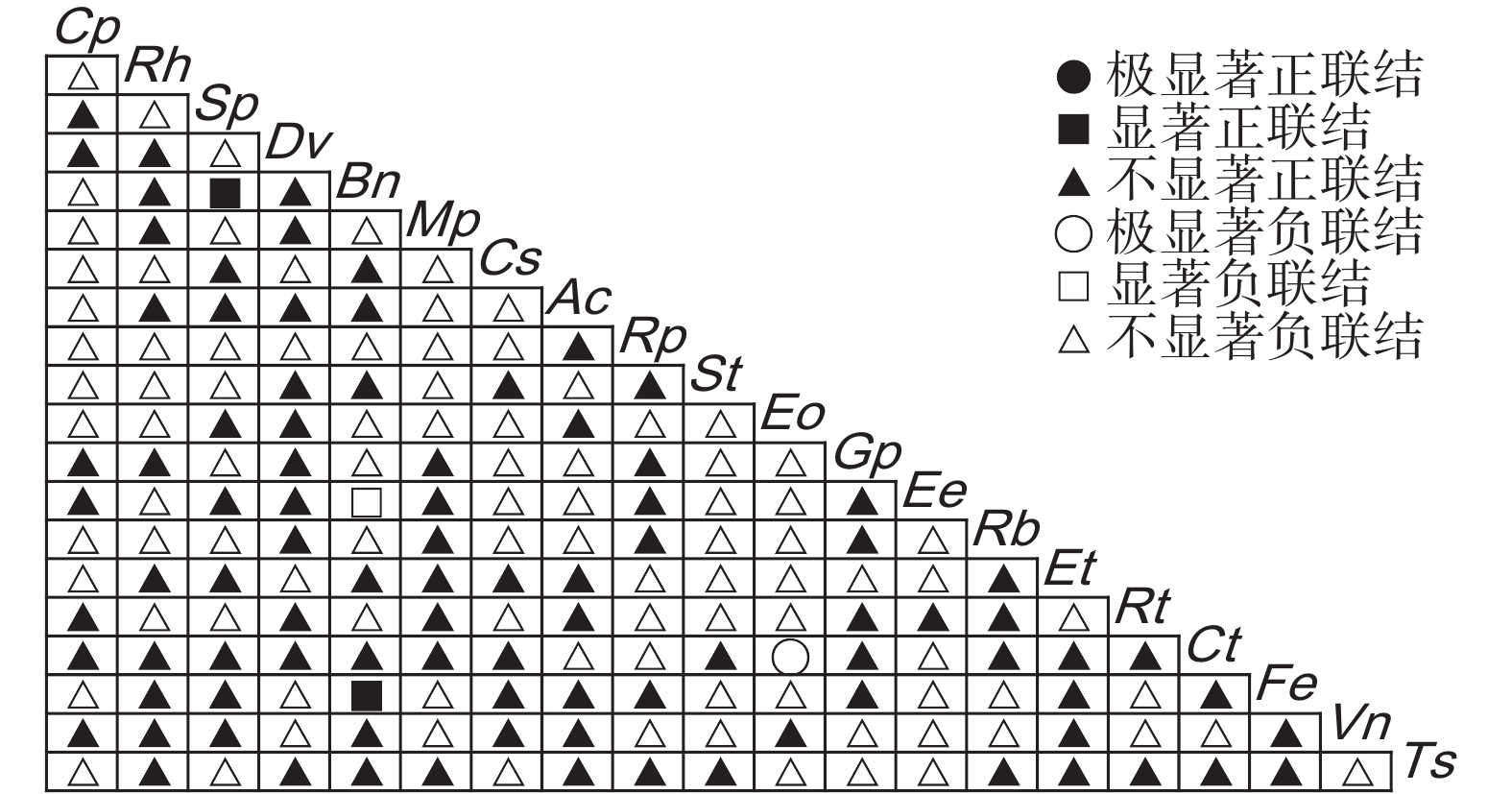
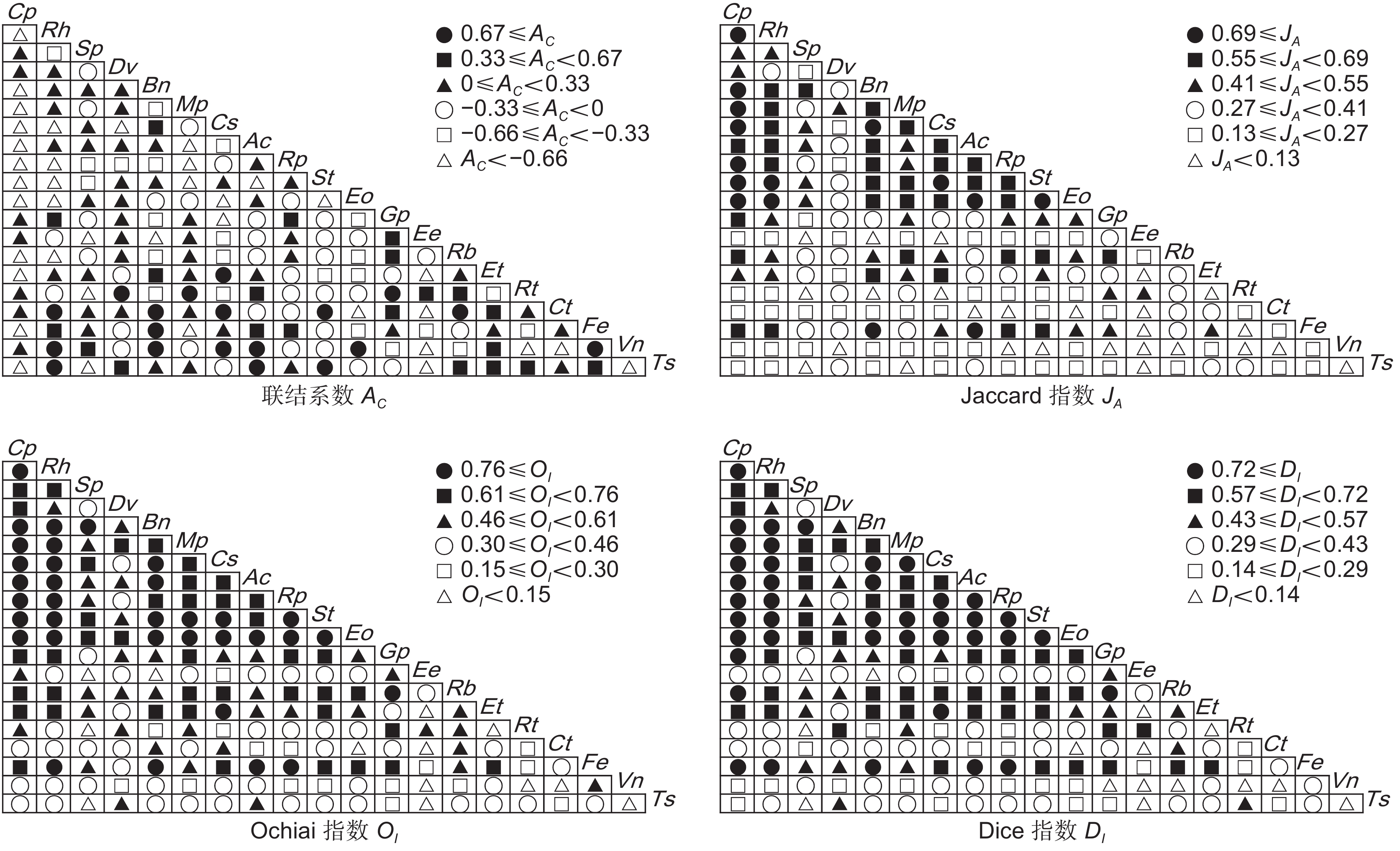
台湾相思(Acacia confusa Merr.)林是霞浦浮鹰岛主要森林群落,为探究其演替动态和共存机制,基于典型样方法,采用生态位测度、方差比率法(VR)、χ2检验和AC联结系数(AC)、Jaccard系数(JA)、Ochiai系数(OI)、Dice系数(DI)检验等方法,对霞浦浮鹰岛台湾相思群落样方灌木层的主要物种生态位与种间联结进行研究。结果显示:(1)杜虹花(Callicarpa pedunculata R. Br.)的重要值和生态位宽度均为最大,在群落灌木层中占据绝对优势。(2)台湾相思群落灌木层主要物种间的生态位相似性和生态位重叠均较小,各物种对资源利用比较充分。(3)物种的生态位宽度越大,其生态位相似性和生态位重叠程度也越高,但不存在绝对的正相关。(4)台湾相思群落灌木层的主要物种总体联结性表现为不显著负联结,群落仍处于动态演替不稳定阶段。(5)种对间正负联结比为0.98,几种联结检验显著率均较低,其种对间联结程度较弱,物种竞争不激烈。(6)联结系数AC、JA、OI、DI指数与生态位相似性和生态位重叠程度之间均呈显著正相关,种间联结越强,其生态位相似性和生态位重叠程度也越高。研究结果表明,霞浦浮鹰岛台湾相思群落灌木层主要物种对环境资源利用较充分,大部分物种间竞争较弱,台湾相思幼苗未能占据绝对优势,群落稳定性较差,存在逆向演替可能,应适当采取人工抚育手段。
Abstract:Acacia confusa Merr. is the dominant forest type on Fuying Island in Xiapu County, China. This study investigated the niche characteristics and interspecific associations of the main species in the A. confusa community shrub layer using data from 92 shrub plots. Niche analysis was conducted using Levins niche breadth (BL), Shannon niche breadth (BS), Schoener niche similarity (Cik), and Pianka niche overlap (Oik). Interspecific associations were examined using the variance ratio (VR), χ2 test, and association (AC), Ochiai (OI), Dice (DI), and Jaccard (JA) coefficients. Results showed that: (1) Among the 20 species analyzed, Callicarpa pedunculata R. Br. exhibited the largest niche breadth and held an absolute competitive advantage in the community. (2) Niche similarity and overlap among species in the shrub layer were low, suggesting efficient resource utilization by each species. (3) Greater niche breadth showed a general correspondence to higher niche similarity and overlap, although this relationship did not show an absolute positive correlation. (4) The W test revealed that the overall interspecific associations were insignificantly negative, reflecting a dynamic stage of succession with instability. (5) The ratio of positive to negative associations among species was 0.98, and the low significance rates across multiple association tests indicated weak interspecific associations and limited competition. (6) The AC, JA, OI, and DI coefficients showed significantly positive correlations with niche similarity and overlap, indicating that stronger positive associations corresponded to greater niche similarity and overlap among species. These findings suggest that the main shrub species within the A. confusa community efficiently utilize environmental resources, with relatively weak interspecies competition. However, young A. taiwanensis trees failed to establish a dominant position in the community. The overall stability of the community is low, with potential for reverse succession. Therefore, targeted artificial management strategies should be adopted.
-
Keywords:
- Xiapu County /
- Acacia confusa forest /
- Niche /
- Interspecific association
-
光合作用作为地球上最重要的一个生理生化过程,为植物生长发育提供了大部分物质和能量[1]。叶片是绿色植物吸收光能和形成同化力的光合器官,植物生长季,其光合机构面临既需要光能又要避免强光、高温等胁迫伤害的情况[2]。因此,一些物种在长期进化过程中形成的异形叶机制,在适应环境方面发挥着重要作用[3, 4]。柏科许多物种均有明显的异形叶[5],而关于柏科的鳞叶和刺叶光合功能差异的研究较少,主要集中于圆柏属(Sabina)物种。臭柏(Juniperus sabina L.)鳞叶单位面积的光合速率高于刺叶,对强光引起的光抑制有更好的耐性;刺叶单位鲜重的光合速率高于鳞叶,且刺叶光补偿点更低[6]。但也有研究结果与之相反,认为臭柏刺叶单位面积的光合速率和水分利用效率高于鳞叶[7, 8]。球柏(J. chinensis 'Globosa')刺叶的净光合速率高于鳞叶[9]。因此,关于圆柏属刺叶和鳞叶的光合能力差异尚存在争议。
雌雄异株是物种对环境长期适应的进化结果[10],雌雄株在生长发育、生理特性、空间分布和资源配置等方面有明显的性别差异[11]。在雌雄异株树木的性别响应差异方面,针对光合特征的研究主要集中在对干旱、极端温度、盐、养分和重金属等非生物因子以及竞争等生物因子的应答能力[12]。雌、雄株对胁迫的反应并不相同[13-16]。以温室盆栽幼苗为材料时,一些物种雌株的光合参数数值高于雄株[16, 17],或低于雄株[14, 15],抑或两者相似[13, 18],这些结果可能源于幼苗与成龄树之间的差异[19]。在自然条件下,雌雄异株成年树间的光合差异明显稳定,除刺柏槲寄生(Phoradendron juniperinum Engelm.)[20]外,北极柳[21](Salix arctica Pall.)、梣叶槭[22]( Acer negundo L.)、窄叶杨[23](Populus angustifolia E. James)、杞柳[24] (S. integra Thunb. in Murray)、连香树[25] (Cercidiphyllum japonicum Siebold & Zucc.)、鼠李[26] (Rhamnus davurica Pall. )等雌株的气体交换参数值均高于雄株。
圆柏(S. chinensis (L.) Ant.)为圆柏属常绿植物,该物种雌雄异株,稀同株,具有鳞叶和刺叶两种叶形。圆柏在我国分布广泛,是北方重要的园林树种。目前,有关圆柏生理代谢的研究主要集中在刺叶的生理抗性[27, 28]、挥发性物质[29]、鳞叶的气孔特征[30]以及刺叶光合日变化[31]等方面,有关性别和叶形对气体交换参数和叶绿素荧光特征的影响报道较少。为此,本研究以圆柏雌株、雄株和雌雄同株的鳞叶和刺叶为材料,对气体交换参数、叶绿素荧光参数和非结构性碳水化合物(NSC)含量进行测定,以期揭示性别和叶形对圆柏光合生理功能的影响,探讨其对光照的适应机制,为圆柏的进化机制研究提供基础。
1. 材料与方法
1.1 研究区概况
样树生长于山西省晋中市太谷区山西农业大学(37°42′N,112°58′E),该地区海拔870 m,属于暖温带大陆气候,年平均气温为9.8 ℃,年平均降水量为456 mm,年均蒸发量为1 740 mm,无霜期年均176 d。
1.2 样树选择
选择生境一致的圆柏样树,雌株、雄株、雌雄同株各3株,样树为同批次栽植,树龄相同,树高和胸径相似,平均胸径为(12.1±0.8)cm。分别选择圆柏树体中部位置的东、南、西3个向阳方位的外围枝条,各方位的鳞、刺叶分别测试3次。
1.3 测定方法
1.3.1 气体交换参数测定
2023年8月,在晴朗无风天气下,基于相同面积,使用Ci-340便携式光合作用测定仪进行气体交换参数测定,测定时间为8:00-18:00,每间隔2 h测定1次,重复3次。指标为:净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs),水分利用率(WUE=Pn/Tr)由公式计算得来。
1.3.2 叶绿素荧光参数测定
叶绿素荧光参数测定前,叶片经过夜间充分暗适应,于次日凌晨4:00-5:00,使用便携式调制叶绿素荧光仪PAM-2500测定PSⅡ实际光化学量子效率(ФPSⅡ)、实际电子传递速率(ETR)、光化光淬灭系数(qP)、非光化光淬灭系数(NPQ)、最小初始荧光(Fo)和最大荧光(Fm),并由仪器自动计算暗适应下PSⅡ最大光化学量子效率(Fv/Fm),最后,计算光能捕获能力(1/Fo−1/Fm)。
1.3.3 快速光响应曲线(RLC)的测量与分析
光合有效辐射(PAR)梯度依次为:0、55、77、144、257、332、430、940、1 364、1 981 μmol·m−2·s−1,持续时间为20 s,测定相对电子传递速率(Relative electron transport rate,rETR),参照Ralph和Gademann[32]的方法,拟合快速光响应曲线,得到光能利用效率(α)、潜在最大电子传递速率(rETRmax)和半饱和光强(Ik)。
1.3.4 非结构性碳水化合物含量测定
非结构性碳水化合物含量的测定采用硫酸蒽酮法[33],测定叶中的可溶性糖(SS)和淀粉(ST)含量。NSC含量为SS与ST含量之和。
1.4 数据处理
所有数据均以平均值±标准误(Mean±SD)表示。使用SPSS 18.0软件进行单因素方差分析和Pearson相关系数分析,P<0.05为差异显著,P<0.01为差异极显著。使用Excel 2019和Origin 2018软件绘制图形。
2. 结果与分析
2.1 气体交换参数比较
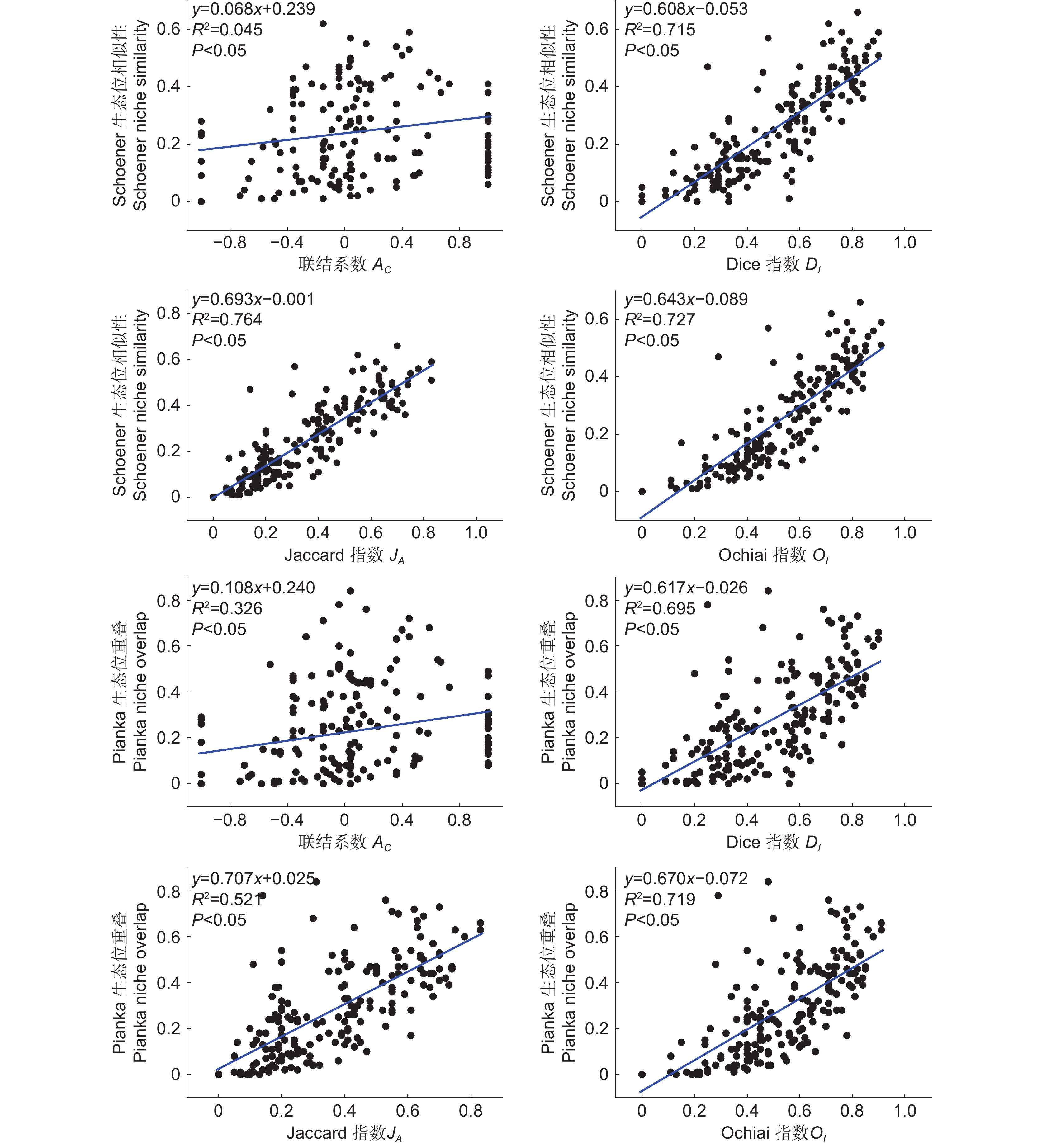
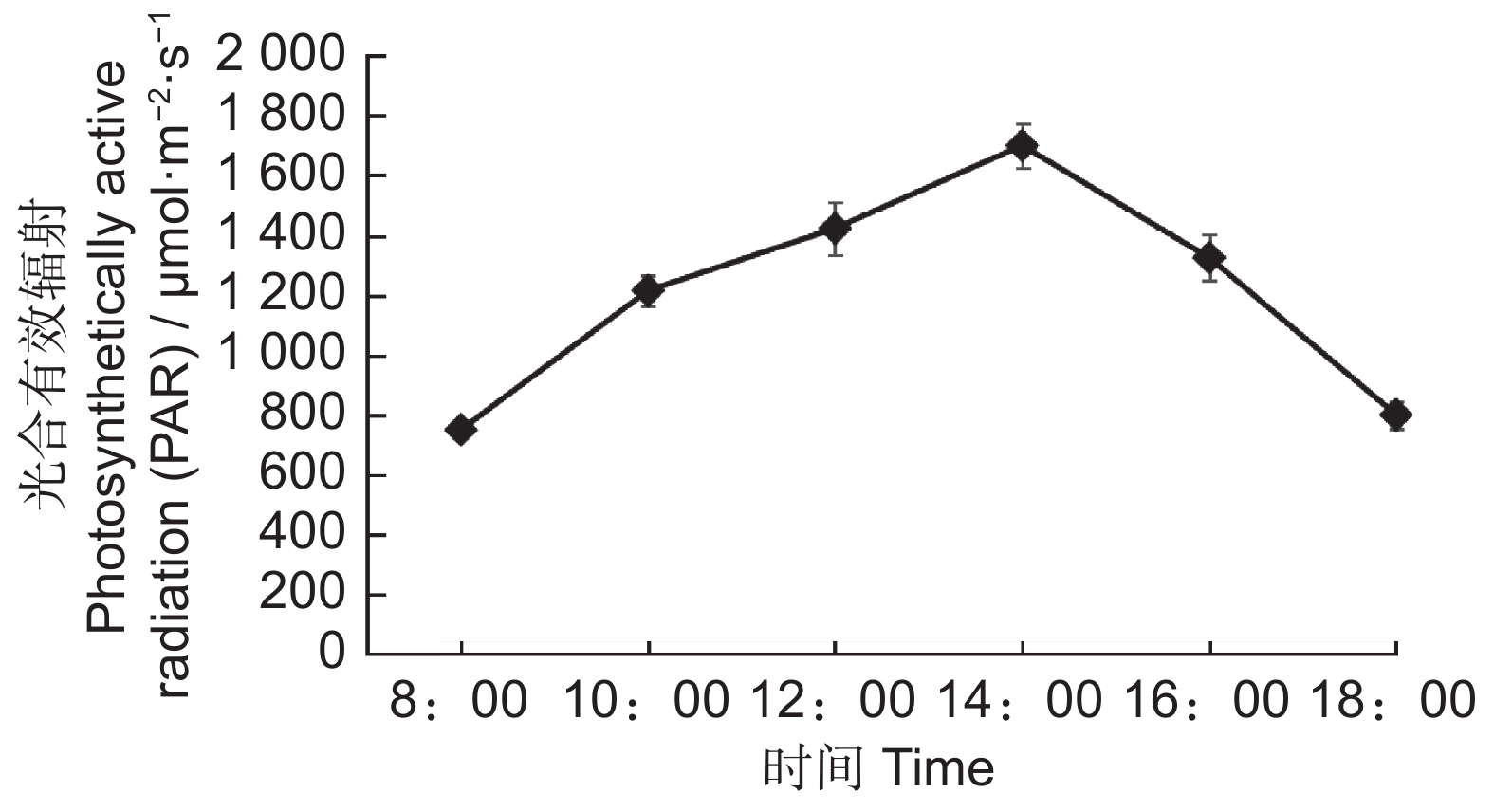
由图1可知,晴天时圆柏光合有效辐射的日变化呈单峰曲线,在14:00达到峰值,日均值为1 202 μmol·m-2·s-1。由表1可知,雌株、雄株、雌雄同株的刺叶和鳞叶Pn日变化呈双峰曲线。“午休”现象出现在14:00,第1峰值均出现在10:00,第2峰值在16:00,第2峰值显著低于第1峰值。在刺叶方面,雌株Pn最高,雌雄同株Pn最低。在鳞叶方面,雌株Pn最高,雄株Pn最低。另外,3种性别植株的刺叶和鳞叶的最大Pn峰值出现时间均早于PAR峰值4小时,二者变化不同步。在14:00时,光合作用受到光抑制,雄株的鳞叶受光抑制程度最严重,与10:00时相比,雄株的刺叶Pn下降了89.40%,鳞叶Pn下降了92.13%。而雌株刺叶和鳞叶的Pn分别下降了86.44% 和81.07%。
表 1 4种光合参数的日变化Table 1. Comparison of four photosynthetic parameters参数
Parameter性别
Sex叶形
Leaf
shape时间
Time8:00 10:00 12:00 14:00 16:00 18:00 Pn / μmol·
m−2·s−1雄株 刺叶 1.2±0.10b(A) 3.5±0.10b(A) 1.7±0.10b(A) 0.4±0.02b(A) 0.9±0.20b(A) 0.1±0.10c(B) 鳞叶 0.7±0.05B(B) 2.2±0.30A(B) 1.2±0.10B(B) 0.2±0.03B(B) 0.7±0.04C(A) 0.3±0.03B(A) 雌株 刺叶 2.2±0.15a(A) 4.7±0.30a(A) 2.9±0.23a(A) 0.6±0.06a(A) 2.8±0.30a(A) 0.9±0.05a(A) 鳞叶 0.8±0.08B(B) 2.8±0.34A(B) 1.4±0.07A(B) 0.5±0.01A(B) 1.3±0.13B(B) 0.3±0.03C(B) 雌雄
同株刺叶 0.7±0.04c(B) 1.8±0.21c(B) 0.5±0.05c(B) 0.2±0.08c(B) 0.9±0.17b(B) 0.3±0.01b(B) 鳞叶 1.2±0.12A(A) 2.7±0.21A(A) 0.9±0.08C(A) 0.6±0.06A(A) 1.5±0.12A(A) 0.8±0.02A(A) Gs / mmol·
m−2·s−1雄株 刺叶 18.0±0.80a(A) 25.6±2.20a(A) 19.7±1.20b(A) 25.7±1.50a(A) 15.3±1.00b(A) 10.1±0.70a(B) 鳞叶 15.0±0.90A(B) 25.9±1.70A(A) 11.5±2.40B(B) 19.1±2.10A(B) 15.6±2.10A(A) 14.2±0.80A(A) 雌株 刺叶 19.1±1.10a(A) 22.1±1.80a(A) 24.4±1.50a(A) 17.5±1.20b(A) 29.9±1.10a(A) 10.8±0.70a(A) 鳞叶 15.3±1.00A(B) 23.1±1.40A(A) 21.1±2.10A(A) 17.7±1.20A(A) 17.8±1.50A(B) 9.8±0.99B(A) 雌雄
同株刺叶 14.0±0.90b(A) 20.1±2.10a(A) 17.0±1.60b(B) 15.0±1.30b(B) 18.0±1.80b(A) 9.9±0.56a(A) 鳞叶 14.0±0.90A(A) 23.1±3.00A(A) 23.0±1.40A(A) 21.0±1.90A(A) 19.0±1.40A(A) 11.0±0.90B(A) Tr / mmol·
m−2·s−1雄株 刺叶 0.4±0.02a(A) 1.1±0.03a(B) 1.4±0.05a(A) 1.7±0.08a(A) 0.9±0.08b(A) 0.4±0.03a(B) 鳞叶 0.3±0.05A(B) 1.2±0.06A(A) 0.8±0.04B(B) 1.0±0.03C(B) 0.7±0.04A(B) 0.7±0.09A(A) 雌株 刺叶 0.4±0.15a(A) 0.7±0.07c(A) 0.8±0.12b(B) 1.3±0.06b(B) 1.1±0.09a(A) 0.3±0.05b(B) 鳞叶 0.3±0.08A(A) 0.9±0.14B(A) 1.0±0.07A(A) 1.4±0.01A(A) 0.8±0.13A(B) 0.4±0.03B(A) 雌雄
同株刺叶 0.2±0.04b(A) 0.9±0.11b(A) 0.6±0.05c(B) 1.0±0.08c(B) 0.8±0.07b(A) 0.3±0.01b(A) 鳞叶 0.3±0.12A(A) 0.7±0.09B(A) 0.8±0.08B(A) 1.3±0.06B(A) 0.8±0.12A(A) 0.3±0.02C(A) WUE /
mmol/
mol雄株 刺叶 3.0±0.10c(A) 2.7±0.18b(A) 0.7±0.10b(B) 0.2±0.04b(A) 1.0±0.20b(A) 0.3±0.10c(B) 鳞叶 2.3±0.05C(B) 1.6±0.30C(B) 0.9±0.10A(A) 0.2±0.02B(A) 1.0±0.04C(A) 0.5±0.03B(A) 雌株 刺叶 5.5±0.15a(A) 5.3±0.30a(A) 3.5±0.23a(A) 0.5±0.06a(A) 2.5±0.30a(A) 2.7±0.05a(A) 鳞叶 2.7±0.18B(B) 2.6±0.34B(B) 1.4±0.27A(B) 0.4±0.11A(B) 1.8±0.13B(B) 0.7±0.17B(B) 雌雄
同株刺叶l 3.3±0.04b(B) 2.0±0.21c(B) 0.8±0.05b(B) 0.2±0.08b(B) 1.2±0.17b(B) 1.1±0.01b(B) 鳞叶 3.9±0.12A(A) 3.7±0.24A(A) 1.1±0.18A(A) 0.4±0.12A(A) 2.0±0.12A(A) 2.5±0.13A(A) 注:不同小写字母表示同一参数下刺叶3种性别间差异显著,不同大写字母表示同一参数下鳞叶3种性别间差异显著,括号内不同大写字母表示同一参数下各性别鳞、刺叶间差异显著(P<0.05)。 Notes: Different lowercase letters indicate significant differences between sexes of prickly leaves under the same parameter, different uppercase letters indicate significant differences between sexes of scaly leaves under the same parameter, and different uppercase letters in parentheses indicate significant differences between sexes of scaly and prickly leaves under the same parameter (P<0.05). 由表1可见, 就刺叶的Pn和Gs来说,雌株Pn显著高于雄株和雌雄同株,雌株与雄株的Gs差异不显著。而鳞叶的Pn和Gs变化较复杂,雌株在8:00、10:00时与雄株无差异,在12:00、2:00、4:00时则显著高于雄株。Gs在雌株与雄株间无显著差异。就Tr和WUE而言,雄株和雌株的刺叶的Tr在8:00-14:00上升,之后下降;雌雄同株个体呈现两个峰值,分别出现在10:00和14:00。雄株的Tr在14:00-18:00始终高于雌雄同株个体,而雌株在该时间段高于雄株。鳞叶的Tr变化较为复杂,但雌株的WUE始终高于雄株,在8:00-10:00和14:00-18:00时,雌雄同株个体的WUE显著高于雌株,在12:00-14:00时,两者无显著差异。
比较鳞、刺叶的气体交换参数,发现对于Pn而言,8:00-16:00时雄株刺叶显著高于鳞叶,8:00-10:00时升高,然后持续下降到14:00,之后再次上升。在17:00时,刺叶的下降幅度较大,而鳞叶的下降速度较缓。在雌株中,8:00-18:00时刺叶显著高于鳞叶。在雌雄同株个体中,鳞叶显著高于刺叶,两者的变化趋势一致,且变化幅度较为平稳。对于Gs而言,雄株和雌株的变化趋势与Pn相同。在雄株中,刺叶在8:00-10:00升高,10:00-12:00下降;鳞叶在10:00达到顶峰,12:00-14:00再次升高后下降。在8:00、12:00-14:00,刺叶显著高于鳞叶。在雌株中,刺叶在8:00-12:00持续上升,12:00达到顶峰,鳞叶在10:00达到顶峰。刺叶在16:00达到第2个峰值,之后明显高于鳞叶。在雌雄同株个体中,8:00-18:00,刺叶和鳞叶间无显著差异。对于Tr而言,在雄株的刺叶中从8:00-14:00持续上升,之后下降。鳞叶在8:00-10:00期间先升高后下降,在14:00再次出现峰值。在8:00、12:00-16:00时,刺叶明显高于鳞叶。在雌株中,刺叶和鳞叶都在14:00达到峰值,12:00之前,鳞叶与刺叶的蒸腾速率无显著差异。12:00-14:00鳞叶显著高于刺叶,14:00之后,刺叶高于鳞叶。在雌雄同株个体中,变化曲线与雄株一致,但叶形相反。3种叶形的WUE变化趋势与“午休”时间一致,在14:00时最低。在雄株中,刺叶在12:00之前高于鳞叶,之后两者无显著差异。在雌株中,刺叶的WUE始终高于鳞叶。而在雌雄同株个体中,鳞叶的WUE始终高于刺叶。
2.2 叶绿素荧光参数差异
对比圆柏雌株、雄株和雌雄同株个体刺叶中的6种叶绿素荧光参数(表2),结果表明,Fv/Fm、ФPSⅡ在性别间无显著差异。ETR在雄株中显著高于雌株,雌雄同株与雄株无差异。NPQ在雌、雄株间无显著差异,雌株显著高于雌雄同株。就1/Fo−1/Fm而言,雌雄同株>雌株>雄株(P<0.05)。
表 2 不同性别圆柏异形叶叶绿素荧光参数Table 2. Chlorophyll fluorescence parameters of heterophyllous leaves of different sexes in Sabina chinensis叶形
Leaf shape性别
Sex最大光化光效率
Fv/Fm实际电子传递速率
ETR实际光化光效率
ФPSⅡ光化学淬灭系数
qP非光化学淬灭系数
NPQ光能捕获能力
1/Fo−1/Fm刺叶 雄株 0.78±0.014b 23.60±1.248c 0.22±0.011b 0.41±0.014b 1.96±0.165a 1.71±0.145c 雌株 0.78±0.013b 21.36±1.700d 0.20±0.016b 0.37±0.015c 2.12±0.126a 1.97±0.169b 雌雄同株 0.78±0.009b 24.65±0.150c 0.23±0.001b 0.41±0.003b 1.82±0.180ab 2.35±0.198a 鳞叶 雄株 0.81±0.010a 30.44±3.440a 0.28±0.046a 0.47±0.021a 1.63±0.129b 1.58±0.164d 雌株 0.78±0.011b 27.56±1.190b 0.26±0.030ab 0.44±0.020ab 2.01±0.141a 1.63±0.092cd 雌雄同株 0.80±0.002a 24.25±0.530c 0.22±0.039b 0.42±0.036b 2.07±0.113a 2.21±0.204a 注:同列不同小写字母表示差异显著(P<0.05)。 Note: Different lowercase letters in the same column indicate significant difference (P<0.05). 比较不同性别植株鳞叶中的6种叶绿素荧光参数,结果表明qP、ФPSⅡ在性别间无显著差异。雄株的Fv/Fm显著高于雌株,雄株与雌雄同株无差异。雌株的NPQ显著高于雄株,雌株与雌雄同株个体间无差异。对于1/Fo−1/Fm而言,雌株与雄株无差异,雌株显著高于雌雄同株个体。对于ETR而言,雄株>雌株>雌雄同株个体(P<0.05)。
比较不同性别个体鳞叶和刺叶的6种叶绿素荧光参数,结果发现,雄株中,鳞叶的Fv/Fm、ETR、ФPSⅡ、qP显著高于刺叶,而刺叶的NPQ、1/Fo−1/Fm显著高于鳞叶。雌株中,鳞叶的Fv/Fm、ФPSⅡ、NPQ与刺叶无显著差异,ETR、qP显著高于刺叶,而刺叶的1/Fo−1/Fm显著高于鳞叶。雌雄同株个体中,除鳞叶的Fv/Fm显著高于刺叶(P<0.05)外,其他荧光参数在两种叶形间无显著差异。
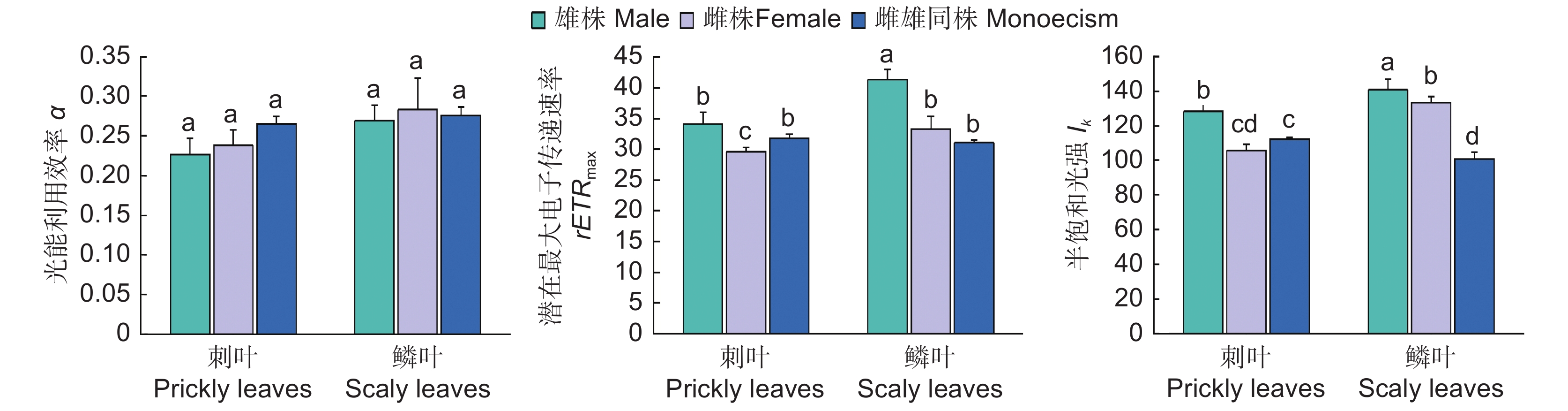
对刺叶α而言,雌雄同株个体>雌株>雄株;对鳞叶α而言,雌株>雌雄同株个体>雄株,但差异均不显著。对3种性别的植株而言,其α均表现为鳞叶>刺叶,但差异不显著(图2)。
在rETRmax方面,对刺叶而言,雄株显著高于雌株,雄株与雌雄同株个体无显著差异;对鳞叶而言,雄株显著高于雌株,雌株与雌雄同株个体无显著差异。比较两种叶形的差异,雄株和雌株均表现为鳞叶>刺叶(P<0.05)(图2)。
在Ik方面,对刺叶而言,雄株显著高于雌株,雌株与雌雄同株个体无差异;对鳞叶而言,表现为雄株>雌株>雌雄同株。比较两种叶形,雄株和雌株均表现为鳞叶>刺叶,雌雄同株个体则表现为刺叶>鳞叶(P<0.05)(图2)。
2.3 非结构性碳水化合物含量比较
由表3可知,3种性别的圆柏,其NSC含量在鳞叶与刺叶间均有显著差异。雌株和雄株中刺叶>鳞叶,雌雄同株个体中鳞叶>刺叶。对比刺叶NSC含量,发现雌株>雄株>雌雄同株,差异显著;分析鳞叶NSC含量,结果显示雌株显著高于雄株(P<0.05),雄株与雌雄同株个体无显著差异。
表 3 不同叶片非结构性碳水化合物含量Table 3. Non-structural carbohydrate content in different leaves性别
Sex叶形
Leaf shape可溶性糖
SS / mg/g淀粉
ST / mg/g非结构性碳水化合物
NSC / mg/g雄株 刺叶 66.33±3.17aB 23.76±1.93aA 90.09±5.10aB 鳞叶 69.20±3.37aA 14.67±2.53bB 83.87±5.90bB 雌株 刺叶 74.58±2.65aA 24.92±2.06aA 99.50±4.71aA 鳞叶 65.70±3.62bAB 21.65±2.11bA 87.34±5.73bA 雌雄同株 刺叶 55.37±4.38aC 22.03±1.80aA 77.40±6.19aC 鳞叶 61.50±3.65bB 20.39±1.28aA 81.89±4.93bB 注:不同小写字母表示相同性别下不同叶形间存在显著差异;不同大写字母表示相同叶形下不同性别间存在显著差异, P<0.05。 Notes: Different lowercase letters indicate significant differences between different leaf shapes in the same sex; different capital letters indicate significant differences between different sexes with the same leaf shape, P<0.05. 雌株和雌雄同株个体的鳞叶SS含量显著高于刺叶,雄株中鳞叶与刺叶差异不明显。分析刺叶SS含量,发现雌株>雄株>雌雄同株,均呈显著差异。对比鳞叶SS含量,结果显示,雌株与雄株之间差异不显著,而雌株显著高于雌雄同株个体(P<0.05)。
雌株和雄株中,刺叶ST含量显著高于鳞叶,而雌雄同株个体无显著差异。刺叶ST含量在3种性别植株中无显著差异。鳞叶ST含量检测发现,雌株显著高于雄株(P<0.05),雌株和雌雄同株个体间无显著差异。
2.4 相关性分析
相关性分析结果显示,NSC与Pn和 1/Fo−1/Fm呈极显著正相关(P<0.01),与ETR呈显著负相关(P<0.05)。
3. 讨论
3.1 叶形对气体交换参数及叶绿素荧光参数的影响
研究显示,同一生境下,圆柏雌、雄株刺叶的光合能力强于鳞叶,刺叶比鳞叶具有更高的Pn、NPQ、1/Fo−1/Fm、Tr、Gs和WUE。其中,NPQ反映的是PSⅡ天线色素吸收的未能用于光合电子传递,而是以热的形式耗散掉的光能部分,这是植物为了避免光抑制和膜受到伤害,调整过剩能量耗散的一套适应机制[34]。NPQ高时可以有效避免刺叶的PSⅡ光损耗,适应强光。1/Fo−1/Fm代表叶片获取光能的能力[35]。刺叶的1/Fo−1/Fm高于鳞叶,表示刺叶能够吸收更多光能,为碳同化提供更多化学能[36]。通常,在相同的饱和PAR下,光合速率越高,植物的光利用效率就越高,在强光下将越不容易受到光胁迫[37]。刺叶较高的光合速率与其较大的气孔导度也有密切关系,气孔导度大有助于叶片的CO2供应[38],同时增强光能的吸收,提高光合作用。
鳞叶的ETR、ФPSⅡ、qP、α、rETRmax和Ik均比刺叶高。ФPSⅡ反映叶片用于光合电子传递的能量占所吸收光能的比例,同时也是光合作用光抑制的度量指标。高ФPSⅡ有利于提高植物的光能转化效率,为暗反应的碳同化积累更多的能量[39]。qP反映PSⅡ天线色素吸收的光能用于光化学电子传递的份额,以及转化成化学能的效率,代表PSⅡ反应中心的开放程度[40]。本研究中,鳞叶的ETR、ФPSⅡ和qP均比刺叶高,表明鳞叶的光能转化效率和PSⅡ反应中心开放程度高于刺叶。在同一光照条件下,PSⅡ反应中心开放程度高时能接受到更多的光量子,鳞叶的PSⅡ受体QA还原速率比刺叶高,具有更强的电子传递能力,使得鳞叶具有更高的PSⅡ光化学效率。鳞叶的α、rETRmax和Ik比刺叶高,与上述推论一致,进一步说明鳞叶的光能转化效率高于刺叶。圆柏幼年期时个体较小,叶片数量较少,总体蒸腾耗水量较小,此时叶片以刺叶为主,具有更高的光合作用,能合成更多的营养物质,从而促进幼苗快速生长。随着植株的生长,刺叶逐渐转变为鳞叶,其光能利用效率及光耐受能力提高,在冬季光照较弱时,可以有效地将光能转化为化学能,使植株能够稳定地进行生理代谢[9]。
NSC是光合作用的产物。树木在白天以NSC的形式储存过剩的光合产物,当夜晚停止光合作用后,植株利用该产物供给代谢[41]。本研究中,在雌、雄株中,刺叶的NSC含量显著高于鳞叶。相关性分析结果显示,NSC含量与Pn、1/Fo−1/Fm呈正相关,与ETR呈负相关,表明净光合速率与光能捕获能力越高,NSC含量越高,进一步说明更高的Pn和1/Fo−1/Fm能使刺叶生产出更多的NSC,以供给植物生长发育。
雌雄同株个体的异形叶在光合参数方面与雌、雄株的趋势相反,而在叶绿素荧光参数方面与雌、雄株的变化趋势相同。目前,有关雌雄同株个体的生理研究较少。Quevedo-Rojas等[42]发现,一些物种能够通过增强NPQ来适应强光照,而其他物种则通过增加ΦPSⅡ和ETR来适应。刺叶的NPQ较高,而鳞叶的ΦPSⅡ、ETR和qP较高,两种叶形同时存在,使圆柏具有适应强光照的能力。
3.2 性别对光合及叶绿素荧光参数的影响
本研究发现,两种叶形的雌株光合能力均强于雄株,表现为雌株的Pn、Tr、WUE、NPQ和1/Fo−1/Fm高于雄株, NSC含量显著高于雄株。而NSC含量与Pn和1/Fo−1/Fm均呈极显著正相关,进一步说明雌株比雄株具有更高的光能捕获能力及热耗散能力,能够生产更多的营养物质,满足其繁殖生长的需要。本研究结果与其他雌雄异株植物中的研究报道一致[25, 26],这可能与雌株获取资源的补偿机制有关。雌株繁殖投入较高,它们会在其他生活史特征上表现出权衡,如雌株叶片在营养或繁殖生长期可增强营养器官的生长和光合作用,以获得更多的可利用资源,这样既能满足繁殖的资源需求,又没有减弱营养生长的资源投入[43]。雄株适应光照的策略与雌株不同,其具有更高的光能转化效率,能够更有效地利用捕获到的光能。雌雄同株个体中,刺叶的叶绿素荧光参数值均高于雌株和雄株,但气体交换参数Pn和WUE低于雄株和雌株;鳞叶的光能捕获能力及NPQ均高于雌株和雄株,光能转化效率低于雌株和雄株,但气体交换参数Pn和WUE高于雌株和雄株。这可能是由于雌雄同株个体同时具有雌株和雄株性质所导致的。
综上所述,圆柏雌株通过较强的光合速率获取较高的非结构性碳水化合物含量,表明雌株更适应强光照;而雄株可通过提高光能转化效率,有效利用光能,更适应弱光照;雌雄同株个体则兼具雌株和雄株的光照利用特点。刺叶可通过较强的光能捕获能力获取更高的NSC含量,同时具有较高的热耗散能力,表明其更适应强光照;而鳞叶的光能利用效率更高,适应弱光照。圆柏兼具鳞叶、刺叶两种叶形,异形叶机制具有“两头下注”的环境适应策略,使得圆柏能够适应不同的光照条件。
-
表 1 浮鹰岛台湾相思群落样方的基本信息
Table 1 Basic information on Acacia confusa community in Fuying Island
样地编号
No.纬度
Latitude (N)经度
Longitude (E)海拔
Elevation / m坡度
Slope / °坡向
Aspect坡位
Slope positionD1 26°35′36.36″ 120°8′32.80″ 68.9 28.9 西北WN 中坡Ms D2 26°35′37.65″ 120°8′40.85″ 136.2 31.6 西南WS 中坡Ms D3 26°36′6.90″ 120°8′56.99″ 51.5 17.6 西W 中坡Ms D4 26°36′6.56″ 120°8′6.25″ 40.0 30.2 西南WS 中坡Ms D5 26°35′59.68″ 120°8′50.20″ 69.5 13.2 西南WN 中坡Ms D6 26°35′58.89″ 120°8′49.65″ 60.92 23.1 西W 中坡Ms D7 26°35′54.10″ 120°8′45.63″ 70.8 44.7 西北WN 中坡Ms D8 26°35′50.16″ 120°9′23.70″ 291.1 22.2 东南ES 上坡Us D9 26°35′50.24″ 120°9′38.86″ 291.1 27.5 西南WS 上坡Us D10 26°35′47.63″ 120°9′35.20″ 296.3 9.5 东E 上坡Us D11 26°36′6.30″ 120°9′22.16″ 180.6 32.5 北N 中坡Ms D12 26°35′0.75″ 120°8′8.80″ 64.5 29.7 西北WN 中坡Ms D13 26°35′16.21″ 120°8′10.85″ 67.1 36.4 西W 中坡Ms D14 26°35′20.17″ 120°8′8.94″ 33.9 27.2 西南WS 中坡Ms D15 26°35′3.25″ 120°8′40.36″ 73.5 27.0 东南ES 中坡Ms D16 26°34′50.74″ 120°8′40.80″ 35.8 27.6 南S 中坡Ms D17 26°35′59.70″ 120°8′20.58″ 67.6 22.7 北N 中坡Ms D18 26°33′56.29″ 120°7′39.85″ 183.6 23.6 西W 上坡Us D19 26°33′59.66″ 120°7′32.63″ 167.0 19.2 东E 中坡Ms D20 26°34′1.06″ 120°7′27.41″ 205.0 10.2 南S 上坡Us D21 26°33′57.03″ 120°7′45.31″ 210.5 13.4 西W 上坡Us D22 26°34′49.31″ 120°8′47.98″ 35.4 6.3 西北WN 中坡Ms D23 26°34′43.89″ 120°8′41.91″ 24.4 28.9 西W 下坡Ds 表 2 浮鹰岛台湾相思群落灌木层主要物种的重要值与生态位宽度
Table 2 Importance values and niche breadths of main shrub species in Acacia confusa community in Fuying Island
序号
No.种名
Species种名缩写
Abbreviation of
species重要值
Importance
value / %Levins 指数
Niche breadth
Levins (BL)Shannon 指数
Niche breadth
Shannon (BS)1 杜虹花Callicarpa pedunculata R. Br. Cp 12.44 17.08 2.94 2 蓬藟Rubus hirsutus Thunb. Rh 6.55 9.95 2.54 3 珊瑚樱Solanum pseudocapsicum L. Sp 5.21 5.51 1.96 4 车桑子Dodonaea viscosa (L.) Jacq. Dv 4.95 4.36 1.67 5 苎麻Boehmeria nivea (L.) Gaudich. Bn 4.88 10.48 2.54 6 鲫鱼胆Maesa perlarius (Lour.) Merr. Mp 3.82 7.35 2.35 7 朴树Celtis sinensis Pers. Cs 3.74 7.13 2.31 8 台湾相思Acacia confusa Merr. Ac 3.67 11.06 2.56 9 茅莓Rubus parvifolius L. Rp 3.08 11.14 2.58 10 雀梅藤Sageretia thea (Osbeck) Johnst. St 3.07 12.80 2.72 11 福建胡颓子Elaeagnus oldhamii Maximowicz Eo 2.96 12.00 2.67 12 算盘子Glochidion puberum (L.) Hutch. Gp 2.90 4.31 1.95 13 滨柃Eurya emarginata (Thunb.) Makino Ee 2.88 3.02 1.26 14 硕苞蔷薇Rosa bracteata Wendl. Rb 2.60 7.76 2.29 15 白簕Eleutherococcus trifoliatus (L.) Hu Et 2.11 4.54 1.83 16 桃金娘Rhodomyrtus tomentosa (Ait.) Hassk. Rt 2.04 1.76 0.88 17 海州常山Clerodendrum trichotomum Thunb. Ct 1.98 2.16 0.87 18 天仙果Ficus erecta Thunb. Fe 1.81 10.50 2.47 19 牡荆Vitex negundo var. Cannabifolia(Sieb.et Zucc.) Hand.-Mazz. Vn 1.53 2.00 0.87 20 乌桕Triadica sebifera (L.) Small Ts 1.50 2.32 0.97 表 3 主要物种总体联结性
Table 3 Overall interspecific associations among main species in shrub layer
方差比率
Variance ratio(VR)检验统计量
Statistic(W)χ2临界值
χ2 threshold(23)检验结果
Results0.87 20.01 13.09,35.17 不显著负联结 -
[1] Ma YM,Li QH,Pan SP,Liu C,Han MS,Brancelj A. Niche and interspecific associations of Pseudoanabaena limnetica–exploring the influencing factors of its succession stage[J]. Ecol Indic,2022,138:108806. doi: 10.1016/j.ecolind.2022.108806
[2] 李锦婷,穆君,申开平,郭云,白小节,等. 小黄花茶群落优势木本植物生态位及种间联结性[J]. 生态学报,2024,44(1):283−294. Li JT,Mu J,Shen KP,Guo Y,Bai XJ,et al. Niche and interspecific association of dominant woody plants in Camellia luteoflora community[J]. Acta Ecologica Sinica,2024,44(1):283−294.
[3] Grinnell J. The niche-relationships of the California thrasher[J]. Auk,1917,34(4):427−433. doi: 10.2307/4072271
[4] Gu L,O’Hara KL,Li WZ,Gong ZW. Spatial patterns and interspecific associations among trees at different stand development stages in the natural secondary forests on the Loess Plateau,China[J]. Ecol Evol,2019,9(11):6410−6421. doi: 10.1002/ece3.5216
[5] 徐满厚,刘敏,翟大彤,刘彤. 植物种间联结研究内容与方法评述[J]. 生态学报,2016,36(24):8224−8233. Xu MH,Liu M,Zhai DT,Liu T. A review of contents and methods used to analyze various aspects of plant interspecific associations[J]. Acta Ecologica Sinica,2016,36(24):8224−8233.
[6] 池源,石洪华,郭振,丁德文. 海岛生态脆弱性的内涵、特征及成因探析[J]. 海洋学报,2015,37(12):93−105. doi: 10.3969/j.issn.0253-4193.2015.12.010 Chi Y,Shi HH,Guo Z,Ding DW. Connotation,features and causes of island ecological vulnerability[J]. Haiyang Xuebao,2015,37(12):93−105. doi: 10.3969/j.issn.0253-4193.2015.12.010
[7] 王国明,叶波. 舟山群岛典型植物群落物种组成及多样性[J]. 生态学杂志,2017,36(2):349−358. Wang GM,Ye B. Floristic composition and diversity of typical plant community in Zhoushan Archipelago,East China[J]. Chinese Journal of Ecology,2017,36(2):349−358.
[8] 陈越琳,黄阿青,肖集泓,王芳,邓传远,陈凌艳. 福建连江县5个无居民海岛种子植物区系及地理分布研究[J]. 热带作物学报,2024,45(2):424−434. Chen YL,Huang AQ,Xiao JH,Wang F,Deng CY,Chen LY. Seed plant flora and distribution on five uninhabited islands in Lianjiang,Fujian province[J]. Chinese Journal of Tropical Crops,2024,45(2):424−434.
[9] 郑俊鸣,张嘉灵,郑建忠,方笑,邓传远. 中国海岛植被修复的适生植物[J]. 世界林业研究,2017,30(3):86−90. Zheng JM,Zhang JL,Zheng JZ,Fang X,Deng CY. Adaptable plant species for island vegetation restoration[J]. World Forestry Research,2017,30(3):86−90.
[10] 张增可,吴雅华,王齐,季凌波,黄柳菁. 环境因子对海岛植物茎、叶功能性状的影响[J]. 广西植物,2020,40(3):433−442. doi: 10.11931/guihaia.gxzw201811051 Zhang ZK,Wu YH,Wang Q,Ji LB,Huang LJ. Effects of environmental factors on stem and leaf functional traits of island plants[J]. Guihaia,2020,40(3):433−442. doi: 10.11931/guihaia.gxzw201811051
[11] 肖君. 福州市主要森林类型林下灌木层生物量和碳密度研究[J]. 林业勘察设计,2023,43(1):1−4. doi: 10.3969/j.issn.1004-2180.2023.01.001 Xiao J. Biomass and carbon density of undergrowth in main forest types in Fuzhou[J]. Forestry Prospect and Design,2023,43(1):1−4. doi: 10.3969/j.issn.1004-2180.2023.01.001
[12] 刘永安,陈小勇,王友芳,马钰洪,马伍卡. 攀西地区台湾相思适宜育苗容器和基质[J]. 东北林业大学学报,2012,40(10):98−102. doi: 10.3969/j.issn.1000-5382.2012.10.022 Liu YA,Chen XY,Wang YF,Ma YH,Ma WK. Proper container and growing media for Acacia richii seedlings in Panzhihua and Xichang regions[J]. Journal of Northeast Forestry University,2012,40(10):98−102. doi: 10.3969/j.issn.1000-5382.2012.10.022
[13] 何晨阳,陈珑,王耘籽,周艳芬,李键,等. 低磷胁迫下内生真菌对台湾相思叶绿素荧光特性的影响[J]. 厦门大学学报(自然科学版),2022,61(5):872−879. He CY,Chen L,Wang YZ,Zhou YF,Li J,et al. Effects of endophytic fungi on chlorophyll fluorescence characteristics of Acacia confusa under low phosphorus stress[J]. Journal of Xiamen University (Natural Science),2022,61(5):872−879.
[14] 黄猛,丁国昌,赵苗菲,阮少宁,李树斌,黄玉梅. 台湾相思开花结实生物学特性研究[J]. 西南林业大学学报,2019,39(1):80−87. doi: 10.11929/j.swfu.201808006 Huang M,Ding GC,Zhao MF,Ruan SN,Li SB,Huang YM. The biological characteristics of flowering and fruiting in Acacia confusa[J]. Journal of Southwest Forestry University,2019,39(1):80−87. doi: 10.11929/j.swfu.201808006
[15] 徐华林,袁天天,王蕾,关开朗,廖文波. 广东内伶仃岛台湾相思群落在15年间的演替研究[J]. 生态科学,2016,35(4):12−22. Xu HL,Yuan TT,Wang L,Guan KL,Liao WB. Succession of Acacia confusa communities during fifteen years in Neilingding Island of Guangdong Province,China[J]. Ecological Science,2016,35(4):12−22.
[16] 王国宏,方精云,郭柯,谢宗强,唐志尧,等. 《中国植被志》研编内容与规范[J]. 植物生态学报,2020,44(2):128−178. doi: 10.17521/cjpe.2019.0272 Wang GH,Fang JY,Guo K,Xie ZQ,Tang ZY,et al. Contents and protocols for the classification and description of Vegetation Formations,Alliances and Associations of vegetation of China[J]. Chinese Journal of Plant Ecology,2020,44(2):128−178. doi: 10.17521/cjpe.2019.0272
[17] 张金屯. 数量生态学[M]. 2版. 北京:科学出版社,2011:1−372. [18] Shannon CE,Weaver W,Wiener N. The mathematical theory of communication[J]. Phys Today,1950,3(9):31−32. doi: 10.1063/1.3067010
[19] Levins RA. Evolution in Changing Environments:Some Theoretical Explorations. (MPB-2)[M]. Princeton:Princeton University Press,1968:1−100.
[20] Schoener TW. Resource partitioning in ecological communities[J]. Science,1974,185(4145):27−39. doi: 10.1126/science.185.4145.27
[21] Pianka ER. The structure of lizard communities[J]. Annu Rev Ecol Evol Syst,1973,4:53−74. doi: 10.1146/annurev.es.04.110173.000413
[22] Schluter D. A variance test for detecting species associations,with some example applications[J]. Ecology,1984,65(3):998−1005. doi: 10.2307/1938071
[23] 尚玉昌. 普通生态学[M]. 2版. 北京:北京大学出版社,2002:35−39. [24] 王刚,赵松岭,张鹏云,陈庆诚. 关于生态位定义的探讨及生态位重叠计测公式改进的研究[J]. 生态学报,1984,4(2):119−127. Wang G,Zhao SL,Zhang PY,Chen QC. On the definition of niche and the improved formula for measuring niche overlap[J]. Acta Ecologica Sinica,1984,4(2):119−127.
[25] 李坤,邢小艺,李逸伦,李晓鹏,李如辰,等. 石林风景区不同石漠化人工修复方式对木本植物群落组成及种群生态位的影响[J]. 生态学报,2020,40(13):4641−4650. Li K,Xing XY,Li YL,Li XP,Li RC,et al. Effect of different artificial restoration methods of Karst rocky desertification on community composition and niche characteristics of woody populations in Shilin scenic area[J]. Acta Ecologica Sinica,2020,40(13):4641−4650.
[26] 刘润红,常斌,荣春艳,姜勇,杨瑞岸,等. 漓江河岸带枫杨群落主要木本植物种群生态位[J]. 应用生态学报,2018,29(12):3917−3926. Liu RH,Chang B,Rong CY,Jiang Y,Yang RA,et al. Niche of main woody plant populations of Pterocarya stenoptera community in riparian zone of Lijiang River,China[J]. Chinese Journal of Applied Ecology,2018,29(12):3917−3926.
[27] 郑俊鸣,李敏,张盟,Tarin MWK,何天友,等. 滨海防护林木麻黄和花吊丝竹混交林群落的种间关联和生态位分析[J]. 热带亚热带植物学报,2021,29(5):465−473. doi: 10.11926/jtsb.4346 Zheng JM,Li M,Zhang M,Tarin MWK,He TY,et al. Interspecific association and niche of mixed forest communities of Casuarina equisetifolia and Dendrocalamus minor var. amoenus in the windbreak of sandy coast[J]. Journal of Tropical and Subtropical Botany,2021,29(5):465−473. doi: 10.11926/jtsb.4346
[28] 马晓迪,姜德刚,刘子琳,王芳,温瑞龙,邓传远. 平潭岛台湾相思群落优势种群生态位研究[J]. 热带作物学报,2022,43(12):2614−2625. doi: 10.3969/j.issn.1000-2561.2022.12.024 Ma XD,Jiang DG,Liu ZL,Wang F,Wen RL,Deng CL. Niche of dominant plant populations of Acacia confusa community in Pingtan Island[J]. Chinese Journal of Tropical Crops,2022,43(12):2614−2625. doi: 10.3969/j.issn.1000-2561.2022.12.024
[29] 肖集泓,熊宽洪,陈越琳,王春晓,江怡萱,等. 福建琅岐岛台湾相思群落灌木层主要物种生态位与种间联结[J]. 热带亚热带植物学报,2023,31(6):805−815. doi: 10.11926/jtsb.4687 Xiao JH,Xiong KH,Chen YL,Wang CX,Jiang YX,et al. Niche and interspecific association of main species in shrub layer of Acacia confusa community in Langqi Island,Fujian Province[J]. Journal of Tropical and Subtropical Botany,2023,31(6):805−815. doi: 10.11926/jtsb.4687
[30] 李燕芬,铁军,张桂萍,郭华. 山西蟒河国家级自然保护区人工油松林生态位特征[J]. 生态学杂志,2014,33(11):2905−2912. Li YF,Tie J,Zhang GP,Guo H. Niche characteristics of an artificial Pinus tabuliformis forest in Manghe National Nature Reserve of Shanxi[J]. Chinese Journal of Ecology,2014,33(11):2905−2912.
[31] 刘润红,陈乐,涂洪润,梁士楚,姜勇,等. 桂林岩溶石山青冈群落灌木层主要物种生态位与种间联结[J]. 生态学报,2020,40(6):2057−2071. Liu RH,Chen L,Tu HR,Liang SC,Jiang Y,et al. Niche and interspecific association of main species in shrub layer of Cyclobalanopsis glauca community in karst hills of Guilin,southwest China[J]. Acta Ecologica Sinica,2020,40(6):2057−2071.
[32] Chai ZZ,Sun CL,Wang DX,Liu WZ. Interspecific associations of dominant tree populations in a virgin old-growth oak forest in the Qinling Mountains,China[J]. Bot Stud,2016,57(1):23. doi: 10.1186/s40529-016-0139-5
[33] 温鑫鸿,王其炳,潘辉,王李睿,陈妍,何东进. 天宝岩柳杉群落主要乔木种群的种间联结性[J]. 森林与环境学报,2022,42(1):1−10. Wen XH,Wang QB,Pan H,Wang LR,Chen Y,He DJ. Interspecific associations of the main tree populations of the Cryptomeria fortunei community in Tianbaoyan[J]. Journal of Forest and Environment,2022,42(1):1−10.
[34] Jonsson BG,Moen J. Patterns in species associations in plant communities:the importance of scale[J]. J Veg Sci,1998,9(3):327−332. doi: 10.2307/3237097
[35] Jiang CC,Fu JQ,Wang YQ,Chai PT,Yang YD,et al. The habitat type and scale dependences of interspecific associations in a subtropical evergreen broad-leaved forest[J]. Forests,2022,13(8):1334. doi: 10.3390/f13081334
[36] 张峰,上官铁梁. 山西翅果油树群落种间关系的数量分析[J]. 植物生态学报,2000,24(3):351−355. doi: 10.3321/j.issn:1005-264X.2000.03.018 Zhang F,Shangguan TL. Numerical analysis of interspecific relationships in an Elaeagnus mollis community in Shanxi[J]. Acta Phytoecologica Sinica,2000,24(3):351−355. doi: 10.3321/j.issn:1005-264X.2000.03.018
[37] 许金石,陈煜,王国勋,柴永福,王茂,等. 陕北桥山林区主要木本植物群落种间联结性[J]. 西北植物学报,2014,34(7):1467−1475. doi: 10.7606/j.issn.1000-4025.2014.07.1467 Xu JS,Chen Y,Wang GX,Chai YF,Wang M,et al. Interspecific association of dominant woody plant communities in Qiaoshan forest region,Shaanxi[J]. Acta Botanica Boreali-Occidentalia Sinica,2014,34(7):1467−1475. doi: 10.7606/j.issn.1000-4025.2014.07.1467
[38] 李丘霖,宗秀虹,邓洪平,万海霞,吴洪英,等. 赤水桫椤群落乔木层优势物种生态位与种间联结性研究[J]. 西北植物学报,2017,37(7):1422−1428. doi: 10.7606/j.issn.1000-4025.2017.07.1422 Li QL,Zong XH,Deng HP,Wan HX,Wu HY,et al. Niche and interspecific association of dominant species in tree layer of Chishui Alsophila spinulosa community[J]. Acta Botanica Boreali-Occidentalia Sinica,2017,37(7):1422−1428. doi: 10.7606/j.issn.1000-4025.2017.07.1422
[39] 李帅锋,刘万德,苏建荣,张志钧. 季风常绿阔叶林不同恢复阶段乔木优势种群生态位和种间联结[J]. 生态学杂志,2011,30(3):508−515. Li SF,Liu WD,Su JR,Zhang ZJ. Niches and interspecific associations of dominant tree populations at different restoration stages of monsoonal broad-leaved evergreen forest[J]. Chinese Journal of Ecology,2011,30(3):508−515.
[40] 邓小艳,刘建国,郭朋军,俞存根,张平,等. 小洋山邻近海域主要游泳动物生态位及种间联结性[J]. 海洋学报,2018,40(1):96−105. doi: 10.3969/j.issn.0253-4193.2018.01.011 Deng XY,Liu JG,Guo PJ,Yu CG,Zhang P,et al. Niche and interspecific association of major nekton in Xiao Yangshan adjacent waters[J]. Haiyang Xuebao,2018,40(1):96−105. doi: 10.3969/j.issn.0253-4193.2018.01.011
[41] 张东梅,赵文智,罗维成. 荒漠草原带盐碱地优势植物生态位与种间联结[J]. 生态学杂志,2018,37(5):1307−1315. Zhang DM,Zhao WZ,Luo WC. Niche and interspecific association of dominant plant species in saline-alkaline soils of desert steppe zone[J]. Chinese Journal of Ecology,2018,37(5):1307−1315.



 下载:
下载: