Research progress on the application of duckweed as a receptor material in heavy metal (metalloid) pollution monitoring
-
摘要:
水体重(类)金属污染已成为当今国内外重要的环境问题,对水生生态系统稳定和人类健康造成严重威胁。目前工程上控制废水中重(类)金属污染的方法存在效率低、成本高、耗时长等问题,而且修复工程本身可能对环境造成二次污染,导致生态系统进一步被破坏。因此,寻求高效、环保的解决方案至关重要。此外,重(类)金属的存在也给淡水生态环境带来了巨大压力,如何高效监测这些重(类)金属并对其毒性进行科学的评价,成为当今环境科学领域的热点问题。传统上讲的水生漂浮植物浮萍(Duckweed)实际上是浮萍科浮萍属(Lemna)、紫萍属(Spirodela)和芜萍属(Wolffia)的总称。由于它们易在受控条件下培养且生长迅速,能对重(类)金属污染进行早期预警和后期修复等特点,目前已成为淡水生态学研究中的重要模式植物。本文对近20年来浮萍科植物作为受试材料指示淡水环境中重(类)金属生态毒性与毒理的研究与应用进行了回顾,总结了不同水平(分子、细胞、个体)浮萍科植物的响应特征和应用特点,并对现存的挑战和未来的发展趋势进行了展望。
Abstract:Heavy metal (metalloid) pollution in aquatic systems is a critical global environmental concern, threatening the stability of aquatic ecosystems and posing severe risks to human health. Current engineering approaches for treating heavy metal (metalloid) pollution in wastewater are hindered by low efficiency, high costs, prolonged treatment times, and the potential to cause secondary pollution, further exacerbating ecosystem degradation. Consequently, the development of efficient, cost-effective, and environmentally sustainable solutions has become a priority. Furthermore, heavy metal (metalloid) contamination imposes immense pressure on freshwater ecosystems, underscoring the urgent need for efficient monitoring tools and scientific methods for evaluating their toxicity. Duckweed, a term encompassing various genera within the family Lemnaceae, including Lemna, Spirodela, and Wolffia, has emerged as a promising model plant in freshwater ecological research. Its rapid growth, ease of cultivation under controlled conditions, and sensitivity to environmental changes make it an ideal candidate for both early detection and subsequent remediation of heavy metal (metalloid) pollution. This review consolidates two decades of research on the application of duckweed as a bioindicator and remediation agent for heavy metal pollution in aquatic ecosystems. We summarize its response mechanisms and applications across molecular, cellular, and individual levels, providing insights into existing challenges and future development trends. This review aims to provide a theoretical framework for its strategic and effective application in monitoring and mitigating heavy metal (metalloid) pollution in freshwater ecosystems.
-
Keywords:
- Duckweed /
- Heavy metal (metalloid) /
- Aquatic ecosystem /
- Ecological risk /
- Oxidative stress /
- Floating plant
-
无居民海岛是指我国海域范围内不用于人口居住的岛屿[1],与有人居住的岛屿数量相比,我国有许多无人居住的岛屿,这些岛屿及周边海域拥有丰富的海洋资源,具有巨大的发展潜力,对我国海洋经济发展和资源合理利用具有重要作用[2]。岛屿植被是岛屿生态系统的重要组成部分,了解岛屿的植物资源对于确定植被的恢复和建设方式具有指导意义[3]。近年来,国内对无居民海岛植被的研究日益增多,主要集中于无居民海岛植物群落的相关环境因子[4-6]、外来入侵植物[7]和海岛开发利用[8-10]等方面。然而,目前对无居民海岛植物物种组成及区系特征的相关研究报道较少。
本研究在实地调查和查阅以往文献的基础上,总结分析了福建平潭5个无居民海岛的种子植物物种组成和地理分布型类型,探索该地区种子植物区系的组成和地理分布,研究结果旨在为保护海岛特色植物群落、促进海岛生态规划和创造海岛优质生态环境提供线索。
1. 材料与方法
1.1 研究区概况
平潭为福建省管辖的综合实验区,位于福建省东部,是福建省第一大岛。平潭属亚热带季风气候,夏季主要为西南风,冬季以东北风为主[11]。本次调查选取包括光幼屿(25°34′54.48″N,119°50′4.56″E)、红山屿(25°34′41.88″N,119°50′27.96″E)、黄门岛(25°27′40.68″N,119°40′ 50.88″E)、姜山岛(25º26′30.12″N,119º48′28.30″E)、龙母屿(25°20′49.26″N,119º41′48.74″E)在内的5座无居民海岛,各岛概况见表1。
表 1 平潭5个无居民海岛基本情况Table 1. Basic information of 5 uninhabited islands in Pingtan岛屿
Island面积
Area / hm²近岸距离
Inshore distance / km周长
Perimeter / m海拔
Altitude / m周长/面积
Perimeter area ratio物种数
Species光幼屿 6.22 22.57 1 075.4 45.1 0.017 77 红山屿 3.07 23.05 1 015.0 33.2 0.033 53 黄门岛 7.18 3.89 1 417.3 24.2 0.020 114 姜山岛 40.24 1.12 4 951.2 22.4 0.012 115 龙母屿 2.88 8.14 993.3 20.8 0.034 102 1.2 调查对象及方法
本研究采用样方法和样线法相结合的技术路线,对平潭5个无居民海岛的植物资源进行详尽的全面踏勘。样方法设置的乔木群落样方面积为20 m×20 m,共22个,四角设置4个5 m×5 m的灌木样方,另外取5个1 m×1 m的草本样方,分别位于样地的四角及中部位置。样线法设置方法为按环岛样线和东西向或南北向沿岛屿中部设置样线的方式,记录样线左右10 m以内出现的植物。随时记录沿路所见植物种类,拍摄照片,对于现场无法识别的植物记录其细节特征,查阅《福建植物志》[12]进行鉴定。依据中国外来入侵物种信息系统(http://www.iplant.cn/ias)和《中国入侵植物名录》[13] 统计外来植物。采用《世界种子植物科的分布区类型》[14]划分种子植物科分布区类型,属、种的分布区类型根据《中国种子植物属的分布区类型》[15] 并结合中国植物志电子版(https://www.iplant.cn/)进行划分。
剔除外来植物后,根据以上方法划分该地种子植物科属种的分布区类型,分析其种子植物区系特征。通过热带属数/温带属数(R/T)研究其区系成分,以平潭5个无居民海岛与其他无居民海岛属的分布区类型为基础,进行聚类分析。采用Jaccard 相似性系数[16],分别计算平潭5个无居民海岛之间的属-种相似性系数,并对岛屿空间特征参数的相关性进行分析。以上数据处理均利用Excel 2016和SPSS 26软件完成。
2. 结果与分析
2.1 平潭5个无居民海岛的种子植物物种组成
调查发现,5个无居民海岛共有种子植物213种(含种下单位,下同),隶属71科179属。其中,被子植物70科178属212种;裸子植物仅1种;单子叶植物10科33属48种,分别占总科、属、种数的14.08%、18.44%和22.54%;双子叶植物61科146属165种,分别占总科、属、种数的85.92%、81.56%和77.46%(表2)。
表 2 平潭5个无居民海岛种子植物物种分类群统计Table 2. Statistics of vascular plant species taxa of 5 uninhabited islands in Pingtan分类群
Plant taxon科数(占比)
No. of families(Percentage / %)属数(占比)
No. of genera(Percentage / %)种数(占比)
No. of species(Percentage / %)裸子植物 1(1.41) 1(0.56) 1(0.47) 被子植物 70(98.59) 178(99.44) 212(99.53) 双子叶植物 61(85.92) 146(81.56) 165(77.46) 单子叶植物 10(14.08) 33(18.44) 48(22.54) 合计 71(100) 179(100) 213(100) 根据整理的种子植物名录,外来草本植物共有42种(19.72%),隶属于20科38属,如鬼针草(Bidens Pilosa L.)、飞扬草(Euphorbia hirta L.)、蟛蜞菊(Wedelia chinensis (L.) Pruski)、牵牛(Pharbitis ni (L.) Roth)和白花地胆草(Elephantopus tomentosus L.)等;原生草本植物共有171种(80.28%),隶属于65科145属。可见,平潭5个无居民海岛的种子植物以原生植物分布为主。
2.2 种子植物生活型统计与分析
植物生活型是植物对环境长期适应的表现形式,体现在外部形态、结构等方面,可反映植物与环境间的关系[17, 18],并揭示植物对环境的生态适应性[19]。由表3可知,植物生活型有乔木、灌木、藤本和草本4种类型。平潭5个无居民海岛的种子植物生活型占比大小依次是草本(59.65%)、灌木(28.07%)、藤本(8.19%)和乔木(4.09%)。草本植物种数最多,其中,多年生草本58种,包括烟豆(Glycine tabacina Benth)、中华补血草(Limonium sinense (Girard) Kuntze)和厚藤(Ipomoea pes-caprae (L.) R. Brown)等;一、二年生植物44种,分别占总种数的21.64%和4.09%,包括画眉草(Eragrostis pilosa (L.) Beauv)、马唐(Digitaria sanguinalis (L.) Scop)和爵床(Justicia procumbens L.)等。
表 3 平潭5个无居民海岛种子植物种子植物生活型统计Table 3. Statistics of life forms of seed plants of 5 uninhabited islands in Pingtan生活型
Life form种数
No. of species占总种数的百分比
Account of total species / %乔木 常绿 2 1.17 落叶 5 2.92 灌木 常绿 31 18.13 落叶 17 9.94 藤本 常绿木质藤本 5 2.92 落叶木质藤本 4 2.34 多年生草质藤本 5 2.92 草本 一年生 37 21.64 二年生 7 4.09 多年生 58 33.92 合计 171 100 2.3 种子植物区系地理成分统计与分析
2.3.1 科分布区类型
在科水平上,平潭5个无居民海岛种子植物65科的地理成分可划分为6个类型4个变型(表4)。其中,世界广布科有29个,占总科数的44.62%,包括菊科、禾本科、蔷薇科、苋科和蝶形花科等。科的地理分布中热带成分占比优势显著,热带性质突出。经统计,热带性质科共28个,占总科数(除世界广布科)的77.78%。热带性质的科主要有大戟科、夹竹桃科、锦葵科和含羞草科等。温带性质的科共8个,包括忍冬科和胡颓子科等,占总科数(除世界广布科)的22.22%。
表 4 平潭5个无居民海岛科、属、种的分布区类型统计Table 4. Distribution pattern statistics of vascular plants families, genera and species on five uninhabited islands in Pingtan分布区类型及其变型
Distribution types and variants科
Families属
Genera种
Species数量
No.占比
Percentage / %数量
No.占比
Percentage / %数量
No.占比
Percentage / %1. 世界分布 29 – 15 – 7 – 2. 泛热带分布 23 63.89 52 40.00 16 9.76 2-1. 热带亚洲-大洋洲和热带美洲分布 1 2.78 2 1.54 1 0.61 2-2. 热带亚洲、非洲和南美洲间断分布 1 2.78 4 3.08 5 3.05 2S. 以南半球为主的泛热带 1 2.78 0 0 0 0 3. 热带亚洲和热带美洲间断分布 1 2.78 4 3.08 7 4.27 4. 旧世界热带分布 1 2.78 14 10.77 6 3.66 4-1. 热带亚洲、非洲和大洋洲间断或星散分布 0 0 2 1.54 3 1.83 5. 热带亚洲至热带大洋洲分布 0 0 8 6.15 19 11.59 6. 热带亚洲至热带非洲 0 0 2 1.54 4 2.44 7. 热带亚洲(印度-马来西亚)分布 0 0 2 1.54 29 17.68 8. 北温带分布 4 11.11 14 10.78 7 4.27 8-4. 北温带和南温带(全温带)间断分布 3 8.33 3 2.31 3 1.83 9. 东亚和北美洲间断分布 0 0 6 4.62 4 2.44 10. 旧世界温带分布 0 0 4 3.08 4 2.44 10-1. 地中海区、西亚(或中亚)和东亚间断分布 0 0 3 2.31 1 0.61 10-3. 欧亚和南部非洲(有时也在大洋洲)间断分布 0 0 1 0.77 0 0 11. 温带亚洲 0 0 0 0 17 10.37 14. 东亚分布 1 2.78 7 5.38 14 8.54 14-1. 中国-喜马拉雅(SH) 0 0 0 0 3 1.83 14-2. 中国-日本(SJ) 0 0 1 0.77 9 5.49 15. 中国特有分布特有 0 0 1 0.77 12 7.32 合计 65 100 145 100 171 100 2.3.2 属分布区类型
在属水平上,平潭5个无居民海岛的种子植物共145属,其地理成分可划分为12个类型7个变型(表4)。世界广布类型的属有15个,占总属数的10.34%,包括莎草属(Cyperus)、苋属(Amaranthus)和马唐属(Digitaria)等。属的分布区类型中热带成分占主导地位,有90个,占总属数(除世界广布属)的69.24%,热带性质明显,包括大戟属(Euphorbia)、南蛇藤属(Celastrus)、紫珠属(Callicarpa)和马齿苋属(Portulaca)等。温带性质的属共40个,占总属数(除世界广布属)的30.02%,包括山麦冬属(Liriope)、胡枝子属(Lespedeza)、胡颓子属(Elaeagnus)和络石属(Trachelospermum)等。
2.3.3 种分布区类型
在种水平上,平潭5个无居民海岛共有171种种子植物(不含外来植物),其地理成分可划分为13个分布区类型7个变型(表4)。世界广布类型的种有7个,占总种数的4.09%,如莎草属(Cyperus)、苋属(Amaranthus)和堇菜属(Viola)等。种的分布区类型中热带成分占主导地位,热带性质(2~7型)的种有90个,占总种数(除世界广布种)的54.88%,热带性质明显,包括马蹄金(Dichondra micrantha Urban)、紫珠(Callicarpa bodinieri Levl)和算盘子(Glochidion puberum (L.) Hutch)等。温带性质(8~14型)的种共62个,占总种数(除世界广布种)的37.80%,有桑(Morus alba L.)、滨柃(Eurya emarginata (Thunb.) Makino)和络石(Trachelospermum jasminoides (Lindl.) Lem)等。
2.3.4 滨海特有植物
仅分布于岛屿或滨海地区且具有明显岛屿特征的植物被称为滨海特色植物[20]。由于海岛的特殊环境结构,平潭5个无居民海岛分布有较多的滨海特色植物,共14科24属24种。其中,滨海前胡(Peucedanum japonicum Thunb)、滨柃(Eurya emarginata (Thunb.) Makino)、肉叶耳草(Hedyotis coreana (DC.) Neupane & N. Wikstr)和滨海珍珠菜(Lysimachia mauritiana Lam)等植物既适应海岛的气候与土壤,又具有滨海特色与观赏价值,同时具有较高的园林利用价值和极高的生态价值。
2.4 平潭5个无居民海岛与其他海岛种子植物区系比较分析
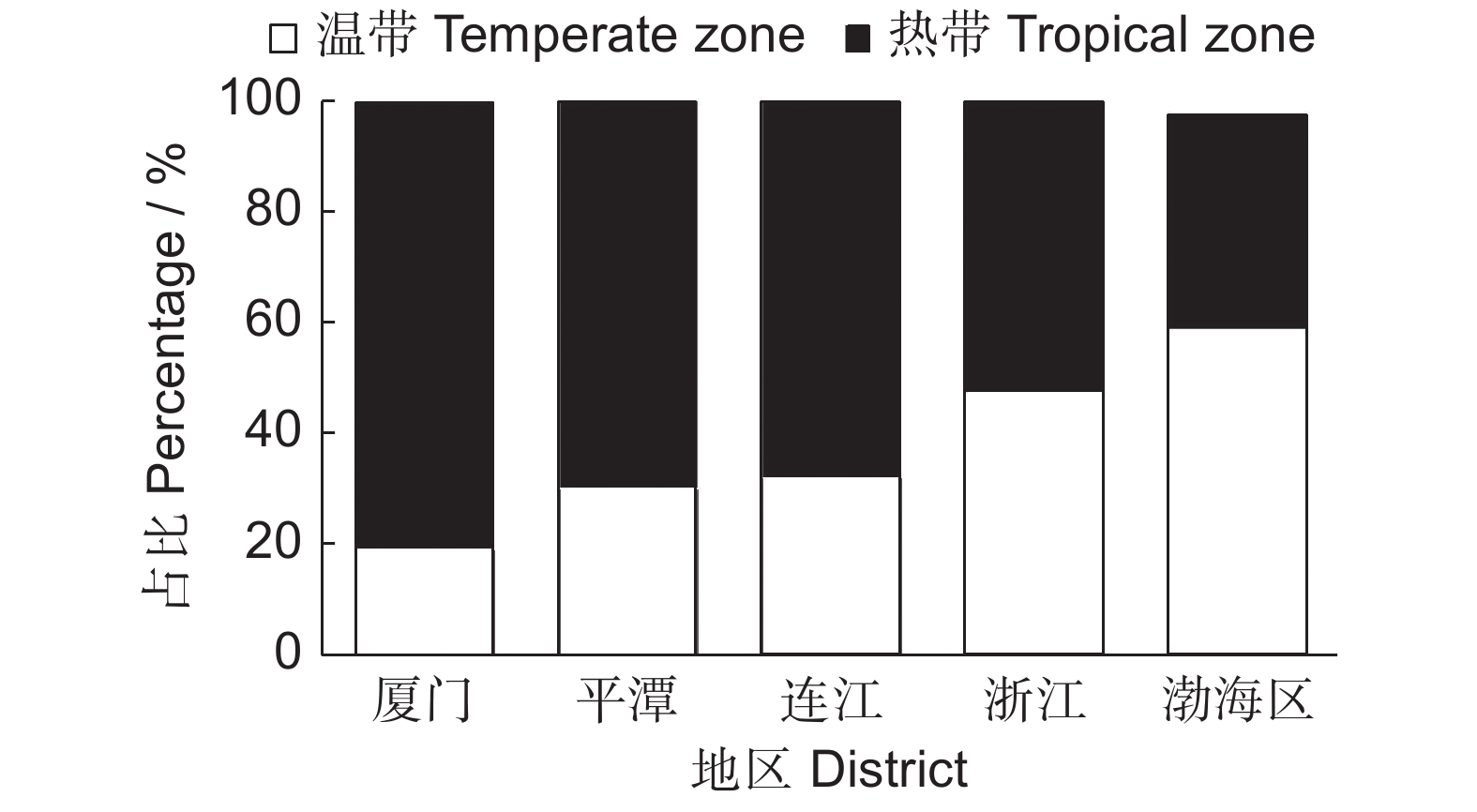
对平潭5个无居民海岛与其他海岛区系进行种子植物属的分布区类型比较,结果见表5。各个地区中泛热带分布型占比较高,为24.03%~40.00%,厦门近岸海域无居民海岛植物区系的R/T值(4.23)远高于其他海岛,热带性质最强烈;纬度相近的平潭和连江无居民海岛的R/T值接近,且均大于2,分别为2.31和2.13,热带优势明显。相反,纬度相对较高的浙江无居民海岛和渤海区9个无居民海岛的热带成分比例稍低,而温带分布比例略高,R/T值最低,仅为1.11和0.66,两者的北温带分布比例则远高于前三者,温带性质趋势明显,符合R/T值的排列顺序。将世界分布属和中国特有属排除后,重新计算这些地区的R/T值(图1)。由图1可知,随着纬度的增加,热带分布型所占比例逐渐降低,而温带分布型占比则逐渐上升,植物区系具有热带向温带过渡的特点,与中国植被类型的分布规律一致[21]。
表 5 平潭与其他地区无居民海岛种子植物属的分布区类型比较Table 5. Comparison of distribution types of seed flora and genera among five uninhabited islands in Pingtan and different island regions分布区
类型
Distribution type平潭(5个)
Pingtan (5)
(25°15′~25°45′N)厦门近岸
Xiamen
(24°25′~24°35′N)连江(5个)
Lianjiang (5)
(26°07′~26°27′N)浙江(5个)
Zhejiang (5)
(28°12′~28°18′N)渤海(9个)
Bohai Sea
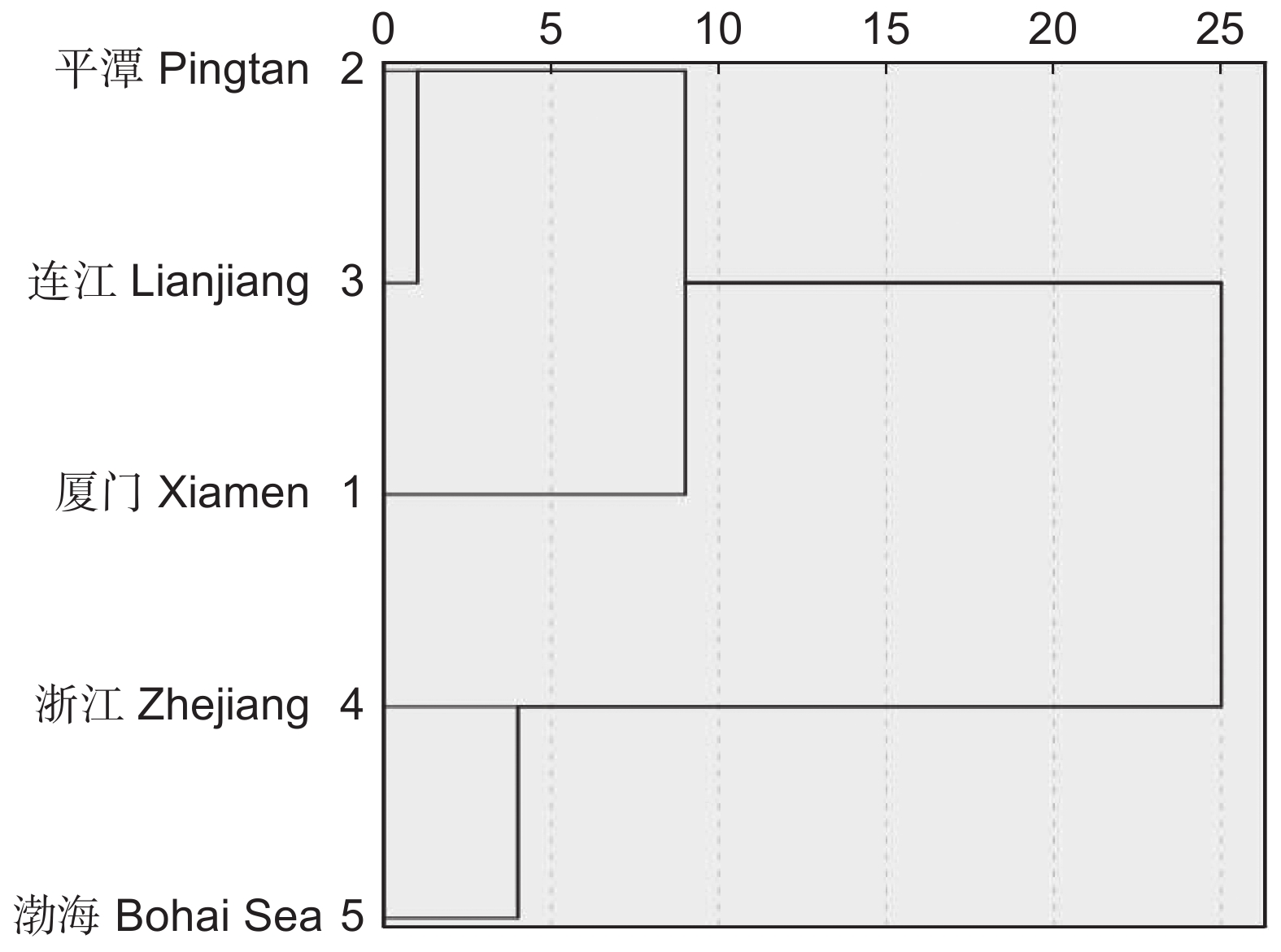
(37°06′~40°55′N)1 10.34 9.35 10.90 12.34 16.67 2 40.00 29.50 36.05 24.03 24.71 3 2.76 11.87 7.48 1.30 0.00 4 11.03 8.63 8.16 7.14 4.71 5 5.52 8.99 6.80 5.19 2.35 6 1.38 6.83 4.08 5.19 3.53 7 1.38 7.19 5.44 3.25 3.53 8 11.72 7.91 13.60 23.38 30.59 9 4.14 3.24 4.08 4.55 5.88 10 5.52 2.16 5.44 4.55 9.41 11 0.00 0.00 0.68 0.64 5.88 12 0.00 0.36 0.00 0.00 2.35 13 0.00 0.00 0.00 0.00 0.00 14 5.52 3.60 8.16 8.44 4.71 15 0.69 0.36 0.00 0.00 2.35 R/T 2.31 4.23 2.13 1.11 0.66 注:1,世界广布;2,泛热带分布;3,热带亚洲和热带美洲分布;4,旧世界热带分布;5,热带亚洲至热带大洋洲分布;6,热带亚洲至热带非洲分布;7,热带亚洲分布;8,北温带分布;9,东亚和北美间断分布;10,旧世界温带分布;11,温带亚洲分布;12,地中海及西亚至中亚分布;13,中亚分布;14,东亚分布;15,中国特有分布。 Notes: 1, Cosmopolitan; 2, Pantropic; 3, Tropical Asia & tropical America disjunct; 4, Old world tropical distributed; 5, Tropical Asia to tropical Australasia distributed; 6, Tropical Asia to tropical Africa distributed; 7, Tropical Asia distributed; 8, North temperate distributed; 9, East Asia & North America disjunct; 10, Old world temperate distributed; 11, Temperate Asia; 12, Mediterranea, West Asia to Central Asia; 13, Central Asia; 14, East Asia distributed; 15, Endemic to China. 为进一步探讨平潭5个无居民海岛与其他地区植物区系的相似性,对其属的分布区类型比率进行聚类分析。如图2所示,当欧氏距离约为10时,可将5个地区划分为2组。第1组为厦门近岸海域无居民海岛、平潭5个无居民海岛和连江县5个无居民海岛,3个地区纬度相近,植物热带成分占50%以上;第2组为渤海区9个无居民海岛和浙江5个无居民海岛,其植物热带成分明显减少,占30%左右。
2.5 不同岛屿间植物的物种相似度与空间特征关系
计算平潭5个无居民海岛属相似性系数与种相似性系数。结果显示,5个海岛在属级水平上相似性程度均不高,属的相似性系数大于30%的有光幼屿分别与红山屿(48%)和黄门岛(32%);以及姜山岛分别与龙母屿(47%)和黄门岛(31%);相似性系数小于30%的有黄门岛与红山屿(28%)、姜山岛分别与光幼屿(21%)和红山屿(20%),龙母屿分别与光幼屿(26%)、红山屿(22%)、黄门岛(28%)(附表1
1 ))。相较于属级水平,各个海岛之间在种级水平上的相似性程度有所降低,姜山岛与光幼屿(19%)以及红山屿(17%)之间的相似度均小于20%,说明这3个海岛在种水平上的差异较大(附表
1 ))。分析物种相似性系数Cj与岛屿空间特征的相关性,结果表明,Cj与面积比(δA)(0.577)、岸线长度比(δPer)(0.585)和高程比(δE)(0.591)呈正相关,与周长面积比的比值(δPAR)(−0.602)和近岸距离比(δI)(−0.211)呈负相关,但均不显著。
3. 讨论
3.1 平潭5个无居民海岛种子植物区系特征
平潭5个无居民海岛的种子植物共有71科179属213种,剔除外来物种后,共65科145属171种,与福建种子植物202科1596属4416种相比[22],本研究区域种子植物的科、属 、种数分别占了福建省植物区系的32.18%、9.09%和3.87%。按照生活型进行分类,草本植物占优势,共计102种(59.65%);其次为灌木48种(28.07%);乔木和藤本的种数则较少,分别是7种(4.09%)和14种(8.19%)。
平潭海岛的种子植物区系优势较为明显,含有较多热带科以及亚热带科,区系科、属、种的地理性质均以热带为主,科的热带成分占77.79%,温带成分仅占22.22%;属的热带成分占69.24%,温带成分为30.02%;种的热带成分占54.88%,温带成分为37.80%。种子植物中含有较多的热带科以及亚热带科,与福建省植物区系的特征相符合。科、属的热带成分以泛热带分布为主,种的热带成分以热带亚洲为主;科、属的温带成分以北温带为主,种的温带成分以温带亚洲及东亚分布为主,整体呈现显著的由热带向温带过渡的趋势。通过对平潭与其他地区岛屿的属分布区类型进行对比发现,除浙江和渤海区的无居民海岛外,其余岛屿的R/T值均具有明显的热带性质,符合其所处的亚热带海洋季风气候区的地理位置及热带起源[23],这一结果与相关研究[24]一致。随着纬度的增加,不同海岛植物区系的属级分布类型中,温带分布型逐渐增加,热带分布型占比逐步减少,显示出海岛植物区系地理成分的纬向分异性。
3.2 平潭5个无居民海岛间植物的物种相似度与空间特征关系
分析平潭5个无居民海岛植物间的种相似性系数及其与岛屿空间特征的相关性,发现Cj与面积比、岸线长度比和高程等空间特征均无显著相关性。平潭5个无居民海岛中,物种组成相似性较高的有光幼屿与红山屿、姜山岛与龙母屿、黄门岛与光幼屿,以及姜山岛与黄门岛,但均未超过50%,说明各个岛屿植物间的亲缘关系较远。
通常海岛面积越大,环境异质性越高,物种丰富度也会更高,这是岛屿生物地理学的普遍规律[25, 26]。平潭5个无居民海岛中姜山岛的面积最大,物种数也最多。但面积最小的龙母屿,其物种数却居第3,原因之一可能是龙母屿的灌木、草本能够较好地适应岛屿环境,且草本植物在该岛占绝对优势[27],其生存所需空间比乔木小得多,所以受岛屿面积的制约较小[28, 29];另一方面,尽管平潭5个无居民海岛同属一个气候带,但不同海岛间的物种数存在差异主要是由海岛环境的特殊性决定的[30]。
由于各个岛屿具有独立性,形成了不同的生态环境,并进行长时间的自然选择[31, 32],因此导致各岛屿的植物种类存在差异。本文仅以分布型从宏观层面对平潭5个无居民海岛的种子植物进行了区系分析,没有从微观层面进行探讨,后期对植物区系的研究可考虑土壤因子、地质变化和岛屿间植物竞争生态位等方面的因素。
3.3 平潭5个无居民海岛的保护和利用
海岛植物物种丰富度与人为活动因素紧密相关[33]。有居民海岛由于长期受人为干扰,海岛植被中的原生植被可能被破坏,从而对原生植物的生态位造成威胁,此外,海岛开发也会导致一定程度上原生植物数量的减少和次生植被的增加[34]。相比有居民海岛,无居民海岛植物受人为干扰较小。
平潭5个无居民岛屿的种子植物以原生植物为主,但海岛上的入侵植物也需要重视,如鬼针草(Bidens pilosa L.)、马缨丹(Lantana camara L.)和小蓬草(Conyza canadensis L.)等。为保护当地的物种多样性,避免物种的进一步同质化[35],应建立一个长期稳定的实时更新数据库,开展生态治理研究[36]。针对以上入侵植物,建议制定具有针对性的防控策略,尽可能挖掘其潜在的利用价值[37],做到有效防控与利用。
-
表 1 浮萍对重(类)金属的积累与吸收能力汇总
Table 1 Accumulation and absorption capacity of duckweed for heavy metals (metalloid)
浮萍种类
Duckweed species重(类)金属种类
Heavy metals (metalloid)环境条件
Environmental
conditions累积水平或去除效率
Accumulation level (mg/g dry
weight) or removal efficiency (%)参考文献
Reference紫萍
Spirodela polyrhiza
(L.) Schleid.Cd 0.04~0.7 mg/L;Hoagland培养基 0.1~0.7a [27] As 采矿废水 ~80%b [28] Cd Cd2 + :2 mg/L;塘水 ~5.8a [29] As、Si、Cd、
Pb、Cr、NiAs:117;Si:249;Cd:163;
Pb:79.4;Cr:138;Ni:36.5
受污染湖水联合暴露,单位为mg/LAs:0.7a;Si:2.0a;Cd:0.1a;
Pb:0.05a;Cr:0.2a;Ni:0.1a[26] Fe、Cu、Cd、Cr、Zn、Ni、As 受污染湖水 40%~60%b [30] Se 0~5 mg/L;Hoagland培养基 Se4 + :0.06a;Se6 + :0.05a [22] 浮萍
Lemna minor L.As 0.5~2 mg/L ~70%b [31] Se 10 mg/L Se采矿废水 ~19.5a [23] Zn、Pb Zn:0.5~20 mg/L;Pb:1~8 mg/L
Coïc & Lessaint培养基Zn:70%~80%b
Pb:~50%b[32] Cd、Cr、Ni、Pb 工业废水 Cd: 5%b;Pb:79%b;
Cr:32%b;Ni: 4%b[33] Co、Ni 0~200 μmol/L;Hoagland培养基 Co:5.4a;Ni:2.0a [34] Cu、Cd Cu:2.5 μmol/L;Cd:5 μmol/L;
Steinberg培养基Cu:0.43~0.54 a;
Cd:0.70~1.06 a[35] Hg、Zn、Pb、Cu Cu:0.5;Hg:0.25;Pb:0.25;Zn:0.25
Murashigey & Skoog培养基Cu:99.8%b;Hg:99.5%b
Pb:97.9%b;Zn:94.4%b[36] B 2 mg/L;Hoagland培养基 ~15.5%b [37] 鼓凸浮萍
Lemna gibba L.Cd、Cu、Zn Cd:0.001~0.1 mg/L;
Hoagland培养基Cu & Zn:70%~80%b;
Cd:~90%b[38] Pb、Cr 2~15 mg/L Pb:91%~96%;
Cr:86%~95%[39] Cu 0.2~1.0 mg/L;Hoagland培养基 ~0.8a [40] 芜萍
Wolffia arrhiza
(L.) WimmerAs 0.1 mg/L;Hoagland培养基 0.02a [41] 注:a为累积水平;b为去除效率。
Notes: a, accumulation level; b, removal efficiency.表 2 重(类)金属对浮萍的毒性效应与机制
Table 2 Toxic effects and mechanisms of heavy metals (metalloid) on duckweed
浮萍种类
Duckweed species重(类)金属种类
Heavy metals (metalloid)培养条件
Cultural conditions毒性终点
Toxicity endpoint参考文献
Reference紫萍
Spirodela polyrhiza
(L.) Sch leid.Cd、Cu Cd:0~8 mg/L;
Cu:0~8 mg/L;
Cd + Cu:0~16 mg/L;
24 h
Hoagland培养基8 mg/L Cd,24 h,
叶绿素a,b,a/b:↓,↓,↓;
PSⅡ光化学最大量子产率:↓
8 mg /L Cu,24 h,
叶绿素a,b,a/b, ↓,↓,↓;
PSⅡ光化学最大量子产率:↓。
8 mg/L Cu + 8 mg/L Cd,24 h,
叶绿素a,b,a/b:↓,↓,↓;
PSⅡ光化学最大量子产率:↓[46] Cd 0.4~6.4 μmol/L
96 h
Hoagland培养基6.4 μmol/L,96 h ,
鲜重:↓;干重:↓
POD:↑[27] Ce、Y 0~60 μmol/L Ce/Y
15 d
Hoagland培养基60 μmol/L Ce/Y,15 d,
鲜重:↓;细胞凋亡:↑;
棕桐油酸:↓;亚油酸:↓;亚麻酸:↓;
MDA:↑; [O2•-]:↓; [H2O2]:↓;
SOD:↓; POD:↑; CAT:↓;
可溶性蛋白:↓; 谷胱甘肽还原酶:↓
还原性谷胱甘肽:↓
抗坏血酸过氧化物酶:↓; 抗坏血酸:↓
叶绿素a,b,类胡萝卜素:↓,↓,↓;
Fv/Fm:↓;Fv/Fo:↓;Fo/Fm:↑;
非光化学淬灭:↓; 光化学淬灭:↓;
叶绿体光合磷酸化:↓[47] Se 0~5 mg/L
7 d
Hoagland培养基5 mg/L Se4 + /Se6 + ,7 d,
鲜重:-; 叶绿素a (Se6 + ):↓;
叶绿素b (Se6 + ): ↓; Car:-;
清蛋白:-; 球蛋白:↓; 醇溶蛋白:-; 谷蛋白:-[22] Cd 2.5~10 μmol/L Cd2 +
4d
Hoagland培养基10 μmol/L Cd2 + , 4 d,
MDA:↑;细胞凋亡:↑;
叶绿素a,b,类胡萝卜素: ↓,↓,↓;
SOD:-;CAT:↓;抗坏血酸:↑;
谷胱甘肽过氧化物酶:↑;
谷胱甘肽还原酶:↓;
还原性谷胱甘肽:↑;
饱和脂肪酸:↑; 不饱和脂肪酸:↓;
脯氨酸:↑; 可溶性糖:↑; 可溶性蛋白:↓[48] Zn、Cd、Cu 0.16~16 μmol/L Cu2 +
0.009~0.09 μmol/L Cd2 +
1.54~385 μmol/L Zn2 +
7 d Hoagland培养基联合暴露7 d,
MDA:↑; 叶绿素a,b :↓,↓;
CAT:↓; SOD:↑; POD:↑;
谷胱甘肽还原酶:↓[49] 少根萍
Landoltia punctata (G. Mey.)Les &D. J. CrawfordSe 0~5 mg/L
7 d
Hoagland培养基5 mg/L Se4 + /Se6 + ,7 d,
鲜重(Se4 + ):↓;
叶绿素a,b,类胡萝卜素: ↓,↓,↑;
清蛋白(Se4 + ):↑; 球蛋白:↑
醇溶蛋白:↑(Se4 + ),↓(Se6 + ); 谷蛋白:↑[22] 浮萍
Lemna minor L.Co、Ni 0~200 μmol/L
7 d
Hoagland培养基200 μmol/L Co/Ni,7 d,
鲜重:↓;
柠檬酸:↑; 苹果酸:↑; 草酸:↑; 酒石酸:↓;
苹果酸脱氢酶:↑(Co); 柠檬酸合成酶:↑(Co);
异柠檬酸脱氢酶:↓;
MDA:↓; SOD:↑; POD:↑; CAT:↑;
磷酸烯醇式丙酮酸羧化酶:↑(Co);
可溶性蛋白:↑(Co),↓(Ni); 可溶性糖:↑;
谷胱甘肽还原酶:↑; 还原性谷胱甘肽:↑;
抗坏血酸过氧化物酶:↓; 抗坏血酸:↑;
叶绿素a,b,类胡萝卜素; ↓,↓,↓;[34] Cd 10 μmol/L
7 d
Hoagland培养基10 μmol/L Cd,7 d,
叶绿素a :↓;叶绿素b:↓;
[O2•-]:↑; [H2O2]:↑;
MDA:↑; SOD:↑; POD:↑; CAT:↑;
谷胱甘肽还原酶:↑; 还原性谷胱甘肽:↓;[50] Co 1~1 000 μmol/L
72 h
Hoagland培养基1~1 000 μmol/L、72 h,
叶片数:↓; 叶绿素a,b,类胡萝卜素: ↓,↓,↓;
Fv/Fm:↓;Fv/Fo:↓;Fo/Fm:↑;
非光化学淬灭:↓; 光化学淬灭:↓;
叶绿体光合磷酸化:↓;
SOD: ↓;脂质过氧化物:↑;[51] Cr 0.5~6 mg K2Cr2O7
7 d
Hoagland培养基叶片数:↓;
PSⅡ光化学最大量子产率:↓;
淀粉:↑;[52] Cu 50~100 μg CuSO4
7 d
Hoagland培养基叶片数:↓; 叶绿素b:↓
[O2•-]:↑;[H2O2]:↑;
谷胱甘肽还原酶:↑;[53] 5~20 μmol/L Cu2 +
4 d
Hoagland培养基鲜重:↓; 叶绿素a,b,类胡萝卜素: ↓,↓,↓; [54] Hg 10~30 μmol/L Hg2 +
7 d叶绿素a,b,类胡萝卜素: ↓,↓,↓;
Fv/Fm:↓;Fv/Fo:↓;
抗坏血酸:↑; 还原性谷胱甘肽:↑;
脯氨酸:↑;可溶性蛋白:↑[55] 稀脉浮萍
Lemna aequinoctialis
Welw.Zn、Cd、Cu 0.16~16 μmol/L Cu2 +
0.009~0.09 μmol/L Cd2 +
1.54~385 μmol/L Zn2 +
7 d
Hoagland培养基联合暴露7 d,
MDA:↑;叶绿素a,b :↓,↓;
CAT:↓; SOD:↑;POD:↑;
谷胱甘肽还原酶:↓[49] 鼓凸浮萍
Lemna gibba L.B 4~128 mg/L B
7 d叶片数:↓; 干重:↓;
叶绿素a,b,类胡萝卜素:↓,↓,↓[56] 注:“↑”上调,“↓”下调。 Notes: “↑”, up-regulated;“↓”, down-regulated. -
[1] Vareda JP,Valente AJM,Durães L. Assessment of heavy metal pollution from anthropogenic activities and remediation strategies:a review[J]. J Environ Manage,2019,246:101−118. doi: 10.1016/j.jenvman.2019.05.126
[2] Sharma R,Lenaghan SC. Duckweed:a potential phytosensor for heavy metals[J]. Plant Cell Rep,2022,41(12):2231−2243. doi: 10.1007/s00299-022-02913-7
[3] Kiskira K,Papirio S,Fourdrin C,van Hullebusch ED,Esposito G. Effect of Cu,Ni and Zn on Fe(Ⅱ)-driven autotrophic denitrification[J]. J Environ Manage,2018,218:209−219. doi: 10.1016/j.jenvman.2018.04.050
[4] Ali S,Abbas Z,Rizwan M,Zaheer IE,Yavaş İ,et al. Application of floating aquatic plants in phytoremediation of heavy metals polluted water:a review[J]. Sustainability,2020,12(5):1927. doi: 10.3390/su12051927
[5] Farooqi ZUR,Hussain MM,Ayub MA,Qadir AA,Ilic P. Potentially toxic elements and phytoremediation:opportunities and challenges[M]//Bhat RA,Tonelli FMP,Dar GH,Hakeem K,eds. Phytoremediation:Biotechnological Strategies for Promoting Invigorating Environs. London:Academic Press,2022:19−36.
[6] Ali MM,Hossain D,Al-Imran,Khan S,Begum M, et al. Environmental pollution with heavy metals:a public health concern[M]//Nazal MK,Zhao HB,eds. Heavy Metals-Their Environmental Impacts and Mitigation. Rijeka:IntechOpen,2021:771−783.
[7] Aziz KHH,Mustafa FS,Omer KM,Hama S,Hamarawf RF,Rahman KO. Heavy metal pollution in the aquatic environment:efficient and low-cost removal approaches to eliminate their toxicity:a review[J]. RSC Adv,2023,13(26):17595−17610. doi: 10.1039/D3RA00723E
[8] Begum A,Harikrishna S. Bioaccumulation of trace metals by aquatic plants[J]. Int J ChemTech Res,2010,2(1):250−254.
[9] Ogundola AF,Adebayo EA,Ajao SO. Phytoremediation:the ultimate technique for reinstating soil contaminated with heavy metals and other pollutants[M]//Kumar V,Shah MP,Shahi SK,eds. Phytoremediation Technology for the Removal of Heavy Metals and Other Contaminants from Soil and Water. Amsterdam:Elsevier,2022:19−49.
[10] Prasad J,Tiwari S,Singh BK,Dubey NK. Phytoextraction of heavy metals:challenges and opportunities[M]//Kumar V,Shah MP,Shahi SK,eds. Phytoremediation Technology for the Removal of Heavy Metals and Other Contaminants from Soil and Water. Amsterdam:Elsevier,2022:173−187.
[11] Singh S,Kumar V,Dhanjal DS,Parihar P,Ramamurthy PC,Singh J. Phytoremediation of heavy metals,metalloids,and radionuclides:prospects and challenges[M]//Kumar V,Shah MP,Shahi SK,eds. Phytoremediation Technology for the Removal of Heavy Metals and Other Contaminants from Soil and Water. Amsterdam:Elsevier,2022:253−276.
[12] Töre GY,Özkoç ÖB. Recent developments in aquatic macrophytes for environmental pollution control:a case study on heavy metal removal from lake water and agricultural return wastewater with the use of duckweed (Lemnacea)[M]//Kumar V,Shah MP,Shahi SK,eds. Phytoremediation Technology for the Removal of Heavy Metals and Other Contaminants from Soil and Water. Amsterdam:Elsevier,2022:75−127.
[13] 史永富,詹倩云,张龙飞,王梦圆,叶洪丽,等. 植物修复中代表性浮水植物移除重金属的能力和特性比较[J]. 生态毒理学报,2022,17(3):316−325. doi: 10.7524/AJE.1673-5897.20210611002 Shi YF,Zhan QY,Zhang LF,Wang MY,Ye HL,et al. Comparison of ability and characteristics of representative floating water plants to remove heavy metals in phytoremediation[J]. Asian Journal of Ecotoxicology,2022,17(3):316−325. doi: 10.7524/AJE.1673-5897.20210611002
[14] Rezania S,Taib SM,Din MFM,Dahalan FA,Kamyab H. Comprehensive review on phytotechnology:heavy metals removal by diverse aquatic plants species from wastewater[J]. J Hazard Mater,2016,318:587−599. doi: 10.1016/j.jhazmat.2016.07.053
[15] Xing W,Wu HP,Hao BB,Huang WM,Liu GH. Bioaccumulation of heavy metals by submerged macrophytes:looking for hyperaccumulators in eutrophic lakes[J]. Environ Sci Technol,2013,47(9):4695−4703. doi: 10.1021/es303923w
[16] Xing W,Huang WM,Liu GH. Effect of excess iron and copper on physiology of aquatic plant Spirodela polyrrhiza (L.) Schleid[J]. Environ Toxicol,2010,25(2):103−112. doi: 10.1002/tox.20480
[17] De Alkimin GD,Santos J,Soares AMVM,Nunes B. Ecotoxicological effects of the azole antifungal agent clotrimazole on the macrophyte species Lemna minor and Lemna gibba[J]. Comp Biochem Physiol Part C Toxicol Pharmacol,2020,237:108835. doi: 10.1016/j.cbpc.2020.108835
[18] Ziegler P,Sree KS,Appenroth KJ. Duckweeds for water remediation and toxicity testing[J]. Toxicol Environ Chem,2016,98(10):1127−1154. doi: 10.1080/02772248.2015.1094701
[19] 杨晶晶,赵旭耀,李高洁,胡诗琦,陈艳,等. 浮萍的研究及应用[J]. 科学通报,2021,66(9):1026−1045. doi: 10.1360/TB-2020-0927 Yang JJ,Zhao XY,Li GJ,Hu SQ,Chen Y,et al. Research and application in duckweeds:a review[J]. Chinese Science Bulletin,2021,66(9):1026−1045. doi: 10.1360/TB-2020-0927
[20] 吴颖琳,杨愿愿,熊倩,王犇,刘芳,应光国. 浮萍在水体污染修复中的应用研究进展[J]. 生态毒理学报,2022,17(2):74−85. Wu YL,Yang YY,Xiong Q,Wang B,Liu F,Ying GG. Research advances on application of duckweed in bioremediation of polluted water[J]. Asian Journal of Ecotoxicology,2022,17(2):74−85.
[21] 王兴利,吴晓晨,王晨野,穆晓东,王晶博,等. 水生植物生态修复重金属污染水体研究进展[J]. 环境污染与防治,2020,42(1):107−112. Wang XL,Wu XC,Wang CY,Mu XD,Wang JB,et al. Research progress on ecological remediation of heavy metal polluted water by aquatic plants[J]. Environmental Pollution and Control,2020,42(1):107−112.
[22] 梁睿. 浮萍对外源无机硒的富集及其蛋白结合形态研究[D]. 南昌:南昌大学,2023:1−10. [23] Mechora Š,Stibilj V,Germ M. Response of duckweed to various concentrations of selenite[J]. Environ Sci Pollut Res Int,2015,22(4):2416−2422. doi: 10.1007/s11356-014-3270-4
[24] Chen DQ,Zhang H,Wang QL,Shao M,Li XY,et al. Intraspecific variations in cadmium tolerance and phytoaccumulation in giant duckweed (Spirodela polyrhiza)[J]. J Hazard Mater,2020,395:122672. doi: 10.1016/j.jhazmat.2020.122672
[25] Naumann B,Eberius M,Appenroth KJ. Growth rate based dose–response relationships and EC-values of ten heavy metals using the duckweed growth inhibition test (ISO 20079) with Lemna minor L. clone St[J]. J Plant Physiol,2007,164(12):1656−1664. doi: 10.1016/j.jplph.2006.10.011
[26] Singh NK,Raghubanshi AS,Upadhyay AK,Rai UN. Arsenic and other heavy metal accumulation in plants and algae growing naturally in contaminated area of West Bengal,India[J]. Ecotoxicol Environ Saf,2016,130:224−233. doi: 10.1016/j.ecoenv.2016.04.024
[27] 李天煜. 稀脉萍(Lemna aequinoctialis)和紫萍(Spirodela polyrrhiza)的重金属生态毒理学研究[D]. 武汉:武汉大学,2003:1−10. [28] Rahman MA,Hasegawa H. Aquatic arsenic:phytoremediation using floating macrophytes[J]. Chemosphere,2011,83(5):633−646. doi: 10.1016/j.chemosphere.2011.02.045
[29] Chaudhuri D,Majumder A,Misra AK,Bandyopadhyay K. Cadmium removal by Lemna minor and Spirodela polyrhiza[J]. Int J Phytoremediation,2014,16(11):1119−1132. doi: 10.1080/15226514.2013.821446
[30] Rai PK. Heavy metals/metalloids remediation from wastewater using free floating macrophytes of a natural wetland[J]. Environ Technol Innov,2019,15:100393. doi: 10.1016/j.eti.2019.100393
[31] Goswami C,Majumder A,Misra AK,Bandyopadhyay K. Arsenic uptake by Lemna minor in hydroponic system[J]. Int J Phytoremediation,2014,16(12):1221−1227. doi: 10.1080/15226514.2013.821452
[32] Jayasri MA,Suthindhiran K. Effect of zinc and lead on the physiological and biochemical properties of aquatic plant Lemna minor:its potential role in phytoremediation[J]. Appl Water Sci,2017,7(3):1247−1253. doi: 10.1007/s13201-015-0376-x
[33] Al-Khafaji MS,Al-Ani FH,Ibrahim AF. Removal of some heavy metals from industrial wastewater by Lemmna minor[J]. KSCE J Civ Eng,2018,22(4):1077−1082. doi: 10.1007/s12205-017-1112-x
[34] 胡丹. 浮萍(Lemna minor)对重金属钴(Co)和镍(Ni)胁迫的应答机制研究[D]. 南京:南京师范大学,2018:1−10. [35] Cvjetko P,Tolić S,Sikić S,Balen B,Tkalec M,et al. Effect of copper on the toxicity and genotoxicity of cadmium in duckweed (Lemna Minor L.)[J]. Arh Hig Rada Toksikol,2010,61(3):287−296. doi: 10.2478/10004-1254-61-2010-2059
[36] Romero-Hernández JA,Amaya-Chávez A,Balderas-Hernández P,Roa-Morales G,González-Rivas N,Ángel M. Tolerance and hyperaccumulation of a mixture of heavy metals (Cu,Pb,Hg,and Zn) by four aquatic macrophytes[J]. Int J Phytoremediation,2017,19(3):239−245. doi: 10.1080/15226514.2016.1207610
[37] Liu CG,Gu WC,Dai Z,Li J,Jiang HR,Zhang Q. Boron accumulation by Lemna minor L. under salt stress[J]. Sci Rep,2018,8(1):8954. doi: 10.1038/s41598-018-27343-y
[38] Megateli S,Semsari S,Couderchet M. Toxicity and removal of heavy metals (cadmium,copper,and zinc) by Lemna gibba[J]. Ecotoxicol Environ Saf,2009,72(6):1774−1780. doi: 10.1016/j.ecoenv.2009.05.004
[39] Abdallah MAM. Phytoremediation of heavy metals from aqueous solutions by two aquatic macrophytes,Ceratophyllum demersum and Lemna gibba L.[J]. Environ Technol,2012,33(14):1609−1614. doi: 10.1080/09593330.2011.640354
[40] Shi JY,Abid AD,Kennedy IM,Hristova KR,Silk WK. To duckweeds (Landoltia punctata),nanoparticulate copper oxide is more inhibitory than the soluble copper in the bulk solution[J]. Environ Pollut,2011,159(5):1277−1282. doi: 10.1016/j.envpol.2011.01.028
[41] Xie WY,Su JQ,Zhu YG. Arsenite oxidation by the phyllosphere bacterial community associated with Wolffia australiana[J]. Environ Sci Technol,2014,48(16):9668−9674. doi: 10.1021/es501510v
[42] Song ZH,Huang GL. Toxic effects of pentachlorophenol on Lemna polyrhiza[J]. Ecotoxicol Environ Saf,2007,66(3):343−347. doi: 10.1016/j.ecoenv.2005.10.001
[43] 张立芳. 重金属锰、铜对紫背浮萍毒害机理研究[D]. 南京:南京师范大学,2016:1−10. [44] 张婷婷. 浮萍(Lemna minor)对重金属汞(Hg)富集的响应——基于生理和RAPD分析[D]. 南京:南京师范大学,2017:1−10. [45] Palma P,Ledo L,Alvarenga P. Ecotoxicological endpoints,are they useful tools to support ecological status assessment in strongly modified water bodies?[J]. Sci Total Environ,2016,541:119−129. doi: 10.1016/j.scitotenv.2015.09.014
[46] 李伶. 镉、铜及其复合胁迫对浮萍(Spirodela polyrrhiea (L.)Schleid)叶绿素荧光参数的影响[D]. 上海:华东师范大学,2010:1−10. [47] 褚为玥. 稀土元素铈(Ce)和钇(Y)在紫背浮萍体内的分子定位及其毒理学效应研究[D]. 南京:南京师范大学,2015:1−10. [48] Su CL,Jiang YJ,Li FF,Yang YR,Lu QQ,et al. Investigation of subcellular distribution,physiological,and biochemical changes in Spirodela polyrhiza as a function of cadmium exposure[J]. Environ Exp Bot,2017,142:24−33. doi: 10.1016/j.envexpbot.2017.07.015
[49] Zhao Z,Shi HJ,Kang XJ,Liu CQ,Chen LC,et al. Inter- and intra-specific competition of duckweed under multiple heavy metal contaminated water[J]. Aquat Toxicol,2017,192:216−223. doi: 10.1016/j.aquatox.2017.09.023
[50] Lu QQ,Zhang TT,Zhang W,Su CL,Yang YR,et al. Alleviation of cadmium toxicity in Lemna minor by exogenous salicylic acid[J]. Ecotoxicol Environ Saf,2018,147:500−508. doi: 10.1016/j.ecoenv.2017.09.015
[51] Begović L,Mlinarić S,Antunović Dunić J,Katanić Z,Lončarić Z,et al. Response of Lemna minor L. to short-term cobalt exposure:the effect on photosynthetic electron transport chain and induction of oxidative damage[J]. Aquat Toxicol,2016,175:117−126. doi: 10.1016/j.aquatox.2016.03.009
[52] Reale L,Ferranti F,Mantilacci S,Corboli M,Aversa S,et al. Cyto-histological and morpho-physiological responses of common duckweed (Lemna minor L.) to chromium[J]. Chemosphere,2016,145:98−105. doi: 10.1016/j.chemosphere.2015.11.047
[53] Obermeier M,Schröder CA,Helmreich B,Schröder P. The enzymatic and antioxidative stress response of Lemna minor to copper and a chloroacetamide herbicide[J]. Environ Sci Pollut Res Int,2015,22(23):18495−18507. doi: 10.1007/s11356-015-5139-6
[54] Hu CW,Liu L,Li XL,Xu YD,Ge ZG,Zhao YJ. Effect of graphene oxide on copper stress in Lemna minor L. :evaluating growth,biochemical responses,and nutrient uptake[J]. J Hazard Mater,2018,341:168−176. doi: 10.1016/j.jhazmat.2017.07.061
[55] Zhang TT,Lu QQ,Su CL,Yang YR,Hu D,Xu QS. Mercury induced oxidative stress,DNA damage,and activation of antioxidative system and Hsp70 induction in duckweed (Lemna minor)[J]. Ecotoxicol Environ Saf,2017,143:46−56. doi: 10.1016/j.ecoenv.2017.04.058
[56] Gür N,Türker OC,Böcük H. Toxicity assessment of boron (B) by Lemna minor L. and Lemna gibba L. and their possible use as model plants for ecological risk assessment of aquatic ecosystems with boron pollution[J]. Chemosphere,2016,157:1−9. doi: 10.1016/j.chemosphere.2016.04.138
[57] 邱寒. 紫背浮萍对铽(Tb)和钕(Nd)胁迫的响应:亚细胞分布、生理生化、超微结构和蛋白组学分析[D]. 南京:南京师范大学,2015:1−10. [58] 徐婷. 紫背浮萍对稀土元素镨(Pr)和镱(Yb)胁迫的应答机制研究[D]. 南京:南京师范大学,2016:1−10. [59] 杨程,李鹏民,张子山,Goltsev V,高辉远. 叶绿素延迟荧光的发生及其在光合作用研究中的应用[J]. 植物生理学报,2013,49(12):1277−1285. Yang C,Li PM,Zhang ZS,Goltsev V,Gao HY. Arising of chlorophyll delayed fluorescence and its application in photosynthesis research[J]. Plant Physiology Journal,2013,49(12):1277−1285.
[60] Ziegler P,Sree KS,Appenroth KJ. Duckweed biomarkers for identifying toxic water contaminants?[J]. Environ Sci Pollut Res Int,2019,26(15):14797−14822. doi: 10.1007/s11356-018-3427-7
计量
- 文章访问数: 121
- HTML全文浏览量: 34
- PDF下载量: 19



 下载:
下载: